高中化学人教版(2019)必修第一册第二章海水中的重要元素纳和氯综合复习题(含答案)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册第二章海水中的重要元素纳和氯综合复习题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 138.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 20:40:42 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
高中化学人教版(2019)必修第一册
第二章海水中的重要元素纳和氯综合复习题
一、单选题
1.劳动成就梦想。下列家务劳动所涉及的化学知识错误的是( )
选项 家务劳动 化学知识
A 用小苏打烘焙糕点 受热易分解
B 用铝制锅烧水、煮饭 铝的熔点较高
C 用白醋清洗水壶中的水垢 白醋可溶解碳酸钙等沉淀
D 用84消毒液对桌椅消毒 具有氧化性
A.A B.B C.C D.D
2.在给定条件下,下列选项中所示物质之间转化均能实现的是
A.
B.
C.
D.
3.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24 L HF和NH3分子所含电子数目均为NA
B.23gC2H6O含C-H键数目一定为2.5NA
C.将1molCl2通入到水中,则N(HClO)+N(Cl )+N(ClO )=2NA(N表示粒子数)
D.8.0gCuO和Cu2S的混合物中含有铜原子的数目为0.1NA
4.某同学在配制500 mL 0.5 mol/L NaOH溶液的实验过程中,除用到玻璃棒、烧杯、500mL容量瓶、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有( )
A.温度计 B.天平 C.蒸发皿 D.酒精灯
5.已知0.5L盐酸和硫酸的混合溶液中,含有0.1mol Cl﹣和0.2mol SO42﹣,则此溶液中H+的物质的量浓度为( )
A.0.1 mol L﹣1 B.1.0 mol L﹣1
C.0.3 mol L﹣1 D.0.4 mol L﹣1
6.向含的水溶液中,加入足量的固体,充分反应后再加入过量的稀盐酸,所得溶液与起始溶液相比,上述离子数目没有变化的有
A.1种 B.2种 C.3种 D.4种
二、多选题
7.下列“实验结论”与“实验操作及现象”一致的是
选项 实验操作及现象 实验结论
A 某物质的焰色反应呈黄色 物质中一定不含有钾元素
B 向某溶液中滴加AgNO3溶液,产生白色沉淀 该溶液中含有Cl—
C 向KI—溶液中滴加氯水,溶液变成蓝色 氧化性:Cl2>I2
D 往新制氯水中滴加几滴紫色石蕊溶液,溶液先变红后褪色 新制氯水显酸性且有氧化性
A.A B.B C.C D.D
8.含有1 mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2后,溶液内发生反应的离子方程式,其中不正确的是
A.x=1.5,2Fe2++4Br-+3Cl2→2Br2+2Fe3++6Cl-
B.x=1.2,Fe2++2Br-+2Cl2→Br2+Fe3++4Cl-
C.x=0.6,2Br-+ Cl2→Br2+2Cl-
D.x=0.4,2Fe2++Cl2→2Fe3++2Cl-
三、填空题
9.某兴趣小组利用数字化实验测定光照过程中氯水的、氯水中氯离子的浓度等变化,实验结果如图所示:
上述实验证明:光照过程中,溶液的导电能力 (填“增强”、“减弱”或“不变”);由图可知时浓度约为,此时氯离子物质的量浓度约为 。(保留3位有效数字)
10.将80克NaOH溶解于水中,配成5 L溶液,则NaOH的物质的量浓度是 。
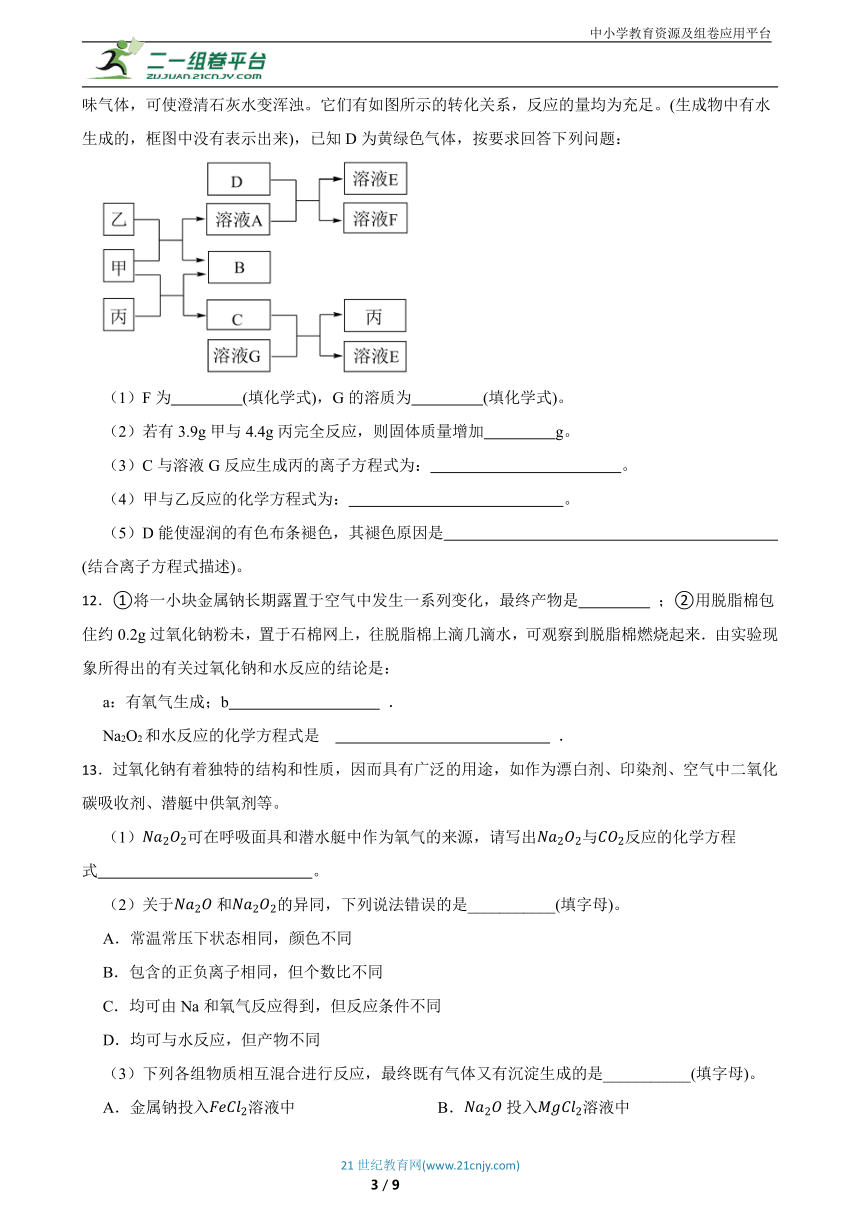
11.甲、乙、丙均为化合物,其中甲为淡黄色固体,乙在常温下为无色无味液体,丙为常见的无色无味气体,可使澄清石灰水变浑浊。它们有如图所示的转化关系,反应的量均为充足。(生成物中有水生成的,框图中没有表示出来),已知D为黄绿色气体,按要求回答下列问题:
(1)F为 (填化学式),G的溶质为 (填化学式)。
(2)若有3.9g甲与4.4g丙完全反应,则固体质量增加 g。
(3)C与溶液G反应生成丙的离子方程式为: 。
(4)甲与乙反应的化学方程式为: 。
(5)D能使湿润的有色布条褪色,其褪色原因是 (结合离子方程式描述)。
12.①将一小块金属钠长期露置于空气中发生一系列变化,最终产物是 ;②用脱脂棉包住约0.2g过氧化钠粉未,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉燃烧起来.由实验现象所得出的有关过氧化钠和水反应的结论是:
a:有氧气生成;b .
Na2O2和水反应的化学方程式是 .
13.过氧化钠有着独特的结构和性质,因而具有广泛的用途,如作为漂白剂、印染剂、空气中二氧化碳吸收剂、潜艇中供氧剂等。
(1)可在呼吸面具和潜水艇中作为氧气的来源,请写出与反应的化学方程式 。
(2)关于和的异同,下列说法错误的是___________(填字母)。
A.常温常压下状态相同,颜色不同
B.包含的正负离子相同,但个数比不同
C.均可由Na和氧气反应得到,但反应条件不同
D.均可与水反应,但产物不同
(3)下列各组物质相互混合进行反应,最终既有气体又有沉淀生成的是___________(填字母)。
A.金属钠投入溶液中 B.投入溶液中
C.投入溶液中 D.投入到溶液中
(4)将一定量的固体投入到含有下列离子的溶液中:、、、,反应完毕后,溶液中上述离子数目几乎不变的有 (填离子符号)。
四、解答题
14.正常的血液中葡萄糖(简称血糖)的浓度在 0.70~1.15g/L之间,下表是某同学的血液检测
项目名称 钾 甘油三酯 葡萄糖 低密度脂蛋白
血液中的含量(10-3mol·L-1) 3.91 0.99 3.00 2.96
该同学1mL 血液中含有的葡萄糖为 g,其血糖含量 (填“正常”或“偏高”或“偏低”)。
15.配制250mL
1.0mol/LH2SO4溶液,需要18mol/L H2SO4溶液的体积是多少
五、实验探究题
16.某同学在做实验时需配制1.0mol/L的NaOH溶液。回答下列问题:
(1)他的配置过程为:称取所需的NaOH固体4.0g放入烧杯中,用适量蒸馏水溶解并搅拌均匀,冷却后,其余步骤的顺序应为____
①塞好瓶塞,反复上下颠倒摇匀
②用少量的水将烧杯等仪器洗涤次,每次洗涤液转移到容量瓶中
③加水至刻度线定容
④将烧杯中的溶液转移到容量瓶中
⑤将溶液倒入空的试剂瓶中,贴好标签
A.②④⑤③① B.④②⑤①③ C.②⑤④①③ D.④②③①⑤
(2)他应选用容量瓶的规格为 mL;在使用容量瓶前必须要进行的一步操作是 。
(3)实验中所用的仪器除托盘天平、药匙、量筒、烧杯、相应规格的容量瓶和试剂瓶外,还有两种玻璃仪器 、 。
(4)下列操作会使配得的溶液浓度偏低的是____ (填序号)
A.容量瓶中原有少量蒸馏水
B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视
D.配制溶液时,加水超过容量瓶刻度线
(5)若实验过程中出现(4)中D这种情况你将如何处理? 。
六、综合题
17.实验室需要0.1mol L﹣1 NaOH溶液450mL和0.5mol L﹣1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是① (填序号),配制上述溶液还需用到的玻璃仪器是② (填仪器名称).
(2)根据计算用托盘天平称取NaOH的质量为 g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1mol L﹣1(填“大于”、“等于”或“小于”).
(3)由计算知,所需质量分数为98%、密度为1.84g cm﹣3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌.
18.某次实验需用0.4mol L-1NaOH溶液480mL。配制方法如下:
(1)配制该溶液应选用 mL容量瓶。
(2)用托盘天平准确称量 g固体NaOH。
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待 后,将烧杯中的溶液注入容量瓶中。
(4)用少量蒸馏水洗涤烧杯 次,把洗涤后的溶液 ,轻轻晃动容量瓶,使溶液混合均匀。
(5)向容量瓶中加入蒸馏水,到液面 时,改用 加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀。
(6)下列情况将使所配得的NaOH溶液的浓度偏高的是 (填序号):
A.所用的NaOH中混有少量Na2CO3
B.用托盘天平称量一定质量NaOH固体时,有少量固体潮解了
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.定容时,俯视容量瓶刻度线
G.定容摇匀静止后,发现液面低于刻度线,再加蒸馏水至刻度线。
19.
(1)标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为7.6g,则混合气体中甲烷的体积分数为 。
(2)某物质A加热时按化学方程式2A═2B+C+3D分解,产物均为气体,测得由生成物组成的混合物气体对H2的相对密度为20,则反应物A的摩尔质量为 。
(3)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为 mol/L。(答案需要化简)
(4)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为 mol/L。
(5)10 mL 0.1 mol·L-1 BaCl2溶液恰好能分别使相同体积的硫酸铁、硫酸铜两种溶液中的SO42-完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是 。
答案解析部分
1.【答案】B
【知识点】钠的重要化合物
2.【答案】D
【知识点】氯气的化学性质;钠的化学性质;氯水、氯气的漂白作用
3.【答案】D
【知识点】阿伏加德罗常数
4.【答案】B
【知识点】配制一定物质的量浓度的溶液
5.【答案】B
【知识点】物质的量浓度
6.【答案】B
【知识点】离子共存;钠的氧化物
7.【答案】C,D
【知识点】氯气的化学性质;焰色反应;氯水、氯气的漂白作用
8.【答案】B,C
【知识点】氯气的化学性质;离子方程式的书写
9.【答案】增强;0.0127
【知识点】电解质溶液的导电性;物质的量浓度;氯水、氯气的漂白作用
10.【答案】0.4 mol·L-1
【知识点】物质的量浓度
11.【答案】(1)NaClO;HCl
(2)1.4
(3)
(4)
(5),次氯酸具有漂白性
【知识点】氯水、氯气的漂白作用
12.【答案】Na2CO3;该反应放出热量;2Na2O2+2H2O=4NaOH+O2↑
【知识点】钠的化学性质
13.【答案】(1)2Na2O2+2CO2=2Na2CO3+O2
(2)B
(3)A;D
(4)
【知识点】钠的化学性质
14.【答案】5.4×10-4;偏低
【知识点】物质的量浓度
15.【答案】解:设需要18mol/L H2SO4溶液的体积为x,依据稀释时溶质守恒有:
0.25L×1.0mol/L=18mol/L×x,解得x=0.0139L。
所以需要18mol/L
H2SO4溶液的体积是13.9mL。
答:配制250mL 1.0mol/L H2SO4溶液,需要18mol/L H2SO4溶液的体积为13.9mL
【知识点】物质的量浓度
16.【答案】(1)D
(2)100;检漏
(3)玻璃棒;胶头滴管
(4)B;D
(5)重新配制
【知识点】配制一定物质的量浓度的溶液
17.【答案】(1)A、C;烧杯、玻璃棒
(2)2.0;小于
(3)13.6;15
【知识点】配制一定物质的量浓度的溶液
18.【答案】(1)500
(2)8.0
(3)溶液冷却至室温
(4)2-3;一起转入容量瓶中
(5)离刻度线下1~2cm;胶头滴管
(6)D;F
【知识点】配制一定物质的量浓度的溶液
19.【答案】(1)75%
(2)120g/mol
(3)1000dV/(MV+2240)
(4)0.4
(5)1∶3
【知识点】摩尔质量;物质的量浓度
21世纪教育网(www.21cnjy.com)
1 / 1
高中化学人教版(2019)必修第一册
第二章海水中的重要元素纳和氯综合复习题
一、单选题
1.劳动成就梦想。下列家务劳动所涉及的化学知识错误的是( )
选项 家务劳动 化学知识
A 用小苏打烘焙糕点 受热易分解
B 用铝制锅烧水、煮饭 铝的熔点较高
C 用白醋清洗水壶中的水垢 白醋可溶解碳酸钙等沉淀
D 用84消毒液对桌椅消毒 具有氧化性
A.A B.B C.C D.D
2.在给定条件下,下列选项中所示物质之间转化均能实现的是
A.
B.
C.
D.
3.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24 L HF和NH3分子所含电子数目均为NA
B.23gC2H6O含C-H键数目一定为2.5NA
C.将1molCl2通入到水中,则N(HClO)+N(Cl )+N(ClO )=2NA(N表示粒子数)
D.8.0gCuO和Cu2S的混合物中含有铜原子的数目为0.1NA
4.某同学在配制500 mL 0.5 mol/L NaOH溶液的实验过程中,除用到玻璃棒、烧杯、500mL容量瓶、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有( )
A.温度计 B.天平 C.蒸发皿 D.酒精灯
5.已知0.5L盐酸和硫酸的混合溶液中,含有0.1mol Cl﹣和0.2mol SO42﹣,则此溶液中H+的物质的量浓度为( )
A.0.1 mol L﹣1 B.1.0 mol L﹣1
C.0.3 mol L﹣1 D.0.4 mol L﹣1
6.向含的水溶液中,加入足量的固体,充分反应后再加入过量的稀盐酸,所得溶液与起始溶液相比,上述离子数目没有变化的有
A.1种 B.2种 C.3种 D.4种
二、多选题
7.下列“实验结论”与“实验操作及现象”一致的是
选项 实验操作及现象 实验结论
A 某物质的焰色反应呈黄色 物质中一定不含有钾元素
B 向某溶液中滴加AgNO3溶液,产生白色沉淀 该溶液中含有Cl—
C 向KI—溶液中滴加氯水,溶液变成蓝色 氧化性:Cl2>I2
D 往新制氯水中滴加几滴紫色石蕊溶液,溶液先变红后褪色 新制氯水显酸性且有氧化性
A.A B.B C.C D.D
8.含有1 mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2后,溶液内发生反应的离子方程式,其中不正确的是
A.x=1.5,2Fe2++4Br-+3Cl2→2Br2+2Fe3++6Cl-
B.x=1.2,Fe2++2Br-+2Cl2→Br2+Fe3++4Cl-
C.x=0.6,2Br-+ Cl2→Br2+2Cl-
D.x=0.4,2Fe2++Cl2→2Fe3++2Cl-
三、填空题
9.某兴趣小组利用数字化实验测定光照过程中氯水的、氯水中氯离子的浓度等变化,实验结果如图所示:
上述实验证明:光照过程中,溶液的导电能力 (填“增强”、“减弱”或“不变”);由图可知时浓度约为,此时氯离子物质的量浓度约为 。(保留3位有效数字)
10.将80克NaOH溶解于水中,配成5 L溶液,则NaOH的物质的量浓度是 。
11.甲、乙、丙均为化合物,其中甲为淡黄色固体,乙在常温下为无色无味液体,丙为常见的无色无味气体,可使澄清石灰水变浑浊。它们有如图所示的转化关系,反应的量均为充足。(生成物中有水生成的,框图中没有表示出来),已知D为黄绿色气体,按要求回答下列问题:
(1)F为 (填化学式),G的溶质为 (填化学式)。
(2)若有3.9g甲与4.4g丙完全反应,则固体质量增加 g。
(3)C与溶液G反应生成丙的离子方程式为: 。
(4)甲与乙反应的化学方程式为: 。
(5)D能使湿润的有色布条褪色,其褪色原因是 (结合离子方程式描述)。
12.①将一小块金属钠长期露置于空气中发生一系列变化,最终产物是 ;②用脱脂棉包住约0.2g过氧化钠粉未,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉燃烧起来.由实验现象所得出的有关过氧化钠和水反应的结论是:
a:有氧气生成;b .
Na2O2和水反应的化学方程式是 .
13.过氧化钠有着独特的结构和性质,因而具有广泛的用途,如作为漂白剂、印染剂、空气中二氧化碳吸收剂、潜艇中供氧剂等。
(1)可在呼吸面具和潜水艇中作为氧气的来源,请写出与反应的化学方程式 。
(2)关于和的异同,下列说法错误的是___________(填字母)。
A.常温常压下状态相同,颜色不同
B.包含的正负离子相同,但个数比不同
C.均可由Na和氧气反应得到,但反应条件不同
D.均可与水反应,但产物不同
(3)下列各组物质相互混合进行反应,最终既有气体又有沉淀生成的是___________(填字母)。
A.金属钠投入溶液中 B.投入溶液中
C.投入溶液中 D.投入到溶液中
(4)将一定量的固体投入到含有下列离子的溶液中:、、、,反应完毕后,溶液中上述离子数目几乎不变的有 (填离子符号)。
四、解答题
14.正常的血液中葡萄糖(简称血糖)的浓度在 0.70~1.15g/L之间,下表是某同学的血液检测
项目名称 钾 甘油三酯 葡萄糖 低密度脂蛋白
血液中的含量(10-3mol·L-1) 3.91 0.99 3.00 2.96
该同学1mL 血液中含有的葡萄糖为 g,其血糖含量 (填“正常”或“偏高”或“偏低”)。
15.配制250mL
1.0mol/LH2SO4溶液,需要18mol/L H2SO4溶液的体积是多少
五、实验探究题
16.某同学在做实验时需配制1.0mol/L的NaOH溶液。回答下列问题:
(1)他的配置过程为:称取所需的NaOH固体4.0g放入烧杯中,用适量蒸馏水溶解并搅拌均匀,冷却后,其余步骤的顺序应为____
①塞好瓶塞,反复上下颠倒摇匀
②用少量的水将烧杯等仪器洗涤次,每次洗涤液转移到容量瓶中
③加水至刻度线定容
④将烧杯中的溶液转移到容量瓶中
⑤将溶液倒入空的试剂瓶中,贴好标签
A.②④⑤③① B.④②⑤①③ C.②⑤④①③ D.④②③①⑤
(2)他应选用容量瓶的规格为 mL;在使用容量瓶前必须要进行的一步操作是 。
(3)实验中所用的仪器除托盘天平、药匙、量筒、烧杯、相应规格的容量瓶和试剂瓶外,还有两种玻璃仪器 、 。
(4)下列操作会使配得的溶液浓度偏低的是____ (填序号)
A.容量瓶中原有少量蒸馏水
B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视
D.配制溶液时,加水超过容量瓶刻度线
(5)若实验过程中出现(4)中D这种情况你将如何处理? 。
六、综合题
17.实验室需要0.1mol L﹣1 NaOH溶液450mL和0.5mol L﹣1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是① (填序号),配制上述溶液还需用到的玻璃仪器是② (填仪器名称).
(2)根据计算用托盘天平称取NaOH的质量为 g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1mol L﹣1(填“大于”、“等于”或“小于”).
(3)由计算知,所需质量分数为98%、密度为1.84g cm﹣3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌.
18.某次实验需用0.4mol L-1NaOH溶液480mL。配制方法如下:
(1)配制该溶液应选用 mL容量瓶。
(2)用托盘天平准确称量 g固体NaOH。
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待 后,将烧杯中的溶液注入容量瓶中。
(4)用少量蒸馏水洗涤烧杯 次,把洗涤后的溶液 ,轻轻晃动容量瓶,使溶液混合均匀。
(5)向容量瓶中加入蒸馏水,到液面 时,改用 加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀。
(6)下列情况将使所配得的NaOH溶液的浓度偏高的是 (填序号):
A.所用的NaOH中混有少量Na2CO3
B.用托盘天平称量一定质量NaOH固体时,有少量固体潮解了
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.定容时,俯视容量瓶刻度线
G.定容摇匀静止后,发现液面低于刻度线,再加蒸馏水至刻度线。
19.
(1)标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为7.6g,则混合气体中甲烷的体积分数为 。
(2)某物质A加热时按化学方程式2A═2B+C+3D分解,产物均为气体,测得由生成物组成的混合物气体对H2的相对密度为20,则反应物A的摩尔质量为 。
(3)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为 mol/L。(答案需要化简)
(4)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为 mol/L。
(5)10 mL 0.1 mol·L-1 BaCl2溶液恰好能分别使相同体积的硫酸铁、硫酸铜两种溶液中的SO42-完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是 。
答案解析部分
1.【答案】B
【知识点】钠的重要化合物
2.【答案】D
【知识点】氯气的化学性质;钠的化学性质;氯水、氯气的漂白作用
3.【答案】D
【知识点】阿伏加德罗常数
4.【答案】B
【知识点】配制一定物质的量浓度的溶液
5.【答案】B
【知识点】物质的量浓度
6.【答案】B
【知识点】离子共存;钠的氧化物
7.【答案】C,D
【知识点】氯气的化学性质;焰色反应;氯水、氯气的漂白作用
8.【答案】B,C
【知识点】氯气的化学性质;离子方程式的书写
9.【答案】增强;0.0127
【知识点】电解质溶液的导电性;物质的量浓度;氯水、氯气的漂白作用
10.【答案】0.4 mol·L-1
【知识点】物质的量浓度
11.【答案】(1)NaClO;HCl
(2)1.4
(3)
(4)
(5),次氯酸具有漂白性
【知识点】氯水、氯气的漂白作用
12.【答案】Na2CO3;该反应放出热量;2Na2O2+2H2O=4NaOH+O2↑
【知识点】钠的化学性质
13.【答案】(1)2Na2O2+2CO2=2Na2CO3+O2
(2)B
(3)A;D
(4)
【知识点】钠的化学性质
14.【答案】5.4×10-4;偏低
【知识点】物质的量浓度
15.【答案】解:设需要18mol/L H2SO4溶液的体积为x,依据稀释时溶质守恒有:
0.25L×1.0mol/L=18mol/L×x,解得x=0.0139L。
所以需要18mol/L
H2SO4溶液的体积是13.9mL。
答:配制250mL 1.0mol/L H2SO4溶液,需要18mol/L H2SO4溶液的体积为13.9mL
【知识点】物质的量浓度
16.【答案】(1)D
(2)100;检漏
(3)玻璃棒;胶头滴管
(4)B;D
(5)重新配制
【知识点】配制一定物质的量浓度的溶液
17.【答案】(1)A、C;烧杯、玻璃棒
(2)2.0;小于
(3)13.6;15
【知识点】配制一定物质的量浓度的溶液
18.【答案】(1)500
(2)8.0
(3)溶液冷却至室温
(4)2-3;一起转入容量瓶中
(5)离刻度线下1~2cm;胶头滴管
(6)D;F
【知识点】配制一定物质的量浓度的溶液
19.【答案】(1)75%
(2)120g/mol
(3)1000dV/(MV+2240)
(4)0.4
(5)1∶3
【知识点】摩尔质量;物质的量浓度
21世纪教育网(www.21cnjy.com)
1 / 1
