第二章海洋中的重要元素——钠和氯同步练习 2024-2025学年高一上学期化学人教版(2019)必修第一册(含答案)
文档属性
| 名称 | 第二章海洋中的重要元素——钠和氯同步练习 2024-2025学年高一上学期化学人教版(2019)必修第一册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 885.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 20:57:51 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第二章海洋中的重要元素——钠和氯
学校:___________姓名:___________班级:___________考号:___________
一、单选题
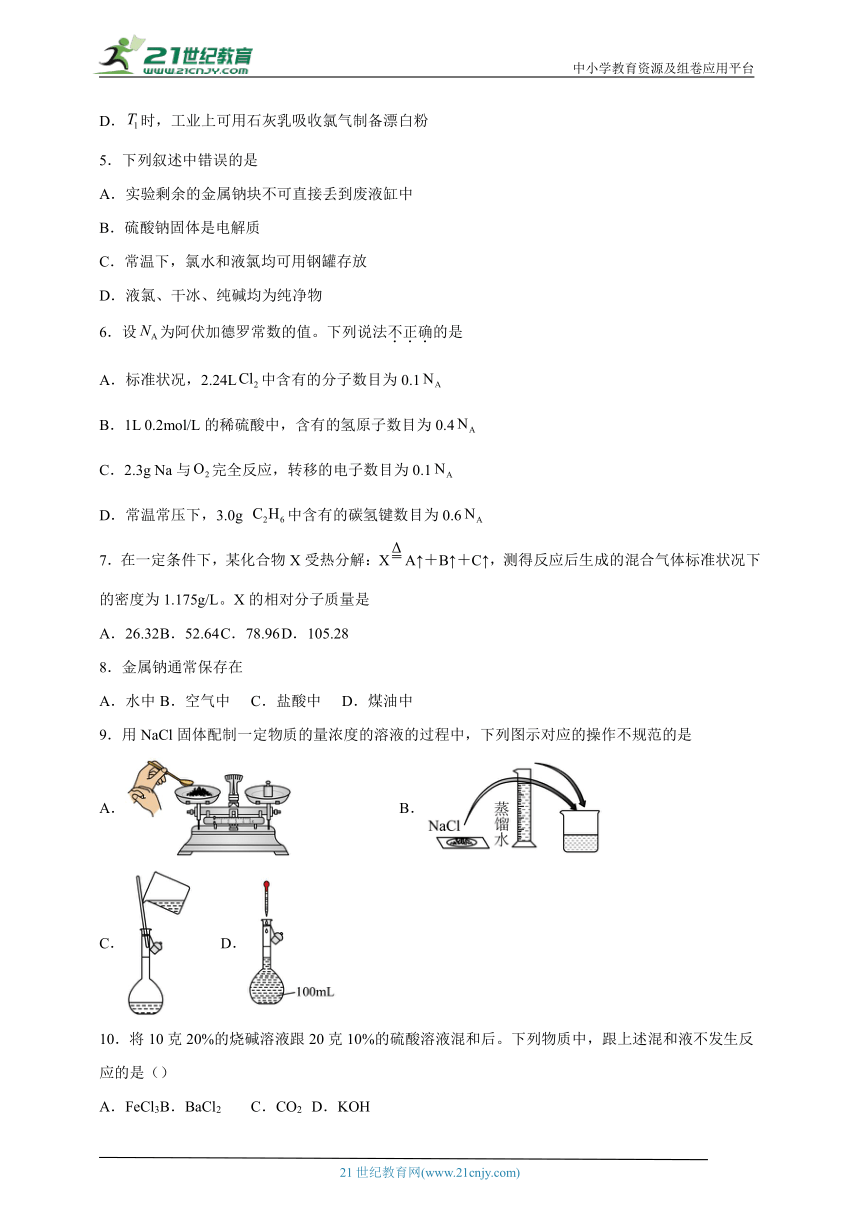
1.下列仪器名称正确的是
A.烧瓶 B.广口瓶 C.锥形瓶 D.洗气瓶
A.A B.B C.C D.D
2.合成氨为基础的化肥工业对粮食增产贡献率高达50%,对人类社会产生深远的影响。下列关于“”的判断(为阿伏加德罗常数的值),不正确的是
A.质量一定为 B.体积一定为
C.含有 D.含有个氨分子
3.下列物质对应的组成不正确的是
A.熟石灰: B.明矾:
C.胆矾: D.小苏打:
4.分别在温度时,将通入溶液中,还原产物的物质的量与的物质的量之间关系如图所示(假设氧化产物只有一种)。下列叙述错误的是
A.时反应的离子方程式为
B.时反应的离子方程式为
C.时,与足量完全反应生成
D.时,工业上可用石灰乳吸收氯气制备漂白粉
5.下列叙述中错误的是
A.实验剩余的金属钠块不可直接丢到废液缸中
B.硫酸钠固体是电解质
C.常温下,氯水和液氯均可用钢罐存放
D.液氯、干冰、纯碱均为纯净物
6.设为阿伏加德罗常数的值。下列说法不正确的是
A.标准状况,2.24L中含有的分子数目为0.1
B.1L 0.2mol/L的稀硫酸中,含有的氢原子数目为0.4
C.2.3g Na与完全反应,转移的电子数目为0.1
D.常温常压下,3.0g 中含有的碳氢键数目为0.6
7.在一定条件下,某化合物X受热分解:XA↑+B↑+C↑,测得反应后生成的混合气体标准状况下的密度为1.175g/L。X的相对分子质量是
A.26.32 B.52.64 C.78.96 D.105.28
8.金属钠通常保存在
A.水中 B.空气中 C.盐酸中 D.煤油中
9.用NaCl固体配制一定物质的量浓度的溶液的过程中,下列图示对应的操作不规范的是
A. B.
C. D.
10.将10克20%的烧碱溶液跟20克10%的硫酸溶液混和后。下列物质中,跟上述混和液不发生反应的是()
A.FeCl3 B.BaCl2 C.CO2 D.KOH
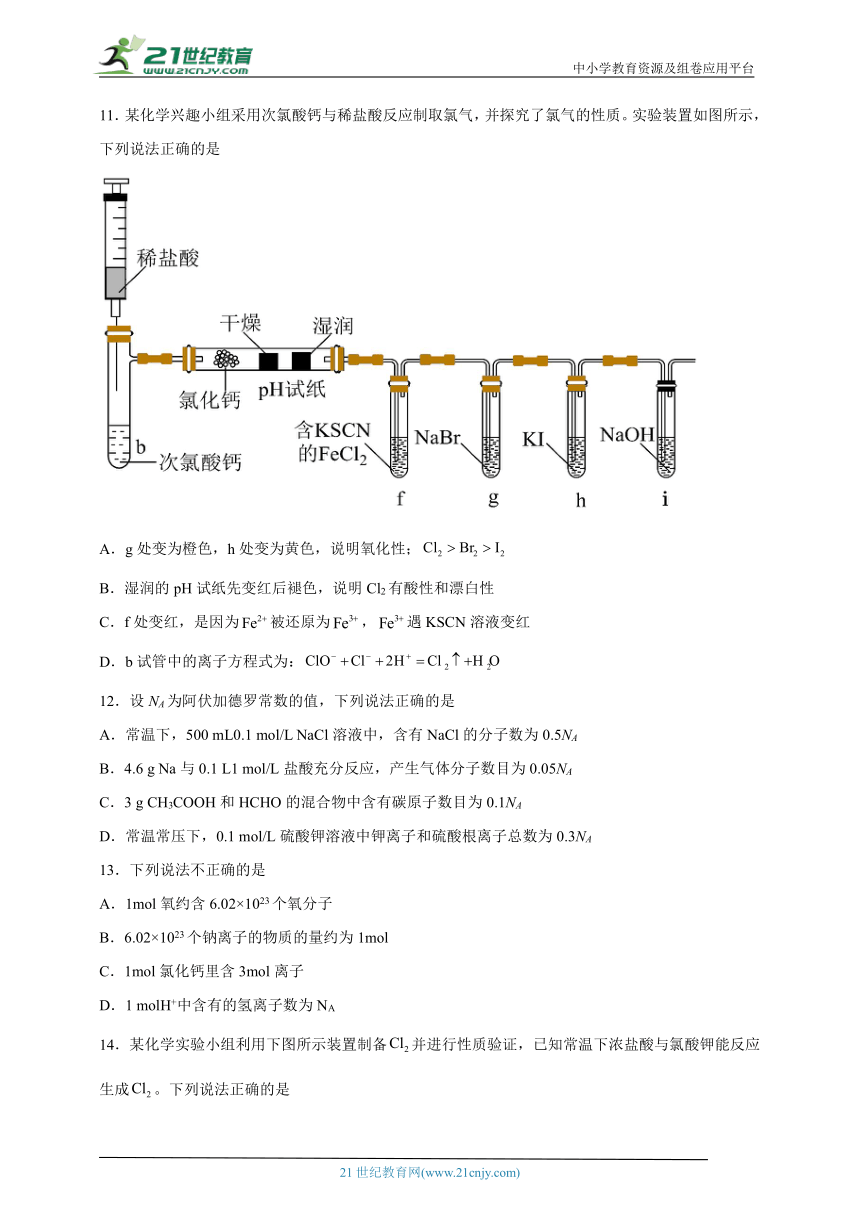
11.某化学兴趣小组采用次氯酸钙与稀盐酸反应制取氯气,并探究了氯气的性质。实验装置如图所示,下列说法正确的是
A.g处变为橙色,h处变为黄色,说明氧化性;
B.湿润的pH试纸先变红后褪色,说明Cl2有酸性和漂白性
C.f处变红,是因为被还原为,遇KSCN溶液变红
D.b试管中的离子方程式为:
12.设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,500 mL0.1 mol/L NaCl溶液中,含有NaCl的分子数为0.5NA
B.4.6 g Na与0.1 L1 mol/L盐酸充分反应,产生气体分子数目为0.05NA
C.3 g CH3COOH和HCHO的混合物中含有碳原子数目为0.1NA
D.常温常压下,0.1 mol/L硫酸钾溶液中钾离子和硫酸根离子总数为0.3NA
13.下列说法不正确的是
A.1mol氧约含6.02×1023个氧分子
B.6.02×1023个钠离子的物质的量约为1mol
C.1mol氯化钙里含3mol离子
D.1 molH+中含有的氢离子数为NA
14.某化学实验小组利用下图所示装置制备并进行性质验证,已知常温下浓盐酸与氯酸钾能反应生成。下列说法正确的是
A.①处湿润的红色布条褪色说明具有漂白性
B.②处石蕊试液先变红说明新制氯水具有酸性
C.③处小试管中液体逐渐变成浅黄绿色说明能溶于水
D.④处出现白烟说明性质活泼
15.下列关于水的说法正确的是
A.1个分子的质量是 B.的摩尔质量是18
C.的质量是 D.标准状况下的体积大约为
二、填空题
16.现有物质:①;②Cu;③固体;④胶体;⑤无水乙醇;⑥CO;⑦稀硫酸,按要求完成下列填空。
(1)以上物质中属于混合物的是 (填序号,下同),属于电解质的是 。
(2)向④中逐滴滴加⑦,可观察到的现象是 。
(3)③可用于治疗胃酸(胃酸主要是盐酸)过多,其原因是(用离子方程式) 。
(4)工业上用饱和食盐水、氨气、二氧化碳制备③,先通入的气体为 ,其原因除溶解度差异外还有 。
(5)物质①、⑤、⑦均可以与金属钠反应,其中反应速率最慢的化学方程式为 。在蒸发皿中放一小块钠,加热至熔化成小球时,用玻璃棒蘸取少量无水粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是 。
a.钠受热易熔成小球说明其熔点低
b.一定条件下,Na可与反应生成Cu
c.将无水粉末改为溶液,反应现象相同
17.2019是国际化学年,中国宣传口号是“化学——我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(1)金属钠等活泼金属着火时,应该用 来灭火,金属钠需密封保存,其中一个目的是与水隔离,原因是 (用化学方程式表示)。
(2)Ca(ClO)2是漂白粉的有效成分,漂白粉在空气中长期放置会变质,变质的原理是 (用化学方程式表示)。
(3)向NaHCO3溶液中滴加少量酚酞试液,溶液变红,说明NaHCO3溶液显 (选填“酸性”,“碱性”或“中性”),NaHCO3可用于治疗胃酸过多,其原理是 (用离子方程式表示)。
18.请回答下列问题:
(1)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为 ,碳原子和氧原子的个数比为 ,该混合气体的摩尔质量为 。
(2)12.4g含Na2X中含Na+0.4mol,则Na2X的摩尔质量是 ,X的相对原子质量是 。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的质量是4.8g,其中氧气和氦气的分子数之比是 ,氧气的质量是 。
19.在空气中长时间放置的漂白粉,最终得到的主要固体物质是 ,其原因是 (用化学方程式说明)。
20.氯气及其许多化合物既是重要的化工原料,又是高效、广普的灭菌消毒剂。请回答:
(1)氯碱工业是工业上制备氯气的主要方法,写出该反应的离子方程式 。实验室用二氧化锰和浓盐酸制备氯气的化学方程式为 ;如果将过量的二氧化锰和的盐酸混合加热,充分反应后生成的氯气明显少于,其原因有 (写出一条即可)。
(2)将氯气通入冷的石灰乳中可以制得较稳定的漂白粉,其有效成分是 (写化学式)。
(3)84消毒液(有效成分为)与洁厕灵(有效成分为盐酸)混用易发生中毒的原因是 (用离子方程式表示)。
(4)常温下为黄色气体,易溶于水,其水溶液是一种广普杀菌剂。一种有效成分为、的“二氧化氯泡腾片”能快速溶于水,溢出大量,得到溶液。上述过程中,生成的反应属于歧化反应,每消耗产生的物质的量为 ;产生的化学方程式为 。
21.甲、乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸。
(1)甲:量取20 ml 18 mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 ml 容量瓶中,用少量的水将烧杯等仪器洗涤2-3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
① 实验所用的玻璃仪器除烧杯和容量瓶外,还有 ;
② 将溶液转移到容量瓶中的正确操作是
③ 定容的正确操作是
(2)乙:用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中错误之处
22.回答下列问题:
(1)和是氧元素的两种单质,根据其化学式完成下列各题:
①等质量的和所含分子个数比为 ,原子个数比为 。
②等温等压下,等体积的和所含分子个数比为 ,原子个数比为 ,质量比为 。
(2)在标准状况下,①、②、③中,④个分子,所含分子数最多的是 (填序号,下同),含原子数最多的是 ,质量最大的是 ,体积最小的是 。
(3)“人造空气”(氧气与氦气的混合气体)可用于减轻某些病痛或供深水潜水员使用。在标准状况下,“人造空气”的质量是,其中氧气与氦气的体积比为 。
23.根据所学知识,写出下列物质去除杂质所需试剂及对应的离子方程式:
物质(括号内为杂质) 试剂或反应条件 离子反应方程式
Na2CO3溶液(NaHCO3)
盐酸(HClO)
HNO3(H2SO4)
Cu(Fe)
24.金属钠及其化合物的用途广泛。请根据所学知识,回答下列问题:
(1)钠元素的碱性氧化物的化学式为 ,钠另一种氧化物是一种淡黄色固体,写出其用于呼吸面具供氧剂的一个主要化学方程式: 。
(2)NaOH 是一种强碱,若实验室用NaOH浓溶液配制0.l mol/LNaOH 480 mL,需要用到的玻璃仪器有量筒、烧杯 ,当450 mL所配溶液与标准状况下672 mLCO2恰好反应时,发生反应的离子方程式为 。
(3)粗盐常含有少量Ca2+、Mg2+、以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是_______(填序号)。
A.溶液a和NaOH可用一种试剂来代替
B.溶液a和溶液b的添加顺序可以互换
C.操作Ⅱ为蒸发结晶,蒸发过程中当蒸发皿中有大量晶体析出时停止加热
D.粗盐提纯的整个操作过程中共有两处需要使用玻璃棒
将NaOH、Na2CO3的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入质量分数为w的盐酸,所加盐酸的质量与产生CO2的质量关系如图所示。
(4)AB段发生反应的化学方程式为 。
(5)当加入35 g盐酸时,产生CO2的质量为 g(用含w的代数式表示)。
(6)原固体混合物中NaOH与Na2CO3的物质的量之比为 。
25.NaHCO3的用途有 、 等。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 B B A C C B C A C D
题号 11 12 13 14 15
答案 D C A C C
1.B
【详解】A.此仪器为容量瓶,不是烧瓶,故A错误;
B.此仪器为广口瓶,可以用于盛放固体药品,也能用于收集气体等,故B正确;
C.此仪器为圆底烧瓶,不是锥形瓶,故C错误;
D.洗气瓶必须有进气口和出气口,此仪器不是洗气瓶,是洗瓶,故D错误;
故选B。
2.B
【详解】A.质量为,故A正确;
B.在标况下的体积为,选项中没说明标况,故B错误;
C.1个分子含有3个H原子,则含有3molH原子,故C正确;
D.1mol任何粒子的个数为NA,故D正确;
故选B。
3.A
【详解】A.熟石灰成分为Ca(OH)2,为生石膏,A错误;
B.明矾为硫酸铝钾晶体,B正确;
C.胆矾为五水合硫酸铜晶体,C正确;
D.小苏打是碳酸氢钠的俗名,D正确;
故选A。
4.C
【详解】A.由图可知温度时,消耗的Cl2与还原产物NaCl的物质的量之比为1∶1,根据原子守恒、电子得失守恒可知,此时氧化产物、还原产物的物质的量之比也为1∶1,所以时反应的离子方程式为:,故A正确;
B.由图可知温度时,消耗0.9molCl2生成1.5mol还原产物NaCl,即,根据原子守恒、电子得失守恒可知,此时氧化产物、还原产物的物质的量之比为1∶5,所以T2时反应的离子方程式为:,故B正确;
C.T2时反应的离子方程式为:,则在条件下与足量完全反应生成的物质的量为,故C错误;
D.据以上分析可知在条件下石灰乳吸收氯气生成CaCl2和,在条件下石灰乳吸收氯气生成CaCl2和,所以在T1时,工业上可用石灰乳吸收氯气制备漂白粉,故D正确;
故选C。
5.C
【详解】A.金属钠能与水反应生成易燃易爆的氢气,所以实验剩余的金属钠块不能直接丢到废液缸中,应放回原试剂瓶中,否则可能发生意外事故,故A正确;
B.硫酸钠属于盐、固体不导电是因为混合物中不存在自由移动的离子,熔融状态下或水溶液中硫酸钠能电离出自由移动的离子,所以硫酸钠固体属于电解质,故B正确;
C.氯水中含有的氯气、盐酸和次氯酸,能与铁反应,所以氯水不能用钢罐储存,故C错误;
D.液氯、干冰、纯碱中均只含有1种物质,均为纯净物,故D正确;
故选C。
6.B
【详解】A.标准状况,2.24L即=0.1mol,分子数目为0.1,故A正确;
B.1L 0.2mol/L的稀硫酸,稀硫酸为强电解质电离出氢离子和硫酸根,硫酸的物质的量,氢离子数目为0.4,故B错误;
C.2.3g Na与完全反应,即0.1mol钠完全反应,转移0.1电子,故C正确;
D.3.0g 的物质的量,1mol乙烷含有6mol碳氢键,0.1mol含有的碳氢键数目为0.6,故D正确;
答案选B。
7.C
【详解】反应后生成的混合气体平均摩尔质量为1.175g/L×22.4L/mol=26.32g/mol,由反应方程式可知X与反应后的混合气体的物质的量之比为1:3,由质量守恒知X的质量等于反应后混合气体的质量,故X与反应后的混合气体的摩尔质量之比为3:1,则X的摩尔质量为26.32g/mol×3=78.96 g/mol;故选C。
8.A
【详解】金属钠的性质非常活泼,能与空气中的氧气和水蒸气反应,为防止钠与空气中的O2和水蒸气反应而变质,金属钠通常保存在石蜡油或煤油中,故选D。
9.C
【详解】A.天平称量固体药品时需左物右码,固体药品要用钥匙取用,接近刻度时轻磕手腕,故A正确;
B.称量的固体置于烧杯中,加蒸馏水溶解,故B正确;
C.烧杯中溶液沿玻璃棒引流注入容量瓶中,玻璃棒下端应伸入刻度线以下,故C错误;
D.定容时,当液面接近刻度线以下1-2cm时,改用胶头滴管滴加,故D正确;
故选:C。
10.D
【详解】
=
解之得:x≈1.63g<10g×20%=2g,所以硫酸溶液被反应完,氢氧化钠溶液有剩余,反应后所得溶液中有NaOH和Na2SO4;
A.氯化铁能和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,不符合题意,故A错误;
B.氯化钡能和硫酸钠反应生成硫酸钡沉淀和氯化钠,不符合题意,故B错误;
C.二氧化碳能和氢氧化钠反应生成碳酸钠和水,不符合题意,故C错误;
D.KOH和氢氧化钠及硫酸钠都不反应,符合题意,故D正确;
答案选D。
11.D
【分析】次氯酸钙溶液与稀盐酸反应可产生氯气,氯气中混杂的水蒸气可被氯化钙吸收。氯气无漂白性,不能使干燥的pH试纸褪色。氯气与水发生反应:Cl2+H2OHCl+HClO,其中HCl水溶液显酸性,HClO有漂白性,因此氯气能使湿润的pH试纸先变红后褪色。氯气具有强氧化性,可通过f、g、h实验验证,用NaOH溶液吸收尾气,据此解答。
【详解】A.g处变为橙色,说明氧化性:Cl2>Br2,h处变为黄色,说明氧化性:Cl2>I2,但是无法说明Br2和I2的氧化性强弱关系,故A错误;
B.氯气与水反应生成HCl和次氯酸,HCl能使pH试纸变红,次氯酸有漂白性,所以后来pH试纸又褪色,但都不是氯气的性质,是氯气和水反应产物的性质,故B错误;
C.f处变红,是因为Fe2+被氯气氧化为Fe3+,Fe3+遇KSCN溶液变红,故C错误;
D.b试管中次氯酸根和氯离子在酸性条件下发生归中反应生成氯气,b中的离子方程式为:,故D正确;
故选D。
12.C
【详解】A.NaCl是离子化合物,在溶液中发生电离产生自由移动的Na+、Cl-,无NaCl分子,A错误;
B.4.6 g Na的物质的量是0.2 mol,0.1 L1 mol/L盐酸中溶质的物质的量是n(HCl)=0.1 mol。Na与HCl反应产生NaCl、H2,反应方程式为:2Na+2HCl=2NaCl+H2↑;当盐酸反应完全后,Na又与H2O发生反应:2Na+2H2O=2NaOH+ H2↑,可见4.6 g Na与0.1 L1 mol/L盐酸充分反应后,产生H2气体的物质的量是0.1 mol,则反应产生的气体分子数目为0.1NA,B错误;
C.CH3COOH和HCHO的最简式都是CH2O,其式量是30,3 g CH3COOH和HCHO的混合物中含有最简式CH2O的物质的量是0.1 mol,因此其中含有的碳原子数目为0.1NA,C正确;
D.只有溶液浓度,缺少溶液体积,不能计算溶质电离产生的离子数目,D错误;
故合理选项是C。
13.A
【详解】A.1mol氧,没有指明是氧原子还是氧气分子,该表示方法不合理,1mol氧气约含6.02×1023个氧分子,A错误;
B.根据阿伏加德罗常数,6.02×1023个钠离子的物质的量约为1mol,B正确;
C.1mol氯化钙里含3mol离子,C正确;
D.根据阿伏加德罗常数,1 molH+中含有的氢离子数为NA,D正确;
故选A。
14.C
【分析】氯酸钾和浓盐酸反应制备氯气,进而进行性质验证,结合物质的性质和问题分析解答。
【详解】A.氯气没有漂白性,①处湿润的红色布条褪色说明和水反应生成的次氯酸具有漂白性,A项错误;
B.浓盐酸易挥发,②处石蕊试液变红不能说明氯水具有酸性,B项错误;
C.氯气是黄绿色气体,③处小试管中液体逐渐变成浅黄绿色说明能溶于水,C项正确;
D.④处出现棕黄色的烟说明氯气能与铜反应生成氯化铜,说明性质活泼,D项错误;
故选C。
15.C
【详解】A.1个分子的物质的量为mol,故质量为,A错误;
B.的摩尔质量是18g/mol,B错误;
C.的质量,C正确;
D.标准状况下为液态物质,1molH2O的体积远大于,D错误;
故选C。
16.(1) ④⑦ ①③
(2)先生成红褐色沉淀,后沉淀溶解,最后生成棕黄色溶液
(3)
(4) 氨气 氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵
(5) c
【详解】(1)H2O属于纯净物,能够电离出氢离子和氢氧根离子,能导电,属于电解质;
②Cu属于纯净物,能够导电,但属于单质,既不是电解质也不是非电解质;
③在熔融状态下和溶于水能够电离出阴阳离子,能够导电,属于纯净物,属于电解质;
④Fe(OH)3胶体属于混合物,能够导电,既不是电解质也不是非电解质;
⑤无水乙醇在水溶液和熔融状态下均以分子形式存在,不导电,属于非电解质;
⑥CO不能溶于水,熔融状态下也不能电离,属于非电解质;
⑦稀硫酸溶液中存在自由移动的离子,能导电,属于混合物,既不是电解质也不是非电解质;
结合以上分析可知:
以上物质中属于混合物的是④⑦;属于电解质的是①③。
(2)氢氧化铁胶体中逐滴加入稀硫酸,胶体先发生聚沉,得到氢氧化铁红褐色沉淀,然后氢氧化铁与硫酸发生中和生成硫酸铁,沉淀溶解,得到棕黄色的溶液。
(3)③固体与盐酸反应产生水和二氧化碳,为固体状态,不能拆开,因此用离子方程式表示其原因是:。
(4)氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,所以实验时,须先通入氨气。
(5)物质①为水、⑤为无水乙醇、⑦稀硫酸,均可以与金属钠反应,反应实质是与H+反应,无水乙醇为非电解质,因此反应速率最慢,反应的化学方程式为:;
a.在蒸发皿中放一小块钠,加热至熔化成小球时,则钠受热易熔成小球说明其熔点低,故a正确;
b.同时有红色物质生成,说明一定条件下,Na可与反应生成Cu,故b正确;
c.将无水粉末改为溶液,钠先与溶液中的水反应,因此现象不相同,故D错误;
综上所述,答案为:c。
17. 沙土 2Na+2H2O=2NaOH+H2↑ Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 碱性 HCO3-+H+=H2O+CO2↑
【详解】(1)金属钠可与水反应,金属钠等活泼金属着火时,应该用干沙土来灭火,金属钠需密封保存,其中一个目的是与水隔离,防止与空气中的水反应生成氢氧化钠和氢气,发生反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(2)Ca(ClO)2是漂白粉的有效成分,漂白粉在空气中长期放置与空气中的二氧化碳作用而变质,变质的原理是Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;
(3)向NaHCO3溶液中滴加少量酚酞试液,溶液变红,说明NaHCO3溶液水解显碱性,NaHCO3可用于治疗胃酸过多,其原理是HCO3-+H+=H2O+CO2↑。
18. 1:2 3:4 33.3g/mol 62g/mol 16 1:4 3.2g
【分析】(1)根据物质的量公式进行计算;
(2)根据摩尔质量公式进行计算,12.4g为0.2molNa2X;
(3)设气体物质的量未知数,列方程组进行计算。
【详解】(1)现有质量比为11:14的CO2和CO的混合气体,二氧化碳的摩尔质量为44g/mol,一氧化碳的摩尔质量为28g/mol,则该混合气体中的CO2和CO物质的量之比为=1:2,碳原子和氧原子的个数比为(1+2):(2+2)=3:4 ,该混合气体的摩尔质量为 。
(2)12.4g含Na2X中含Na+0.4mol,说明Na2X的物质的量为0.2mol,摩尔质量是,X的相对原子质量是62-2×23=16。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的物质的量为0.5mol,质量是4.8g,设氧气物质的量为xmol,氦气物质的量为ymol,则x+y=0.5,32x+4y=4.8,即x=0.1,y=0.4,其中氧气和氦气的分子数之比是1:4,氧气的质量是0.1mol×32g/mol=3.2g。
19. CaCO3和CaCl2 Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO 2HCl+O2↑,CaCO3+2HCl=CaCl2+CO2↑+H2O
【详解】漂白粉的主要成分是氯化钙和次氯酸钙,在空气中长期放置,次氯酸钙会和空气中的二氧化碳和水分反应生成碳酸钙和次氯酸,化学方程式为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,次氯酸不稳定,见光分解生成氧气和盐酸,化学方程式为:2HClO 2HCl+O2↑,最终次氯酸钙消耗完毕,转化成碳酸钙,部分碳酸钙也可与盐酸反应:CaCO3+2HCl=CaCl2+CO2↑+H2O。故所得的主要固体是碳酸钙和氯化钙。
20.(1) 2Cl-+2H2O2OH-+Cl2↑+H2↑ MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 反应过程中消耗HCl使盐酸浓度变稀,反应停止(或加热时盐酸挥发了)
(2)Ca(ClO)2
(3)ClO-+Cl-+2H+=Cl2↑+H2O
(4) 0.8 NaHSO4+NaHCO3=Na2SO4+CO2↑+H2O
【详解】(1)氯碱工业是电解饱和食盐水获得NaOH、H2、Cl2,其离子方程式为2Cl-+2H2OH2↑+Cl2↑+2OH-;二氧化锰作氧化剂,将浓盐酸氧化成氯气,其反应方程式为MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑;二氧化锰只与浓盐酸反应,不与稀盐酸反应,随着反应进行,浓度减小,反应停止,且盐酸易挥发,浓度也会变小;故答案为2Cl-+2H2OH2↑+Cl2↑+2OH-;MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑;反应过程中消耗HCl使盐酸浓度变稀,反应停止或加热时盐酸挥发;
(2)氯气与石灰乳发生2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉成分是CaCl2、Ca(ClO)2,其有效成分是Ca(ClO)2,故答案为Ca(ClO)2;
(3)NaClO与HCl发生氧化还原反应,得到有毒氯气,因此两者不能混有,NaClO与盐酸反应离子方程式为ClO-+H++Cl-= Cl2↑+H2O,故答案为ClO-+H++Cl-= Cl2↑+H2O;
(4)NaClO2发生歧化反应生成ClO2,其离子方程式为5ClO+4H+=4ClO2+Cl-+2H2O,每消耗5molNaClO2,生成4molClO2,因此有消耗1molNaClO2,生成ClO2物质的量为=0.8mol;NaHSO4在水中电离方程式为NaHSO4=Na++H++SO,H+与碳酸氢钠反应生成二氧化碳,其化学方程式为NaHSO4+NaHCO3=Na2SO4+CO2↑+H2O;故答案为0.8;NaHSO4+NaHCO3=Na2SO4+CO2↑+H2O。
21. 量筒、玻璃棒、胶头滴管 将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中 加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切 不能用量筒配制溶液,不能将水加入到浓硫酸中
【详解】(1)①操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故需要的仪器有:烧杯、筒量、玻璃棒、100mL容量瓶、胶头滴管,故实验所用的玻璃仪器除烧杯和容量瓶外,还有:玻璃棒、胶头滴管、量筒,故答案为玻璃棒、胶头滴管、量筒;
②将溶液转移到容量瓶中的作为:将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中,故答案为将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中;
③定容的操作是:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切,故答案为加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(2)不能用量筒配制溶液,不能将水加入到浓硫酸中,故该做法不正确,故答案为不正确,不能用量筒配制溶液,不能将水加入到浓硫酸中。
22.(1) 3:2 1:1 1:1 2:3 2:3
(2) ① ① ④ ③
(3)1:4
【详解】(1)①O2和O3均由氧原子构成,二者质量相等,则含原子个数相等,即含有原子数目之比为1:1;1个O2含有2个氧原子,1个O3含有3个氧原子,则等质量的两种物质的所含分子个数比为3:2;
②根据阿伏加德罗定律可知,等温等压下,等体积的O2和O3所含分子个数比为1:1,原子个数比为(2×1):(3×1)=2:3,质量比为(1mol×32g/mol):(1mol×48g/mol=)2:3,故答案为:1:1;2:3;2:3;
(2)在标准状况下,①4g H2的物质的量为:;
②标准状况下11.2LO2的物质的量为:;
③H2O的物质的量为1mol;
④HCl的物质的量是;
根据N=n·NA可知,相同条件下,气体的物质的量越多,分子数越多,故所含分子数最多的是①;
①4g H2中原子数目为:;
②标准状况11.2LO2中原子数目为;;
③1molH2O中原子数目为:;
④9.03×1023个HCl分子的质量为:;所以,质量最大的是④;相同条件下,物质的量越多,气体的体积越大,但在标准状况下水为液体,体积最小;故答案为:①;①;④;③;
(3)22.4L“人造空气”的物质的量为1mol,根据,解得,所以氧气与氦气的体积比为0.2mol:0.8mol=1:4。
23. 适量NaOH溶液 +OH-=+H2O 光照 2HClO=2H++2Cl-+O2↑ 适量Ba(NO3)2溶液 Ba2++=BaSO4↓ 过量盐酸 Fe+2H+=Fe+H2↑
【详解】NaHCO3可以和NaOH反应生成Na2CO3,所以Na2CO3溶液中NaHCO3可以用适量的NaOH溶液除去,离子方程式为+OH-=+H2O;
HClO受光照易分解生成HCl和O2,所以盐酸中的HClO可以通过光照除去,离子方程式为2HClO=2H++2Cl-+O2↑;
硫酸可以和钡盐反应生成硫酸钡沉淀,为了不引入新的杂质,可以加入适量的硝酸钡溶液除去硝酸中硫酸,离子方程式为Ba2++=BaSO4↓;
铜的活泼性不如氢,所以不能和盐酸反应,所以可以用过量盐酸除去铜中的铁杂质,离子方程式为Fe+2H+=Fe+H2↑。
24.(1) Na2O
(2) 500 mL容量瓶、胶头滴管、玻璃棒 3OH-+2CO2=++H2O
(3)AC
(4)NaHCO3+HCl=NaCl+H2O+CO2↑
(5)
(6)1:4
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签;
NaOH、Na2CO3的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入盐酸,盐酸首先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成氯化钠和碳酸氢钠,再和碳酸氢钠生成氯化钠和水、二氧化碳;
【详解】(1)钠元素的碱性氧化物是氧化钠,化学式:Na2O;钠另一种氧化物是一种淡黄色固体,是过氧化钠,过氧化钠和二氧化碳生成碳酸钠和氧气,其可用于呼吸面具供氧剂,化学方程式:;
(2)实验室没有480mL规格的容量瓶,需使用500mL的容量瓶,该实验所需的玻璃仪器除玻璃棒、量筒、烧杯之外,还有500mL容量瓶、胶头滴管;450mL0.l mol/LNaOH溶液中氢氧化钠的物质的量为0.045mol,标准状况下672mLCO2物质的量:0.03mol,氢氧化钠和二氧化碳的物质的量之比为3:2,恰好反应生成等量的碳酸钠和碳酸氢钠,离子方程式:3OH-+2CO2=++H2O;
(3)A.根据粗盐提纯流程可知,溶液a为BaCl2溶液(除出硫酸根离子),氢氧化钠除去镁离子;则NaOH溶液与BaCl2溶液可以用氢氧化钡溶液代替,A正确;
B.溶液b为碳酸钠溶液,其既要除去钙离子杂质,也需要除去多余的钡离子,故二者顺序不可调换,B错误;
C.氯化钠溶解度受温度影响较小,根据蒸发结晶的要求,操作Ⅱ为蒸发结晶,蒸发过程中当蒸发皿中有大量晶体析出时停止加热,C正确;
D.粗盐提纯的整个操作过程中共有三处需要使用玻璃棒,分别是:搅拌加速溶解、过滤引流,搅拌使蒸发结晶受热均匀,D错误;
答案选AC;
(4)由分析可知,盐酸首先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成氯化钠和碳酸氢钠,再和碳酸氢钠生成氯化钠和水、二氧化碳,故AB段发生反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;
(5)当加入35 g盐酸时,生成二氧化碳消耗的盐酸为35g-25g=10g,NaHCO3+HCl=NaCl+H2O+CO2↑,结合方程式可知,生成二氧化碳质量为;
(6)、,结合方程式可知,OA段碳酸钠消耗的盐酸质量为45g-25g=20g,则氢氧化钠消耗的盐酸质量为25g-20g=5g,结合NaOH+HCl = NaCl+ H2O可知,原固体混合物中NaOH与Na2CO3的物质的量之比等于OA段氢氧化钠、碳酸钠消耗的盐酸的量之比,故为5:20=1:4。
25. 制药 焙制糕点
【详解】碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多;碳酸氢钠是食品工业中一种应用广泛的疏松剂,可用于焙制糕点等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第二章海洋中的重要元素——钠和氯
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列仪器名称正确的是
A.烧瓶 B.广口瓶 C.锥形瓶 D.洗气瓶
A.A B.B C.C D.D
2.合成氨为基础的化肥工业对粮食增产贡献率高达50%,对人类社会产生深远的影响。下列关于“”的判断(为阿伏加德罗常数的值),不正确的是
A.质量一定为 B.体积一定为
C.含有 D.含有个氨分子
3.下列物质对应的组成不正确的是
A.熟石灰: B.明矾:
C.胆矾: D.小苏打:
4.分别在温度时,将通入溶液中,还原产物的物质的量与的物质的量之间关系如图所示(假设氧化产物只有一种)。下列叙述错误的是
A.时反应的离子方程式为
B.时反应的离子方程式为
C.时,与足量完全反应生成
D.时,工业上可用石灰乳吸收氯气制备漂白粉
5.下列叙述中错误的是
A.实验剩余的金属钠块不可直接丢到废液缸中
B.硫酸钠固体是电解质
C.常温下,氯水和液氯均可用钢罐存放
D.液氯、干冰、纯碱均为纯净物
6.设为阿伏加德罗常数的值。下列说法不正确的是
A.标准状况,2.24L中含有的分子数目为0.1
B.1L 0.2mol/L的稀硫酸中,含有的氢原子数目为0.4
C.2.3g Na与完全反应,转移的电子数目为0.1
D.常温常压下,3.0g 中含有的碳氢键数目为0.6
7.在一定条件下,某化合物X受热分解:XA↑+B↑+C↑,测得反应后生成的混合气体标准状况下的密度为1.175g/L。X的相对分子质量是
A.26.32 B.52.64 C.78.96 D.105.28
8.金属钠通常保存在
A.水中 B.空气中 C.盐酸中 D.煤油中
9.用NaCl固体配制一定物质的量浓度的溶液的过程中,下列图示对应的操作不规范的是
A. B.
C. D.
10.将10克20%的烧碱溶液跟20克10%的硫酸溶液混和后。下列物质中,跟上述混和液不发生反应的是()
A.FeCl3 B.BaCl2 C.CO2 D.KOH
11.某化学兴趣小组采用次氯酸钙与稀盐酸反应制取氯气,并探究了氯气的性质。实验装置如图所示,下列说法正确的是
A.g处变为橙色,h处变为黄色,说明氧化性;
B.湿润的pH试纸先变红后褪色,说明Cl2有酸性和漂白性
C.f处变红,是因为被还原为,遇KSCN溶液变红
D.b试管中的离子方程式为:
12.设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,500 mL0.1 mol/L NaCl溶液中,含有NaCl的分子数为0.5NA
B.4.6 g Na与0.1 L1 mol/L盐酸充分反应,产生气体分子数目为0.05NA
C.3 g CH3COOH和HCHO的混合物中含有碳原子数目为0.1NA
D.常温常压下,0.1 mol/L硫酸钾溶液中钾离子和硫酸根离子总数为0.3NA
13.下列说法不正确的是
A.1mol氧约含6.02×1023个氧分子
B.6.02×1023个钠离子的物质的量约为1mol
C.1mol氯化钙里含3mol离子
D.1 molH+中含有的氢离子数为NA
14.某化学实验小组利用下图所示装置制备并进行性质验证,已知常温下浓盐酸与氯酸钾能反应生成。下列说法正确的是
A.①处湿润的红色布条褪色说明具有漂白性
B.②处石蕊试液先变红说明新制氯水具有酸性
C.③处小试管中液体逐渐变成浅黄绿色说明能溶于水
D.④处出现白烟说明性质活泼
15.下列关于水的说法正确的是
A.1个分子的质量是 B.的摩尔质量是18
C.的质量是 D.标准状况下的体积大约为
二、填空题
16.现有物质:①;②Cu;③固体;④胶体;⑤无水乙醇;⑥CO;⑦稀硫酸,按要求完成下列填空。
(1)以上物质中属于混合物的是 (填序号,下同),属于电解质的是 。
(2)向④中逐滴滴加⑦,可观察到的现象是 。
(3)③可用于治疗胃酸(胃酸主要是盐酸)过多,其原因是(用离子方程式) 。
(4)工业上用饱和食盐水、氨气、二氧化碳制备③,先通入的气体为 ,其原因除溶解度差异外还有 。
(5)物质①、⑤、⑦均可以与金属钠反应,其中反应速率最慢的化学方程式为 。在蒸发皿中放一小块钠,加热至熔化成小球时,用玻璃棒蘸取少量无水粉末与其接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法错误的是 。
a.钠受热易熔成小球说明其熔点低
b.一定条件下,Na可与反应生成Cu
c.将无水粉末改为溶液,反应现象相同
17.2019是国际化学年,中国宣传口号是“化学——我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(1)金属钠等活泼金属着火时,应该用 来灭火,金属钠需密封保存,其中一个目的是与水隔离,原因是 (用化学方程式表示)。
(2)Ca(ClO)2是漂白粉的有效成分,漂白粉在空气中长期放置会变质,变质的原理是 (用化学方程式表示)。
(3)向NaHCO3溶液中滴加少量酚酞试液,溶液变红,说明NaHCO3溶液显 (选填“酸性”,“碱性”或“中性”),NaHCO3可用于治疗胃酸过多,其原理是 (用离子方程式表示)。
18.请回答下列问题:
(1)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为 ,碳原子和氧原子的个数比为 ,该混合气体的摩尔质量为 。
(2)12.4g含Na2X中含Na+0.4mol,则Na2X的摩尔质量是 ,X的相对原子质量是 。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的质量是4.8g,其中氧气和氦气的分子数之比是 ,氧气的质量是 。
19.在空气中长时间放置的漂白粉,最终得到的主要固体物质是 ,其原因是 (用化学方程式说明)。
20.氯气及其许多化合物既是重要的化工原料,又是高效、广普的灭菌消毒剂。请回答:
(1)氯碱工业是工业上制备氯气的主要方法,写出该反应的离子方程式 。实验室用二氧化锰和浓盐酸制备氯气的化学方程式为 ;如果将过量的二氧化锰和的盐酸混合加热,充分反应后生成的氯气明显少于,其原因有 (写出一条即可)。
(2)将氯气通入冷的石灰乳中可以制得较稳定的漂白粉,其有效成分是 (写化学式)。
(3)84消毒液(有效成分为)与洁厕灵(有效成分为盐酸)混用易发生中毒的原因是 (用离子方程式表示)。
(4)常温下为黄色气体,易溶于水,其水溶液是一种广普杀菌剂。一种有效成分为、的“二氧化氯泡腾片”能快速溶于水,溢出大量,得到溶液。上述过程中,生成的反应属于歧化反应,每消耗产生的物质的量为 ;产生的化学方程式为 。
21.甲、乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸。
(1)甲:量取20 ml 18 mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 ml 容量瓶中,用少量的水将烧杯等仪器洗涤2-3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
① 实验所用的玻璃仪器除烧杯和容量瓶外,还有 ;
② 将溶液转移到容量瓶中的正确操作是
③ 定容的正确操作是
(2)乙:用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中错误之处
22.回答下列问题:
(1)和是氧元素的两种单质,根据其化学式完成下列各题:
①等质量的和所含分子个数比为 ,原子个数比为 。
②等温等压下,等体积的和所含分子个数比为 ,原子个数比为 ,质量比为 。
(2)在标准状况下,①、②、③中,④个分子,所含分子数最多的是 (填序号,下同),含原子数最多的是 ,质量最大的是 ,体积最小的是 。
(3)“人造空气”(氧气与氦气的混合气体)可用于减轻某些病痛或供深水潜水员使用。在标准状况下,“人造空气”的质量是,其中氧气与氦气的体积比为 。
23.根据所学知识,写出下列物质去除杂质所需试剂及对应的离子方程式:
物质(括号内为杂质) 试剂或反应条件 离子反应方程式
Na2CO3溶液(NaHCO3)
盐酸(HClO)
HNO3(H2SO4)
Cu(Fe)
24.金属钠及其化合物的用途广泛。请根据所学知识,回答下列问题:
(1)钠元素的碱性氧化物的化学式为 ,钠另一种氧化物是一种淡黄色固体,写出其用于呼吸面具供氧剂的一个主要化学方程式: 。
(2)NaOH 是一种强碱,若实验室用NaOH浓溶液配制0.l mol/LNaOH 480 mL,需要用到的玻璃仪器有量筒、烧杯 ,当450 mL所配溶液与标准状况下672 mLCO2恰好反应时,发生反应的离子方程式为 。
(3)粗盐常含有少量Ca2+、Mg2+、以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是_______(填序号)。
A.溶液a和NaOH可用一种试剂来代替
B.溶液a和溶液b的添加顺序可以互换
C.操作Ⅱ为蒸发结晶,蒸发过程中当蒸发皿中有大量晶体析出时停止加热
D.粗盐提纯的整个操作过程中共有两处需要使用玻璃棒
将NaOH、Na2CO3的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入质量分数为w的盐酸,所加盐酸的质量与产生CO2的质量关系如图所示。
(4)AB段发生反应的化学方程式为 。
(5)当加入35 g盐酸时,产生CO2的质量为 g(用含w的代数式表示)。
(6)原固体混合物中NaOH与Na2CO3的物质的量之比为 。
25.NaHCO3的用途有 、 等。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 B B A C C B C A C D
题号 11 12 13 14 15
答案 D C A C C
1.B
【详解】A.此仪器为容量瓶,不是烧瓶,故A错误;
B.此仪器为广口瓶,可以用于盛放固体药品,也能用于收集气体等,故B正确;
C.此仪器为圆底烧瓶,不是锥形瓶,故C错误;
D.洗气瓶必须有进气口和出气口,此仪器不是洗气瓶,是洗瓶,故D错误;
故选B。
2.B
【详解】A.质量为,故A正确;
B.在标况下的体积为,选项中没说明标况,故B错误;
C.1个分子含有3个H原子,则含有3molH原子,故C正确;
D.1mol任何粒子的个数为NA,故D正确;
故选B。
3.A
【详解】A.熟石灰成分为Ca(OH)2,为生石膏,A错误;
B.明矾为硫酸铝钾晶体,B正确;
C.胆矾为五水合硫酸铜晶体,C正确;
D.小苏打是碳酸氢钠的俗名,D正确;
故选A。
4.C
【详解】A.由图可知温度时,消耗的Cl2与还原产物NaCl的物质的量之比为1∶1,根据原子守恒、电子得失守恒可知,此时氧化产物、还原产物的物质的量之比也为1∶1,所以时反应的离子方程式为:,故A正确;
B.由图可知温度时,消耗0.9molCl2生成1.5mol还原产物NaCl,即,根据原子守恒、电子得失守恒可知,此时氧化产物、还原产物的物质的量之比为1∶5,所以T2时反应的离子方程式为:,故B正确;
C.T2时反应的离子方程式为:,则在条件下与足量完全反应生成的物质的量为,故C错误;
D.据以上分析可知在条件下石灰乳吸收氯气生成CaCl2和,在条件下石灰乳吸收氯气生成CaCl2和,所以在T1时,工业上可用石灰乳吸收氯气制备漂白粉,故D正确;
故选C。
5.C
【详解】A.金属钠能与水反应生成易燃易爆的氢气,所以实验剩余的金属钠块不能直接丢到废液缸中,应放回原试剂瓶中,否则可能发生意外事故,故A正确;
B.硫酸钠属于盐、固体不导电是因为混合物中不存在自由移动的离子,熔融状态下或水溶液中硫酸钠能电离出自由移动的离子,所以硫酸钠固体属于电解质,故B正确;
C.氯水中含有的氯气、盐酸和次氯酸,能与铁反应,所以氯水不能用钢罐储存,故C错误;
D.液氯、干冰、纯碱中均只含有1种物质,均为纯净物,故D正确;
故选C。
6.B
【详解】A.标准状况,2.24L即=0.1mol,分子数目为0.1,故A正确;
B.1L 0.2mol/L的稀硫酸,稀硫酸为强电解质电离出氢离子和硫酸根,硫酸的物质的量,氢离子数目为0.4,故B错误;
C.2.3g Na与完全反应,即0.1mol钠完全反应,转移0.1电子,故C正确;
D.3.0g 的物质的量,1mol乙烷含有6mol碳氢键,0.1mol含有的碳氢键数目为0.6,故D正确;
答案选B。
7.C
【详解】反应后生成的混合气体平均摩尔质量为1.175g/L×22.4L/mol=26.32g/mol,由反应方程式可知X与反应后的混合气体的物质的量之比为1:3,由质量守恒知X的质量等于反应后混合气体的质量,故X与反应后的混合气体的摩尔质量之比为3:1,则X的摩尔质量为26.32g/mol×3=78.96 g/mol;故选C。
8.A
【详解】金属钠的性质非常活泼,能与空气中的氧气和水蒸气反应,为防止钠与空气中的O2和水蒸气反应而变质,金属钠通常保存在石蜡油或煤油中,故选D。
9.C
【详解】A.天平称量固体药品时需左物右码,固体药品要用钥匙取用,接近刻度时轻磕手腕,故A正确;
B.称量的固体置于烧杯中,加蒸馏水溶解,故B正确;
C.烧杯中溶液沿玻璃棒引流注入容量瓶中,玻璃棒下端应伸入刻度线以下,故C错误;
D.定容时,当液面接近刻度线以下1-2cm时,改用胶头滴管滴加,故D正确;
故选:C。
10.D
【详解】
=
解之得:x≈1.63g<10g×20%=2g,所以硫酸溶液被反应完,氢氧化钠溶液有剩余,反应后所得溶液中有NaOH和Na2SO4;
A.氯化铁能和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,不符合题意,故A错误;
B.氯化钡能和硫酸钠反应生成硫酸钡沉淀和氯化钠,不符合题意,故B错误;
C.二氧化碳能和氢氧化钠反应生成碳酸钠和水,不符合题意,故C错误;
D.KOH和氢氧化钠及硫酸钠都不反应,符合题意,故D正确;
答案选D。
11.D
【分析】次氯酸钙溶液与稀盐酸反应可产生氯气,氯气中混杂的水蒸气可被氯化钙吸收。氯气无漂白性,不能使干燥的pH试纸褪色。氯气与水发生反应:Cl2+H2OHCl+HClO,其中HCl水溶液显酸性,HClO有漂白性,因此氯气能使湿润的pH试纸先变红后褪色。氯气具有强氧化性,可通过f、g、h实验验证,用NaOH溶液吸收尾气,据此解答。
【详解】A.g处变为橙色,说明氧化性:Cl2>Br2,h处变为黄色,说明氧化性:Cl2>I2,但是无法说明Br2和I2的氧化性强弱关系,故A错误;
B.氯气与水反应生成HCl和次氯酸,HCl能使pH试纸变红,次氯酸有漂白性,所以后来pH试纸又褪色,但都不是氯气的性质,是氯气和水反应产物的性质,故B错误;
C.f处变红,是因为Fe2+被氯气氧化为Fe3+,Fe3+遇KSCN溶液变红,故C错误;
D.b试管中次氯酸根和氯离子在酸性条件下发生归中反应生成氯气,b中的离子方程式为:,故D正确;
故选D。
12.C
【详解】A.NaCl是离子化合物,在溶液中发生电离产生自由移动的Na+、Cl-,无NaCl分子,A错误;
B.4.6 g Na的物质的量是0.2 mol,0.1 L1 mol/L盐酸中溶质的物质的量是n(HCl)=0.1 mol。Na与HCl反应产生NaCl、H2,反应方程式为:2Na+2HCl=2NaCl+H2↑;当盐酸反应完全后,Na又与H2O发生反应:2Na+2H2O=2NaOH+ H2↑,可见4.6 g Na与0.1 L1 mol/L盐酸充分反应后,产生H2气体的物质的量是0.1 mol,则反应产生的气体分子数目为0.1NA,B错误;
C.CH3COOH和HCHO的最简式都是CH2O,其式量是30,3 g CH3COOH和HCHO的混合物中含有最简式CH2O的物质的量是0.1 mol,因此其中含有的碳原子数目为0.1NA,C正确;
D.只有溶液浓度,缺少溶液体积,不能计算溶质电离产生的离子数目,D错误;
故合理选项是C。
13.A
【详解】A.1mol氧,没有指明是氧原子还是氧气分子,该表示方法不合理,1mol氧气约含6.02×1023个氧分子,A错误;
B.根据阿伏加德罗常数,6.02×1023个钠离子的物质的量约为1mol,B正确;
C.1mol氯化钙里含3mol离子,C正确;
D.根据阿伏加德罗常数,1 molH+中含有的氢离子数为NA,D正确;
故选A。
14.C
【分析】氯酸钾和浓盐酸反应制备氯气,进而进行性质验证,结合物质的性质和问题分析解答。
【详解】A.氯气没有漂白性,①处湿润的红色布条褪色说明和水反应生成的次氯酸具有漂白性,A项错误;
B.浓盐酸易挥发,②处石蕊试液变红不能说明氯水具有酸性,B项错误;
C.氯气是黄绿色气体,③处小试管中液体逐渐变成浅黄绿色说明能溶于水,C项正确;
D.④处出现棕黄色的烟说明氯气能与铜反应生成氯化铜,说明性质活泼,D项错误;
故选C。
15.C
【详解】A.1个分子的物质的量为mol,故质量为,A错误;
B.的摩尔质量是18g/mol,B错误;
C.的质量,C正确;
D.标准状况下为液态物质,1molH2O的体积远大于,D错误;
故选C。
16.(1) ④⑦ ①③
(2)先生成红褐色沉淀,后沉淀溶解,最后生成棕黄色溶液
(3)
(4) 氨气 氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵
(5) c
【详解】(1)H2O属于纯净物,能够电离出氢离子和氢氧根离子,能导电,属于电解质;
②Cu属于纯净物,能够导电,但属于单质,既不是电解质也不是非电解质;
③在熔融状态下和溶于水能够电离出阴阳离子,能够导电,属于纯净物,属于电解质;
④Fe(OH)3胶体属于混合物,能够导电,既不是电解质也不是非电解质;
⑤无水乙醇在水溶液和熔融状态下均以分子形式存在,不导电,属于非电解质;
⑥CO不能溶于水,熔融状态下也不能电离,属于非电解质;
⑦稀硫酸溶液中存在自由移动的离子,能导电,属于混合物,既不是电解质也不是非电解质;
结合以上分析可知:
以上物质中属于混合物的是④⑦;属于电解质的是①③。
(2)氢氧化铁胶体中逐滴加入稀硫酸,胶体先发生聚沉,得到氢氧化铁红褐色沉淀,然后氢氧化铁与硫酸发生中和生成硫酸铁,沉淀溶解,得到棕黄色的溶液。
(3)③固体与盐酸反应产生水和二氧化碳,为固体状态,不能拆开,因此用离子方程式表示其原因是:。
(4)氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,所以实验时,须先通入氨气。
(5)物质①为水、⑤为无水乙醇、⑦稀硫酸,均可以与金属钠反应,反应实质是与H+反应,无水乙醇为非电解质,因此反应速率最慢,反应的化学方程式为:;
a.在蒸发皿中放一小块钠,加热至熔化成小球时,则钠受热易熔成小球说明其熔点低,故a正确;
b.同时有红色物质生成,说明一定条件下,Na可与反应生成Cu,故b正确;
c.将无水粉末改为溶液,钠先与溶液中的水反应,因此现象不相同,故D错误;
综上所述,答案为:c。
17. 沙土 2Na+2H2O=2NaOH+H2↑ Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 碱性 HCO3-+H+=H2O+CO2↑
【详解】(1)金属钠可与水反应,金属钠等活泼金属着火时,应该用干沙土来灭火,金属钠需密封保存,其中一个目的是与水隔离,防止与空气中的水反应生成氢氧化钠和氢气,发生反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(2)Ca(ClO)2是漂白粉的有效成分,漂白粉在空气中长期放置与空气中的二氧化碳作用而变质,变质的原理是Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;
(3)向NaHCO3溶液中滴加少量酚酞试液,溶液变红,说明NaHCO3溶液水解显碱性,NaHCO3可用于治疗胃酸过多,其原理是HCO3-+H+=H2O+CO2↑。
18. 1:2 3:4 33.3g/mol 62g/mol 16 1:4 3.2g
【分析】(1)根据物质的量公式进行计算;
(2)根据摩尔质量公式进行计算,12.4g为0.2molNa2X;
(3)设气体物质的量未知数,列方程组进行计算。
【详解】(1)现有质量比为11:14的CO2和CO的混合气体,二氧化碳的摩尔质量为44g/mol,一氧化碳的摩尔质量为28g/mol,则该混合气体中的CO2和CO物质的量之比为=1:2,碳原子和氧原子的个数比为(1+2):(2+2)=3:4 ,该混合气体的摩尔质量为 。
(2)12.4g含Na2X中含Na+0.4mol,说明Na2X的物质的量为0.2mol,摩尔质量是,X的相对原子质量是62-2×23=16。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的物质的量为0.5mol,质量是4.8g,设氧气物质的量为xmol,氦气物质的量为ymol,则x+y=0.5,32x+4y=4.8,即x=0.1,y=0.4,其中氧气和氦气的分子数之比是1:4,氧气的质量是0.1mol×32g/mol=3.2g。
19. CaCO3和CaCl2 Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO 2HCl+O2↑,CaCO3+2HCl=CaCl2+CO2↑+H2O
【详解】漂白粉的主要成分是氯化钙和次氯酸钙,在空气中长期放置,次氯酸钙会和空气中的二氧化碳和水分反应生成碳酸钙和次氯酸,化学方程式为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,次氯酸不稳定,见光分解生成氧气和盐酸,化学方程式为:2HClO 2HCl+O2↑,最终次氯酸钙消耗完毕,转化成碳酸钙,部分碳酸钙也可与盐酸反应:CaCO3+2HCl=CaCl2+CO2↑+H2O。故所得的主要固体是碳酸钙和氯化钙。
20.(1) 2Cl-+2H2O2OH-+Cl2↑+H2↑ MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 反应过程中消耗HCl使盐酸浓度变稀,反应停止(或加热时盐酸挥发了)
(2)Ca(ClO)2
(3)ClO-+Cl-+2H+=Cl2↑+H2O
(4) 0.8 NaHSO4+NaHCO3=Na2SO4+CO2↑+H2O
【详解】(1)氯碱工业是电解饱和食盐水获得NaOH、H2、Cl2,其离子方程式为2Cl-+2H2OH2↑+Cl2↑+2OH-;二氧化锰作氧化剂,将浓盐酸氧化成氯气,其反应方程式为MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑;二氧化锰只与浓盐酸反应,不与稀盐酸反应,随着反应进行,浓度减小,反应停止,且盐酸易挥发,浓度也会变小;故答案为2Cl-+2H2OH2↑+Cl2↑+2OH-;MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑;反应过程中消耗HCl使盐酸浓度变稀,反应停止或加热时盐酸挥发;
(2)氯气与石灰乳发生2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉成分是CaCl2、Ca(ClO)2,其有效成分是Ca(ClO)2,故答案为Ca(ClO)2;
(3)NaClO与HCl发生氧化还原反应,得到有毒氯气,因此两者不能混有,NaClO与盐酸反应离子方程式为ClO-+H++Cl-= Cl2↑+H2O,故答案为ClO-+H++Cl-= Cl2↑+H2O;
(4)NaClO2发生歧化反应生成ClO2,其离子方程式为5ClO+4H+=4ClO2+Cl-+2H2O,每消耗5molNaClO2,生成4molClO2,因此有消耗1molNaClO2,生成ClO2物质的量为=0.8mol;NaHSO4在水中电离方程式为NaHSO4=Na++H++SO,H+与碳酸氢钠反应生成二氧化碳,其化学方程式为NaHSO4+NaHCO3=Na2SO4+CO2↑+H2O;故答案为0.8;NaHSO4+NaHCO3=Na2SO4+CO2↑+H2O。
21. 量筒、玻璃棒、胶头滴管 将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中 加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切 不能用量筒配制溶液,不能将水加入到浓硫酸中
【详解】(1)①操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故需要的仪器有:烧杯、筒量、玻璃棒、100mL容量瓶、胶头滴管,故实验所用的玻璃仪器除烧杯和容量瓶外,还有:玻璃棒、胶头滴管、量筒,故答案为玻璃棒、胶头滴管、量筒;
②将溶液转移到容量瓶中的作为:将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中,故答案为将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中;
③定容的操作是:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切,故答案为加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(2)不能用量筒配制溶液,不能将水加入到浓硫酸中,故该做法不正确,故答案为不正确,不能用量筒配制溶液,不能将水加入到浓硫酸中。
22.(1) 3:2 1:1 1:1 2:3 2:3
(2) ① ① ④ ③
(3)1:4
【详解】(1)①O2和O3均由氧原子构成,二者质量相等,则含原子个数相等,即含有原子数目之比为1:1;1个O2含有2个氧原子,1个O3含有3个氧原子,则等质量的两种物质的所含分子个数比为3:2;
②根据阿伏加德罗定律可知,等温等压下,等体积的O2和O3所含分子个数比为1:1,原子个数比为(2×1):(3×1)=2:3,质量比为(1mol×32g/mol):(1mol×48g/mol=)2:3,故答案为:1:1;2:3;2:3;
(2)在标准状况下,①4g H2的物质的量为:;
②标准状况下11.2LO2的物质的量为:;
③H2O的物质的量为1mol;
④HCl的物质的量是;
根据N=n·NA可知,相同条件下,气体的物质的量越多,分子数越多,故所含分子数最多的是①;
①4g H2中原子数目为:;
②标准状况11.2LO2中原子数目为;;
③1molH2O中原子数目为:;
④9.03×1023个HCl分子的质量为:;所以,质量最大的是④;相同条件下,物质的量越多,气体的体积越大,但在标准状况下水为液体,体积最小;故答案为:①;①;④;③;
(3)22.4L“人造空气”的物质的量为1mol,根据,解得,所以氧气与氦气的体积比为0.2mol:0.8mol=1:4。
23. 适量NaOH溶液 +OH-=+H2O 光照 2HClO=2H++2Cl-+O2↑ 适量Ba(NO3)2溶液 Ba2++=BaSO4↓ 过量盐酸 Fe+2H+=Fe+H2↑
【详解】NaHCO3可以和NaOH反应生成Na2CO3,所以Na2CO3溶液中NaHCO3可以用适量的NaOH溶液除去,离子方程式为+OH-=+H2O;
HClO受光照易分解生成HCl和O2,所以盐酸中的HClO可以通过光照除去,离子方程式为2HClO=2H++2Cl-+O2↑;
硫酸可以和钡盐反应生成硫酸钡沉淀,为了不引入新的杂质,可以加入适量的硝酸钡溶液除去硝酸中硫酸,离子方程式为Ba2++=BaSO4↓;
铜的活泼性不如氢,所以不能和盐酸反应,所以可以用过量盐酸除去铜中的铁杂质,离子方程式为Fe+2H+=Fe+H2↑。
24.(1) Na2O
(2) 500 mL容量瓶、胶头滴管、玻璃棒 3OH-+2CO2=++H2O
(3)AC
(4)NaHCO3+HCl=NaCl+H2O+CO2↑
(5)
(6)1:4
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签;
NaOH、Na2CO3的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入盐酸,盐酸首先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成氯化钠和碳酸氢钠,再和碳酸氢钠生成氯化钠和水、二氧化碳;
【详解】(1)钠元素的碱性氧化物是氧化钠,化学式:Na2O;钠另一种氧化物是一种淡黄色固体,是过氧化钠,过氧化钠和二氧化碳生成碳酸钠和氧气,其可用于呼吸面具供氧剂,化学方程式:;
(2)实验室没有480mL规格的容量瓶,需使用500mL的容量瓶,该实验所需的玻璃仪器除玻璃棒、量筒、烧杯之外,还有500mL容量瓶、胶头滴管;450mL0.l mol/LNaOH溶液中氢氧化钠的物质的量为0.045mol,标准状况下672mLCO2物质的量:0.03mol,氢氧化钠和二氧化碳的物质的量之比为3:2,恰好反应生成等量的碳酸钠和碳酸氢钠,离子方程式:3OH-+2CO2=++H2O;
(3)A.根据粗盐提纯流程可知,溶液a为BaCl2溶液(除出硫酸根离子),氢氧化钠除去镁离子;则NaOH溶液与BaCl2溶液可以用氢氧化钡溶液代替,A正确;
B.溶液b为碳酸钠溶液,其既要除去钙离子杂质,也需要除去多余的钡离子,故二者顺序不可调换,B错误;
C.氯化钠溶解度受温度影响较小,根据蒸发结晶的要求,操作Ⅱ为蒸发结晶,蒸发过程中当蒸发皿中有大量晶体析出时停止加热,C正确;
D.粗盐提纯的整个操作过程中共有三处需要使用玻璃棒,分别是:搅拌加速溶解、过滤引流,搅拌使蒸发结晶受热均匀,D错误;
答案选AC;
(4)由分析可知,盐酸首先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成氯化钠和碳酸氢钠,再和碳酸氢钠生成氯化钠和水、二氧化碳,故AB段发生反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;
(5)当加入35 g盐酸时,生成二氧化碳消耗的盐酸为35g-25g=10g,NaHCO3+HCl=NaCl+H2O+CO2↑,结合方程式可知,生成二氧化碳质量为;
(6)、,结合方程式可知,OA段碳酸钠消耗的盐酸质量为45g-25g=20g,则氢氧化钠消耗的盐酸质量为25g-20g=5g,结合NaOH+HCl = NaCl+ H2O可知,原固体混合物中NaOH与Na2CO3的物质的量之比等于OA段氢氧化钠、碳酸钠消耗的盐酸的量之比,故为5:20=1:4。
25. 制药 焙制糕点
【详解】碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多;碳酸氢钠是食品工业中一种应用广泛的疏松剂,可用于焙制糕点等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
