3.3金属晶体与离子晶体同步练习 2024-2025学年高二化学人教版(2019)选择性必修2(含答案)
文档属性
| 名称 | 3.3金属晶体与离子晶体同步练习 2024-2025学年高二化学人教版(2019)选择性必修2(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 21:04:08 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
3.3金属晶体与离子晶体
学校:___________姓名:___________班级:___________考号:___________
一、单选题
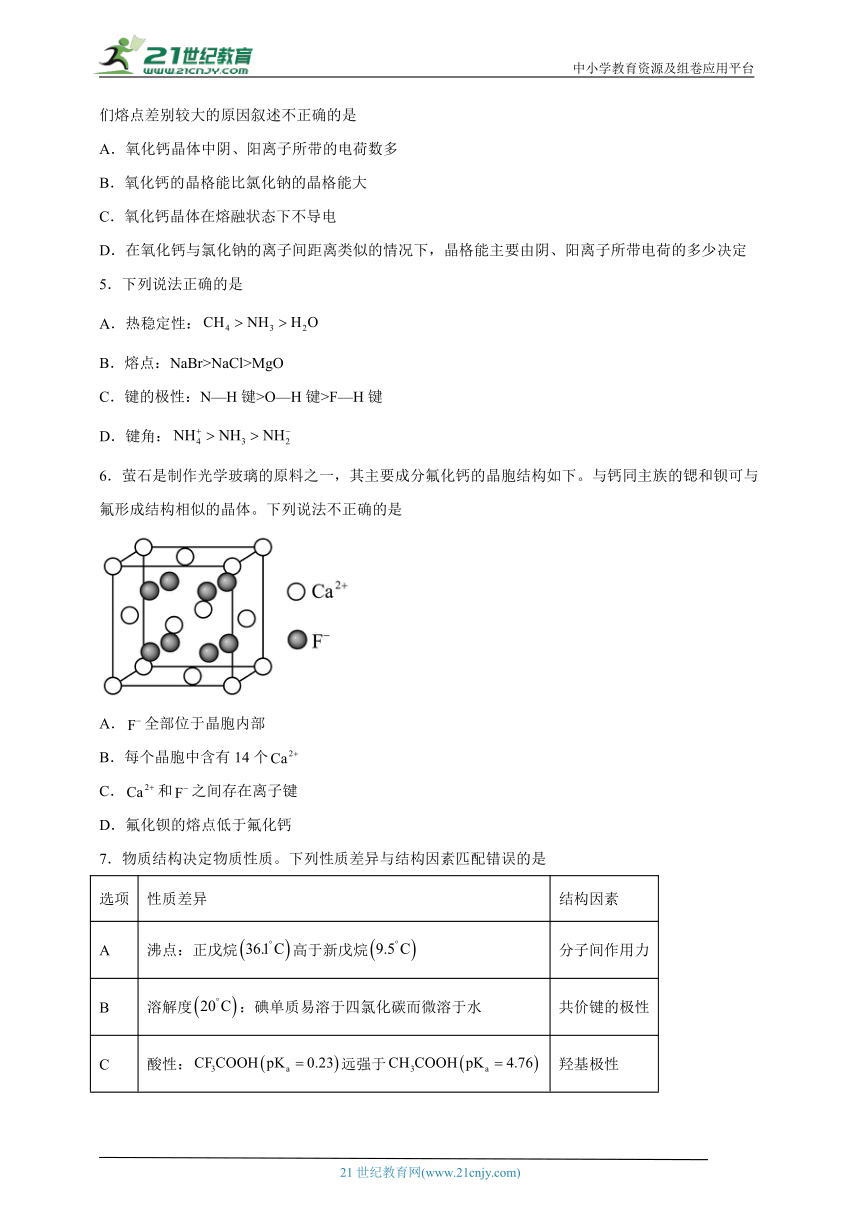
1.某碳酸盐是抗酸药的主要成分,其摩尔质量为,晶胞结构和晶胞参数如图所示。下列说法错误的是
A.的离子构型为平面三角形,在晶胞中有2种不同的取向
B.①、②号与③号离子之间的距离相等
C.该碳酸盐的化学式为不可能为
D.该晶体的密度为
2.几种氧化物的化学键中离子键成分的百分数如下表所示:
氧化物
离子键成分的百分数/% 62 50 41 33
由表格信息,可推知:前四周期元素组成的离子晶体中,离子键成分的百分数最高的是
A. B. C. D.
3.金属晶体和离子晶体的结构多样,种类繁多。下列说法正确的是
A.NaCl的熔点高于KCl的 B.常温下,能导电的晶体一定是金属晶体
C.是含有非极性键的离子晶体 D.离子晶体的熔、沸点均高于金属晶体的
4.氧化钙在2973K时熔化,而氯化钠在1074K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体在熔融状态下不导电
D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定
5.下列说法正确的是
A.热稳定性:
B.熔点:NaBr>NaCl>MgO
C.键的极性:N—H键>O—H键>F—H键
D.键角:
6.萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如下。与钙同主族的锶和钡可与氟形成结构相似的晶体。下列说法不正确的是
A.全部位于晶胞内部
B.每个晶胞中含有14个
C.和之间存在离子键
D.氟化钡的熔点低于氟化钙
7.物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项 性质差异 结构因素
A 沸点:正戊烷高于新戊烷 分子间作用力
B 溶解度:碘单质易溶于四氯化碳而微溶于水 共价键的极性
C 酸性:远强于 羟基极性
D 熔点:远高于(升华) 晶体类型
A.A B.B C.C D.D
8.下列关于晶体的叙述不正确的是
A.晶体与非晶体的本质区别为是否具有自范性
B.金属晶体的熔点都比分子晶体的熔点高
C.氯化铝晶体和干冰晶体熔融时,克服的粒子间作用力相同
D.共价晶体都具有三维骨架结构,熔点高、硬度大
9.近期,某科研团队将离子液体1-乙基-3-甲基咪唑六氟磷酸盐(用IL表示)和单原子Co-bCN(相关物质结构如图1所示)共同负载在超薄g-C3N4纳米片上,大幅改善了光催化还原CO2的电化学反应(相关电化学原理如图2所示)。光照时,光催化电极产生电子(e-)和空穴(h+)。下列说法错误的是
A.Co-bCN中的Co元素位于周期表ds区,属于副族元素
B.IL中的阴离子的空间构型为正八面体
C.该电化学装置的阳极反应为:
D.相比传统有机溶剂,IL中粒子为带电荷的离子,故具有难挥发的优势
10.工业上制备NaBrO3的原理:,下列叙述正确的是
A.CO2是非极性分子 B.Br2挥发时断裂非极性键
C.和的空间结构相同 D.熔点:
11.下列各组物质中,化学键类型相同,晶体类型也相同的是
A.C(金刚石)和C(石墨) B.CH4和H2O
C.AlCl3和NaCl D.O2和Ar
12.某化合物由Cu、S两种元素组成,其晶胞中S的位置如图所示,晶胞参数为a pm。已知S构成的每个正四面体中心均含一个Cu。下列说法错误的是
A.该化合物的化学式为
B.晶胞中S的配位数为8
C.沿晶胞体对角线投影图中S的位置为
D.晶胞中Cu、S的最短距离为
13.结构决定性质,性质决定用途。对下列事实解释错误的是
事实 解释
A HNO3的沸点较低 HNO3存在分子内氢键
B 石墨的导电性只能沿石墨平面的方向 相邻碳原子平面之间相隔较远,未杂化的p轨道重叠使电子几乎只能在整个碳原子平面中运动
C CO2中C=O的键能比HCHO中C=O的键能大 CO2中有两组3中心4电子π键,电子云分布更均匀,能量更高
D CH2=CHCH2Cl与HClO加成的主要产物是ClCH2CHClCH2OH CH2=CHCH2Cl中Cl的电负性较大,使双键电子云向中心碳原子偏移,HClO中带正电性的Cl易连在带负电性中心碳原子上
A.A B.B C.C D.D
14.《神农本草经》中记载的白矾主要成分为,下列说法正确的是
A.半径: B.电离能:
C.电负性: D.熔点:
15.X、Y、Z、W是原子序数依次增大的前四周期元素,X元素有三种能量不同的电子,且最高能级含有3个单电子;Y元素原子的核外电子只有8种运动状态;Z为地壳中含量最多的金属元素;基态W原子在前四周期元素中未成对电子数最多。下列说法正确的是
A.键角: B.第一电离能:
C.W为第四周期ds区元素 D.单质熔、沸点:
二、填空题
16.物质都是由原子构成的,请回答下列关于物质结构方面的问题。
(1)关于下面几种物质或粒子,请将合适的组号填在空格上。
①H2O与D2O ②C2H2与C6H6 ③12C、13C与14C ④16O2与18O3
是同素异形体的 ,是同位素的 。
(2)①碘溶于四氯化碳中;②HCl溶于水;③SiO2熔化;④干冰升华;⑤Na2O熔化;⑥水在2000℃下分解。试分析上述各种情况下微粒间作用力的变化情况:
破坏离子键的有 ;破坏共价键的有 。
(3)请写出CO2的电子式 ;已知CO2的沸点为-78℃,则CS2的沸点 (填“高”或“低”)于-78℃,其原因是: 。
(4)已知:氯胺NH2Cl熔点-66℃,NH4Cl熔点340℃,从物质结构的角度解释两者熔点相差较大的原因 。氯胺与水反应可以产生具有消毒能力的物质,因而可以作为水体的消毒剂使用,请用化学方程式表示该反应 。
17.回答下列问题
(1)第三周期元素氟化物的熔点如下表:
化合物
熔点/℃ 993 1261 1291
解释表中氟化物熔点变化的原因: 。
(2)、都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示:
物质
熔点/℃ 1700 1480
解释、熔点变化的原因: 。
(3)正戊烷、异戊烷、正丁烷、异丁烷的熔点由低到高的顺序为 。
(4)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 晶体。
18.有、、三种晶体,分别由、、、四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
晶体 熔点/℃ 硬度 水溶性 导电性 水溶液与反应
801 较大 易溶 水溶液(或熔融)导电 白色沉淀
3500 很大 不溶 不导电 不反应
很小 易溶 液态不导电 白色沉淀
(1)晶体的化学式分别为 ; 。
(2)晶体的类型分别为 ; , 。
(3)、晶体中粒子间的作用力分别为 、 。
19.离子晶体
(1)定义:由 和 相互作用而形成的晶体。
(2)成键粒子:
(3)相互作用:阴、阳离子间以 结合
(4)常见的离子晶体: 、活泼金属氧化物和过氧化物、大部分盐。
20.解释下列现象或原理:
(1)的熔点(1291℃)比的熔点(190℃)高很多的原因是 ;
(2)溶于水克服的微粒间作用力有 。
(3)比较对羟基苯甲酸( )与邻羟基苯甲酸( )熔点高低并解释产生这种现象的原因是
21.请回答下列问题
(1)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是 。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
(2)对羟基苯甲酸()的熔点(213~217°C)比邻羟基苯甲酸()的熔点(135~136℃)高,原因是 。
22.锂离子电池在生产生活中应用广泛,LiFePO4、LiPF6和LiAsF6均可作锂离子电池的电极材料。回答下列问题:
(1)基态锂原子的轨道表达式为 。
(2)O2-和F-半径更大的是 ;O、F、Fe的第一电离能由大到小的顺序为 。
(3)H3AsO4的酸性强于H3AsO3的原因为 。
(4)锂离子电池工作时,Li+可在离子导体中迁移。Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示,该迁移过程属于 (填“物理变化”或“化学变化”)。
(5)以LiPF6和LiAsF6作锂离子电池的负极材料时,放电过程的实质是Li+从负极材料脱嵌。相同条件下,Li+更易在 (填“LiPF6”或“LiAsF6”)电极中脱嵌,解释其原因为 。
23.硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是 。
(2)①硫单质的一种结构为,杂化方式为 ,该物质 (填“可溶”或“难溶”)于水,该晶体中存在的作用力 、 。
②SO42-、CS2、CO32-键角由大到小的顺序是 。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6 A1F3(填“>”或“<”),原因是 。
②分析并比较与的沸点高低: 。
(4)ZnS晶胞如图所示:
①由图可知,Zn2+填在了S2-形成的 空隙中。
②已知晶胞密度为,g/cm3,阿伏伽德罗常数为NA,则晶胞边长为 pm。
24.晶体模型如下图所示:
(1)在晶体中,每个周围同时吸引 个,每个周围也同时吸引着 个;在晶胞中含有 个、 个,晶体中每个周围与它距离最近且相等的共有 个。
(2)对于氯化钠晶体,下列描述正确的是_______。
A.它是离子晶体
B.相邻的阴、阳离子核间距等于阴、阳离子半径之和
C.与氯化铯晶体结构相同
D.每个与6个紧邻
25.各图为几种分子、晶体或晶胞的结构示意图。
请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是 、晶体;构成晶体的粒子之间主要以氢键结合形成的晶体是 。
(2)冰、金刚石、、、干冰5种晶体的熔点由高到低的顺序为 。
(3)每个晶胞中实际占有 个原子,每个MgO晶胞中实际占有 个镁离子,晶体中每个周围距离最近且相等的有 个。
(4)金刚石和晶体都是碳元素形成的单质,晶体中含键数目为 。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C C A C D B B B A A
题号 11 12 13 14 15
答案 B D C D A
1.C
【分析】由晶胞结构可知有8个为于顶点上4个位于棱上,4个位于晶体内,则的个数为,位于8个在棱上,4个在晶体内,则的个数为,则晶体的化学式为,每个晶胞中共含6个,据此解答。
【详解】A.中心原子C的孤对电子数为,则价电子数为3,空间构型为平面三角形,沿Z轴的投影呈星形可知,有两种不同的取向,故A正确;
B.由图可以看出①、②号与③号离子之间的距离相等,故B正确;
C.由分析可知,碳酸盐的化学式为中n=2,则M可能为,故C错误;
D.该晶胞中x轴和y轴夹角为120°,则该晶胞的体积为,每个晶胞含有6个,则该晶胞的密度为,故D正确;
故选C。
2.C
【详解】根据表格信息,电负性差值越大的两种元素组成的化合物中离子键百分数越大。前四周期元素中,钾电负性最小,氟电负性最大,C项符合题意。
故选C;
3.A
【详解】A.氯化钠和氯化钾都是离子晶体,钠离子半径小于钾离子半径,氯化钠的晶格能比氯化钾的高,故NaCl的熔点高于KCl的,A正确;
B.常温下,能导电的晶体不一定是金属晶体,例如石墨,B错误;
C.是含有镁离子和氯离子的离子晶体,不含非极性键,C错误;
D.金属晶体的熔沸点有很高的,如钨,也有很低的,如钠,离子晶体的熔、沸点不一定高于金属晶体的,D错误;
故选A。
4.C
【详解】A.离子晶体熔沸点与晶格能有关,晶格能与离子半径成反比、与电荷成正比,二者离子间距离和晶体结构相似,氧化钙中氧离子所带电荷大于氯离子、钙离子所带电荷大于钠离子,所以导致氧化钙熔点高于氯化钠,A正确;
B.CaO中阴、阳离子电荷数均为2,NaCl中阴、阳离子电荷数均为1,因此晶格能 CaO> NaCl,B正确;
C.CaO和NaCl都属于离子晶体,熔融状态下都可导电,C错误;
D.二者熔点的高低可根据晶格能的大小判断,晶格能的大小与离子所带电荷多少、离子间距离等因素有关,CaO和NaCl的离子间距离和晶体结构都类似,故晶格能主要由阴、阳离子所带电荷的多少决定,D正确;
故选C。
5.D
【详解】A.元素的非金属性越强,简单氢化物的热稳定性越强,非金属性:O>N>C,因此热稳定性:,,A错误;
B.离子半径越小,所带电荷越多,形成的离子晶体的晶格能越大,熔点越高,所以熔点:NaBr<NaCl<MgO,B错误;
C.电负性越强,与氢原子形成的化学键极性越强,同一周期从左往右元素的非金属性逐渐增强,电负性逐渐增大,由于电负性:N<O<F,因此键的极性:N-H键<O-H键<F-H键,C错误;
D.为sp3杂化无孤电子对,为sp3杂化1对孤电子对,为sp3杂化2对孤电子对,杂化类型相同,孤电子对越多键角越小,D正确;
故选D。
6.B
【详解】A.由晶胞结构可知,氟离子全部位于晶胞内部,故A正确;
B.由晶胞结构可知,晶胞中位于顶点和面心的钙离子个数为8×+6×=4,故B错误;
C.氟化钙是由钙离子和氟离子构成的离子化合物,化合物中只含有离子键,故C正确;
D.氟化钡和氟化钙都是离子晶体,钡离子的离子半径大于钙离子,则氟化钡中的离子键弱于氯化钙,熔点低于氟化钙,故D正确;
故选B。
7.B
【详解】A.正戊烷和新戊烷形成的晶体都是分子晶体,由于新戊烷支链多,对称性好,分子间作用力小,所以沸点较低,故A正确
B.水为极性分子,碘单质与四氯化碳为非极性分子,根据相似相溶可知,碘单质易溶于四氯化碳而微溶于水,与共价键极性无关,故B错误;
C.由于电负性F>H,C-F键极性大于C-H键,使得羧基上的羟基极性增强,氢原子更容易电离,酸性增强,故C正确;
D.AlF3为离子化合物,形成的晶体为离子晶体,熔点较高,AlCl3为共价化合物,形成的晶体为分子晶体,熔点较低,所以AlF3熔点远高于AlCl3,故D正确;
故选B。
8.B
【详解】A.晶体和非晶体的本质区别是内部粒子排列的有序性,从而使晶体在宏观上具有自范性,A正确;
B. 金属晶体的 熔点不一定比 分子晶体的熔点高,大多数情况下,金属晶体的熔点高于分子晶体,但也存在例外,例如, 汞的熔点为-38.87℃,而一些分子晶体的熔点可能高于这个温度,B错误;
C.干冰、氯化铝均为分子晶体,两者所克服的粒子间作用力均为分子间作用力,C正确;
D.共价晶体中,由于各原子均以共价键相结合,具有三维骨架结构,因此一般熔点很高,硬度很大,D正确;
故选B。
9.A
【详解】A.Co为27号元素,价电子排布式为3d74s2,排布在周期表的第Ⅷ族,属于副族元素,它属于d区元素,不属于ds区元素,A错误;
B.IL中的阴离子中,P原子的价层电子对数为6,发生sp3d2杂化,空间构型为正八面体,B正确;
C.该电化学装置中,H2O在阳极得到空穴(h+)后生成O2等,则阳极反应为:,C正确;
D.传统有机溶剂,微粒间只存在微弱的分子间作用力(有的含有氢键),而IL中粒子为带电荷的离子(离子液体),故具有难挥发的优势,D正确;
故选A。
10.A
【详解】A.CO2中心原子碳原子为sp杂化,直线型结构,属于非极性分子,A项正确;
B.液溴挥发时克服分子间作用力,B项错误;
C.是三角锥形,是平面三角形,C项错误;
D.离子半径:,熔点:NaCl>NaBr,D项错误;
答案选A。
11.B
【详解】A.C(金刚石)和C(石墨)中都只含有共价键,C(金刚石)是共价晶体,C(石墨)是混合型晶体,晶体类型不同,故A错误;
B.CH4和H2O都是分子晶体,CH4和H2O都只含共价键,晶体和化学键类型都相同,故B正确;
C.AlCl3中含有共价键,NaCl中含有离子键,AlCl3是分子晶体,NaCl是离子晶体,化学键类型、晶体类型都不相同,故C错误;
D.O2中含有共价键,属于分子晶体,Ar中不含有化学键,故D错误;
故选B。
12.D
【详解】A.晶胞中S原子个数为8×+6×=4,又S构成的每个正四面体中心均含一个Cu,所以Cu原子的数目为8,该化合物的化学式为,A项正确;
B.S构成的每个正四面体中心均含一个Cu,所以晶胞中Cu的配位数为4,化合物的化学式为,则晶胞中S的配位数为4×2=8,B项正确;
C.晶胞中S位于8个顶点和6个面心,沿晶胞体对角线投影图中S的位置为,C项正确;
D.晶胞中S位于8个顶点和6个面心,又S构成的每个正四面体中心均含一个Cu,所以Cu、S的最短距离为体对角线的,即为pm,D项错误;
故选D。
13.C
【详解】A.分子内的羟基氢与非羟基氧形成氢键,即分子内氢键,导致沸点较低。A正确;
B.石墨为层状结构,层与层之间的碳原子平面相隔较远,电子不易跨越,所以未杂化的p轨道重叠使电子几乎只能在整个碳原子平面中运动,石墨的导电性只能沿石墨平面的方向,B正确;
C.中有两组3中心4电子键,电子云分布更均匀,分子较为稳定,能量较低,C错误;
D.Cl的电负性较大,是吸电子基团,使双键电子云向中间碳原子偏移,电荷相反基团相互吸引,所以分子中带正电性的Cl易连在带负电性中心碳原子上,D正确;
故选C。
14.D
【详解】A.电子层数相同,质子数越多半径越小,半径:,故A错误;
B.同主族从上到下,第一电离能逐渐减小,电离能:,故B错误;
C.非金属性越强,电负性越大,电负性:,故C错误;
D.金属原子半径越小、价电子数越多熔点越高,熔点:,故D正确;
选D。
15.A
【分析】X、Y、Z、W是原子序数依次增大的前四周期元素,X元素有三种能量不同的电子,且最高能级含有3个单电子,X为N;Y元素原子的核外电子只有8种运动状态,Y为O;Z为地壳中含量最多的金属元素,Z为Al;基态W原子在前四周期元素中未成对电子数最多,W为Cr;故X、Y、Z、W分别为N、O、Al、Cr。
【详解】A.为,中心原子价层电子对数为,sp2杂化,没有孤对电子,键角为120°;为,中心原子价层电子对数为,sp2杂化,有1对孤对电子,因为孤对电子对成键电子对的排斥力大于成键电子对之间的排斥力,故键角小于120°,故键角,A正确;
B.N的最高能级为半充满稳定结构,第一电离能大于O,Al易失去电子,第一电离能小,故第一电离能:,B错误;
C.Cr为d区元素,C错误;
D.单质Y 为O2,分子晶体,熔沸点最小;Z 为Al,W为Cr,同为金属晶体,价电子数越多,原子半径越小,金属键越强,Cr的价电子数为6,而Al为3,故金属键键能Cr>Al,熔沸点Cr>Al,故熔、沸点:Cr>Al > O2,D错误;
故答案选A。
16.(1) ④ ③
(2) ⑤ ②③⑥
(3) 高于 两者均为分子晶体,结构相似,CS2的相对分子质量较大,沸点较高
(4) 氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,离子晶体的熔沸点高于分子晶体的熔沸点 NH2Cl+H2O NH3+HClO
【详解】(1)同种元素组成的不同种单质互称同素异形体,16O2与18O3属于同素异形体。具有相同质子数、不同中子数的同种元素的不同种原子互称为同位素,12C、13C与14C属于同位素,答案:④;③;
(2)①碘溶于四氯化碳中,破坏分子间作用力,②HCl溶于水,HCl发生电离,破坏共价键,③SiO2熔化,破坏共价键④干冰升华,破坏分子间作用力⑤Na2O熔化,发生电离,破坏离子键⑥水在2000℃下分解,破坏共价键, 所以破坏离子键的有⑤;破坏共价键的有②③⑥,答案:⑤;②③⑥;
(3)CO2电子式因为CO2和CS2均为分子晶体,结构相似,CS2的相对分子质量较大,范德华力较大,沸点较高,答案:;高于;两者均为分子晶体,结构相似,CS2的相对分子质量较大,沸点较高;
(4)氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,离子晶体的熔沸点高于分子晶体的熔沸点。NH2Cl与水反应产生有消毒能力的HClO,同时生成NH3,化学方程式NH2Cl+H2O NH3+HClO,答案:氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,离子晶体的熔沸点高于分子晶体的熔沸点;NH2Cl+H2O NH3+HClO。
17.(1)前三种氟化物为离子晶体,、、的半径依次减小,离子键依次增强;后三种氟化物为分子晶体,相对分子质量依次增大,分子间作用力依次增大
(2)二者属于共价晶体,半径,键长,键能,故熔点比的高
(3)异丁烷<正丁烷<异戊烷<正戊烷
(4)分子
【详解】(1)从题表中各物质熔点可判断前三种氟化物均为离子晶体,其熔点逐渐升高是因为、、的半径依次减小,故它们的离子键依次增强,熔点逐渐升高;后三种氟化物熔点很低,为分子晶体,由于相对分子质量越大,分子间作用力越强,故其熔点逐渐升高;
(2)、都是很好的半导体材料,晶体类型与晶体硅类似,都属于共价晶体,原子半径,键长,键能,故熔点前者高;
(3)烷烃中碳原子数越多,熔点越高;相同碳原子数的烷烃,支链越多,熔点越低,故答案为:异丁烷<正丁烷<异戊烷<正戊烷;
(4)根据题目中的信息知,的熔、沸点低,易溶于水等,它符合分子晶体的特征,故属于分子晶体。
18. 离子晶体 原子晶体 分子晶体 离子键 共价键
【分析】A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成。根据A的水溶液与Ag+反应有白色沉淀,说明A的水溶液中有Cl-,再根据其可以导电得A为NaCl或HCl,又因为其硬度较大,熔点较高,所以A为NaCl;根据B的熔点很高、硬度很大、不导电、不溶于水,可判断其应该为原子晶体,所以B为金刚石;根据C的熔点很低、硬度很小,液态不导电,判断其为气体,易溶于水,水溶液与Ag+反应有白色沉淀,所以C为HCl;结合物质的组成和性质分析解答。
【详解】(1)由以上分析可知,A为NaCl,B为金刚石(C),C为HCl,故答案为:NaCl;HCl;
(2)A的熔点较高,熔融状态下能导电,为离子晶体;B的熔点很高、硬度很大、不导电、不溶于水,为原子晶体;C熔点很低、硬度很小,为分子晶体,故答案为:离子晶体;原子晶体;分子晶体;
(3)A为NaCl,NaCl为离子化合物,晶体中粒子间的作用力为离子键;B为金刚石(C),金刚石为原子晶体,原子间以共价键结合,故答案为:离子键;共价键。
【点睛】把握离子晶体、原子晶体以及分子晶体的结构和性质的区别是解题的关键。本题的易错点为A的判断,要注意分子晶体和离子晶体熔融状态导电性的区别。
19.(1) 阳离子 阴离子
(2)阴、阳离子
(3)离子键
(4)强碱
【解析】略
20.(1)为离子晶体,而分子晶体,克服离子键比分子间作用力更难
(2)离子键、共价键、分子间作用力(氢键)
(3)对羟基苯甲酸的熔点高于邻羟基苯甲酸,原因为:对羟基苯甲酸形成分子间氢键,比邻羟基苯甲酸形成的分子内氢键作用力更强
【解析】(1)
为离子晶体,而分子晶体,克服离子键比分子间作用力更难,因此的熔点(1291℃)比的熔点(190℃)高很多,故答案为:为离子晶体,而分子晶体,克服离子键比分子间作用力更难;
(2)
溶于水生成氢氧化钠,克服的微粒间作用力有离子键、共价键、分子间作用力(氢键),故答案为:离子键、共价键、分子间作用力(氢键);
(3)
对羟基苯甲酸能形成分子间氢键,而邻羟基苯甲酸能形成分子内氢键,当对羟基苯甲酸熔融时,需要消耗较多的能量克服分子间氢键,所以对羟基苯甲酸的熔点高于邻羟基苯甲酸,故答案为:对羟基苯甲酸的熔点高于邻羟基苯甲酸,原因为:对羟基苯甲酸形成分子间氢键,比邻羟基苯甲酸形成的分子内氢键作用力更强。
21.(1)TiF4为离子化合物,熔点高,其他三种均为共价化合物,其组成和结构相似,随相对分子质量的增大,分子间作用力增大,熔点逐渐升高
(2)邻羟基苯甲酸形成分子内氢键,使熔点降低,而对羟基苯甲酸形成分子间氢键,使熔点升高
【分析】(1)
根据题目所给数据可知TiF4熔点较高,可知其应为离子化合物,其他三种均为共价化合物,为分子晶体,其组成和结构相似,随相对分子质量的增大,分子间作用力增大,熔点逐渐升高。
(2)
邻羟基苯甲酸形成分子内氢键,使熔点降低,而对羟基苯甲酸形成分子间氢键,分子间氢键增大了分子间的作用力,使熔点升高,故对羟基苯甲酸的熔点比邻羟基苯甲酸的熔点高。
22. O2- F>O>Fe H3AsO4中非羟基氧原子数多于H3AsO3, As的正电性更高,更容易电离出氢离子 化学变化 LiAsF6 AsF的半径比PF的大,AsF与Li+的作用力比PF弱
【详解】(1)基态锂原子的轨道表达式为;
(2)O2-和F-的核外电子排布相同,核电荷数越小,半径越大,故半径更大的是O2-;非金属的第一电离能比金属元素的第一电离能大,同周期从左至右,第一电离能呈增大趋势,故O、F、Fe的第一电离能由大到小的顺序为F>O>Fe;
(3)H3AsO4的酸性强于H3AsO3的原因为H3AsO4中非羟基氧原子数多于H3AsO3,As的正电性更高,更容易电离出氢离子;
(4)从图可知,Li+迁移过程中生成了新的物质,发生了化学变化;
(5)由于P原子的半径小于As原子的半径,所以AsF的半径比PF的大,AsF与Li+的作用力比PF弱,故导致Li+更易在LiAsF6电极中脱嵌。
23.(1)
(2) sp3杂化 难溶 范德华力 共价键 CS2>>
(3) < SF6是分子晶体,AlF3是离子晶体,离子晶体的熔点高于分子晶体 沸点更高,因为形成分子间氢键
(4) 正四面体
【详解】(1)硫的核电荷数为16,基态硫原子的电子排布式为1s22s22p63s23p4,则其价层电子排布图是;
(2)①在分子中每个硫原子与两个硫原子形成共价键,另外硫原子还有2个未成键电子对,则其杂化方式为sp3杂化,该分子内只存在非极性共价键,为非极性分子,难溶于极性溶剂水中,该晶体中存在的作用力分子间作用力和、共价键(或非极性共价键);
②SO42-中硫原子为sp3杂化、CS2中碳原子为sp杂化、CO32-中碳原子为sp2杂化,则三者键角由大到小的顺序是CS2>CO32->SO42-;
(3)①SF6是分子晶体,AlF3是离子晶体,离子晶体的熔点高于分子晶体,即熔点SF6>_A1F3;
② 分子间能形成氢键,而只能形成分子内氢键,则沸点更高;
(4)①由图可知,Zn2+周围最靠近的4个S2-形成正四面体结构,Zn2+填在了S2-形成的正四面体空隙中;
②设晶胞的边长为xcm,则晶胞体积为x3cm3,晶胞中含有ZnS的数目应该是4个,则NA个晶胞的质量为4×87g,晶胞的密度=(4×87g)÷(NA×x3cm3)=g/cm3,解题x=_=_pm。
24.(1) 6 6 4 4 12
(2)AD
【详解】(1)在NaCl晶体中,每个Na+周围同时吸引6个Cl-,每个Cl-周围同时吸引6个Na+;该晶胞中,Na+的个数为12+1=4,Cl-的个数为=4;晶体中每个Na+周围与它距离最近且相等的Na+共有12个。
(2)A.氯化钠晶体是由Na+、Cl-构成的粒子晶体,A正确;
B.氯化钠晶体中,相邻的阴、阳离子核间距大于阴、阳离子半径之和,B错误;
C.氯化钠晶体呈面心立方堆积,氯化铯晶体呈体心立方堆积,二者晶体结构不同,C错误;
D.氯化钠晶体中以Na+为中心向三维方向伸展,有6个Cl-与Na+紧邻,D正确;
故选AD。
25.(1) 干冰晶体 冰晶体
(2)金刚石冰干冰
(3) 4 4 8
(4)
【详解】(1)根据各晶体的构成和分析,分子晶体中粒子之间为范德华力,构成晶体的粒子之间主要以范德华力结合形成的晶体是干冰晶体、冰晶体;故答案为:干冰晶体;冰晶体;
(2)熔点的一般规律:共价晶体>离子晶体>分子晶体,再结合晶体微粒作用力可得,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石冰干冰,故答案为:金刚石冰干冰;
(3)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为=4;MgO晶胞中Mg2+位于棱上与体心,晶胞中Mg2+数目为1+12×=4,;在CaCl2晶体中,每个Cl-周围最近距离的Ca2+分布在一个顶点以及和这个顶点相连的三个面的面心上,一共是4个,每个Ca2+被8个Cl-所包围,故答案为:4:4:8;
(4)C60晶体中,每2个C原子形成一个π键,则1mol C60晶体中含π键数目为1mol×60××NAmol-1=30NA,故答案为:30NA。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.3金属晶体与离子晶体
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.某碳酸盐是抗酸药的主要成分,其摩尔质量为,晶胞结构和晶胞参数如图所示。下列说法错误的是
A.的离子构型为平面三角形,在晶胞中有2种不同的取向
B.①、②号与③号离子之间的距离相等
C.该碳酸盐的化学式为不可能为
D.该晶体的密度为
2.几种氧化物的化学键中离子键成分的百分数如下表所示:
氧化物
离子键成分的百分数/% 62 50 41 33
由表格信息,可推知:前四周期元素组成的离子晶体中,离子键成分的百分数最高的是
A. B. C. D.
3.金属晶体和离子晶体的结构多样,种类繁多。下列说法正确的是
A.NaCl的熔点高于KCl的 B.常温下,能导电的晶体一定是金属晶体
C.是含有非极性键的离子晶体 D.离子晶体的熔、沸点均高于金属晶体的
4.氧化钙在2973K时熔化,而氯化钠在1074K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体在熔融状态下不导电
D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定
5.下列说法正确的是
A.热稳定性:
B.熔点:NaBr>NaCl>MgO
C.键的极性:N—H键>O—H键>F—H键
D.键角:
6.萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如下。与钙同主族的锶和钡可与氟形成结构相似的晶体。下列说法不正确的是
A.全部位于晶胞内部
B.每个晶胞中含有14个
C.和之间存在离子键
D.氟化钡的熔点低于氟化钙
7.物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项 性质差异 结构因素
A 沸点:正戊烷高于新戊烷 分子间作用力
B 溶解度:碘单质易溶于四氯化碳而微溶于水 共价键的极性
C 酸性:远强于 羟基极性
D 熔点:远高于(升华) 晶体类型
A.A B.B C.C D.D
8.下列关于晶体的叙述不正确的是
A.晶体与非晶体的本质区别为是否具有自范性
B.金属晶体的熔点都比分子晶体的熔点高
C.氯化铝晶体和干冰晶体熔融时,克服的粒子间作用力相同
D.共价晶体都具有三维骨架结构,熔点高、硬度大
9.近期,某科研团队将离子液体1-乙基-3-甲基咪唑六氟磷酸盐(用IL表示)和单原子Co-bCN(相关物质结构如图1所示)共同负载在超薄g-C3N4纳米片上,大幅改善了光催化还原CO2的电化学反应(相关电化学原理如图2所示)。光照时,光催化电极产生电子(e-)和空穴(h+)。下列说法错误的是
A.Co-bCN中的Co元素位于周期表ds区,属于副族元素
B.IL中的阴离子的空间构型为正八面体
C.该电化学装置的阳极反应为:
D.相比传统有机溶剂,IL中粒子为带电荷的离子,故具有难挥发的优势
10.工业上制备NaBrO3的原理:,下列叙述正确的是
A.CO2是非极性分子 B.Br2挥发时断裂非极性键
C.和的空间结构相同 D.熔点:
11.下列各组物质中,化学键类型相同,晶体类型也相同的是
A.C(金刚石)和C(石墨) B.CH4和H2O
C.AlCl3和NaCl D.O2和Ar
12.某化合物由Cu、S两种元素组成,其晶胞中S的位置如图所示,晶胞参数为a pm。已知S构成的每个正四面体中心均含一个Cu。下列说法错误的是
A.该化合物的化学式为
B.晶胞中S的配位数为8
C.沿晶胞体对角线投影图中S的位置为
D.晶胞中Cu、S的最短距离为
13.结构决定性质,性质决定用途。对下列事实解释错误的是
事实 解释
A HNO3的沸点较低 HNO3存在分子内氢键
B 石墨的导电性只能沿石墨平面的方向 相邻碳原子平面之间相隔较远,未杂化的p轨道重叠使电子几乎只能在整个碳原子平面中运动
C CO2中C=O的键能比HCHO中C=O的键能大 CO2中有两组3中心4电子π键,电子云分布更均匀,能量更高
D CH2=CHCH2Cl与HClO加成的主要产物是ClCH2CHClCH2OH CH2=CHCH2Cl中Cl的电负性较大,使双键电子云向中心碳原子偏移,HClO中带正电性的Cl易连在带负电性中心碳原子上
A.A B.B C.C D.D
14.《神农本草经》中记载的白矾主要成分为,下列说法正确的是
A.半径: B.电离能:
C.电负性: D.熔点:
15.X、Y、Z、W是原子序数依次增大的前四周期元素,X元素有三种能量不同的电子,且最高能级含有3个单电子;Y元素原子的核外电子只有8种运动状态;Z为地壳中含量最多的金属元素;基态W原子在前四周期元素中未成对电子数最多。下列说法正确的是
A.键角: B.第一电离能:
C.W为第四周期ds区元素 D.单质熔、沸点:
二、填空题
16.物质都是由原子构成的,请回答下列关于物质结构方面的问题。
(1)关于下面几种物质或粒子,请将合适的组号填在空格上。
①H2O与D2O ②C2H2与C6H6 ③12C、13C与14C ④16O2与18O3
是同素异形体的 ,是同位素的 。
(2)①碘溶于四氯化碳中;②HCl溶于水;③SiO2熔化;④干冰升华;⑤Na2O熔化;⑥水在2000℃下分解。试分析上述各种情况下微粒间作用力的变化情况:
破坏离子键的有 ;破坏共价键的有 。
(3)请写出CO2的电子式 ;已知CO2的沸点为-78℃,则CS2的沸点 (填“高”或“低”)于-78℃,其原因是: 。
(4)已知:氯胺NH2Cl熔点-66℃,NH4Cl熔点340℃,从物质结构的角度解释两者熔点相差较大的原因 。氯胺与水反应可以产生具有消毒能力的物质,因而可以作为水体的消毒剂使用,请用化学方程式表示该反应 。
17.回答下列问题
(1)第三周期元素氟化物的熔点如下表:
化合物
熔点/℃ 993 1261 1291
解释表中氟化物熔点变化的原因: 。
(2)、都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示:
物质
熔点/℃ 1700 1480
解释、熔点变化的原因: 。
(3)正戊烷、异戊烷、正丁烷、异丁烷的熔点由低到高的顺序为 。
(4)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 晶体。
18.有、、三种晶体,分别由、、、四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
晶体 熔点/℃ 硬度 水溶性 导电性 水溶液与反应
801 较大 易溶 水溶液(或熔融)导电 白色沉淀
3500 很大 不溶 不导电 不反应
很小 易溶 液态不导电 白色沉淀
(1)晶体的化学式分别为 ; 。
(2)晶体的类型分别为 ; , 。
(3)、晶体中粒子间的作用力分别为 、 。
19.离子晶体
(1)定义:由 和 相互作用而形成的晶体。
(2)成键粒子:
(3)相互作用:阴、阳离子间以 结合
(4)常见的离子晶体: 、活泼金属氧化物和过氧化物、大部分盐。
20.解释下列现象或原理:
(1)的熔点(1291℃)比的熔点(190℃)高很多的原因是 ;
(2)溶于水克服的微粒间作用力有 。
(3)比较对羟基苯甲酸( )与邻羟基苯甲酸( )熔点高低并解释产生这种现象的原因是
21.请回答下列问题
(1)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是 。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
(2)对羟基苯甲酸()的熔点(213~217°C)比邻羟基苯甲酸()的熔点(135~136℃)高,原因是 。
22.锂离子电池在生产生活中应用广泛,LiFePO4、LiPF6和LiAsF6均可作锂离子电池的电极材料。回答下列问题:
(1)基态锂原子的轨道表达式为 。
(2)O2-和F-半径更大的是 ;O、F、Fe的第一电离能由大到小的顺序为 。
(3)H3AsO4的酸性强于H3AsO3的原因为 。
(4)锂离子电池工作时,Li+可在离子导体中迁移。Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示,该迁移过程属于 (填“物理变化”或“化学变化”)。
(5)以LiPF6和LiAsF6作锂离子电池的负极材料时,放电过程的实质是Li+从负极材料脱嵌。相同条件下,Li+更易在 (填“LiPF6”或“LiAsF6”)电极中脱嵌,解释其原因为 。
23.硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是 。
(2)①硫单质的一种结构为,杂化方式为 ,该物质 (填“可溶”或“难溶”)于水,该晶体中存在的作用力 、 。
②SO42-、CS2、CO32-键角由大到小的顺序是 。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6 A1F3(填“>”或“<”),原因是 。
②分析并比较与的沸点高低: 。
(4)ZnS晶胞如图所示:
①由图可知,Zn2+填在了S2-形成的 空隙中。
②已知晶胞密度为,g/cm3,阿伏伽德罗常数为NA,则晶胞边长为 pm。
24.晶体模型如下图所示:
(1)在晶体中,每个周围同时吸引 个,每个周围也同时吸引着 个;在晶胞中含有 个、 个,晶体中每个周围与它距离最近且相等的共有 个。
(2)对于氯化钠晶体,下列描述正确的是_______。
A.它是离子晶体
B.相邻的阴、阳离子核间距等于阴、阳离子半径之和
C.与氯化铯晶体结构相同
D.每个与6个紧邻
25.各图为几种分子、晶体或晶胞的结构示意图。
请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是 、晶体;构成晶体的粒子之间主要以氢键结合形成的晶体是 。
(2)冰、金刚石、、、干冰5种晶体的熔点由高到低的顺序为 。
(3)每个晶胞中实际占有 个原子,每个MgO晶胞中实际占有 个镁离子,晶体中每个周围距离最近且相等的有 个。
(4)金刚石和晶体都是碳元素形成的单质,晶体中含键数目为 。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C C A C D B B B A A
题号 11 12 13 14 15
答案 B D C D A
1.C
【分析】由晶胞结构可知有8个为于顶点上4个位于棱上,4个位于晶体内,则的个数为,位于8个在棱上,4个在晶体内,则的个数为,则晶体的化学式为,每个晶胞中共含6个,据此解答。
【详解】A.中心原子C的孤对电子数为,则价电子数为3,空间构型为平面三角形,沿Z轴的投影呈星形可知,有两种不同的取向,故A正确;
B.由图可以看出①、②号与③号离子之间的距离相等,故B正确;
C.由分析可知,碳酸盐的化学式为中n=2,则M可能为,故C错误;
D.该晶胞中x轴和y轴夹角为120°,则该晶胞的体积为,每个晶胞含有6个,则该晶胞的密度为,故D正确;
故选C。
2.C
【详解】根据表格信息,电负性差值越大的两种元素组成的化合物中离子键百分数越大。前四周期元素中,钾电负性最小,氟电负性最大,C项符合题意。
故选C;
3.A
【详解】A.氯化钠和氯化钾都是离子晶体,钠离子半径小于钾离子半径,氯化钠的晶格能比氯化钾的高,故NaCl的熔点高于KCl的,A正确;
B.常温下,能导电的晶体不一定是金属晶体,例如石墨,B错误;
C.是含有镁离子和氯离子的离子晶体,不含非极性键,C错误;
D.金属晶体的熔沸点有很高的,如钨,也有很低的,如钠,离子晶体的熔、沸点不一定高于金属晶体的,D错误;
故选A。
4.C
【详解】A.离子晶体熔沸点与晶格能有关,晶格能与离子半径成反比、与电荷成正比,二者离子间距离和晶体结构相似,氧化钙中氧离子所带电荷大于氯离子、钙离子所带电荷大于钠离子,所以导致氧化钙熔点高于氯化钠,A正确;
B.CaO中阴、阳离子电荷数均为2,NaCl中阴、阳离子电荷数均为1,因此晶格能 CaO> NaCl,B正确;
C.CaO和NaCl都属于离子晶体,熔融状态下都可导电,C错误;
D.二者熔点的高低可根据晶格能的大小判断,晶格能的大小与离子所带电荷多少、离子间距离等因素有关,CaO和NaCl的离子间距离和晶体结构都类似,故晶格能主要由阴、阳离子所带电荷的多少决定,D正确;
故选C。
5.D
【详解】A.元素的非金属性越强,简单氢化物的热稳定性越强,非金属性:O>N>C,因此热稳定性:,,A错误;
B.离子半径越小,所带电荷越多,形成的离子晶体的晶格能越大,熔点越高,所以熔点:NaBr<NaCl<MgO,B错误;
C.电负性越强,与氢原子形成的化学键极性越强,同一周期从左往右元素的非金属性逐渐增强,电负性逐渐增大,由于电负性:N<O<F,因此键的极性:N-H键<O-H键<F-H键,C错误;
D.为sp3杂化无孤电子对,为sp3杂化1对孤电子对,为sp3杂化2对孤电子对,杂化类型相同,孤电子对越多键角越小,D正确;
故选D。
6.B
【详解】A.由晶胞结构可知,氟离子全部位于晶胞内部,故A正确;
B.由晶胞结构可知,晶胞中位于顶点和面心的钙离子个数为8×+6×=4,故B错误;
C.氟化钙是由钙离子和氟离子构成的离子化合物,化合物中只含有离子键,故C正确;
D.氟化钡和氟化钙都是离子晶体,钡离子的离子半径大于钙离子,则氟化钡中的离子键弱于氯化钙,熔点低于氟化钙,故D正确;
故选B。
7.B
【详解】A.正戊烷和新戊烷形成的晶体都是分子晶体,由于新戊烷支链多,对称性好,分子间作用力小,所以沸点较低,故A正确
B.水为极性分子,碘单质与四氯化碳为非极性分子,根据相似相溶可知,碘单质易溶于四氯化碳而微溶于水,与共价键极性无关,故B错误;
C.由于电负性F>H,C-F键极性大于C-H键,使得羧基上的羟基极性增强,氢原子更容易电离,酸性增强,故C正确;
D.AlF3为离子化合物,形成的晶体为离子晶体,熔点较高,AlCl3为共价化合物,形成的晶体为分子晶体,熔点较低,所以AlF3熔点远高于AlCl3,故D正确;
故选B。
8.B
【详解】A.晶体和非晶体的本质区别是内部粒子排列的有序性,从而使晶体在宏观上具有自范性,A正确;
B. 金属晶体的 熔点不一定比 分子晶体的熔点高,大多数情况下,金属晶体的熔点高于分子晶体,但也存在例外,例如, 汞的熔点为-38.87℃,而一些分子晶体的熔点可能高于这个温度,B错误;
C.干冰、氯化铝均为分子晶体,两者所克服的粒子间作用力均为分子间作用力,C正确;
D.共价晶体中,由于各原子均以共价键相结合,具有三维骨架结构,因此一般熔点很高,硬度很大,D正确;
故选B。
9.A
【详解】A.Co为27号元素,价电子排布式为3d74s2,排布在周期表的第Ⅷ族,属于副族元素,它属于d区元素,不属于ds区元素,A错误;
B.IL中的阴离子中,P原子的价层电子对数为6,发生sp3d2杂化,空间构型为正八面体,B正确;
C.该电化学装置中,H2O在阳极得到空穴(h+)后生成O2等,则阳极反应为:,C正确;
D.传统有机溶剂,微粒间只存在微弱的分子间作用力(有的含有氢键),而IL中粒子为带电荷的离子(离子液体),故具有难挥发的优势,D正确;
故选A。
10.A
【详解】A.CO2中心原子碳原子为sp杂化,直线型结构,属于非极性分子,A项正确;
B.液溴挥发时克服分子间作用力,B项错误;
C.是三角锥形,是平面三角形,C项错误;
D.离子半径:,熔点:NaCl>NaBr,D项错误;
答案选A。
11.B
【详解】A.C(金刚石)和C(石墨)中都只含有共价键,C(金刚石)是共价晶体,C(石墨)是混合型晶体,晶体类型不同,故A错误;
B.CH4和H2O都是分子晶体,CH4和H2O都只含共价键,晶体和化学键类型都相同,故B正确;
C.AlCl3中含有共价键,NaCl中含有离子键,AlCl3是分子晶体,NaCl是离子晶体,化学键类型、晶体类型都不相同,故C错误;
D.O2中含有共价键,属于分子晶体,Ar中不含有化学键,故D错误;
故选B。
12.D
【详解】A.晶胞中S原子个数为8×+6×=4,又S构成的每个正四面体中心均含一个Cu,所以Cu原子的数目为8,该化合物的化学式为,A项正确;
B.S构成的每个正四面体中心均含一个Cu,所以晶胞中Cu的配位数为4,化合物的化学式为,则晶胞中S的配位数为4×2=8,B项正确;
C.晶胞中S位于8个顶点和6个面心,沿晶胞体对角线投影图中S的位置为,C项正确;
D.晶胞中S位于8个顶点和6个面心,又S构成的每个正四面体中心均含一个Cu,所以Cu、S的最短距离为体对角线的,即为pm,D项错误;
故选D。
13.C
【详解】A.分子内的羟基氢与非羟基氧形成氢键,即分子内氢键,导致沸点较低。A正确;
B.石墨为层状结构,层与层之间的碳原子平面相隔较远,电子不易跨越,所以未杂化的p轨道重叠使电子几乎只能在整个碳原子平面中运动,石墨的导电性只能沿石墨平面的方向,B正确;
C.中有两组3中心4电子键,电子云分布更均匀,分子较为稳定,能量较低,C错误;
D.Cl的电负性较大,是吸电子基团,使双键电子云向中间碳原子偏移,电荷相反基团相互吸引,所以分子中带正电性的Cl易连在带负电性中心碳原子上,D正确;
故选C。
14.D
【详解】A.电子层数相同,质子数越多半径越小,半径:,故A错误;
B.同主族从上到下,第一电离能逐渐减小,电离能:,故B错误;
C.非金属性越强,电负性越大,电负性:,故C错误;
D.金属原子半径越小、价电子数越多熔点越高,熔点:,故D正确;
选D。
15.A
【分析】X、Y、Z、W是原子序数依次增大的前四周期元素,X元素有三种能量不同的电子,且最高能级含有3个单电子,X为N;Y元素原子的核外电子只有8种运动状态,Y为O;Z为地壳中含量最多的金属元素,Z为Al;基态W原子在前四周期元素中未成对电子数最多,W为Cr;故X、Y、Z、W分别为N、O、Al、Cr。
【详解】A.为,中心原子价层电子对数为,sp2杂化,没有孤对电子,键角为120°;为,中心原子价层电子对数为,sp2杂化,有1对孤对电子,因为孤对电子对成键电子对的排斥力大于成键电子对之间的排斥力,故键角小于120°,故键角,A正确;
B.N的最高能级为半充满稳定结构,第一电离能大于O,Al易失去电子,第一电离能小,故第一电离能:,B错误;
C.Cr为d区元素,C错误;
D.单质Y 为O2,分子晶体,熔沸点最小;Z 为Al,W为Cr,同为金属晶体,价电子数越多,原子半径越小,金属键越强,Cr的价电子数为6,而Al为3,故金属键键能Cr>Al,熔沸点Cr>Al,故熔、沸点:Cr>Al > O2,D错误;
故答案选A。
16.(1) ④ ③
(2) ⑤ ②③⑥
(3) 高于 两者均为分子晶体,结构相似,CS2的相对分子质量较大,沸点较高
(4) 氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,离子晶体的熔沸点高于分子晶体的熔沸点 NH2Cl+H2O NH3+HClO
【详解】(1)同种元素组成的不同种单质互称同素异形体,16O2与18O3属于同素异形体。具有相同质子数、不同中子数的同种元素的不同种原子互称为同位素,12C、13C与14C属于同位素,答案:④;③;
(2)①碘溶于四氯化碳中,破坏分子间作用力,②HCl溶于水,HCl发生电离,破坏共价键,③SiO2熔化,破坏共价键④干冰升华,破坏分子间作用力⑤Na2O熔化,发生电离,破坏离子键⑥水在2000℃下分解,破坏共价键, 所以破坏离子键的有⑤;破坏共价键的有②③⑥,答案:⑤;②③⑥;
(3)CO2电子式因为CO2和CS2均为分子晶体,结构相似,CS2的相对分子质量较大,范德华力较大,沸点较高,答案:;高于;两者均为分子晶体,结构相似,CS2的相对分子质量较大,沸点较高;
(4)氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,离子晶体的熔沸点高于分子晶体的熔沸点。NH2Cl与水反应产生有消毒能力的HClO,同时生成NH3,化学方程式NH2Cl+H2O NH3+HClO,答案:氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,离子晶体的熔沸点高于分子晶体的熔沸点;NH2Cl+H2O NH3+HClO。
17.(1)前三种氟化物为离子晶体,、、的半径依次减小,离子键依次增强;后三种氟化物为分子晶体,相对分子质量依次增大,分子间作用力依次增大
(2)二者属于共价晶体,半径,键长,键能,故熔点比的高
(3)异丁烷<正丁烷<异戊烷<正戊烷
(4)分子
【详解】(1)从题表中各物质熔点可判断前三种氟化物均为离子晶体,其熔点逐渐升高是因为、、的半径依次减小,故它们的离子键依次增强,熔点逐渐升高;后三种氟化物熔点很低,为分子晶体,由于相对分子质量越大,分子间作用力越强,故其熔点逐渐升高;
(2)、都是很好的半导体材料,晶体类型与晶体硅类似,都属于共价晶体,原子半径,键长,键能,故熔点前者高;
(3)烷烃中碳原子数越多,熔点越高;相同碳原子数的烷烃,支链越多,熔点越低,故答案为:异丁烷<正丁烷<异戊烷<正戊烷;
(4)根据题目中的信息知,的熔、沸点低,易溶于水等,它符合分子晶体的特征,故属于分子晶体。
18. 离子晶体 原子晶体 分子晶体 离子键 共价键
【分析】A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成。根据A的水溶液与Ag+反应有白色沉淀,说明A的水溶液中有Cl-,再根据其可以导电得A为NaCl或HCl,又因为其硬度较大,熔点较高,所以A为NaCl;根据B的熔点很高、硬度很大、不导电、不溶于水,可判断其应该为原子晶体,所以B为金刚石;根据C的熔点很低、硬度很小,液态不导电,判断其为气体,易溶于水,水溶液与Ag+反应有白色沉淀,所以C为HCl;结合物质的组成和性质分析解答。
【详解】(1)由以上分析可知,A为NaCl,B为金刚石(C),C为HCl,故答案为:NaCl;HCl;
(2)A的熔点较高,熔融状态下能导电,为离子晶体;B的熔点很高、硬度很大、不导电、不溶于水,为原子晶体;C熔点很低、硬度很小,为分子晶体,故答案为:离子晶体;原子晶体;分子晶体;
(3)A为NaCl,NaCl为离子化合物,晶体中粒子间的作用力为离子键;B为金刚石(C),金刚石为原子晶体,原子间以共价键结合,故答案为:离子键;共价键。
【点睛】把握离子晶体、原子晶体以及分子晶体的结构和性质的区别是解题的关键。本题的易错点为A的判断,要注意分子晶体和离子晶体熔融状态导电性的区别。
19.(1) 阳离子 阴离子
(2)阴、阳离子
(3)离子键
(4)强碱
【解析】略
20.(1)为离子晶体,而分子晶体,克服离子键比分子间作用力更难
(2)离子键、共价键、分子间作用力(氢键)
(3)对羟基苯甲酸的熔点高于邻羟基苯甲酸,原因为:对羟基苯甲酸形成分子间氢键,比邻羟基苯甲酸形成的分子内氢键作用力更强
【解析】(1)
为离子晶体,而分子晶体,克服离子键比分子间作用力更难,因此的熔点(1291℃)比的熔点(190℃)高很多,故答案为:为离子晶体,而分子晶体,克服离子键比分子间作用力更难;
(2)
溶于水生成氢氧化钠,克服的微粒间作用力有离子键、共价键、分子间作用力(氢键),故答案为:离子键、共价键、分子间作用力(氢键);
(3)
对羟基苯甲酸能形成分子间氢键,而邻羟基苯甲酸能形成分子内氢键,当对羟基苯甲酸熔融时,需要消耗较多的能量克服分子间氢键,所以对羟基苯甲酸的熔点高于邻羟基苯甲酸,故答案为:对羟基苯甲酸的熔点高于邻羟基苯甲酸,原因为:对羟基苯甲酸形成分子间氢键,比邻羟基苯甲酸形成的分子内氢键作用力更强。
21.(1)TiF4为离子化合物,熔点高,其他三种均为共价化合物,其组成和结构相似,随相对分子质量的增大,分子间作用力增大,熔点逐渐升高
(2)邻羟基苯甲酸形成分子内氢键,使熔点降低,而对羟基苯甲酸形成分子间氢键,使熔点升高
【分析】(1)
根据题目所给数据可知TiF4熔点较高,可知其应为离子化合物,其他三种均为共价化合物,为分子晶体,其组成和结构相似,随相对分子质量的增大,分子间作用力增大,熔点逐渐升高。
(2)
邻羟基苯甲酸形成分子内氢键,使熔点降低,而对羟基苯甲酸形成分子间氢键,分子间氢键增大了分子间的作用力,使熔点升高,故对羟基苯甲酸的熔点比邻羟基苯甲酸的熔点高。
22. O2- F>O>Fe H3AsO4中非羟基氧原子数多于H3AsO3, As的正电性更高,更容易电离出氢离子 化学变化 LiAsF6 AsF的半径比PF的大,AsF与Li+的作用力比PF弱
【详解】(1)基态锂原子的轨道表达式为;
(2)O2-和F-的核外电子排布相同,核电荷数越小,半径越大,故半径更大的是O2-;非金属的第一电离能比金属元素的第一电离能大,同周期从左至右,第一电离能呈增大趋势,故O、F、Fe的第一电离能由大到小的顺序为F>O>Fe;
(3)H3AsO4的酸性强于H3AsO3的原因为H3AsO4中非羟基氧原子数多于H3AsO3,As的正电性更高,更容易电离出氢离子;
(4)从图可知,Li+迁移过程中生成了新的物质,发生了化学变化;
(5)由于P原子的半径小于As原子的半径,所以AsF的半径比PF的大,AsF与Li+的作用力比PF弱,故导致Li+更易在LiAsF6电极中脱嵌。
23.(1)
(2) sp3杂化 难溶 范德华力 共价键 CS2>>
(3) < SF6是分子晶体,AlF3是离子晶体,离子晶体的熔点高于分子晶体 沸点更高,因为形成分子间氢键
(4) 正四面体
【详解】(1)硫的核电荷数为16,基态硫原子的电子排布式为1s22s22p63s23p4,则其价层电子排布图是;
(2)①在分子中每个硫原子与两个硫原子形成共价键,另外硫原子还有2个未成键电子对,则其杂化方式为sp3杂化,该分子内只存在非极性共价键,为非极性分子,难溶于极性溶剂水中,该晶体中存在的作用力分子间作用力和、共价键(或非极性共价键);
②SO42-中硫原子为sp3杂化、CS2中碳原子为sp杂化、CO32-中碳原子为sp2杂化,则三者键角由大到小的顺序是CS2>CO32->SO42-;
(3)①SF6是分子晶体,AlF3是离子晶体,离子晶体的熔点高于分子晶体,即熔点SF6>_A1F3;
② 分子间能形成氢键,而只能形成分子内氢键,则沸点更高;
(4)①由图可知,Zn2+周围最靠近的4个S2-形成正四面体结构,Zn2+填在了S2-形成的正四面体空隙中;
②设晶胞的边长为xcm,则晶胞体积为x3cm3,晶胞中含有ZnS的数目应该是4个,则NA个晶胞的质量为4×87g,晶胞的密度=(4×87g)÷(NA×x3cm3)=g/cm3,解题x=_=_pm。
24.(1) 6 6 4 4 12
(2)AD
【详解】(1)在NaCl晶体中,每个Na+周围同时吸引6个Cl-,每个Cl-周围同时吸引6个Na+;该晶胞中,Na+的个数为12+1=4,Cl-的个数为=4;晶体中每个Na+周围与它距离最近且相等的Na+共有12个。
(2)A.氯化钠晶体是由Na+、Cl-构成的粒子晶体,A正确;
B.氯化钠晶体中,相邻的阴、阳离子核间距大于阴、阳离子半径之和,B错误;
C.氯化钠晶体呈面心立方堆积,氯化铯晶体呈体心立方堆积,二者晶体结构不同,C错误;
D.氯化钠晶体中以Na+为中心向三维方向伸展,有6个Cl-与Na+紧邻,D正确;
故选AD。
25.(1) 干冰晶体 冰晶体
(2)金刚石冰干冰
(3) 4 4 8
(4)
【详解】(1)根据各晶体的构成和分析,分子晶体中粒子之间为范德华力,构成晶体的粒子之间主要以范德华力结合形成的晶体是干冰晶体、冰晶体;故答案为:干冰晶体;冰晶体;
(2)熔点的一般规律:共价晶体>离子晶体>分子晶体,再结合晶体微粒作用力可得,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石冰干冰,故答案为:金刚石冰干冰;
(3)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为=4;MgO晶胞中Mg2+位于棱上与体心,晶胞中Mg2+数目为1+12×=4,;在CaCl2晶体中,每个Cl-周围最近距离的Ca2+分布在一个顶点以及和这个顶点相连的三个面的面心上,一共是4个,每个Ca2+被8个Cl-所包围,故答案为:4:4:8;
(4)C60晶体中,每2个C原子形成一个π键,则1mol C60晶体中含π键数目为1mol×60××NAmol-1=30NA,故答案为:30NA。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
