第一章原子结构与元素性质同步练习 2024-2025学年高二化学人教版(2019)选择性必修2(含答案)
文档属性
| 名称 | 第一章原子结构与元素性质同步练习 2024-2025学年高二化学人教版(2019)选择性必修2(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 819.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 21:09:31 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第一章原子结构与元素性质
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列状态的硼中,失去一个电子需要吸收能量最大的是
A. B. C. D.
2.下列化学用语正确的是
A.乙烯的球棍模型:
B.基态的价层电子排布式:
C.HClO的电子式:
D.基态电子排布的轨道表示式:
3.我国成功研制72亿年仅误差一秒的锶原子光晶格钟。下列有关说法不正确的是
A.Sr位于第五周期 B.Sr位于s区
C.Sr与同周期ⅢA族元素原子序数相差1 D.的碱性强于
4.雄黄(,)与雌黄(,)是古代重要的药物和染料,二者可发生如图转化:雄黄(三元弱酸)雄黄。下列说法错误的是
A.1mol雄黄中含有极性共价键的数目为
B.基态As原子最高能级有3个未成对电子
C.溶液中的离子浓度存在如下关系:
D.雄黄和雌黄分子中各原子最外层均满足8电子稳定结构
5.某元素原子的外围电子排布式为2s22p4,则下列对其在周期表中的位置叙述正确的是
A.第2周期第ⅥA族 B.第2周期第ⅦA族
C.第2周期第ⅤA族 D.第3周期ⅡA族
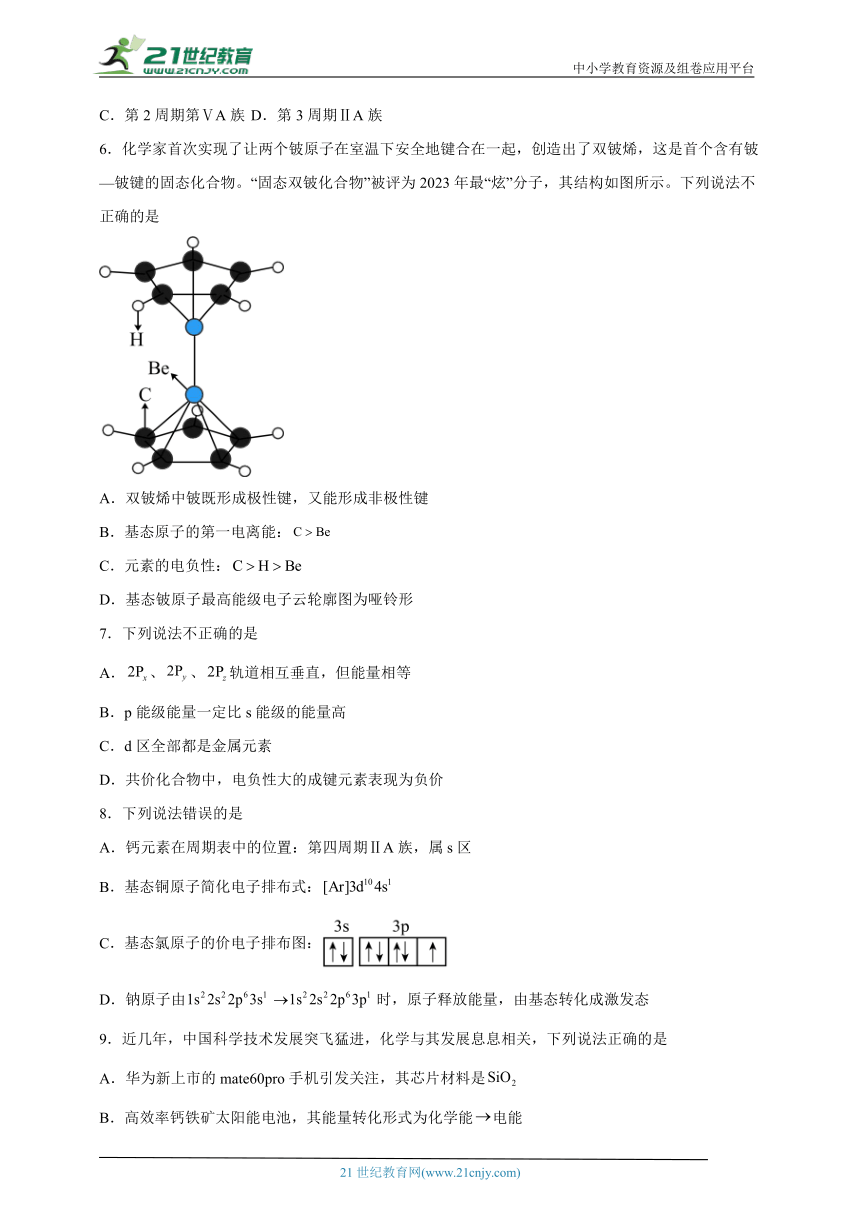
6.化学家首次实现了让两个铍原子在室温下安全地键合在一起,创造出了双铍烯,这是首个含有铍—铍键的固态化合物。“固态双铍化合物”被评为2023年最“炫”分子,其结构如图所示。下列说法不正确的是
A.双铍烯中铍既形成极性键,又能形成非极性键
B.基态原子的第一电离能:
C.元素的电负性:
D.基态铍原子最高能级电子云轮廓图为哑铃形
7.下列说法不正确的是
A.、、轨道相互垂直,但能量相等
B.p能级能量一定比s能级的能量高
C.d区全部都是金属元素
D.共价化合物中,电负性大的成键元素表现为负价
8.下列说法错误的是
A.钙元素在周期表中的位置:第四周期ⅡA族,属s区
B.基态铜原子简化电子排布式:
C.基态氯原子的价电子排布图:
D.钠原子由时,原子释放能量,由基态转化成激发态
9.近几年,中国科学技术发展突飞猛进,化学与其发展息息相关,下列说法正确的是
A.华为新上市的mate60pro手机引发关注,其芯片材料是
B.高效率钙铁矿太阳能电池,其能量转化形式为化学能电能
C.“北斗卫星”授时系统的“星载铷钟”所含的铷是通过原子光谱发现的元素
D.“深海一号”母船海水浸泡区的铝基保护船体的方法为外加电流保护法
10.下列叙述I和叙述II均正确,且有因果关系的是
选项 叙述I 叙述II
A 氯乙烷易分解且吸收热量 氯乙烷可用于运动中的急性损伤
B 铅蓄电池发生了充电反应 铅蓄电池使用过程中两电极的质量均增加
C 原子的能级是量子化的 原子光谱是连续的线状谱线
D SO2具有杀菌、防氧化功能 酿造葡萄酒的过程中添加适量SO2
A.A B.B C.C D.D
11.海水晒盐后精制得到,氯碱工业电解饱和溶液得到和;以、、等为原料可得到;向海水晒盐得到的卤水中通可制溴;从海水中还能提取镁。中,第一电离能最小的是
A. B. C. D.
12.下列化学用语表示错误的是
A.的结构式:
B.F2的共价键电子云轮廓图:
C.原子核内有8个中子的碳原子:
D.熔融状态下NaHSO4的电离方程式:NaHSO4=Na++
13.血红素是人体内重要的物质,结构如图所示。下列说法正确旳是
A.第一电离能:CB.基态氮原子价层电子的轨道表示式为:
C.基态碳原子核外电子运动状态有6种
D.基态氧原子最高能级的电子云轮廓图为球形
14.下列图像表示正确的是
A. B. C. D.
15.2022年诺贝尔化学奖授予开发“点击化学”的科学家。分子R称为“点击化学试剂”,其结构如图所示。下列说法错误的是
A.基态O原子价电子排布式为:
B.离子半径:
C.F原子核外有7种空间运动状态不同的电子
D.分子R中四种元素都位于元素周期表p区
二、填空题
16.回答下列问题:
(1)①元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为 nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
②基态K原子中,核外电子占据最高能层的符号是 ,占据该能层电子的电子云轮廓图形状为 。
(2)①氮原子价层电子的轨道表达式(电子排布图)为 。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是 ;氮元素的E1呈现异常的原因是
(3)①Fe3+基态核外电子排布式为
②C、H、O三种元素的电负性由小到大的顺序为 。
17.按要求完成下列问题。
(1)完成下列关于磷与硫的比较(用“>”或“<”或“=”)。
原子半径:P S;非金属性:P S;电负性:P S;第一电离能:P S。
(2)第一电离能介于B、N之间的第二周期元素有 种。
18.检验K元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因: 。
19.回答下列问题。
(1)已知电负性:H>Si,则SiHCl3充分水解的化学方程式为 。
(2)氮杂氟硼二吡咯具有作为光动力学治疗(PDT)光敏剂的潜能,结构如图所示,该分子中所有元素的电负性由大到小的顺序为 (用元素符号表示)。
20.I.请写出下列基态粒子的简化电子排布式:
(1)S: 。
(2)Cr: 。
II.
(3)在一定温度下,Mg(OH)2在水中的沉淀溶解平衡可用离子方程式表示为 ,该平衡的Ksp可表示为 。
21.电池材料的很多金属元素灼烧时会产生特殊的火焰颜色,焰色反应是原子的 光谱。
A.发射 B.吸收 C.两者都不是
22.完成下列问题
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第 周期第 族。
②基态C原子核外电子排布式为 ;基态N原子核外有 种运动状态的电子。
③基态Si原子核外电子占据的最高能级的电子云轮廓图为 形。
④Mg、Al 两种元素中第一电离能较大的是 (填元素符号),原因为 。
(2)几种元素的电负性数据如下表:
O F Al Br ……
3.5 4.0 1.5 2.8 ……
①AlF3的熔点 AlBr3的熔点(填“大于”、“小于”或“等于”),原因是 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为 。
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为 。
23.比较下列能级的能量大小关系(填“>”“=”或“<”):
(1)2s 4s;3p 3d;
(2)3d 4s;
24.如图是元素周期表的一部分,请回答下列问题:
IA IIA IIIA IVA VA VIA VIIA 0族
1 ①
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)在这些元素中,单质的化学性质最不活泼的是 (填元素符号)。
(2)③的气态氢化物的电子式 ,②④形成的气态化合物的结构式 。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为 (填物质的化学式),写出它的电子式: ;酸性最强的含氧酸为 (填物质的化学式),写出它的电离方程式: 。
(4)在②和③两种元素中,非金属性较强的是 (填元素名称),②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式 。
(5)②与Si元素分别形成的最高价氧化物, 的熔点更高,原因是 。
25.回答下列问题。
(1)基态与离子中未成对的电子数之比为 。
(2)基态原子的核外电子排布式为 。
(3)位于元素周期表中第四周期第 族。
(4)基态原子价电子的电子排布图(轨道表达式)为 。
(5)原子核外电子排布式为 。
(6)氮原子价层电子的轨道表达式(电子排布图)为 。
(7)基态原子核外电子排布式为 。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 A B C C A D B D C D
题号 11 12 13 14 15
答案 A C C C C
1.A
【分析】原子轨道能量的高低顺序为ns【详解】A.1s22s2和1s22s12p1表示B已经失去1个电子,第二电离能大于第一电离能,由于能量nsB.1s22s22p1为基态B原子,失去一个电子需要吸收的能量为第一电离能,1s22s2表示B已经失去1个电子,第二电离能大于第一电离能,B错误;
C.1s22s12p1表示B已经失去1个电子,由于能量nsD.1s22s12p2为B原子激发态,能量高于1s22s22p1,1s22s12p2电离最外层一个电子能量低于1s22s22p1,均小于1s22s2,D错误;
故答案选A。
2.B
【详解】
A.乙烯为平面结构,球棍模型为:,空间填充模型为:,故A错误;
B.基态Fe原子的核外电子排布式为:1s22s22p63s23p63d64s2,因此基态的价层电子排布式:,故B正确;
C.次氯酸的电子式:,故C错误;
D.氧为8号元素,核外电子排布式为:1s22s22p4,氧的基态原子的轨道表示式:,基态电子排布为:1s22s22p6,轨道表示式:,故D错误;
故答案选B。
3.C
【详解】A.Sr的原子序数为38,为Ca元素同主族的下一周期元素,故为第五周期元素,故A正确;
B.Sr为Ca元素同主族的下一周期元素,位于第IIA族,是s区元素,故B正确;
C.Sr与同周期ⅢA族元素中间相差了10种过渡金属元素,原子序数相差11,故C错误;
D.Sr为Ca元素同主族的下一周期元素,Sr的金属性强于Ca,故的碱性强于,故D正确;
答案选C。
4.C
【详解】A.1mol雄黄中含有极性共价键As-S的数目为8NA,故A正确;
B.基态As原子价电子排布式为1s2s22p63s23p63d104s24p3,最高能级4p上有3个未成对电子,故B正确;
C.0.1mol/LNa2HAsO3溶液中存在电荷守恒,溶液中的离子浓度存在如下关系:,故C错误;
D.每个As原子连接3个S原子,每个S原子连接2个As原子,S、As原子最外层均满足8电子稳定结构,故D正确;
答案选C。
5.A
【详解】元素原子的外围电子排布式为2s22p4,该元素为O,在周期表中的位置为:第2周期第ⅥA族,故选A。
6.D
【详解】A.由其结构可以看出,其含有的Be-C之间是极性键,Be-Be之间是非极性键,故A正确;
B.同周期元素第一电离能从左到右呈增大的趋势,则基态原子的第一电离能:,故B正确;
C.根据元素的性质,各元素的电负性由大到小的顺序为:,故C正确;
D.基态铍原子其核外电子排布式为1s22s2,最高能级为2s,电子云轮廓图为球形,故D错误;
故选D。
7.B
【详解】A.2Px、2Py、2Pz轨道相互垂直,均为2p轨道,能量相等,A正确;
B.在同一个能层中能级能量按照s、p、d等依次升高,但是若是不同能层则p能级的能量不一定高于s能级,如4s能级比2p能级能量高, B错误;
C.由元素周期表可知,d区全部是金属元素,C正确;
D.共价化合物中电负性大的成键元素吸引电子能力强,表现为负价,D正确;
故选B。
8.D
【详解】A.钙元素基态原子的电子排布式为,位于元素周期表的第四周期ⅡA族,属s区,A正确;
B.基态铜原子的电子排布式:,简化电子排布式:,B正确;
C.基态氯原子的价电子排布式:,则氯原子的价电子排布图:,C正确;
D.钠原子由基态转化为激发态,要吸收能量,D错误;
故选D。
9.C
【详解】A.华为新上市的mate60pro手机引发关注,其芯片材料是晶体硅,A错误;
B.高效率钙钛矿太阳能电池,其能量转化形式为太阳能→电能,B错误;
C.“北斗卫星”授时系统的“星载铷钟”所含的铷元素是通过原子光谱发现的,C正确;
D.“深海一号”母船海水浸泡区的铝基保护船体的方法为牺牲阳极保护法,D错误;
故选C。
10.D
【详解】A.氯乙烷由液态转变为气态时,分子间的距离增大,需要吸收周围环境中的热量,从而减缓运动中因急性损伤而产生的疼痛,并未分解,故A错误;
B.铅蓄电池充电时,阳极发生氧化反应:PbSO4+2H2O-2e-=PbO2+4H++,阴极发生还原反应:PbSO4+2e-=Pb+,充电时两个电极质量减少,故B错误;
C.原子光谱是不连续的线状谱线,说明原子的能级是不连续的,原子能级是量子化的,故C错误;
D.二氧化硫具有还原性,葡萄酒中添加适量的SO2可以起到杀菌和抗氧化的作用,故D正确;
故选D。
11.A
【详解】同周期元素:随着原子序数的递增,元素的第一电离能呈现增大的趋势,但第ⅡA与VA元素由于s能级全满或p能级半满的原因,第一电离能会有所不同,故Cl>Mg>Na,同主族元素:从上到下,第一电离能逐渐减小,Cl>Br,因Br为非金属元素则第一电离能大于Mg和Na,因此第一电离能最小的是Na;
故选A。
12.C
【详解】A.是共价化合物,结构式为,A正确;
B.F2中两个F原子的2p轨道“头碰头”重叠形成p-p键,电子云轮廓图:,B正确;
C.原子核内有8个中子的碳原子质量数为8+6=14,表示为,C错误;
D.熔融状态下NaHSO4电离产生Na+和,电离方程式为:NaHSO4=Na++,D正确;
故选C。
13.C
【详解】A.已知同一周期从左往右元素第一电离能呈增大趋势,ⅡA与ⅢA、ⅤA与ⅥA反常,故第一电离能:C< O < N,A错误;
B.已知N为7号元素,则基态氮原子价层电子的电子排布式为:2s22p3,根据洪特规则可知,其价电子的轨道表示式为:,B错误;
C.根据泡利不相容原理可知,碳为6号元素,故基态碳原子核外电子运动状态有6种,C正确;
D.已知O为8号元素,则基态氧原子的价层电子排布式为:2s22p4,故最高能级为2p能级,故电子云轮廓图为纺锤体或哑铃形,D错误;
故答案为:C。
14.C
【详解】A.氟、氯、溴的原子半径依次增大,氢卤键长增长,键能减小,故A错误;
B.NH3分子间存在氢键,NH3沸点最高,PH3和AsH3相比,相对分子质量越大,分子间作用力越大沸点越高,故沸点NH3>AsH3>PH3,故B错误;
C.非金属元素原子与氢原子形成共价键时,元素非金属性越强,键的极性越强。C、N、F处于同周期,原子序数逐渐增大,非金属性逐渐增强,键的极性增强,故C正确;
D.镁原子价电子为3s2,失去2个电子后为8电子稳定结构,其第三电离能远大于第二电离能,D错误;
故选C。
15.C
【详解】A.基态O原子价电子层有6个电子,所以其价电子排布式为:,故A正确;
B.三种离子具有相同电子层结构,所以核电荷数越小,离子半径越大,即离子半径:,故B正确;
C.F原子核外电子数为9,每个电子都有其特定的运动状态,包括轨道和自旋状态,所以有9种空间运动状态不同的电子,故C错误;
D.分子R中有四种元素,都位于元素周期表p区,故D正确;
故选C。
16.(1) A N 球形
(2) 同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N原子的2p轨道为半充满状态,具有稳定性,故不易结合一个电子
(3) [Ar]3d5或1s22s22p63s23p63d5 H<C<O
【解析】(1)
①紫色光对应的辐射波长范围是400~430 nm,选A;
②基态K原子中,核外电子排布式为1s22s22p63s23p64s1,核外电子占据最高能层的符号是N,占据该能层的电子处于4s能级,电子云轮廓图形状为球形;
(2)
①氮原子核外电子排布式是1s22s22p3,价层电子排布式是2s22p3,轨道表达式(电子排布图)为;
②同周期元素,从左到右非金属性依次增大,原子核对电子的束缚能力增大,除氮原子外,其他原子得电子能力依次增大,得电子后形成的阴离子稳定性逐渐增大,所以根据第一电子亲和能的定义可知同周期元素的第一电子亲和能自左向右依次增大;N的2p能级上有3个电子,处于半满状态,属于较稳定状态,得电子能力相对较弱,因此第一电子亲和能较同周期相邻元素要低;
(3)
①Fe为26号,价层电子数为26-18=8,价层电子排布式为3d64s2,失去电子时,先失去4s上的2个电子,再失去3d上的一个电子,即为[Ar]3d5;
②元素的非金属性越强电负性越大,非金属性O>C>H,所以电负性:O>C>H。
17.(1) > < < >
(2)三
【详解】(1)同周期主族元素,从左至右,原子半径逐渐减小;非金属性逐渐增大;电负性逐渐增大;第一电离能有逐渐增大的趋势,但IIA族> IIA族,VA族> VIA族,故答案为:原子半径:P>S,非金属性:P S;
(2)同周期主族元素,从左至右,第一电离能有逐渐增大的趋势,但IIA族>IIIA族,VA族> VIA族,故第一电离能介于B、N之间的有:Be、 C、O共三种;
18.当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态原子,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量
【详解】当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态原子,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量
19.(1)SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑
(2)F>N>C>H>B
【详解】(1)已知电负性:H>Si,则H吸引电子的能力比Si强,SiHCl3中H显-1价,Si显+4价,因此SiHCl3水解时除生成硅酸和HCl外,其-1价的H还和H2O中+1价的H反应生成氢气,故其水解的化学方程式为SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑;
(2)该分子中所有元素为H、B、C、N、F,根据同一周期从左往右电负性依次增大,同一主族从上往下电负性依次减小,电负性由大到小的顺序为F>N>C>H>B。
20.(1)
(2)
(3)
【详解】(1)S为16号元素,简化电子排布式为:;
(2)Cr为24号元素,根据洪特规则特例,简化电子排布式为:;
(3)在一定温度下,Mg(OH)2难溶于水,在水中的沉淀溶解平衡可用离子方程式表示为;该平衡的。
21.A
【详解】当基态原子的电子吸收能量后,电子会跃迁到较高能级,原子从基态变成激发态,电子从能量较高的轨道回到能量较低的轨道时,将以光的形式释放能量,产生特殊的火焰颜色,则焰色反应是原子的发射光谱,故选A。
22.(1) 四 IB 1s22s22p2 7 锤形(哑铃) Mg 镁原子3s能级上有两个电子,失去的是3s能级上的电子,铝原子价电子排布式为3s23p1,失去的是3p上的电子,3p上的电子能量较高,容易失去,所以镁的第一电离能大
(2) 大于 AlF3中两元素电负性差值大于1.7,属于离子化合物;而AlBr3中两元素电负性差值小于1.7 属于共价化合物;离子化合物熔点高于共价化合物 小于2.8 +1
【详解】(1)①Cu位于元素周期表中的第四周期ⅠB族;
②C原子位于元素周期表第二周期第ⅣA族,因此基态C原子核外电子排布式为1s22s22p2;N核外有7个电子,则有7种不同运动状态的电子;
③基态Si原子核外电子占据的最高能级的电子云轮廓图为锤形(哑铃);
④镁原子3s能级上有两个电子,失去的是3s能级上的电子,铝原子价电子排布式为3s23p1,失去的是3p上的电子,3p上的电子能量较高,容易失去,所以镁的第一电离能大;
(2)①AlF3中两元素电负性差值大于1.7,属于离子化合物;而AlBr3中两元素电负性差值小于1.7 属于共价化合物;离子化合物熔点高于共价化合物,因此为大于;
②F、Br是同一主族根据题意可知同主族自上而下电负性减小因此I的电负性小于2.8;
③根据题意可知Cl的电负性小于4.0大于2.8,而I的电负性小于2.8,Cl的电负性强于I得电子能力大于I,因此I的化合价为+1。
23.(1) < <
(2)>
【分析】由构造原理可知:①同一电子层的能级能量高低顺序为 ns<np<nd<nf;②不同电子层之间,能量会产生能级交错现象,即电子层序数大的能级,其能量不一定高,如3d能级具有的能量就高于4s能级所具有的能量,
【详解】(1)由构造原理可知2s能级能量小于4s能级的能量,同一电子层的能级能量高低顺序为 np<nd,故答案为:<;<;
(2)由于能级交错现象导致3d能级具有的能量就高于4s能级所具有的能量,故答案为:>。
24. Ar O=C=O NaOH HClO4 HClO4=H++ClO4- 氮 C+4HNO3(浓)CO2↑+4NO2↑+2H2O SiO2 SiO2为原子晶体,熔融时需破坏共价键
【分析】由表中元素所在的位置,可确定①为氢(H),②为碳(C),③为氮(N),④为氧(O),⑤为钠(Na),⑥为镁(Mg),⑦为硫(S),⑧氯(Cl),⑨为氩(Ar)。
【详解】(1)在这些元素中,单质的化学性质最不活泼的是稀有气体元素Ar。答案为:Ar;
(2)③为氮元素,其气态氢化物的化学式为NH3,电子式为,②④形成的气态化合物为CO2,它的结构式为O=C=O。答案为:;O=C=O;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的是钠的氢氧化物,化学式为NaOH,它的电子式为;酸性最强的含氧酸为高氯酸,化学式为HClO4,它是一元强酸,发生完全电离,电离方程式为HClO4=H++ClO4-。答案为:NaOH;;HClO4;HClO4=H++ClO4-;
(4)同周期元素,从左往右,非金属性依次增强,则在②和③两种元素中,非金属性较强的是氮,②的单质为碳,和③的最高价氧化物的水化物硝酸反应,生成二氧化碳、二氧化氮和水,有关化学方程式为C+4HNO3(浓) CO2↑+4NO2↑+2H2O。答案为:氮;C+4HNO3(浓) CO2↑+4NO2↑+2H2O;
(5)②与Si元素分别形成的最高价氧化物为CO2、SiO2,前者为分子晶体,后者为原子晶体,SiO2的熔点更高,原因是SiO2为原子晶体,熔融时需破坏共价键。答案为:SiO2;SiO2为原子晶体,熔融时需破坏共价键。
【点睛】碳与稀硝酸即便在加热条件下也不能发生化学反应,碳与浓硝酸混合液,若不加热,反应不能发生,也就是说,只有碳与浓硝酸在加热条件下才能反应,生成三种非金属氧化物。
25.(1)4:5
(2)1s22s22p63s23p63d24s2或[Ar] 3d24s2
(3)ⅦB
(4)
(5)1s22s22p63s23p63d104s2或[Ar] 3d104s2
(6)
(7)1s22s22p63s23p63d74s2或[Ar] 3d74s2
【详解】(1)Fe2+的电子排布式为1s22s22p63s23p63d6,Fe3+的电子排布式为1s22s22p63s23p63d5,Fe2+有4个未成对电子,Fe3+基态有5个未成对电子,则基态与离子中未成对的电子数之比为4:5;
(2)Ti为22号元素,核外共22个电子,电子排布式为1s22s22p63s23p63d24s2或[Ar] 3d24s2。
(3))Mn是25号元素,价电子排布式为:3d54s2,故Mn位于元素周期表中第四周期第ⅦB族;
(4)
基态Fe原子核外电子排布为1s22s22p63s23p63d64s2,价电子的电子排布图(轨道表达式)为;
(5)Zn为30号元素,核外有30个电子,对应电子排布式为1s22s22p63s23p63d104s2或[Ar] 3d104s2;
(6)
N元素位于第二周期第ⅤA族,价层电子的轨道表达式(电子排布图)为;
(7)钴是27号元素,其基态原子核外有27个电子,对应排布式为1s22s22p63s23p63d74s2或[Ar] 3d74s2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第一章原子结构与元素性质
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列状态的硼中,失去一个电子需要吸收能量最大的是
A. B. C. D.
2.下列化学用语正确的是
A.乙烯的球棍模型:
B.基态的价层电子排布式:
C.HClO的电子式:
D.基态电子排布的轨道表示式:
3.我国成功研制72亿年仅误差一秒的锶原子光晶格钟。下列有关说法不正确的是
A.Sr位于第五周期 B.Sr位于s区
C.Sr与同周期ⅢA族元素原子序数相差1 D.的碱性强于
4.雄黄(,)与雌黄(,)是古代重要的药物和染料,二者可发生如图转化:雄黄(三元弱酸)雄黄。下列说法错误的是
A.1mol雄黄中含有极性共价键的数目为
B.基态As原子最高能级有3个未成对电子
C.溶液中的离子浓度存在如下关系:
D.雄黄和雌黄分子中各原子最外层均满足8电子稳定结构
5.某元素原子的外围电子排布式为2s22p4,则下列对其在周期表中的位置叙述正确的是
A.第2周期第ⅥA族 B.第2周期第ⅦA族
C.第2周期第ⅤA族 D.第3周期ⅡA族
6.化学家首次实现了让两个铍原子在室温下安全地键合在一起,创造出了双铍烯,这是首个含有铍—铍键的固态化合物。“固态双铍化合物”被评为2023年最“炫”分子,其结构如图所示。下列说法不正确的是
A.双铍烯中铍既形成极性键,又能形成非极性键
B.基态原子的第一电离能:
C.元素的电负性:
D.基态铍原子最高能级电子云轮廓图为哑铃形
7.下列说法不正确的是
A.、、轨道相互垂直,但能量相等
B.p能级能量一定比s能级的能量高
C.d区全部都是金属元素
D.共价化合物中,电负性大的成键元素表现为负价
8.下列说法错误的是
A.钙元素在周期表中的位置:第四周期ⅡA族,属s区
B.基态铜原子简化电子排布式:
C.基态氯原子的价电子排布图:
D.钠原子由时,原子释放能量,由基态转化成激发态
9.近几年,中国科学技术发展突飞猛进,化学与其发展息息相关,下列说法正确的是
A.华为新上市的mate60pro手机引发关注,其芯片材料是
B.高效率钙铁矿太阳能电池,其能量转化形式为化学能电能
C.“北斗卫星”授时系统的“星载铷钟”所含的铷是通过原子光谱发现的元素
D.“深海一号”母船海水浸泡区的铝基保护船体的方法为外加电流保护法
10.下列叙述I和叙述II均正确,且有因果关系的是
选项 叙述I 叙述II
A 氯乙烷易分解且吸收热量 氯乙烷可用于运动中的急性损伤
B 铅蓄电池发生了充电反应 铅蓄电池使用过程中两电极的质量均增加
C 原子的能级是量子化的 原子光谱是连续的线状谱线
D SO2具有杀菌、防氧化功能 酿造葡萄酒的过程中添加适量SO2
A.A B.B C.C D.D
11.海水晒盐后精制得到,氯碱工业电解饱和溶液得到和;以、、等为原料可得到;向海水晒盐得到的卤水中通可制溴;从海水中还能提取镁。中,第一电离能最小的是
A. B. C. D.
12.下列化学用语表示错误的是
A.的结构式:
B.F2的共价键电子云轮廓图:
C.原子核内有8个中子的碳原子:
D.熔融状态下NaHSO4的电离方程式:NaHSO4=Na++
13.血红素是人体内重要的物质,结构如图所示。下列说法正确旳是
A.第一电离能:C
C.基态碳原子核外电子运动状态有6种
D.基态氧原子最高能级的电子云轮廓图为球形
14.下列图像表示正确的是
A. B. C. D.
15.2022年诺贝尔化学奖授予开发“点击化学”的科学家。分子R称为“点击化学试剂”,其结构如图所示。下列说法错误的是
A.基态O原子价电子排布式为:
B.离子半径:
C.F原子核外有7种空间运动状态不同的电子
D.分子R中四种元素都位于元素周期表p区
二、填空题
16.回答下列问题:
(1)①元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为 nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
②基态K原子中,核外电子占据最高能层的符号是 ,占据该能层电子的电子云轮廓图形状为 。
(2)①氮原子价层电子的轨道表达式(电子排布图)为 。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是 ;氮元素的E1呈现异常的原因是
(3)①Fe3+基态核外电子排布式为
②C、H、O三种元素的电负性由小到大的顺序为 。
17.按要求完成下列问题。
(1)完成下列关于磷与硫的比较(用“>”或“<”或“=”)。
原子半径:P S;非金属性:P S;电负性:P S;第一电离能:P S。
(2)第一电离能介于B、N之间的第二周期元素有 种。
18.检验K元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因: 。
19.回答下列问题。
(1)已知电负性:H>Si,则SiHCl3充分水解的化学方程式为 。
(2)氮杂氟硼二吡咯具有作为光动力学治疗(PDT)光敏剂的潜能,结构如图所示,该分子中所有元素的电负性由大到小的顺序为 (用元素符号表示)。
20.I.请写出下列基态粒子的简化电子排布式:
(1)S: 。
(2)Cr: 。
II.
(3)在一定温度下,Mg(OH)2在水中的沉淀溶解平衡可用离子方程式表示为 ,该平衡的Ksp可表示为 。
21.电池材料的很多金属元素灼烧时会产生特殊的火焰颜色,焰色反应是原子的 光谱。
A.发射 B.吸收 C.两者都不是
22.完成下列问题
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第 周期第 族。
②基态C原子核外电子排布式为 ;基态N原子核外有 种运动状态的电子。
③基态Si原子核外电子占据的最高能级的电子云轮廓图为 形。
④Mg、Al 两种元素中第一电离能较大的是 (填元素符号),原因为 。
(2)几种元素的电负性数据如下表:
O F Al Br ……
3.5 4.0 1.5 2.8 ……
①AlF3的熔点 AlBr3的熔点(填“大于”、“小于”或“等于”),原因是 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为 。
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为 。
23.比较下列能级的能量大小关系(填“>”“=”或“<”):
(1)2s 4s;3p 3d;
(2)3d 4s;
24.如图是元素周期表的一部分,请回答下列问题:
IA IIA IIIA IVA VA VIA VIIA 0族
1 ①
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)在这些元素中,单质的化学性质最不活泼的是 (填元素符号)。
(2)③的气态氢化物的电子式 ,②④形成的气态化合物的结构式 。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为 (填物质的化学式),写出它的电子式: ;酸性最强的含氧酸为 (填物质的化学式),写出它的电离方程式: 。
(4)在②和③两种元素中,非金属性较强的是 (填元素名称),②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式 。
(5)②与Si元素分别形成的最高价氧化物, 的熔点更高,原因是 。
25.回答下列问题。
(1)基态与离子中未成对的电子数之比为 。
(2)基态原子的核外电子排布式为 。
(3)位于元素周期表中第四周期第 族。
(4)基态原子价电子的电子排布图(轨道表达式)为 。
(5)原子核外电子排布式为 。
(6)氮原子价层电子的轨道表达式(电子排布图)为 。
(7)基态原子核外电子排布式为 。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 A B C C A D B D C D
题号 11 12 13 14 15
答案 A C C C C
1.A
【分析】原子轨道能量的高低顺序为ns
C.1s22s12p1表示B已经失去1个电子,由于能量ns
故答案选A。
2.B
【详解】
A.乙烯为平面结构,球棍模型为:,空间填充模型为:,故A错误;
B.基态Fe原子的核外电子排布式为:1s22s22p63s23p63d64s2,因此基态的价层电子排布式:,故B正确;
C.次氯酸的电子式:,故C错误;
D.氧为8号元素,核外电子排布式为:1s22s22p4,氧的基态原子的轨道表示式:,基态电子排布为:1s22s22p6,轨道表示式:,故D错误;
故答案选B。
3.C
【详解】A.Sr的原子序数为38,为Ca元素同主族的下一周期元素,故为第五周期元素,故A正确;
B.Sr为Ca元素同主族的下一周期元素,位于第IIA族,是s区元素,故B正确;
C.Sr与同周期ⅢA族元素中间相差了10种过渡金属元素,原子序数相差11,故C错误;
D.Sr为Ca元素同主族的下一周期元素,Sr的金属性强于Ca,故的碱性强于,故D正确;
答案选C。
4.C
【详解】A.1mol雄黄中含有极性共价键As-S的数目为8NA,故A正确;
B.基态As原子价电子排布式为1s2s22p63s23p63d104s24p3,最高能级4p上有3个未成对电子,故B正确;
C.0.1mol/LNa2HAsO3溶液中存在电荷守恒,溶液中的离子浓度存在如下关系:,故C错误;
D.每个As原子连接3个S原子,每个S原子连接2个As原子,S、As原子最外层均满足8电子稳定结构,故D正确;
答案选C。
5.A
【详解】元素原子的外围电子排布式为2s22p4,该元素为O,在周期表中的位置为:第2周期第ⅥA族,故选A。
6.D
【详解】A.由其结构可以看出,其含有的Be-C之间是极性键,Be-Be之间是非极性键,故A正确;
B.同周期元素第一电离能从左到右呈增大的趋势,则基态原子的第一电离能:,故B正确;
C.根据元素的性质,各元素的电负性由大到小的顺序为:,故C正确;
D.基态铍原子其核外电子排布式为1s22s2,最高能级为2s,电子云轮廓图为球形,故D错误;
故选D。
7.B
【详解】A.2Px、2Py、2Pz轨道相互垂直,均为2p轨道,能量相等,A正确;
B.在同一个能层中能级能量按照s、p、d等依次升高,但是若是不同能层则p能级的能量不一定高于s能级,如4s能级比2p能级能量高, B错误;
C.由元素周期表可知,d区全部是金属元素,C正确;
D.共价化合物中电负性大的成键元素吸引电子能力强,表现为负价,D正确;
故选B。
8.D
【详解】A.钙元素基态原子的电子排布式为,位于元素周期表的第四周期ⅡA族,属s区,A正确;
B.基态铜原子的电子排布式:,简化电子排布式:,B正确;
C.基态氯原子的价电子排布式:,则氯原子的价电子排布图:,C正确;
D.钠原子由基态转化为激发态,要吸收能量,D错误;
故选D。
9.C
【详解】A.华为新上市的mate60pro手机引发关注,其芯片材料是晶体硅,A错误;
B.高效率钙钛矿太阳能电池,其能量转化形式为太阳能→电能,B错误;
C.“北斗卫星”授时系统的“星载铷钟”所含的铷元素是通过原子光谱发现的,C正确;
D.“深海一号”母船海水浸泡区的铝基保护船体的方法为牺牲阳极保护法,D错误;
故选C。
10.D
【详解】A.氯乙烷由液态转变为气态时,分子间的距离增大,需要吸收周围环境中的热量,从而减缓运动中因急性损伤而产生的疼痛,并未分解,故A错误;
B.铅蓄电池充电时,阳极发生氧化反应:PbSO4+2H2O-2e-=PbO2+4H++,阴极发生还原反应:PbSO4+2e-=Pb+,充电时两个电极质量减少,故B错误;
C.原子光谱是不连续的线状谱线,说明原子的能级是不连续的,原子能级是量子化的,故C错误;
D.二氧化硫具有还原性,葡萄酒中添加适量的SO2可以起到杀菌和抗氧化的作用,故D正确;
故选D。
11.A
【详解】同周期元素:随着原子序数的递增,元素的第一电离能呈现增大的趋势,但第ⅡA与VA元素由于s能级全满或p能级半满的原因,第一电离能会有所不同,故Cl>Mg>Na,同主族元素:从上到下,第一电离能逐渐减小,Cl>Br,因Br为非金属元素则第一电离能大于Mg和Na,因此第一电离能最小的是Na;
故选A。
12.C
【详解】A.是共价化合物,结构式为,A正确;
B.F2中两个F原子的2p轨道“头碰头”重叠形成p-p键,电子云轮廓图:,B正确;
C.原子核内有8个中子的碳原子质量数为8+6=14,表示为,C错误;
D.熔融状态下NaHSO4电离产生Na+和,电离方程式为:NaHSO4=Na++,D正确;
故选C。
13.C
【详解】A.已知同一周期从左往右元素第一电离能呈增大趋势,ⅡA与ⅢA、ⅤA与ⅥA反常,故第一电离能:C< O < N,A错误;
B.已知N为7号元素,则基态氮原子价层电子的电子排布式为:2s22p3,根据洪特规则可知,其价电子的轨道表示式为:,B错误;
C.根据泡利不相容原理可知,碳为6号元素,故基态碳原子核外电子运动状态有6种,C正确;
D.已知O为8号元素,则基态氧原子的价层电子排布式为:2s22p4,故最高能级为2p能级,故电子云轮廓图为纺锤体或哑铃形,D错误;
故答案为:C。
14.C
【详解】A.氟、氯、溴的原子半径依次增大,氢卤键长增长,键能减小,故A错误;
B.NH3分子间存在氢键,NH3沸点最高,PH3和AsH3相比,相对分子质量越大,分子间作用力越大沸点越高,故沸点NH3>AsH3>PH3,故B错误;
C.非金属元素原子与氢原子形成共价键时,元素非金属性越强,键的极性越强。C、N、F处于同周期,原子序数逐渐增大,非金属性逐渐增强,键的极性增强,故C正确;
D.镁原子价电子为3s2,失去2个电子后为8电子稳定结构,其第三电离能远大于第二电离能,D错误;
故选C。
15.C
【详解】A.基态O原子价电子层有6个电子,所以其价电子排布式为:,故A正确;
B.三种离子具有相同电子层结构,所以核电荷数越小,离子半径越大,即离子半径:,故B正确;
C.F原子核外电子数为9,每个电子都有其特定的运动状态,包括轨道和自旋状态,所以有9种空间运动状态不同的电子,故C错误;
D.分子R中有四种元素,都位于元素周期表p区,故D正确;
故选C。
16.(1) A N 球形
(2) 同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N原子的2p轨道为半充满状态,具有稳定性,故不易结合一个电子
(3) [Ar]3d5或1s22s22p63s23p63d5 H<C<O
【解析】(1)
①紫色光对应的辐射波长范围是400~430 nm,选A;
②基态K原子中,核外电子排布式为1s22s22p63s23p64s1,核外电子占据最高能层的符号是N,占据该能层的电子处于4s能级,电子云轮廓图形状为球形;
(2)
①氮原子核外电子排布式是1s22s22p3,价层电子排布式是2s22p3,轨道表达式(电子排布图)为;
②同周期元素,从左到右非金属性依次增大,原子核对电子的束缚能力增大,除氮原子外,其他原子得电子能力依次增大,得电子后形成的阴离子稳定性逐渐增大,所以根据第一电子亲和能的定义可知同周期元素的第一电子亲和能自左向右依次增大;N的2p能级上有3个电子,处于半满状态,属于较稳定状态,得电子能力相对较弱,因此第一电子亲和能较同周期相邻元素要低;
(3)
①Fe为26号,价层电子数为26-18=8,价层电子排布式为3d64s2,失去电子时,先失去4s上的2个电子,再失去3d上的一个电子,即为[Ar]3d5;
②元素的非金属性越强电负性越大,非金属性O>C>H,所以电负性:O>C>H。
17.(1) > < < >
(2)三
【详解】(1)同周期主族元素,从左至右,原子半径逐渐减小;非金属性逐渐增大;电负性逐渐增大;第一电离能有逐渐增大的趋势,但IIA族> IIA族,VA族> VIA族,故答案为:原子半径:P>S,非金属性:P
(2)同周期主族元素,从左至右,第一电离能有逐渐增大的趋势,但IIA族>IIIA族,VA族> VIA族,故第一电离能介于B、N之间的有:Be、 C、O共三种;
18.当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态原子,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量
【详解】当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态原子,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量
19.(1)SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑
(2)F>N>C>H>B
【详解】(1)已知电负性:H>Si,则H吸引电子的能力比Si强,SiHCl3中H显-1价,Si显+4价,因此SiHCl3水解时除生成硅酸和HCl外,其-1价的H还和H2O中+1价的H反应生成氢气,故其水解的化学方程式为SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑;
(2)该分子中所有元素为H、B、C、N、F,根据同一周期从左往右电负性依次增大,同一主族从上往下电负性依次减小,电负性由大到小的顺序为F>N>C>H>B。
20.(1)
(2)
(3)
【详解】(1)S为16号元素,简化电子排布式为:;
(2)Cr为24号元素,根据洪特规则特例,简化电子排布式为:;
(3)在一定温度下,Mg(OH)2难溶于水,在水中的沉淀溶解平衡可用离子方程式表示为;该平衡的。
21.A
【详解】当基态原子的电子吸收能量后,电子会跃迁到较高能级,原子从基态变成激发态,电子从能量较高的轨道回到能量较低的轨道时,将以光的形式释放能量,产生特殊的火焰颜色,则焰色反应是原子的发射光谱,故选A。
22.(1) 四 IB 1s22s22p2 7 锤形(哑铃) Mg 镁原子3s能级上有两个电子,失去的是3s能级上的电子,铝原子价电子排布式为3s23p1,失去的是3p上的电子,3p上的电子能量较高,容易失去,所以镁的第一电离能大
(2) 大于 AlF3中两元素电负性差值大于1.7,属于离子化合物;而AlBr3中两元素电负性差值小于1.7 属于共价化合物;离子化合物熔点高于共价化合物 小于2.8 +1
【详解】(1)①Cu位于元素周期表中的第四周期ⅠB族;
②C原子位于元素周期表第二周期第ⅣA族,因此基态C原子核外电子排布式为1s22s22p2;N核外有7个电子,则有7种不同运动状态的电子;
③基态Si原子核外电子占据的最高能级的电子云轮廓图为锤形(哑铃);
④镁原子3s能级上有两个电子,失去的是3s能级上的电子,铝原子价电子排布式为3s23p1,失去的是3p上的电子,3p上的电子能量较高,容易失去,所以镁的第一电离能大;
(2)①AlF3中两元素电负性差值大于1.7,属于离子化合物;而AlBr3中两元素电负性差值小于1.7 属于共价化合物;离子化合物熔点高于共价化合物,因此为大于;
②F、Br是同一主族根据题意可知同主族自上而下电负性减小因此I的电负性小于2.8;
③根据题意可知Cl的电负性小于4.0大于2.8,而I的电负性小于2.8,Cl的电负性强于I得电子能力大于I,因此I的化合价为+1。
23.(1) < <
(2)>
【分析】由构造原理可知:①同一电子层的能级能量高低顺序为 ns<np<nd<nf;②不同电子层之间,能量会产生能级交错现象,即电子层序数大的能级,其能量不一定高,如3d能级具有的能量就高于4s能级所具有的能量,
【详解】(1)由构造原理可知2s能级能量小于4s能级的能量,同一电子层的能级能量高低顺序为 np<nd,故答案为:<;<;
(2)由于能级交错现象导致3d能级具有的能量就高于4s能级所具有的能量,故答案为:>。
24. Ar O=C=O NaOH HClO4 HClO4=H++ClO4- 氮 C+4HNO3(浓)CO2↑+4NO2↑+2H2O SiO2 SiO2为原子晶体,熔融时需破坏共价键
【分析】由表中元素所在的位置,可确定①为氢(H),②为碳(C),③为氮(N),④为氧(O),⑤为钠(Na),⑥为镁(Mg),⑦为硫(S),⑧氯(Cl),⑨为氩(Ar)。
【详解】(1)在这些元素中,单质的化学性质最不活泼的是稀有气体元素Ar。答案为:Ar;
(2)③为氮元素,其气态氢化物的化学式为NH3,电子式为,②④形成的气态化合物为CO2,它的结构式为O=C=O。答案为:;O=C=O;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的是钠的氢氧化物,化学式为NaOH,它的电子式为;酸性最强的含氧酸为高氯酸,化学式为HClO4,它是一元强酸,发生完全电离,电离方程式为HClO4=H++ClO4-。答案为:NaOH;;HClO4;HClO4=H++ClO4-;
(4)同周期元素,从左往右,非金属性依次增强,则在②和③两种元素中,非金属性较强的是氮,②的单质为碳,和③的最高价氧化物的水化物硝酸反应,生成二氧化碳、二氧化氮和水,有关化学方程式为C+4HNO3(浓) CO2↑+4NO2↑+2H2O。答案为:氮;C+4HNO3(浓) CO2↑+4NO2↑+2H2O;
(5)②与Si元素分别形成的最高价氧化物为CO2、SiO2,前者为分子晶体,后者为原子晶体,SiO2的熔点更高,原因是SiO2为原子晶体,熔融时需破坏共价键。答案为:SiO2;SiO2为原子晶体,熔融时需破坏共价键。
【点睛】碳与稀硝酸即便在加热条件下也不能发生化学反应,碳与浓硝酸混合液,若不加热,反应不能发生,也就是说,只有碳与浓硝酸在加热条件下才能反应,生成三种非金属氧化物。
25.(1)4:5
(2)1s22s22p63s23p63d24s2或[Ar] 3d24s2
(3)ⅦB
(4)
(5)1s22s22p63s23p63d104s2或[Ar] 3d104s2
(6)
(7)1s22s22p63s23p63d74s2或[Ar] 3d74s2
【详解】(1)Fe2+的电子排布式为1s22s22p63s23p63d6,Fe3+的电子排布式为1s22s22p63s23p63d5,Fe2+有4个未成对电子,Fe3+基态有5个未成对电子,则基态与离子中未成对的电子数之比为4:5;
(2)Ti为22号元素,核外共22个电子,电子排布式为1s22s22p63s23p63d24s2或[Ar] 3d24s2。
(3))Mn是25号元素,价电子排布式为:3d54s2,故Mn位于元素周期表中第四周期第ⅦB族;
(4)
基态Fe原子核外电子排布为1s22s22p63s23p63d64s2,价电子的电子排布图(轨道表达式)为;
(5)Zn为30号元素,核外有30个电子,对应电子排布式为1s22s22p63s23p63d104s2或[Ar] 3d104s2;
(6)
N元素位于第二周期第ⅤA族,价层电子的轨道表达式(电子排布图)为;
(7)钴是27号元素,其基态原子核外有27个电子,对应排布式为1s22s22p63s23p63d74s2或[Ar] 3d74s2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
