3.1卤代烃同步练习 2024-2025学年高二化学人教版(2019)选择性必修3(含答案)
文档属性
| 名称 | 3.1卤代烃同步练习 2024-2025学年高二化学人教版(2019)选择性必修3(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 21:11:56 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
3.1卤代烃
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.由下列实验操作和现象得出的实验结论正确的是
选项 实验操作和现象 实验结论
A 将电石与饱和氯化钠溶液反应产生的气体(含乙炔、等)通入酸性溶液中,酸性溶液褪色 乙炔分子中含碳碳三键,具有还原性
B 向苯中滴入溴水,振荡,静置,水层变为无色 苯与溴发生加成反应
C 向1-溴丁烷中加入的乙醇溶液,微热,产生的气体通入溴的溶液中,溴的溶液褪色 1-溴丁烷发生消去反应生成1-丁烯
D 向溴乙烷中加入溶液,加热,然后加入溶液,无淡黄色沉淀生成 溴乙烷没有发生取代反应
A.A B.B C.C D.D
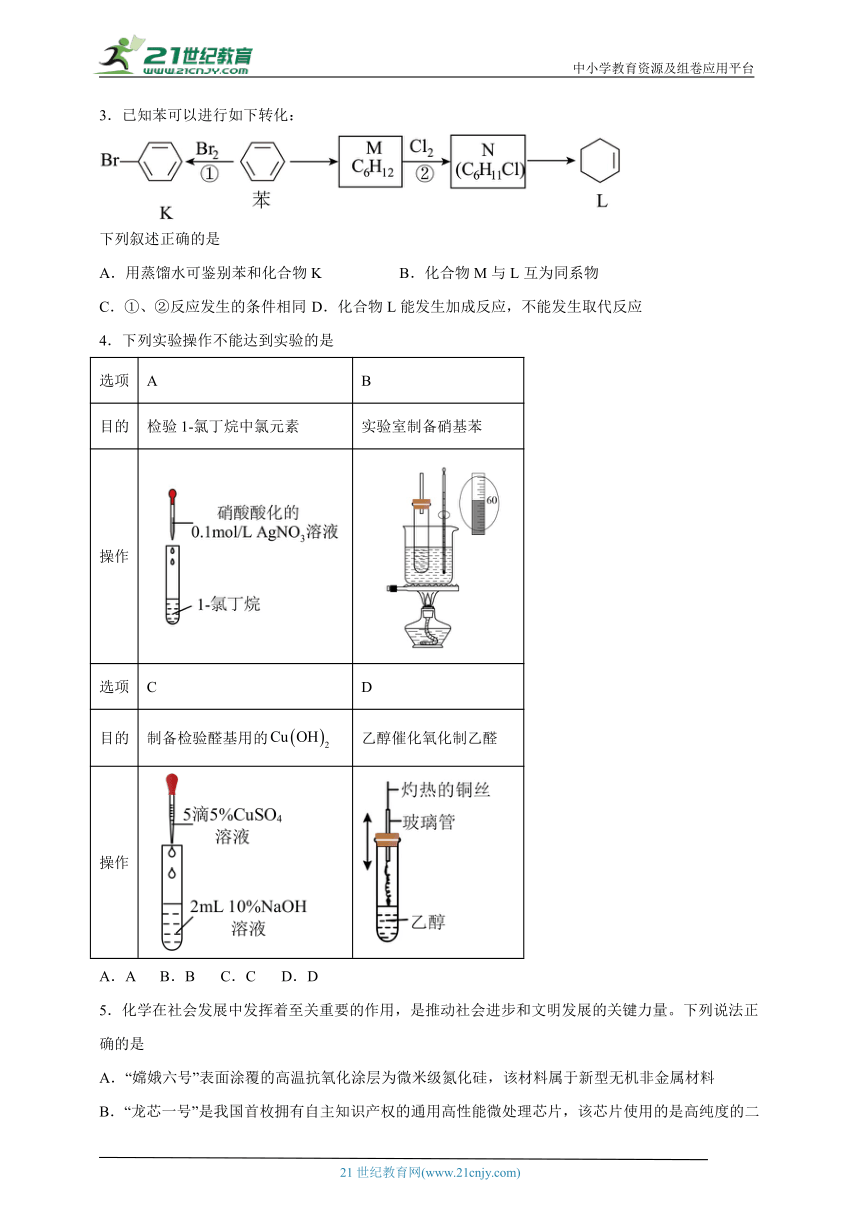
2.实验室制备2,6-二溴吡啶的操作主要包括:①将2,6-二氯吡啶溶于冰醋酸;②维持反应温度,缓慢通入溴化氢气体;③分离乙酸和产品。其制备装置如图所示(加热和夹持装置已略去)。下列说法中正确的是
A.检查装置气密性时,无须关闭恒压滴液漏斗下方活塞
B.气体的制备反应为:
C.为使受热更均匀,应采用水浴加热
D.烧杯中生成的沉淀只有
3.已知苯可以进行如下转化:
下列叙述正确的是
A.用蒸馏水可鉴别苯和化合物K B.化合物M与L互为同系物
C.①、②反应发生的条件相同 D.化合物L能发生加成反应,不能发生取代反应
4.下列实验操作不能达到实验的是
选项 A B
目的 检验1-氯丁烷中氯元素 实验室制备硝基苯
操作
选项 C D
目的 制备检验醛基用的 乙醇催化氧化制乙醛
操作
A.A B.B C.C D.D
5.化学在社会发展中发挥着至关重要的作用,是推动社会进步和文明发展的关键力量。下列说法正确的是
A.“嫦娥六号”表面涂覆的高温抗氧化涂层为微米级氮化硅,该材料属于新型无机非金属材料
B.“龙芯一号”是我国首枚拥有自主知识产权的通用高性能微处理芯片,该芯片使用的是高纯度的二氧化硅
C.四氯乙烯是一种氯代烃类的有机溶剂,是衣物干洗剂的主要成分之一,它属于烃类
D.磁流体是一种新型的液态功能材料,它兼有固体材料的磁性和液体材料的流动性,其中磁铁的主要成分是
6.下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法不正确的是
A.②③④的反应类型分别为消去反应、加成反应、消去反应
B.反应④的反应试剂和反应条件是醇溶液、加热
C.A的结构简式为
D.环戊二烯与以的物质的量之比加成,可生成
7.物质的鉴别有多种方法,下列不能达到鉴别目的的是
A.用水鉴别苯、乙醇、溴苯
B.用溴水鉴别苯和己烯
C.点燃鉴别甲烷和乙烯
D.用酸性高锰酸钾溶液鉴别苯和环己烷
8.下列反应的离子方程式书写正确的是
A.用硫化亚铁除去废水中汞离子:
B.用铁氰化钾溶液检验:
C.用铁作电极电解饱和溶液:
D.溴乙烷的水解:
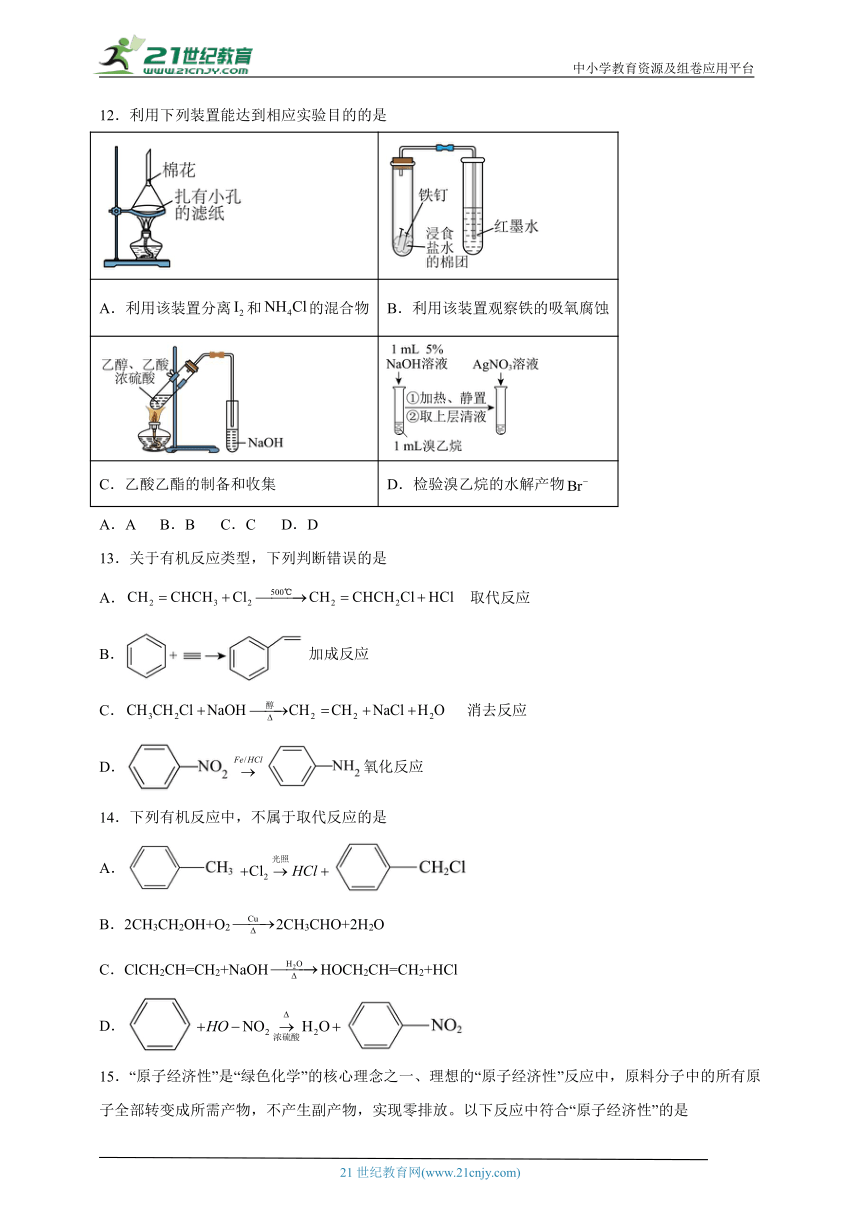
9.下列实验方案设计、现象和结论都正确的是
选项 实验方案 现象 结论
A 室温下,向苯酚浊液中加入碳酸钠溶液 溶液变澄清 酸性:(苯酚)
B 取钢铁电极附近的溶液,向其中滴加溶液 产生蓝色沉淀 钢铁发生吸氧腐蚀
C 与乙醇溶液混合共热,将产生的气体通入酸性溶液中 酸性褪色 发生消去反应
D 将少量固体加入饱和溶液中,充分搅拌,静置、弃去上层清液,反复多次。过滤,将所得固体加入稀盐酸中 固体溶解 则说明转化为,
A.A B.B C.C D.D
10.下列化学用语或图示正确的是
A.1-氯丙烯的结构简式:
B.基态氮原子电子排布轨道表达式写成违背了泡利原理
C.分子的球棍模型:
D.的电子式:
11.卤代烃广泛用于药物合成、化工生产中。溴乙烷是向有机化合物分子中引入乙基的重要试剂,以邻二氯苯为原料经硝化、氟代、还原、缩合、水解等一系列反应,可合成治疗敏感菌引起的各类感染的“诺氟沙星”。
下列有关有机化学反应中反应类型的说法正确的是
A.硝化反应过程中引入的官能团是-NH2 B.氟代反应的产物只有一种
C.水解反应属于氧化还原反应 D.溴乙烷能发生消去反应
12.利用下列装置能达到相应实验目的的是
A.利用该装置分离和的混合物 B.利用该装置观察铁的吸氧腐蚀
C.乙酸乙酯的制备和收集 D.检验溴乙烷的水解产物
A.A B.B C.C D.D
13.关于有机反应类型,下列判断错误的是
A. 取代反应
B.加成反应
C. 消去反应
D.氧化反应
14.下列有机反应中,不属于取代反应的是
A.
B.2CH3CH2OH+O22CH3CHO+2H2O
C.ClCH2CH=CH2+NaOHHOCH2CH=CH2+HCl
D.
15.“原子经济性”是“绿色化学”的核心理念之一、理想的“原子经济性”反应中,原料分子中的所有原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合“原子经济性”的是
A.丙烷与氯气反应制2-氯丙烷 B.溴乙烷与NaOH醇溶液共热制乙烯
C.氯乙烯在一定条件下制聚氯乙烯 D.乙醇催化氧化制乙醛
二、填空题
16.Ⅰ.维生素C的结构简式是,它的分子式是 。由于它能防治坏血病,又称为 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
Ⅱ.(1)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号) 。
(2)氟氯代烷是一种能破坏臭氧层的物质。在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2
上列的反应的总反应式是 ,少量氟氯代烷能破坏大量臭氧的原因是 。
17.卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是 。工业上分离这些多氯代甲烷的方法是 。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式 (不考虑立体异构)。
(3)聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式为 ,反应类型为 ;反应②的化学反应方程式为 反应类型为 。
18.丙烯可发生如下转化,
回答下列问题:
(1)X的结构简式为 ,写出X与足量KOH溶液共热的化学方程式 。
(2)Y的化学名称是 ,分子中有 种不同化学环境的氢原子。
(3)丙烯中碳原子的轨道杂化类型有 种,分子中最多 个原子共平面。
(4)丙烯生成Z的化学方程式为 ,反应类型为 。
19.卤代烃在现代工业中有着广泛的应用。其可以发生如下反应:CH3Cl+NaOHCH3OH+NaCl
(1)生产CH3CH2Cl的方法有两种:
①CH3CH3+Cl2CH3CH2Cl+HCl
②CH2=CH2+HClCH3CH2Cl
上述两种方法,第 (填“①”或“②”)种更好。以CH3CH2Cl为原料, (填“可以”或“不可以”)合成乙烯。
(2)氯乙烯(CH2=CHCl)分子中,最多 个原子共平面,以氯乙烯为原料合成PVC塑料的化学方程式为 。
(3)将乙烷和溴蒸气的混合气体置于光照条件下,可以生成 种产物;其中,分子中只有一种处于不同化学环境下的氢原子的产物有 种。
20.案例——卤代烃的性质和制备(以1-溴丙烷为例)
(1)1-溴丙烷的物理性质:
颜色 状态 沸点 密度 溶解性
无色 71℃ 比水
(2)1-溴丙烷的分子结构: 。
21.为检验1-溴丁烷中的溴元素,下列实验操作正确的顺序是 (填序号)。
①加热煮沸 ②加入硝酸银溶液 ③取少量1-溴丁烷
④加入足量稀硝酸酸化 ⑤加入氢氧化钠溶液 ⑥冷却
22.有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯 ②乙烷在空气中燃烧 ③乙烯使溴的四氯化碳溶液褪色 ④乙烯使酸性高锰酸钾溶液褪色 ⑤甲烷与氯气在光照的条件下反应 ⑥溴乙烷和氢氧化钠乙醇溶液共热 ⑦溴乙烷和氢氧化钠溶液共热
其中属于取代反应的是 ;属于氧化反应的是. ;属于加成反应的是. ;属消去反应的是
23.氯乙烯是合成聚氯乙烯的单体。乙烯氧化法是生产氯乙烯的主要方法。分三步进行,如下图所示:
(1)关于乙烯、氯乙烯、聚氯乙烯说法正确的是 (填字母)
A.都能在氧气中燃烧 B.都能发生加成反应使溴水褪色
C.都能使得酸性高锰酸钾褪色 D.氯乙烯分子中所有原子共平面
(2)从环境角度考虑,氧化法的优点是
(3)某学生设计下列反应:
请写出③化学方程式
(4)请已知二氯乙烷与氢氧化钠溶液共热可以生成乙二醇(HOCH2CH2OH),写出乙二醇与过量乙酸完全发生反应的方程式
(5)焚烧废旧塑料过程中会排放有毒物质,写出聚氯乙烯塑料完全燃烧的化学方程式
24.有机合成路线流程图示例如下:CH2=CH2CH3CHO CH3COOH
按要求写出下列合成的线流程图(无机试剂任选)
(1)以为原料,合成: 。
(2)一卤代烃R-X与金属钠作用,可以增加碳链,反应的化学方程式为:R-X+2Na+X-R*R-R*+2NaX,R,R*为烃基,可相同,也可不相同,X为卤原子,试以苯、乙炔、Br2、HBr、钠为主要原料,通过三步反应合成。
。
25.苯及芳香族化合物在生活生产中有着非常广泛的应用,人们对苯及芳香族化合物的认识有一个不断深化的过程。回答下列问题:
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出一种分子式为C6H6的含两个三键且无支链的链烃的结构简式: (写出一种即可)。
(2)已知分子式为C6H6的有机物有多种,其中的两种为。
①这两种结构的区别表现在以下两方面:定性方面(即化学性质方面):Ⅱ能发生而Ⅰ不能发生的反应为 (填字母)。
a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
②定量方面:与H2加成时Ⅰ需要3molH2,而Ⅱ需要H2 mol。
(3)C6H6还可能有一种立体结构,如,该结构的二氯代物有 种。
(4)溴苯可以通过苯为原料制取,同属于卤代烃的溴乙烷可以发生水解反应,写出溴乙烷水解的化学方程式 。
(5)苯及芳香族化合物在生活生产中有着非常广泛的应用,其中苯甲酸是一种常用的食品防腐剂。某小组设计粗苯甲酸(含有少量NaCl和泥沙)的提纯方案如下:
判断下列说法不正确的是___________。
A.操作I中依据苯甲酸的溶解度估算加水量
B.操作II需要趁热的原因是防止NaCl冷却析出
C.操作I与操作III缓中玻璃棒的作用相同
D.检验操作IV产物是否纯净可用硝酸酸化的AgNO3
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C A A A A C D B A D
题号 11 12 13 14 15
答案 D B D B C
1.C
【详解】A.硫化氢也能与酸性高锰酸钾溶液使溶液褪色,所以酸性高锰酸钾溶液褪色不能说明乙炔分子中含碳碳三键,具有还原性,故A错误;
B.向苯中滴入溴水,振荡,静置后水层变为无色,利用了萃取原理,苯能将溴从水中萃取出来,而非发生了加成反应,故B错误;
C.1-溴丁烷在氢氧化钠乙醇溶液中共热发生消去反应生成1-丁烯、溴化钠和水,乙醇具有挥发性,挥发出的乙醇不能与溴的四氯化碳溶液反应,则溶液褪色可以说明1-溴丁烷发生消去反应生成1-丁烯,故C正确;
D.氢氧化钠溶液也能与硝酸银溶液反应,会干扰溴离子与银离子的反应,所以未加入稀硝酸中和氢氧化钠,直接进入硝酸银溶液,无淡黄色沉淀生成无法判断溴乙烷是否发生了取代反应,故D错误;
故选C。
2.A
【详解】A.恒压滴液漏斗的支管连接了活塞上下,故无需关闭活塞,A正确;
B.浓硫酸会将氧化,故应用浓磷酸代替,B错;
C.加热温度为,故应用油浴,C错;
D.三颈烧瓶中发生的是取代反应,会有生成,故沉淀是和的混合物,D错;
答案选A。
3.A
【分析】
苯与Br2发生取代反应,得到K,苯生成M,由M的分子式得,M为,M与Cl2发生取代反应生成N,N为,N发生消去反应生成L。
【详解】A.化合物K为溴苯,溴苯的密度比水大,苯的密度比水小,且苯、溴苯与水互不相溶,用蒸馏水可鉴别苯和溴苯,故A正确;
B.L中存在碳碳双键,M为,不存在碳碳双键,结构不相似,且没有相差若干个CH2原子团,化合物M与L不是同系物,故B错误;
C.反应①为苯的取代,反应条件为溴、铁或溴化铁作催化剂,②为烷烃的取代反应,反应条件为Br2、光照,故C错误;
D.L中有碳碳双键能发生加成反应,其它碳原子上的氢也可以被取代,故D错误;
故选A。
4.A
【详解】A.1-氯丁烷中氯元素为氯原子,不能用硝酸酸化的硝酸银溶液检验,不能达到实验目的,故A选;
B.实验室用苯和硝酸在浓硫酸催化下制备硝基苯,反应需水浴加热,且需要用温度计控制温度为50℃~60℃,能达到实验目的,故B选;
C.向2mL10%的氢氧化钠溶液中滴加5滴5%的硫酸铜溶液,制得新制氢氧化铜,且氢氧化钠过量,检验醛基时产生砖红色沉淀,能达到实验目的,故C选;
D.乙醇催化氧化制取乙醛,铜可以做催化剂,能达到实验目的,故D选;
故选A。
5.A
【详解】A.氮化硅属于新型无机非金属材料,故A项正确;
B.芯片使用的是高纯度的硅,而不是二氧化硅,故B项错误;
C.四氯乙烯属于卤代烃,卤代烃是烃的衍生物,不属于烃类,故C项错误;
D.磁铁的主要成分是,故D项错误;
故本题选A。
6.C
【分析】
由合成路线可知,反应①为环戊烷与氯气光照条件下的取代反应,反应②为氯代烃的消去反应,反应③为烯烃与卤素单质的加成反应,反应④卤代烃的消去反应,故A为,B可以为。
【详解】A.通过以上分析知,②③④的反应类型分别为消去反应、加成反应、消去反应,故A正确;
B.反应④为溴代烃的消去反应,该反应的反应试剂和反应条件是NaOH醇溶液、加热,故B正确;
C.通过以上分析知,A的结构简式为,故C错误;
D.环戊二烯与Br2以1:1的物质的量之比发生1,4-加成,可生成,故D正确;
故选C。
7.D
【详解】A.苯、溴苯都不溶于水,但是苯密度小于水,溴苯密度大于水,所以苯和水混合时分层且油层在上方,溴苯和水混合时分层但是油层在下方,乙醇和水互溶,现象不同可以鉴别,A不合题意;
B.己烯能与Br2发生加成反应而使溴水褪色,但苯不与Br2反应,能够萃取分层,上层呈深橙红色,下层接近无色,现象不同可以用溴水鉴别苯和己烯,B不合题意;
C.乙烯燃烧时的现象:火焰明亮、有黑烟;甲烷燃烧时的现象:发出淡蓝色的火焰,现象不同可以鉴别,C不合题意;
D.苯和环己烷都不能被酸性高锰酸钾溶液氧化,且密度均比酸性高锰酸钾溶液小,即现象一样,不能用酸性高锰酸钾溶液鉴别苯和环己烷,D符合题意;
故答案为:D。
8.B
【详解】A.用FeS处理含Hg2+废水,离子方程式为:Hg2++FeS=HgS+Fe2+,故A错误;
B.将K3[Fe(CN)6]溶液滴入FeCl2溶液中产生蓝色沉淀,反应的离子方程式为:,故B正确;
C.铁为电极,阳极铁放电,不会生成氯气,正确的电极反应为:Fe+2H2O =Fe(OH)2↓+H2↑,故C错误;
D.溴乙烷水解的条件为氢氧化钠的水溶液并加热,生成溴化钠,不会生成溴原子,正确的离子方程式为:,故D错误;
故选B。
9.A
【详解】A.室温下,向苯酚浊液中加入碳酸钠溶液,由于,苯酚转化为苯酚钠,溶液变澄清,故A正确;
B.取钢铁电极附近的溶液,向其中滴加溶液,产生蓝色沉淀,说明钢铁发生了腐蚀,不能说明是析氢还是吸氧腐蚀,故B错误;
C.挥发的醇及生成的乙烯均使酸性高锰酸钾溶液褪色,则紫色褪去不能证明溴乙烷发生消去反应,故C错误;
D.将少量固体加入饱和溶液中,由于的相差不大,存在平衡,加入后,平衡逆向移动,生成少量,不能说明,故D错误;
故选A。
10.D
【详解】A.1-氯丙烯的结构简式:CH3-CH=CHCl,A错误;
B.基态氮原子电子排布轨道表达式写成违背了洪特规则,B错误;
C.O3的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键,所以O3分子的球棍模型不是:,C错误;
D.CO为共价化合物,其电子式为:,D正确;
故选D。
11.D
【详解】A.硝化反应过程中引入的官能团是-NO2,故A错误;
B.氟代反应为取代反应,可以取代不同位置的氢,产物不只一种,故B错误;
C.水解反应属于取代反应,不属于氧化还原反应,故C错误;
D.溴乙烷在氢氧化钠的乙醇溶液中加热能发生消去反应生成乙烯,故D正确;
答案选D。
12.B
【详解】A.加热时氯化铵受热分解,碘单质升华,二者无法用加热的方法分离,A错误;
B.铁钉在盐水环境下与空气中O2反应,气压降低,导管中红墨水液面上升,能说明左侧试管中铁发生吸氧腐蚀,B正确;
C.制备乙酸乙酯时用饱和碳酸钠溶液进行收集,不能用NaOH溶液,乙酸乙酯会在NaOH溶液中水解,C错误;
D.溴乙烷在碱性条件下水解,需要先加入硝酸反应掉多余的NaOH溶液,再加入硝酸银检验水解产物,D错误;
故选B。
13.D
【详解】A.丙烯与氯气发生取代反应转化为CH2=CHCH2Cl和HCl ,A正确;
B.苯与乙炔发生加成反应转化为苯乙烯,B正确;
C.卤代烃在氢氧化钠的醇溶液中加热发生消去反应,C正确;
D.硝基苯发生还原反应转化为,D错误;
故选D。
14.B
【详解】A.甲苯分子中的甲基氢原子被氯原子取代,属于取代反应,A不符合题意;
B.醇被氧化为醛的反应属于氧化反应,不属于取代反应,B符合题意;
C.在水、加热条件下,ClCH2CH=CH2与NaOH反应生成HOCH2CH=CH2,属于取代反应,C不符合题意;
D.苯环上的氢原子被硝基取代生成硝基苯,属于取代反应,D不符合题意;
故选B。
15.C
【分析】根据绿色化学的定义可知,原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放,以此解答该题。
【详解】A.丙烷与氯气反应除生成2-氯丙烷外,还有1-氯丙烷等副产物,同时有HCl生成,原子利用率不是100%,故A不符合“原子经济性”;
B.溴乙烷与NaOH醇溶液共热,除制得乙烯外还产生溴化钠和水,故B不符合“原子经济性”;
C.氯乙烯在一定条件下制聚氯乙烯,原料分子中的所有原子全部转变成所需产物,没有产生副产物,实现零排放,故C符合“原子经济性”;
D.乙醇催化氧化制乙醛,同时生成水,原子没有全部利用,,故D不符合“原子经济性”;
故答案选C。
16. C6H8O6 抗坏血酸 酸 溶液蓝色褪去 还原性 Ⅰ、Ⅲ、Ⅱ 2O3→3O2 氟氯代烷分解产生的Cl对O3的分解有促进作用
【分析】Ⅰ。根据结构简式书写其分子式;紫色石蕊试液遇酸变红色;根据淀粉的碘水溶液颜色变化判断其性质;
Ⅱ。(1)金属腐蚀的速度;原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀;
(2)将方程式①②③相加得出氧气和臭氧的关系式;根据Cl+O3→ClO+O2判断氟氯代烷能破坏大量臭氧的原因。
【详解】Ⅰ。维生素C的分子式为C6H8O6;称为抗坏血酸;紫色石蕊试液遇酸变红色,在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有酸性;维生素C能和碘反应而使淀粉的碘水溶液褪色,碘有氧化性,所以维生素C有还原性;
故答案为C6H8O6;抗坏血酸;酸;溶液蓝色褪去;还原性;
Ⅱ。(1)铁处于Ⅰ的环境中做原电池的负极,腐蚀速率较快,铁处于Ⅱ的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于Ⅲ的环境中的金属铁发生化学腐蚀,速度较慢;
综上所述,本题正确答案为:Ⅰ>Ⅲ>Ⅱ;
(2)由①Cl+O3→ClO+O2、O3→O+O2、③ClO+O→Cl+O2,将方程式①+②+③得方程式:2O3 →3O2;氟氯代烷受紫外线的照射分解出氯原子,Cl+O3→ClO+O2,Cl对O3的分解有促进作用,所以能破坏臭氧层;
故答案为2O3→3O2;氟氯代烷分解产生的Cl对O3的分解有促进作用。
17.(1) 四氯化碳 分馏
(2)CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2
(3) H2C=CH2+Cl2→CH2ClCH2Cl 加成反应 CH2ClCH2ClCH2=CHCl+HCl 消去反应
【详解】(1)分子结构为正四面体的为四氯化碳,工业上分离这些多氯代甲烷,根据物质的沸点不同,常用分馏的方法分离;
(2)三氟氯溴乙烷(CF3CHClBr)对应的同分异构体中,可根据卤素原子的位置不同判断,如F不在同一个C原子上,存在的同分异构体有CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2三种;
(3)反应①是乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应的方程式为H2C=CH2+Cl2→CH2ClCH2Cl,加热480~530℃生成氯乙烯,发生消去反应,反应的化学方程式为CH2ClCH2ClCH2=CHCl+HCl。
18.(1)
(2) 二溴丙烷 3
(3) 2 7
(4) 加聚反应
【分析】
根据丙烯的转化关系图可知,丙烯在光照条件下发生取代反应,生成的X为,丙烯与的溶液发生加成反应,生成的Y为,丙烯在催化剂存在条件下发生加聚反应,生成的Z为。
【详解】(1)丙烯在光照条件下发生取代反应,生成的X为;属于卤代烃,与足量KOH溶液共热可发生取代反应,化学方程式为;
故答案为:;;
(2)Y为,名称为:二溴丙烷;分子中有3种不同化学环境的氢原子;
故答案为:二溴丙烷;3;
(3)
分子中形成碳碳双键的碳原子杂化方式为,甲基碳原子杂化方式为,则碳原子的轨道杂化类型有2种;丙烯中碳碳双键为平面形,6个原子一定在同一平面上,甲基碳原子为四面体形,最多有1个H原子可在该平面上,有2个H原子不在该平面上,故分子中最多有7个原子共平面;
故答案为:2;7;
(4)
丙烯在催化剂存在条件下发生加聚反应,生成的Z为,反应的化学方程式为:,该反应类型为加聚反应;
故答案为:;加聚反应。
19.(1) ② 可以
(2) 6
(3) 10 5
【详解】(1)乙烯和氯化氢加成生成氯乙烷,没有其他副产物生成,而乙烷和氯气光照取代副产物较多,故②更好;氯乙烷在氢氧化钠、醇、加热的条件下发生消去反应可以生成乙烯;
(2)氯乙烯可以看做是乙烯中的1个氢原子被氯原子取代的产物,故其中所有原子都可以共平面,即最多有6个原子共平面;氯乙烯加聚可以生成PVC,方程式为:;
(3)乙烷分子中含有6个氢原子,与一定量氯气光照条件下反应,生成的产物有一溴乙烷(1种)、二溴乙烷(2种)、三溴乙烷(2种)、四溴乙烷(2种)、五溴乙烷(1种)、六溴乙烷(1种)及HBr,总共10种物质;其中,分子中只有一种处于不同化学环境下的氢原子的产物有,、、、、,一共5种。
20.(1) 液体 大 难溶于水,易溶于有机溶剂
(2)
【解析】略
21.③⑤①⑥④②
【详解】先取少量1-溴丁烷,加入氢氧化钠溶液进行水解,然后加热加快反应速率,溶液冷却后,加入硝酸中和过量的氢氧化钠,再加入硝酸银观察是否有沉淀,故正确顺序为:③⑤①⑥④②。
22. ⑤⑦ ②④ ①③ ⑥
【详解】由乙炔制氯乙烯,发生乙炔与HCl的加成反应;②乙烷在空气中燃烧,是乙烷被氧气氧化生成了二氧化碳,属于氧化反应;③乙烯使溴的四氯化碳溶液褪色,是乙烯与溴发生加成反应;④乙烯使酸性高锰酸钾溶液褪色,是乙烯被高锰酸钾氧化,发生氧化反应;⑤甲烷与氯气在光照的条件下反应,发生取代反应;⑥溴乙烷和氢氧化钠乙醇溶液共热,生成乙烯,属于消去反应; ⑦溴乙烷和氢氧化钠溶液共热,是溴乙烷中的溴原子被羟基所取代生成乙醇,属于取代反应; 故答案依次为⑤⑦ ;②④;①③;⑥。
23. AD 利用二氯乙烷热裂解所产生的氯化氢作为氯化剂,从而使氯得到完全利用,不向环境排放毒害气体
【分析】
【详解】(1)A. 乙烯、氯乙烯、聚氯乙烯都能在氧气中燃烧,A正确;
B. 聚氯乙烯不含碳碳双键,不能和溴水发生加成反应,B错误;
C. 聚氯乙烯不含碳碳双键,不能和酸性高锰酸钾溶液反应,C错误;
D. 氯乙烯分子中含有碳碳双键,所有原子共平面,D正确;
故合理选项为AD;
(2)利用二氯乙烷热裂解所产生的氯化氢作为氯化剂,从而使氯得到完全利用,不向环境排放毒害气体,减少对环境的危害;
(3)苯生成硝基苯的方程式为:;
(4)乙二醇和过量乙酸的反应方程式为:;
(5)聚氯乙烯燃烧的方程式为:。
24.
【详解】(1)以合成,可以首先与氢气加成生成,然后消去生成环己烯,再用环己烯与氯气加成生成二氯环己烷,再发生消去生成,再发生1,4-加成后与氢气加成即可,合成路线为 ,故答案为: ;
(2)在溴化铁作催化剂条件下,苯和液溴发生取代反应生成溴苯,在一定条件下,乙炔和溴化氢发生加成反应生成溴乙烯溴苯和溴乙烯、钠在一定条件下反应生成苯乙烯和溴化钠,流程为:,故答案为:。
25.(1)HC≡C—C≡C—CH2CH3(或HC≡C—CH2—C≡C—CH3或HC≡C—CH2—CH2—C≡CH或H3C—C≡C—C≡C—CH3)
(2) ab 2
(3)3
(4)CH3CH2Br+NaOHCH3CH2OH+NaBr
(5)BC
【分析】粗苯甲酸中含有少量NaCl和泥沙,由流程可知,加水溶解时需保证苯甲酸完全溶解,趁热过滤可防止苯甲酸结晶析出,过滤除去泥沙,滤液含苯甲酸、NaCl,NaCl的溶解度受温度影响不大,苯甲酸的溶解度随温度的升高而增大,则冷却结晶可析出苯甲酸,过滤、洗涤得到苯甲酸;
【详解】(1)分子式为C6H6的含两个三键且无支链的链烃的结构简式为:HC≡C—C≡C—CH2CH3(或HC≡C—CH2—C≡C—CH3或HC≡C—CH2—CH2—C≡CH或H3C—C≡C—C≡C—CH3);
(2)①由于Ⅱ中存在碳碳双键,故Ⅱ可被高锰酸钾酸性溶液氧化,也能与溴水发生加成反应,而Ⅰ中存在特殊的键不能发生上述反应,故选ab;
②由于苯环上加氢后形成环己烷(C6H12),故需3molH2,而Ⅱ分子中有两个碳碳双键,故需2molH2;
(3)
采用“定1移1”的方法,据对称性即可写出,即二氯代物有3种;
(4)溴乙烷与NaOH水溶液发生水解反应生成乙醇和NaBr,反应的化学方程式为:CH3CH2Br+NaOHCH3CH2OH+NaBr;
(5)A.加水溶解时需保证苯甲酸完全溶解,则操作Ⅰ中依据苯甲酸的溶解度估算加水量,故A正确;
B.苯甲酸在水的溶解度较小,则操作II需要趁热的原因是防止苯甲酸冷却析出,而不是防止NaCl冷却析出,故B错误;
C.操作Ⅰ为溶解,玻璃棒作用是通过搅拌加速溶解,操作III为冷却结晶,玻璃棒作用是通过搅拌防止局部温度过高导致液体飞溅,则两者玻璃棒的作用不相同,故C错误;
D.检验操作IV产物是否纯净可通过检验最后一次洗涤液中是否存在氯离子,可用硝酸酸化的AgNO3,故D正确;
故选BC。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.1卤代烃
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.由下列实验操作和现象得出的实验结论正确的是
选项 实验操作和现象 实验结论
A 将电石与饱和氯化钠溶液反应产生的气体(含乙炔、等)通入酸性溶液中,酸性溶液褪色 乙炔分子中含碳碳三键,具有还原性
B 向苯中滴入溴水,振荡,静置,水层变为无色 苯与溴发生加成反应
C 向1-溴丁烷中加入的乙醇溶液,微热,产生的气体通入溴的溶液中,溴的溶液褪色 1-溴丁烷发生消去反应生成1-丁烯
D 向溴乙烷中加入溶液,加热,然后加入溶液,无淡黄色沉淀生成 溴乙烷没有发生取代反应
A.A B.B C.C D.D
2.实验室制备2,6-二溴吡啶的操作主要包括:①将2,6-二氯吡啶溶于冰醋酸;②维持反应温度,缓慢通入溴化氢气体;③分离乙酸和产品。其制备装置如图所示(加热和夹持装置已略去)。下列说法中正确的是
A.检查装置气密性时,无须关闭恒压滴液漏斗下方活塞
B.气体的制备反应为:
C.为使受热更均匀,应采用水浴加热
D.烧杯中生成的沉淀只有
3.已知苯可以进行如下转化:
下列叙述正确的是
A.用蒸馏水可鉴别苯和化合物K B.化合物M与L互为同系物
C.①、②反应发生的条件相同 D.化合物L能发生加成反应,不能发生取代反应
4.下列实验操作不能达到实验的是
选项 A B
目的 检验1-氯丁烷中氯元素 实验室制备硝基苯
操作
选项 C D
目的 制备检验醛基用的 乙醇催化氧化制乙醛
操作
A.A B.B C.C D.D
5.化学在社会发展中发挥着至关重要的作用,是推动社会进步和文明发展的关键力量。下列说法正确的是
A.“嫦娥六号”表面涂覆的高温抗氧化涂层为微米级氮化硅,该材料属于新型无机非金属材料
B.“龙芯一号”是我国首枚拥有自主知识产权的通用高性能微处理芯片,该芯片使用的是高纯度的二氧化硅
C.四氯乙烯是一种氯代烃类的有机溶剂,是衣物干洗剂的主要成分之一,它属于烃类
D.磁流体是一种新型的液态功能材料,它兼有固体材料的磁性和液体材料的流动性,其中磁铁的主要成分是
6.下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法不正确的是
A.②③④的反应类型分别为消去反应、加成反应、消去反应
B.反应④的反应试剂和反应条件是醇溶液、加热
C.A的结构简式为
D.环戊二烯与以的物质的量之比加成,可生成
7.物质的鉴别有多种方法,下列不能达到鉴别目的的是
A.用水鉴别苯、乙醇、溴苯
B.用溴水鉴别苯和己烯
C.点燃鉴别甲烷和乙烯
D.用酸性高锰酸钾溶液鉴别苯和环己烷
8.下列反应的离子方程式书写正确的是
A.用硫化亚铁除去废水中汞离子:
B.用铁氰化钾溶液检验:
C.用铁作电极电解饱和溶液:
D.溴乙烷的水解:
9.下列实验方案设计、现象和结论都正确的是
选项 实验方案 现象 结论
A 室温下,向苯酚浊液中加入碳酸钠溶液 溶液变澄清 酸性:(苯酚)
B 取钢铁电极附近的溶液,向其中滴加溶液 产生蓝色沉淀 钢铁发生吸氧腐蚀
C 与乙醇溶液混合共热,将产生的气体通入酸性溶液中 酸性褪色 发生消去反应
D 将少量固体加入饱和溶液中,充分搅拌,静置、弃去上层清液,反复多次。过滤,将所得固体加入稀盐酸中 固体溶解 则说明转化为,
A.A B.B C.C D.D
10.下列化学用语或图示正确的是
A.1-氯丙烯的结构简式:
B.基态氮原子电子排布轨道表达式写成违背了泡利原理
C.分子的球棍模型:
D.的电子式:
11.卤代烃广泛用于药物合成、化工生产中。溴乙烷是向有机化合物分子中引入乙基的重要试剂,以邻二氯苯为原料经硝化、氟代、还原、缩合、水解等一系列反应,可合成治疗敏感菌引起的各类感染的“诺氟沙星”。
下列有关有机化学反应中反应类型的说法正确的是
A.硝化反应过程中引入的官能团是-NH2 B.氟代反应的产物只有一种
C.水解反应属于氧化还原反应 D.溴乙烷能发生消去反应
12.利用下列装置能达到相应实验目的的是
A.利用该装置分离和的混合物 B.利用该装置观察铁的吸氧腐蚀
C.乙酸乙酯的制备和收集 D.检验溴乙烷的水解产物
A.A B.B C.C D.D
13.关于有机反应类型,下列判断错误的是
A. 取代反应
B.加成反应
C. 消去反应
D.氧化反应
14.下列有机反应中,不属于取代反应的是
A.
B.2CH3CH2OH+O22CH3CHO+2H2O
C.ClCH2CH=CH2+NaOHHOCH2CH=CH2+HCl
D.
15.“原子经济性”是“绿色化学”的核心理念之一、理想的“原子经济性”反应中,原料分子中的所有原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合“原子经济性”的是
A.丙烷与氯气反应制2-氯丙烷 B.溴乙烷与NaOH醇溶液共热制乙烯
C.氯乙烯在一定条件下制聚氯乙烯 D.乙醇催化氧化制乙醛
二、填空题
16.Ⅰ.维生素C的结构简式是,它的分子式是 。由于它能防治坏血病,又称为 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
Ⅱ.(1)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号) 。
(2)氟氯代烷是一种能破坏臭氧层的物质。在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2
上列的反应的总反应式是 ,少量氟氯代烷能破坏大量臭氧的原因是 。
17.卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是 。工业上分离这些多氯代甲烷的方法是 。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式 (不考虑立体异构)。
(3)聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式为 ,反应类型为 ;反应②的化学反应方程式为 反应类型为 。
18.丙烯可发生如下转化,
回答下列问题:
(1)X的结构简式为 ,写出X与足量KOH溶液共热的化学方程式 。
(2)Y的化学名称是 ,分子中有 种不同化学环境的氢原子。
(3)丙烯中碳原子的轨道杂化类型有 种,分子中最多 个原子共平面。
(4)丙烯生成Z的化学方程式为 ,反应类型为 。
19.卤代烃在现代工业中有着广泛的应用。其可以发生如下反应:CH3Cl+NaOHCH3OH+NaCl
(1)生产CH3CH2Cl的方法有两种:
①CH3CH3+Cl2CH3CH2Cl+HCl
②CH2=CH2+HClCH3CH2Cl
上述两种方法,第 (填“①”或“②”)种更好。以CH3CH2Cl为原料, (填“可以”或“不可以”)合成乙烯。
(2)氯乙烯(CH2=CHCl)分子中,最多 个原子共平面,以氯乙烯为原料合成PVC塑料的化学方程式为 。
(3)将乙烷和溴蒸气的混合气体置于光照条件下,可以生成 种产物;其中,分子中只有一种处于不同化学环境下的氢原子的产物有 种。
20.案例——卤代烃的性质和制备(以1-溴丙烷为例)
(1)1-溴丙烷的物理性质:
颜色 状态 沸点 密度 溶解性
无色 71℃ 比水
(2)1-溴丙烷的分子结构: 。
21.为检验1-溴丁烷中的溴元素,下列实验操作正确的顺序是 (填序号)。
①加热煮沸 ②加入硝酸银溶液 ③取少量1-溴丁烷
④加入足量稀硝酸酸化 ⑤加入氢氧化钠溶液 ⑥冷却
22.有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯 ②乙烷在空气中燃烧 ③乙烯使溴的四氯化碳溶液褪色 ④乙烯使酸性高锰酸钾溶液褪色 ⑤甲烷与氯气在光照的条件下反应 ⑥溴乙烷和氢氧化钠乙醇溶液共热 ⑦溴乙烷和氢氧化钠溶液共热
其中属于取代反应的是 ;属于氧化反应的是. ;属于加成反应的是. ;属消去反应的是
23.氯乙烯是合成聚氯乙烯的单体。乙烯氧化法是生产氯乙烯的主要方法。分三步进行,如下图所示:
(1)关于乙烯、氯乙烯、聚氯乙烯说法正确的是 (填字母)
A.都能在氧气中燃烧 B.都能发生加成反应使溴水褪色
C.都能使得酸性高锰酸钾褪色 D.氯乙烯分子中所有原子共平面
(2)从环境角度考虑,氧化法的优点是
(3)某学生设计下列反应:
请写出③化学方程式
(4)请已知二氯乙烷与氢氧化钠溶液共热可以生成乙二醇(HOCH2CH2OH),写出乙二醇与过量乙酸完全发生反应的方程式
(5)焚烧废旧塑料过程中会排放有毒物质,写出聚氯乙烯塑料完全燃烧的化学方程式
24.有机合成路线流程图示例如下:CH2=CH2CH3CHO CH3COOH
按要求写出下列合成的线流程图(无机试剂任选)
(1)以为原料,合成: 。
(2)一卤代烃R-X与金属钠作用,可以增加碳链,反应的化学方程式为:R-X+2Na+X-R*R-R*+2NaX,R,R*为烃基,可相同,也可不相同,X为卤原子,试以苯、乙炔、Br2、HBr、钠为主要原料,通过三步反应合成。
。
25.苯及芳香族化合物在生活生产中有着非常广泛的应用,人们对苯及芳香族化合物的认识有一个不断深化的过程。回答下列问题:
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出一种分子式为C6H6的含两个三键且无支链的链烃的结构简式: (写出一种即可)。
(2)已知分子式为C6H6的有机物有多种,其中的两种为。
①这两种结构的区别表现在以下两方面:定性方面(即化学性质方面):Ⅱ能发生而Ⅰ不能发生的反应为 (填字母)。
a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
②定量方面:与H2加成时Ⅰ需要3molH2,而Ⅱ需要H2 mol。
(3)C6H6还可能有一种立体结构,如,该结构的二氯代物有 种。
(4)溴苯可以通过苯为原料制取,同属于卤代烃的溴乙烷可以发生水解反应,写出溴乙烷水解的化学方程式 。
(5)苯及芳香族化合物在生活生产中有着非常广泛的应用,其中苯甲酸是一种常用的食品防腐剂。某小组设计粗苯甲酸(含有少量NaCl和泥沙)的提纯方案如下:
判断下列说法不正确的是___________。
A.操作I中依据苯甲酸的溶解度估算加水量
B.操作II需要趁热的原因是防止NaCl冷却析出
C.操作I与操作III缓中玻璃棒的作用相同
D.检验操作IV产物是否纯净可用硝酸酸化的AgNO3
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C A A A A C D B A D
题号 11 12 13 14 15
答案 D B D B C
1.C
【详解】A.硫化氢也能与酸性高锰酸钾溶液使溶液褪色,所以酸性高锰酸钾溶液褪色不能说明乙炔分子中含碳碳三键,具有还原性,故A错误;
B.向苯中滴入溴水,振荡,静置后水层变为无色,利用了萃取原理,苯能将溴从水中萃取出来,而非发生了加成反应,故B错误;
C.1-溴丁烷在氢氧化钠乙醇溶液中共热发生消去反应生成1-丁烯、溴化钠和水,乙醇具有挥发性,挥发出的乙醇不能与溴的四氯化碳溶液反应,则溶液褪色可以说明1-溴丁烷发生消去反应生成1-丁烯,故C正确;
D.氢氧化钠溶液也能与硝酸银溶液反应,会干扰溴离子与银离子的反应,所以未加入稀硝酸中和氢氧化钠,直接进入硝酸银溶液,无淡黄色沉淀生成无法判断溴乙烷是否发生了取代反应,故D错误;
故选C。
2.A
【详解】A.恒压滴液漏斗的支管连接了活塞上下,故无需关闭活塞,A正确;
B.浓硫酸会将氧化,故应用浓磷酸代替,B错;
C.加热温度为,故应用油浴,C错;
D.三颈烧瓶中发生的是取代反应,会有生成,故沉淀是和的混合物,D错;
答案选A。
3.A
【分析】
苯与Br2发生取代反应,得到K,苯生成M,由M的分子式得,M为,M与Cl2发生取代反应生成N,N为,N发生消去反应生成L。
【详解】A.化合物K为溴苯,溴苯的密度比水大,苯的密度比水小,且苯、溴苯与水互不相溶,用蒸馏水可鉴别苯和溴苯,故A正确;
B.L中存在碳碳双键,M为,不存在碳碳双键,结构不相似,且没有相差若干个CH2原子团,化合物M与L不是同系物,故B错误;
C.反应①为苯的取代,反应条件为溴、铁或溴化铁作催化剂,②为烷烃的取代反应,反应条件为Br2、光照,故C错误;
D.L中有碳碳双键能发生加成反应,其它碳原子上的氢也可以被取代,故D错误;
故选A。
4.A
【详解】A.1-氯丁烷中氯元素为氯原子,不能用硝酸酸化的硝酸银溶液检验,不能达到实验目的,故A选;
B.实验室用苯和硝酸在浓硫酸催化下制备硝基苯,反应需水浴加热,且需要用温度计控制温度为50℃~60℃,能达到实验目的,故B选;
C.向2mL10%的氢氧化钠溶液中滴加5滴5%的硫酸铜溶液,制得新制氢氧化铜,且氢氧化钠过量,检验醛基时产生砖红色沉淀,能达到实验目的,故C选;
D.乙醇催化氧化制取乙醛,铜可以做催化剂,能达到实验目的,故D选;
故选A。
5.A
【详解】A.氮化硅属于新型无机非金属材料,故A项正确;
B.芯片使用的是高纯度的硅,而不是二氧化硅,故B项错误;
C.四氯乙烯属于卤代烃,卤代烃是烃的衍生物,不属于烃类,故C项错误;
D.磁铁的主要成分是,故D项错误;
故本题选A。
6.C
【分析】
由合成路线可知,反应①为环戊烷与氯气光照条件下的取代反应,反应②为氯代烃的消去反应,反应③为烯烃与卤素单质的加成反应,反应④卤代烃的消去反应,故A为,B可以为。
【详解】A.通过以上分析知,②③④的反应类型分别为消去反应、加成反应、消去反应,故A正确;
B.反应④为溴代烃的消去反应,该反应的反应试剂和反应条件是NaOH醇溶液、加热,故B正确;
C.通过以上分析知,A的结构简式为,故C错误;
D.环戊二烯与Br2以1:1的物质的量之比发生1,4-加成,可生成,故D正确;
故选C。
7.D
【详解】A.苯、溴苯都不溶于水,但是苯密度小于水,溴苯密度大于水,所以苯和水混合时分层且油层在上方,溴苯和水混合时分层但是油层在下方,乙醇和水互溶,现象不同可以鉴别,A不合题意;
B.己烯能与Br2发生加成反应而使溴水褪色,但苯不与Br2反应,能够萃取分层,上层呈深橙红色,下层接近无色,现象不同可以用溴水鉴别苯和己烯,B不合题意;
C.乙烯燃烧时的现象:火焰明亮、有黑烟;甲烷燃烧时的现象:发出淡蓝色的火焰,现象不同可以鉴别,C不合题意;
D.苯和环己烷都不能被酸性高锰酸钾溶液氧化,且密度均比酸性高锰酸钾溶液小,即现象一样,不能用酸性高锰酸钾溶液鉴别苯和环己烷,D符合题意;
故答案为:D。
8.B
【详解】A.用FeS处理含Hg2+废水,离子方程式为:Hg2++FeS=HgS+Fe2+,故A错误;
B.将K3[Fe(CN)6]溶液滴入FeCl2溶液中产生蓝色沉淀,反应的离子方程式为:,故B正确;
C.铁为电极,阳极铁放电,不会生成氯气,正确的电极反应为:Fe+2H2O =Fe(OH)2↓+H2↑,故C错误;
D.溴乙烷水解的条件为氢氧化钠的水溶液并加热,生成溴化钠,不会生成溴原子,正确的离子方程式为:,故D错误;
故选B。
9.A
【详解】A.室温下,向苯酚浊液中加入碳酸钠溶液,由于,苯酚转化为苯酚钠,溶液变澄清,故A正确;
B.取钢铁电极附近的溶液,向其中滴加溶液,产生蓝色沉淀,说明钢铁发生了腐蚀,不能说明是析氢还是吸氧腐蚀,故B错误;
C.挥发的醇及生成的乙烯均使酸性高锰酸钾溶液褪色,则紫色褪去不能证明溴乙烷发生消去反应,故C错误;
D.将少量固体加入饱和溶液中,由于的相差不大,存在平衡,加入后,平衡逆向移动,生成少量,不能说明,故D错误;
故选A。
10.D
【详解】A.1-氯丙烯的结构简式:CH3-CH=CHCl,A错误;
B.基态氮原子电子排布轨道表达式写成违背了洪特规则,B错误;
C.O3的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键,所以O3分子的球棍模型不是:,C错误;
D.CO为共价化合物,其电子式为:,D正确;
故选D。
11.D
【详解】A.硝化反应过程中引入的官能团是-NO2,故A错误;
B.氟代反应为取代反应,可以取代不同位置的氢,产物不只一种,故B错误;
C.水解反应属于取代反应,不属于氧化还原反应,故C错误;
D.溴乙烷在氢氧化钠的乙醇溶液中加热能发生消去反应生成乙烯,故D正确;
答案选D。
12.B
【详解】A.加热时氯化铵受热分解,碘单质升华,二者无法用加热的方法分离,A错误;
B.铁钉在盐水环境下与空气中O2反应,气压降低,导管中红墨水液面上升,能说明左侧试管中铁发生吸氧腐蚀,B正确;
C.制备乙酸乙酯时用饱和碳酸钠溶液进行收集,不能用NaOH溶液,乙酸乙酯会在NaOH溶液中水解,C错误;
D.溴乙烷在碱性条件下水解,需要先加入硝酸反应掉多余的NaOH溶液,再加入硝酸银检验水解产物,D错误;
故选B。
13.D
【详解】A.丙烯与氯气发生取代反应转化为CH2=CHCH2Cl和HCl ,A正确;
B.苯与乙炔发生加成反应转化为苯乙烯,B正确;
C.卤代烃在氢氧化钠的醇溶液中加热发生消去反应,C正确;
D.硝基苯发生还原反应转化为,D错误;
故选D。
14.B
【详解】A.甲苯分子中的甲基氢原子被氯原子取代,属于取代反应,A不符合题意;
B.醇被氧化为醛的反应属于氧化反应,不属于取代反应,B符合题意;
C.在水、加热条件下,ClCH2CH=CH2与NaOH反应生成HOCH2CH=CH2,属于取代反应,C不符合题意;
D.苯环上的氢原子被硝基取代生成硝基苯,属于取代反应,D不符合题意;
故选B。
15.C
【分析】根据绿色化学的定义可知,原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放,以此解答该题。
【详解】A.丙烷与氯气反应除生成2-氯丙烷外,还有1-氯丙烷等副产物,同时有HCl生成,原子利用率不是100%,故A不符合“原子经济性”;
B.溴乙烷与NaOH醇溶液共热,除制得乙烯外还产生溴化钠和水,故B不符合“原子经济性”;
C.氯乙烯在一定条件下制聚氯乙烯,原料分子中的所有原子全部转变成所需产物,没有产生副产物,实现零排放,故C符合“原子经济性”;
D.乙醇催化氧化制乙醛,同时生成水,原子没有全部利用,,故D不符合“原子经济性”;
故答案选C。
16. C6H8O6 抗坏血酸 酸 溶液蓝色褪去 还原性 Ⅰ、Ⅲ、Ⅱ 2O3→3O2 氟氯代烷分解产生的Cl对O3的分解有促进作用
【分析】Ⅰ。根据结构简式书写其分子式;紫色石蕊试液遇酸变红色;根据淀粉的碘水溶液颜色变化判断其性质;
Ⅱ。(1)金属腐蚀的速度;原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀;
(2)将方程式①②③相加得出氧气和臭氧的关系式;根据Cl+O3→ClO+O2判断氟氯代烷能破坏大量臭氧的原因。
【详解】Ⅰ。维生素C的分子式为C6H8O6;称为抗坏血酸;紫色石蕊试液遇酸变红色,在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有酸性;维生素C能和碘反应而使淀粉的碘水溶液褪色,碘有氧化性,所以维生素C有还原性;
故答案为C6H8O6;抗坏血酸;酸;溶液蓝色褪去;还原性;
Ⅱ。(1)铁处于Ⅰ的环境中做原电池的负极,腐蚀速率较快,铁处于Ⅱ的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于Ⅲ的环境中的金属铁发生化学腐蚀,速度较慢;
综上所述,本题正确答案为:Ⅰ>Ⅲ>Ⅱ;
(2)由①Cl+O3→ClO+O2、O3→O+O2、③ClO+O→Cl+O2,将方程式①+②+③得方程式:2O3 →3O2;氟氯代烷受紫外线的照射分解出氯原子,Cl+O3→ClO+O2,Cl对O3的分解有促进作用,所以能破坏臭氧层;
故答案为2O3→3O2;氟氯代烷分解产生的Cl对O3的分解有促进作用。
17.(1) 四氯化碳 分馏
(2)CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2
(3) H2C=CH2+Cl2→CH2ClCH2Cl 加成反应 CH2ClCH2ClCH2=CHCl+HCl 消去反应
【详解】(1)分子结构为正四面体的为四氯化碳,工业上分离这些多氯代甲烷,根据物质的沸点不同,常用分馏的方法分离;
(2)三氟氯溴乙烷(CF3CHClBr)对应的同分异构体中,可根据卤素原子的位置不同判断,如F不在同一个C原子上,存在的同分异构体有CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2三种;
(3)反应①是乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应的方程式为H2C=CH2+Cl2→CH2ClCH2Cl,加热480~530℃生成氯乙烯,发生消去反应,反应的化学方程式为CH2ClCH2ClCH2=CHCl+HCl。
18.(1)
(2) 二溴丙烷 3
(3) 2 7
(4) 加聚反应
【分析】
根据丙烯的转化关系图可知,丙烯在光照条件下发生取代反应,生成的X为,丙烯与的溶液发生加成反应,生成的Y为,丙烯在催化剂存在条件下发生加聚反应,生成的Z为。
【详解】(1)丙烯在光照条件下发生取代反应,生成的X为;属于卤代烃,与足量KOH溶液共热可发生取代反应,化学方程式为;
故答案为:;;
(2)Y为,名称为:二溴丙烷;分子中有3种不同化学环境的氢原子;
故答案为:二溴丙烷;3;
(3)
分子中形成碳碳双键的碳原子杂化方式为,甲基碳原子杂化方式为,则碳原子的轨道杂化类型有2种;丙烯中碳碳双键为平面形,6个原子一定在同一平面上,甲基碳原子为四面体形,最多有1个H原子可在该平面上,有2个H原子不在该平面上,故分子中最多有7个原子共平面;
故答案为:2;7;
(4)
丙烯在催化剂存在条件下发生加聚反应,生成的Z为,反应的化学方程式为:,该反应类型为加聚反应;
故答案为:;加聚反应。
19.(1) ② 可以
(2) 6
(3) 10 5
【详解】(1)乙烯和氯化氢加成生成氯乙烷,没有其他副产物生成,而乙烷和氯气光照取代副产物较多,故②更好;氯乙烷在氢氧化钠、醇、加热的条件下发生消去反应可以生成乙烯;
(2)氯乙烯可以看做是乙烯中的1个氢原子被氯原子取代的产物,故其中所有原子都可以共平面,即最多有6个原子共平面;氯乙烯加聚可以生成PVC,方程式为:;
(3)乙烷分子中含有6个氢原子,与一定量氯气光照条件下反应,生成的产物有一溴乙烷(1种)、二溴乙烷(2种)、三溴乙烷(2种)、四溴乙烷(2种)、五溴乙烷(1种)、六溴乙烷(1种)及HBr,总共10种物质;其中,分子中只有一种处于不同化学环境下的氢原子的产物有,、、、、,一共5种。
20.(1) 液体 大 难溶于水,易溶于有机溶剂
(2)
【解析】略
21.③⑤①⑥④②
【详解】先取少量1-溴丁烷,加入氢氧化钠溶液进行水解,然后加热加快反应速率,溶液冷却后,加入硝酸中和过量的氢氧化钠,再加入硝酸银观察是否有沉淀,故正确顺序为:③⑤①⑥④②。
22. ⑤⑦ ②④ ①③ ⑥
【详解】由乙炔制氯乙烯,发生乙炔与HCl的加成反应;②乙烷在空气中燃烧,是乙烷被氧气氧化生成了二氧化碳,属于氧化反应;③乙烯使溴的四氯化碳溶液褪色,是乙烯与溴发生加成反应;④乙烯使酸性高锰酸钾溶液褪色,是乙烯被高锰酸钾氧化,发生氧化反应;⑤甲烷与氯气在光照的条件下反应,发生取代反应;⑥溴乙烷和氢氧化钠乙醇溶液共热,生成乙烯,属于消去反应; ⑦溴乙烷和氢氧化钠溶液共热,是溴乙烷中的溴原子被羟基所取代生成乙醇,属于取代反应; 故答案依次为⑤⑦ ;②④;①③;⑥。
23. AD 利用二氯乙烷热裂解所产生的氯化氢作为氯化剂,从而使氯得到完全利用,不向环境排放毒害气体
【分析】
【详解】(1)A. 乙烯、氯乙烯、聚氯乙烯都能在氧气中燃烧,A正确;
B. 聚氯乙烯不含碳碳双键,不能和溴水发生加成反应,B错误;
C. 聚氯乙烯不含碳碳双键,不能和酸性高锰酸钾溶液反应,C错误;
D. 氯乙烯分子中含有碳碳双键,所有原子共平面,D正确;
故合理选项为AD;
(2)利用二氯乙烷热裂解所产生的氯化氢作为氯化剂,从而使氯得到完全利用,不向环境排放毒害气体,减少对环境的危害;
(3)苯生成硝基苯的方程式为:;
(4)乙二醇和过量乙酸的反应方程式为:;
(5)聚氯乙烯燃烧的方程式为:。
24.
【详解】(1)以合成,可以首先与氢气加成生成,然后消去生成环己烯,再用环己烯与氯气加成生成二氯环己烷,再发生消去生成,再发生1,4-加成后与氢气加成即可,合成路线为 ,故答案为: ;
(2)在溴化铁作催化剂条件下,苯和液溴发生取代反应生成溴苯,在一定条件下,乙炔和溴化氢发生加成反应生成溴乙烯溴苯和溴乙烯、钠在一定条件下反应生成苯乙烯和溴化钠,流程为:,故答案为:。
25.(1)HC≡C—C≡C—CH2CH3(或HC≡C—CH2—C≡C—CH3或HC≡C—CH2—CH2—C≡CH或H3C—C≡C—C≡C—CH3)
(2) ab 2
(3)3
(4)CH3CH2Br+NaOHCH3CH2OH+NaBr
(5)BC
【分析】粗苯甲酸中含有少量NaCl和泥沙,由流程可知,加水溶解时需保证苯甲酸完全溶解,趁热过滤可防止苯甲酸结晶析出,过滤除去泥沙,滤液含苯甲酸、NaCl,NaCl的溶解度受温度影响不大,苯甲酸的溶解度随温度的升高而增大,则冷却结晶可析出苯甲酸,过滤、洗涤得到苯甲酸;
【详解】(1)分子式为C6H6的含两个三键且无支链的链烃的结构简式为:HC≡C—C≡C—CH2CH3(或HC≡C—CH2—C≡C—CH3或HC≡C—CH2—CH2—C≡CH或H3C—C≡C—C≡C—CH3);
(2)①由于Ⅱ中存在碳碳双键,故Ⅱ可被高锰酸钾酸性溶液氧化,也能与溴水发生加成反应,而Ⅰ中存在特殊的键不能发生上述反应,故选ab;
②由于苯环上加氢后形成环己烷(C6H12),故需3molH2,而Ⅱ分子中有两个碳碳双键,故需2molH2;
(3)
采用“定1移1”的方法,据对称性即可写出,即二氯代物有3种;
(4)溴乙烷与NaOH水溶液发生水解反应生成乙醇和NaBr,反应的化学方程式为:CH3CH2Br+NaOHCH3CH2OH+NaBr;
(5)A.加水溶解时需保证苯甲酸完全溶解,则操作Ⅰ中依据苯甲酸的溶解度估算加水量,故A正确;
B.苯甲酸在水的溶解度较小,则操作II需要趁热的原因是防止苯甲酸冷却析出,而不是防止NaCl冷却析出,故B错误;
C.操作Ⅰ为溶解,玻璃棒作用是通过搅拌加速溶解,操作III为冷却结晶,玻璃棒作用是通过搅拌防止局部温度过高导致液体飞溅,则两者玻璃棒的作用不相同,故C错误;
D.检验操作IV产物是否纯净可通过检验最后一次洗涤液中是否存在氯离子,可用硝酸酸化的AgNO3,故D正确;
故选BC。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
