1.1反应热同步练习 2024-2025学年高二上学期化学人教版(2019)选择性必修1(含答案)
文档属性
| 名称 | 1.1反应热同步练习 2024-2025学年高二上学期化学人教版(2019)选择性必修1(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 21:16:55 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
1.1反应热
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.以太阳能为驱动力,在介导上产生空穴(空穴是指共价键上流失一个电子,最后在共价键上留下空位的现象),在室温条件下可将氮气转化为氨气,其工作原理如下。下列说法错误的是
A.该过程中能量变化是光能转化为化学能
B.该工艺可能生成副产物氢气
C.生成氨气的总反应:
D.上产生,上产生(标准状况)
2.现代社会中,人类的一切活动都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。以下反应能量变化符合图像所示的是
①灼热的炭与二氧化碳的反应 ②盐酸与碳酸氢钠的反应
③氢气与氯气的反应 ④铁片与盐酸的反应
⑤氢氧化钡与氯化铵的反应 ⑥铜与浓硝酸反应
A.①③⑤ B.①②④ C.③④⑥ D.①③⑥
3.下列判断或分析错误的是
A.图1表示的反应可能是铝热反应
B.加入固体,反应的平衡不移动
C.向氨水中不断加水稀释,的值逐渐减小
D.已知:,,则相关物质的能量可用图2表示
4.已知:丙烯(CH3CH=CH2)与HCl可发生反应①和②,其能量与反应进程如下图所示:
①CH3CH=CH2+HCl→CH3CH2CH2Cl
②CH3CH=CH2+HCl→CH3CHClCH3
下列分析不正确的是
A.反应①、②均为加成反应
B.反应①、②的Ⅰ步过程均吸收能量
C.CH3CH2CH2Cl比CH3CHClCH3稳定
D.CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
5.酸碱中和反应是一个典型的放热反应,在测定中和热的实验中,下列叙述正确的是
A.将50mL0.55mol/LNaOH溶液与50mL0.50mol/L盐酸改为50mL0.65mol/LNaOH溶液与50mL0.60mol/L盐酸,所得中和热的数值保持不变
B.测定中和反应反应热的实验中,混合溶液的温度不再变化时,该温度为终止温度
C.测了盐酸溶液温度的温度计未洗涤立马测定氢氧化钠溶液的温度,会使得△H偏小
D.实验中可使用相同浓度的氨水替代氢氧化钠溶液
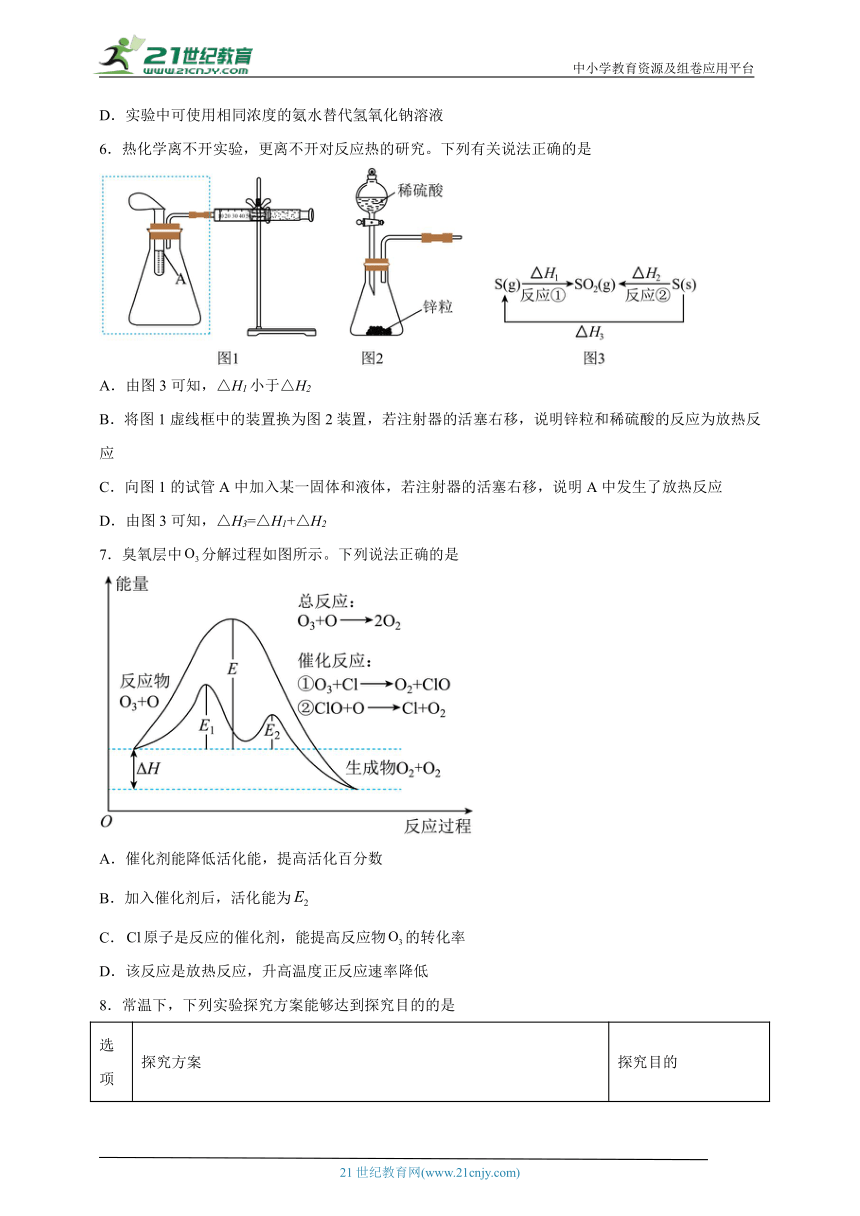
6.热化学离不开实验,更离不开对反应热的研究。下列有关说法正确的是
A.由图3可知,△H1小于△H2
B.将图1虚线框中的装置换为图2装置,若注射器的活塞右移,说明锌粒和稀硫酸的反应为放热反应
C.向图1的试管A中加入某一固体和液体,若注射器的活塞右移,说明A中发生了放热反应
D.由图3可知,△H3=△H1+△H2
7.臭氧层中分解过程如图所示。下列说法正确的是
A.催化剂能降低活化能,提高活化百分数
B.加入催化剂后,活化能为
C.原子是反应的催化剂,能提高反应物的转化率
D.该反应是放热反应,升高温度正反应速率降低
8.常温下,下列实验探究方案能够达到探究目的的是
选项 探究方案 探究目的
A 将一块铁片放入浓硫酸中,片刻后取出,用蒸馏水冲洗后浸入CuSO4溶液,观察铁片表面的现象 常温下,铁遇浓硫酸发生钝化
B 将铁锈溶于浓盐酸,再向溶液中滴入几滴酸性KMnO4溶液,观察溶液颜色变化 铁锈中含有二价铁
C 向Al(OH)3 沉淀中分别滴加盐酸和氨水,观察沉淀变化 Al(OH)3为两性氢氧化物
D 用0.100 0 mol·L-1 NaOH溶液滴定25.00 mL未知浓度的盐酸,用温度传感器采集锥形瓶内溶液的温度数据 测定中和反应的反应热
A.A B.B C.C D.D
9.工业上制硝酸原理如图所示:
信息:①N2(g)+O2(g)=2NO(g) ΔH=+182kJ mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-903kJ mol-1
下列说法不正确的是
A.工业制硝酸选择氨气氧化制得NO,也可以选择氮气氧化制得NO
B.反应②通常在760~840℃和Pt(铂)-Rh(铑)合金网催化剂下进行,目的是让催化剂活性最大以提高NO生成速率
C.为避免硝酸工业尾气中的氮氧化物污染环境,常用Na2CO3吸收尾气
D.氨氧化法制硝酸产生的大量余热可以用于发电,实现能源高效利用、绿色低碳发展
10.下列反应中的能量变化与下图一致的是
A.碳酸钙受热分解反应 B.稀盐酸与碳酸氢钠溶液的反应
C.与晶体反应 D.钠与水的反应
11.反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示,下列叙述正确的是
A.A+B→C的反应一定要加热 B.物质A、B、X、C中X最稳定
C.A和B的总能量大于C的总能量 D.①②两步反应均为放热反应
12.CO用于处理大气污染物,在催化剂作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。下列说法正确的是
A.总反应的
B.稳定性:IM1>IM2>IM3>IM4
C.反应①和反应②均为放热反应
D.总反应的催化剂为
13.在载人航天器中,的再生可通过如下过程实现:
① ;
② 。
下列叙述正确的是
A.氢气的燃烧热
B.
C.
D.反应②既有非极性键的断裂又有非极性键的形成
14.已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是
A.该反应需要在加热条件下才能进行
B.断裂1mol A-A键和1mol B-B键,放出a kJ能量
C.A2的总能量一定低于AB的总能量
D.每生成1mol AB(g)吸收的能量为0.5(a-b)kJ
15.能量以各种不同的形式呈现在人们面前,我们通过化学反应等方式可以实现不同形式的能量间的转化。下列叙述错误的是
A.同温同压下,在光照和点燃条件下的相同
B.化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因
C.水能、风能、潮汐能天然气均属于可再生能源
D.化学家借助太阳能产生的电能和热能,用空气和水成功地合成了氨气,该过程中电能转化为化学能
二、填空题
16.回答下列问题
(1)已知C(s,石墨)=C(s,金刚石) △H>0,则稳定性:金刚石 石墨(填“>”、“=”或“<”)
(2)已知:2C(s) +2O2(g)=2CO2(g) △H1 2C(s) +O2(g)=2CO(g) △H2
则 △H1 △H2 (填“>”、“=”或“<”)
(3)“嫦娥五号”已于2020年11月24日在海南文昌发射中心成功发射。火箭的第一、二级发动机所用的燃料为偏二甲肼和四氧化二氮,其中偏二甲肼可与肼(N2H4)来制备。用肼为燃料,四氧化二氮做氧化剂,二者反应生成氮气和气态水。已知:
①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol
②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol
写出气态肼和四氧化二氮反应的热化学方程式
(4)25℃、101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ的热量,写出该反应的热化学方程式
(5)0.50L 2.00mol/LH2SO4溶液与2.0L 1.00mol/LKOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H=
17.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) △H1=-57.3 kJ/mol。
(1)下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是 (填序号)。
A.稀硫酸与氢氧化钡溶液
B.盐酸与氢氧化钠溶液
C.浓硫酸与氢氧化钠固体
D.硫酸氢钠溶液与氢氧化钾溶液
E.氢氧化镁溶于稀盐酸
(2)若稀硫酸与氢氧化钡稀溶液反应生成1 mol H2O(l),则反应放出的热量 (填“大于”“等于”或“小于”)57.3kJ,原因是 (从化学键的角度简单解释即可)。
(3)若稀硫酸与氢氧化钠固体反应生成1 mol H2O(l),则反应放出的热量 (填“大于”“等于”或“小于”)57.3 kJ,原因是 。
(4)醋酸(CH3COOH)是一种常见弱酸,在水溶液中不能完全电离,而酸碱的中和反应是酸电离出的H+与碱电离出的OH-结合生成H2O的反应。醋酸与氢氧化钠稀溶液反应的离子方程式为CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H2O(l) △H2=a kJ/mol,则△H1和△H2的大小关系为△H1 △H2(填“>”“=”或“<”)。
18.回答下列问题。
(1)已知:、燃烧热分别为、,和的混合气体(标准状况下)完全燃烧生成和液态水时放出的热量,则混合气体中和的物质的量之比是 。(整数比)
(2)某些共价键的键能数据如下表(单位:):
共价键
键能 436 243 194 432 299 153 946 463 391
把分解为气态原子时,需要 (填“吸收”或“放出”)243kJ能量。由表中所列化学键形成的单质分子中,最稳定的是 ;
(3)发射火箭时用气态肼作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知完全发生上述反应放出的热量,热化学方程式是: 。
19.我国发射宇宙飞船的 “神舟”系列火箭用偏二甲肼(C2H8N2)作燃料,液态四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式: 。
(2)该反应是 (填“放热”或“吸热”)反应,反应物的总能量 (填“大于”、“小于”或“等于”)生成物的总能量,断开化学键 的总能量 (填“大于”、“小于”或“等于”)形成化学键 的总能量。
20.某同学进行图1实验,以检验化学反应中的能量变化.请回答下列问题:
实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是 热反应(填“放”或“吸”),Ba(OH)2 8H2O与NH4Cl的反应ΔH 0,反应过程 (填“①”或“②”)的能量变化可用图2表示。
21.有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 B C D E F
原子半径/nm 0.186 0.143 0.102 0.099 0.074
主要化合价 +1 +3 +6、-2 +7、-1 -2
根据上述信息回答以下问题。
(1)D在元素周期表中的位置 ;E的离子结构示意图 。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由 。
(3)用电子式表示B的单质与D的单质形成化合物的过程 。
(4)下列各项比较,正确的是 。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因 。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式 。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为 。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式 。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论 。
22.已知一定条件下,金刚石转化为石墨释放出能量,则金刚石比石墨稳定性 (填“强”、“弱”),等质量的金刚石和石墨充分燃烧均生成二氧化碳, 放出热量多。
23. 的氯气和焦炭、 固体完全反应,生成 液体和一种还原性的气体,放出热量,写出该反应的热化学方程式 。
24.焓与焓变
(1)焓(H):是一个与内能有关的 。
(2)焓变():在恒压下,化学反应过程中 的热量称为该反应的焓变。常用单位kJ/mol或kJ·mol-1。
25.从微观角度理解反应热的实质
以H2(g)+Cl2(g)=2HCl(g)反应的能量变化为例说明,如图所示:
由图可知:
化学键 反应中能量变化
断裂或形成1mol化学键的能量变化 断裂或形成化学键的总能量变化
H—H 吸收 kJ 共吸收 kJ
Cl—Cl 吸收 kJ
H—Cl 放出 kJ 共放出 kJ
结论 H2(g)+Cl2(g)=2HCl(g)的反应热ΔH=
①图示:化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:
其中, 表示反应物断裂化学键吸收的总热量, 表示生成物形成化学键放出的总热量,E1与E2的差值表示 。上述反应过程表示该反应为 反应。
②焓变计算公式:ΔH=E总(断键)-E总(成键)
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 D C C C A A A A A D
题号 11 12 13 14 15
答案 C A C D C
1.D
【详解】A.以太阳能为驱动力,在室温条件下可将氮气转化为氨气,能量变化是光能转化为化学能,A正确;
B.图中氢离子可能得到电子发生还原反应生成副产物氢气,B正确;
C.由图,总反应为氮气和水在光催化作用下生成氨气和氧气,C正确;
D.氮化合价由0变为-3得到氨气,则上产生,上产生1mol氨气,为22.4L(标准状况),D错误;
故选D。
2.C
【详解】由图可知,所示的应该为放热反应。
①灼热的炭与二氧化碳的反应 ②盐酸与碳酸氢钠的反应 ⑤氢氧化钡与氯化铵的反应均为吸热反应;
③氢气与氯气的反应④铁片与盐酸的反应⑥ 铜与浓硝酸反应均为放热反应;
故符合图像所示的为③④⑥;
答案选C。
3.C
【详解】A.铝热反应为放热反应,反应物的总能量高于生成物的总能量,A正确;
B.的反应本质为,加入固体,平衡不移动,B正确;
C.氨水中,,加水稀释促进一水合氨的电离,导致增大,而减小,所以的值增大,C错误;
D.已知:①,②,由于③H2O(l)=H2O(g) ,则反应②放出的热量>2×反应①,反应放出的热量<反应②,相关物质的能量可用图2表示,D正确;
故选C。
4.C
【详解】A.两个或多个分子互相作用,生成一个加成产物的反应称为加成反应,故反应①、②均为加成反应,A正确;
B.反应①、②的Ⅰ步反应物总能量低于生成物总能量,均为吸热反应,B正确;
C.根据反应进程可知, CH3CHClCH3的总能量低于CH3CH2CH2Cl,能量越低越稳定,故 CH3CHClCH3比CH3CH2CH2Cl稳定,C错误;
D.CH3CH2CH2Cl与CH3CHClCH3具有相同的分子式不同的结构式,互为同分异构体,D正确;
答案选C。
5.A
【详解】A.反应放出的热量和所用酸以及碱的量的多少有关,中和热是强酸和强碱的稀溶液反应生成1mol水时放出的热,与酸碱的用量无关,则将50mL0.55mol/LNaOH溶液与50mL0.50mol/L盐酸改为50mL0.65mol/LNaOH溶液与50mL0.60mol/L盐酸时放热增多,但所得中和热的数值保持不变,故A项正确;
B.酸碱恰好反应完全时放热最多,所以测定中和反应热的实验中,混合溶液温度最高时的温度为终止温度,故B项错误;
C.测盐酸溶液温度的温度计未洗涤立马测定氢氧化钠溶液的温度时,所测NaOH溶液的温度偏高,温度差偏小,反应热数值偏小,但中和热△H为负值,所以测得的△H偏大,故C项错误;
D.一水合氨是弱碱,电离吸热,实验中使用相同浓度的氨水替代氢氧化钠溶液时,测得中和热数值偏小,故D项错误;
故本题选A。
6.A
【详解】A.气态的硫的能量比固态硫的高,故反应①放出的热量比反应②的多,则由图3可知,反应①的△H1小于反应②的△H2,A正确;
B.由于锌粒与稀硫酸反应生成了H2,使注射器的活塞右移,故将图1虚线框框中的装置换为图2装置,若注射器的活塞右移,不能说明锌粒和稀硫酸的反应为放热反应,B错误;
C.很多物质溶解过程也是放热的,故向图l的试管A中加入某一固体和液体,若注射器的活塞右移,不能说明A中发生了放热反应,C错误;
D.反应①+反应②≠过程③,故由图3可知,△H3≠△H1+△H2,应该是反应②=过程③+反应①,即△H2=△H3+△H1,D错误;
故合理选项是A。
7.A
【详解】A.催化剂改变反应历程,降低活化能,提高活化百分数,A正确;
B.加入催化剂后,反应①的活化能为,反应②的活化能小于E2,B错误;
C.由图可知,Cl是反应的催化剂,催化剂改变反应速率,但不能提高反应物的反应率,B错误;
D.反应物总能量大于生成物的总能量,总反应是放热反应,升高温度正逆反应速率均会升高,D错误;
故选A。
8.A
【详解】A.将一块铁片放入浓硫酸中,片刻后取出,用蒸馏水冲洗后浸入CuSO4溶液,铁片表面无红色铜析出,说明铁遇浓硫酸发生钝化,故选A;
B.将铁锈溶于浓盐酸,再向溶液中滴入几滴酸性KMnO4溶液,氯离子也能被高锰酸钾溶液氧化,高锰酸钾溶液褪色,不能证明铁锈中含有二价铁,故不选B;
C.Al(OH)3和氨水不反应,故不选C;
D.用0.100 0 mol·L-1 NaOH溶液滴定25.00 mL未知浓度的盐酸,用温度传感器采集锥形瓶内溶液的温度数据,热量散失过多,不能测定中和反应的反应热,故不选D;
答案选A。
9.A
【分析】氨气催化氧化得到NO,NO与氧气反应生成NO2,NO2与水反应生成HNO3。
【详解】A.工业制硝酸选择氨气氧化制得NO,由“信息”可知,氮气与氧气反应是吸热反应,从能源角度考虑不选择氮气氧化制得NO,A错误;
B.适当的温度和载体可使催化剂活性最大,以提高NO生成速率,B正确;
C.Na2CO3溶液呈碱性,为避免硝酸工业尾气中的氮氧化物污染环境,常用Na2CO3溶液吸收尾气,C正确;
D.由“信息”可知,氨气催化氧化放出大量的热,氨氧化法制硝酸产生的大量余热可以用于发电,实现能源高效利用、绿色低碳发展,D正确;
故选A。
10.D
【分析】图中可知反应物总能量高于生成物总能量,为放热反应。
【详解】A.碳酸钙受热分解反应是吸热反应,故A错误;
B.稀盐酸与碳酸氢钠溶液的反应是吸热反应,故B错误;
C.与晶体反应是吸热反应,故C错误;
D.钠与水的反应是放热反应,故D正确;
故答案为:D。
11.C
【详解】A.吸热反应或放热反应,与是否需要加热等反应条件无关,A错误;
B.能量越低越稳定,图中C物质具有的能量比X低,所以C物质比X稳定,由图只能看出A和B的总能量,无法确定二者具体的能量大小,所以无法判断这两种物质与其他物质的稳定性高低,B错误;
C.由图可以看出,A和B的总能量大于C的总能量,C正确;
D.由图可以看出第一步A+B→X,反应物总能量低于生成物总能量,属于吸热反应,第二步X→C,反应物总能量高于生成物总能量,属于放热反应,D错误;
故选C。
12.A
【分析】ΔH=生成物的总能量-反应物的总能量,根据图1和图2可以看出反应的催化剂为为Zn+,ZnO+为中间产物,以此做题。
【详解】A.根据流程图可以看出反应过程中CO变为CO2,N2O变成N2,总反应为CO(g)+N2O(g)=CO2(g)+N2(g),生成物的总能量小于反应物的总能量,差值为361.22kJ/mol,因此该反应的 ΔH= 361.22kJ mol 1,故A正确;
B.能量越低越稳定,所以稳定性:IM1C.反应①是Zn+和N2O反应生成N2和ZnO+,生成物能量高于反应物能量,是吸热反应,反应②是放热反应,故C错误;
D.根据图1和图2结合,可以看出反应的催化剂为Zn+,ZnO+为中间产物,故D错误;
故选A。
13.C
【详解】A.由反应②可知,氢气的燃烧热为,A项错误;
B.由于为放热过程,故反应 ,B项错误;
C.根据盖斯定律(-2×②―①)可得 ,C项正确;
D.分子内无非极性键,故反应②无非极性键的断裂,只有非极性键的形成,D项错误;
故选C。
14.D
【分析】根据图像分析,此反应属于吸热反应,产物总能量高于反应物总能量。
【详解】A.1 mol A2和1 mol B2反应生成2mol AB,每生成2mol AB(g)吸收(a一b)kJ的热量,A项错误;
B.断裂1 mol A一A 键和1 mol B-B键,吸收a kJ能量,B项错误;
C.依据题图可知,反应物的总能量低于反应产物的总能量,C项错误;
D.反应能量变化=反应产物的总能量-反应物的总能量,所以生成1mol AB吸收的能量为0.5(a一b)kJ· mol-1,D项正确;
故答案选D。
15.C
【详解】A.焓变△H=生成物具有的能量-反应物具有的能量,只与物质的起始状态有关,与反应条件无关,所以同温同压下,在光照和点燃条件下的△H相等,故A正确;
B.化学键断裂吸热,化学键形成放热,是化学反应中能量变化的主要原因,故B正确;
C.天然气属于不可再生能源,故C错误;
D.在电能和热能的作用下,用空气和水作原料成功地合成了氨气,电能转化为了化学能,故D正确;
答案选C。
16.(1)<
(2)<
(3)2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol
(4)CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1
(5)-57.3kJ /mol
【详解】(1)物质的能量越高,该物质越不稳定,C(s,石墨)=C(s,金刚石) △H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故答案为:<;
(2)C的燃烧为放热反应,则△H < 0,完全燃烧放出较多能量,放出的能量越多△H越小,则△H1<△H2,故答案为:< ;
(3)①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol;②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol,由盖斯定律②×2 -①得到2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol,故答案为:2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol;
(4)1molCO为28g,14gCO在足量的O2中充分燃烧,放出141.3kJ 的热,则1molCO完全燃烧放出282.6kJ热量,CO的燃烧热为△H =-282.6kJ·mol-1,该反应的热化学方程式为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1,故答案为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1;
(5)0.50L 2.00mol/ L H2SO4溶液与2.00L 1.00mol/ L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为- 11.46kJ/mol,中和热为- 57.3kJ/mol,故答案为:-57.3kJ /mol。
17. BD 大于 生成BaSO4沉淀时有新化学键的形成,会放出更多的热量 大于 氢氧化钠固体溶解放热 <
【分析】(1)H+(aq)+OH-(aq)=H2O(l)表示强酸、强碱反应产生可溶性盐和1 mol水;
(2) H+(aq)+OH-(aq)=H2O(l)表示强酸、强碱反应产生可溶性盐和1 mol水放出的热量;
【详解】(1)H+(aq)+OH-(aq)=H2O(l)表示强酸、强碱反应产生可溶性盐和1 mol水;
A.稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀水,硫酸钡不能拆分为离子,所以离子方程式不是H++OH-=H2O,A错误;
B.盐酸与氢氧化钠溶液反应生成NaCl和水,离子方程式为H++OH-=H2O,B正确;
C.浓硫酸与氢氧化钠固体不是离子反应,不能用离子方程式H++OH-=H2O表示,C错误;
D.硫酸氢钠溶液与氢氧化钾溶液反应生成硫酸钠、硫酸钾和水,离子方程式为H++OH-=H2O,D正确;
E.氢氧化镁溶于稀盐酸生成氯化镁和水,氢氧化镁是难溶物质,不能拆分为离子,所以不能用离子方程式H++OH-=H2O表示,E错误;
故合理选项是BD;
(2)稀硫酸与氢氧化钡稀溶液反应生成硫酸钡沉淀和水,反应中除了中和热以外,还有形成沉淀过程放出的热量,所以若稀硫酸与氢氧化钡稀溶液反应生成1 mol H2O(l),则反应放出的热量大于57.3 kJ;
(3)氢氧化钠固体溶解会放热,所以稀硫酸与氢氧化钠固体反应生成1 mol H2O(l),则反应放出的热量大于57.3 kJ;
(4)醋酸是弱酸,电离时会吸热,反应放热越多,反应热越小,则醋酸与氢氧化钠稀溶液反应生成1 mol水放出的热量小于57.3 kJ,则△H1<△H2。
【点睛】本题考查了化学反应中的能量变化、反应热的计算与比较。注意理解中和热的概念、把握热化学方程式的书写方法。
18.(1)1:3
(2) 吸收 N2
(3)
【详解】(1)设氢气与甲烷物质的量分别是x、y,混合气体总物质的量为,则x+y=5mol,,解得x=1.25mol,y=3.75mol,则混合气体中和的物质的量之比是;
(2)化学键断裂要吸收能量,由表中数据可知,把1molCl2分解为气态原子时,需吸收243kJ能量;因键能越大越稳定,所以最稳定的是氮气;
(3)1molN2H4(g)和二氧化氮完全反应生成氮气和气态水,放出568kJ的热量,其热化学方程式为: 。
19. C2H8N2+2N2O42CO2↑+3N2↑+4H2O 放热 大于 吸收 小于 放出
【分析】(1)偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体,据此写出化学方程式;
(2)该反应能提供飞船飞行所需的能量,据此分析反应吸放热和反应物的总能量、生成物的总能量之间的关系。
【详解】(1)偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体,根据电子守恒、原子守恒,可得该反应的化学方程式为:C2H8N2+2N2O42CO2↑+3N2↑+4H2O;
(2)该反应能提供飞船飞行所需的能量,说明此反应为放热反应,则反应物的总能量大于生成物的总能量,断开化学键所吸收的总能量小于形成化学键放出的总能量。
【点睛】本题考查了化学方程式的书写和反应吸、放热的判断的知识,应注意的是反应吸放反应还是放热反应取决于反应物和生成物的总能量的相对大小或断键吸收能量和成键放出能量的相对大小。
20. 放 > ①
【分析】结合实验现象分析反应中的能量变化,根据反应物的总能量与生成物的总能量相对大小确定反应是吸热或放热反应。
【详解】通过实验测出,反应后①烧杯中的温度升高,则Al跟盐酸的反应是放热反应,而②烧杯中的温度降低,则Ba(OH)2 8H2O跟NH4Cl的反应是吸热反应,即ΔH>0;根据图2数据可知,该反应中,反应物总能量大于生成物总能量,则该反应为放热反应,可表示反应①的能量变化。
【点睛】考查化学反应中的吸热反应与放热反应,明确化学反应中能量变化,反应物、生成物总能量与吸热反应、放热反应的关系为解答关键,特别注意吸热反应的ΔH>0,这是易错点。
21.(1) 第三周期,第ⅥA族
(2)氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构)
(3)
(4)①
(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒
(6)2Al+2OH-+2H2O=2AlO +3H2↑
(7)2Al+Fe2O3Al2O3+2Fe
(8)Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol
(9)NH3 + H3O+=NH+ H2O
【分析】已知A的单质是最清洁的能源物质,A是H;根据元素的原子半径及主要化合价可知D一定是S,E一定是Cl,F一定是O,则B一定是Na,C一定是Al。
【详解】(1)S在元素周期表中的位置是第三周期第ⅥA族;Cl-离子结构示意图为。故答案为:第三周期,第ⅥA族;;
(2)由于氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构),因此有人主张把它放在第ⅦA族。故答案为:氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构);
(3)B的单质与D的单质形成的化合物是离子化合物硫化钠,其形成过程可表示为。故答案为:;
(4)①水分子间存在氢键,则氢化物的沸点:D低于F,正确;②离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A~F元素的简单离子半径:S的最大,错误;③氯元素非金属性强于硫,气态氢化物稳定性:E比D稳定,错误;④钠的金属性强于铝,最高价氧化物对应的水化物碱性:B大于C,错误,答案选①;故答案为:①;
(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒。故答案为:Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒;
(6)铝单质与B的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑。故答案为:2Al+2OH-+2H2O=2AlO +3H2↑;
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,即铝与氧化铁发生的铝热反应,该反应的化学方程式为2Al+Fe2O3Al2O3+2Fe。故答案为:2Al+Fe2O3Al2O3+2Fe;
(8)已知铁的燃烧热为375kJ/mol,则表示其燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)ΔH=-375kJ/mol。故答案为:Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol;
(9)根据反应NH3+H3O+=NH+H2O可说明NH3结合质子的能力强于水。故答案为:NH3 + H3O+=NH+ H2O;
22. 弱 金刚石
【详解】一定条件下,金刚石转化为石墨释放出能量,则金刚石的能量高于石墨的能量,又物质能量越低越稳定,故金刚石比石墨稳定性弱;金刚石和石墨充分燃烧生成二氧化碳均是放热反应,金刚石的能量更高,故放出的热量更多。
23.
【详解】与焦炭、 完全反应,生成一种还原性气体和TiCl4,放热4.28 kJ,由质量守恒可知还原性气体为 ,反应的化学方程式为, 氯气反应放出的热量为,所以热化学方程式为。
24.(1)物理量
(2)吸收或释放
【详解】(1)焓(H):是一个与内能有关的物理量;
(2)焓变():在恒压下,化学反应过程中吸收或释放的热量称为该反应的焓变,常用单位kJ/mol或kJ·mol-1。
25. 436 243 679 431 862 -183kJ·mol-1 E1 E2 反应热 放热
【详解】化学键断裂吸收能量,化学键形成放出能量。根据图示,1molH—H键断裂吸收436kJ能量,1molCl—Cl键断裂吸收243kJ能量,1molH—H键和1molCl—Cl键断裂共吸收679kJ能量;1molH—Cl键形成放出431kJ能量,2molH—Cl键形成共放出862kJ能量,故H2(g)+Cl2(g)=2HCl(g)的反应热ΔH=679-862=-183kJ·mol-1。
①根据图示,E1表示反应物断裂化学键吸收的总热量,E2表示生成物形成化学键放出的总热量,E1与E2的差值表示反应热。上述反应过程表示该反应为放热反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
1.1反应热
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.以太阳能为驱动力,在介导上产生空穴(空穴是指共价键上流失一个电子,最后在共价键上留下空位的现象),在室温条件下可将氮气转化为氨气,其工作原理如下。下列说法错误的是
A.该过程中能量变化是光能转化为化学能
B.该工艺可能生成副产物氢气
C.生成氨气的总反应:
D.上产生,上产生(标准状况)
2.现代社会中,人类的一切活动都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。以下反应能量变化符合图像所示的是
①灼热的炭与二氧化碳的反应 ②盐酸与碳酸氢钠的反应
③氢气与氯气的反应 ④铁片与盐酸的反应
⑤氢氧化钡与氯化铵的反应 ⑥铜与浓硝酸反应
A.①③⑤ B.①②④ C.③④⑥ D.①③⑥
3.下列判断或分析错误的是
A.图1表示的反应可能是铝热反应
B.加入固体,反应的平衡不移动
C.向氨水中不断加水稀释,的值逐渐减小
D.已知:,,则相关物质的能量可用图2表示
4.已知:丙烯(CH3CH=CH2)与HCl可发生反应①和②,其能量与反应进程如下图所示:
①CH3CH=CH2+HCl→CH3CH2CH2Cl
②CH3CH=CH2+HCl→CH3CHClCH3
下列分析不正确的是
A.反应①、②均为加成反应
B.反应①、②的Ⅰ步过程均吸收能量
C.CH3CH2CH2Cl比CH3CHClCH3稳定
D.CH3CH2CH2Cl与CH3CHClCH3互为同分异构体
5.酸碱中和反应是一个典型的放热反应,在测定中和热的实验中,下列叙述正确的是
A.将50mL0.55mol/LNaOH溶液与50mL0.50mol/L盐酸改为50mL0.65mol/LNaOH溶液与50mL0.60mol/L盐酸,所得中和热的数值保持不变
B.测定中和反应反应热的实验中,混合溶液的温度不再变化时,该温度为终止温度
C.测了盐酸溶液温度的温度计未洗涤立马测定氢氧化钠溶液的温度,会使得△H偏小
D.实验中可使用相同浓度的氨水替代氢氧化钠溶液
6.热化学离不开实验,更离不开对反应热的研究。下列有关说法正确的是
A.由图3可知,△H1小于△H2
B.将图1虚线框中的装置换为图2装置,若注射器的活塞右移,说明锌粒和稀硫酸的反应为放热反应
C.向图1的试管A中加入某一固体和液体,若注射器的活塞右移,说明A中发生了放热反应
D.由图3可知,△H3=△H1+△H2
7.臭氧层中分解过程如图所示。下列说法正确的是
A.催化剂能降低活化能,提高活化百分数
B.加入催化剂后,活化能为
C.原子是反应的催化剂,能提高反应物的转化率
D.该反应是放热反应,升高温度正反应速率降低
8.常温下,下列实验探究方案能够达到探究目的的是
选项 探究方案 探究目的
A 将一块铁片放入浓硫酸中,片刻后取出,用蒸馏水冲洗后浸入CuSO4溶液,观察铁片表面的现象 常温下,铁遇浓硫酸发生钝化
B 将铁锈溶于浓盐酸,再向溶液中滴入几滴酸性KMnO4溶液,观察溶液颜色变化 铁锈中含有二价铁
C 向Al(OH)3 沉淀中分别滴加盐酸和氨水,观察沉淀变化 Al(OH)3为两性氢氧化物
D 用0.100 0 mol·L-1 NaOH溶液滴定25.00 mL未知浓度的盐酸,用温度传感器采集锥形瓶内溶液的温度数据 测定中和反应的反应热
A.A B.B C.C D.D
9.工业上制硝酸原理如图所示:
信息:①N2(g)+O2(g)=2NO(g) ΔH=+182kJ mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=-903kJ mol-1
下列说法不正确的是
A.工业制硝酸选择氨气氧化制得NO,也可以选择氮气氧化制得NO
B.反应②通常在760~840℃和Pt(铂)-Rh(铑)合金网催化剂下进行,目的是让催化剂活性最大以提高NO生成速率
C.为避免硝酸工业尾气中的氮氧化物污染环境,常用Na2CO3吸收尾气
D.氨氧化法制硝酸产生的大量余热可以用于发电,实现能源高效利用、绿色低碳发展
10.下列反应中的能量变化与下图一致的是
A.碳酸钙受热分解反应 B.稀盐酸与碳酸氢钠溶液的反应
C.与晶体反应 D.钠与水的反应
11.反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示,下列叙述正确的是
A.A+B→C的反应一定要加热 B.物质A、B、X、C中X最稳定
C.A和B的总能量大于C的总能量 D.①②两步反应均为放热反应
12.CO用于处理大气污染物,在催化剂作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。下列说法正确的是
A.总反应的
B.稳定性:IM1>IM2>IM3>IM4
C.反应①和反应②均为放热反应
D.总反应的催化剂为
13.在载人航天器中,的再生可通过如下过程实现:
① ;
② 。
下列叙述正确的是
A.氢气的燃烧热
B.
C.
D.反应②既有非极性键的断裂又有非极性键的形成
14.已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是
A.该反应需要在加热条件下才能进行
B.断裂1mol A-A键和1mol B-B键,放出a kJ能量
C.A2的总能量一定低于AB的总能量
D.每生成1mol AB(g)吸收的能量为0.5(a-b)kJ
15.能量以各种不同的形式呈现在人们面前,我们通过化学反应等方式可以实现不同形式的能量间的转化。下列叙述错误的是
A.同温同压下,在光照和点燃条件下的相同
B.化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因
C.水能、风能、潮汐能天然气均属于可再生能源
D.化学家借助太阳能产生的电能和热能,用空气和水成功地合成了氨气,该过程中电能转化为化学能
二、填空题
16.回答下列问题
(1)已知C(s,石墨)=C(s,金刚石) △H>0,则稳定性:金刚石 石墨(填“>”、“=”或“<”)
(2)已知:2C(s) +2O2(g)=2CO2(g) △H1 2C(s) +O2(g)=2CO(g) △H2
则 △H1 △H2 (填“>”、“=”或“<”)
(3)“嫦娥五号”已于2020年11月24日在海南文昌发射中心成功发射。火箭的第一、二级发动机所用的燃料为偏二甲肼和四氧化二氮,其中偏二甲肼可与肼(N2H4)来制备。用肼为燃料,四氧化二氮做氧化剂,二者反应生成氮气和气态水。已知:
①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol
②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol
写出气态肼和四氧化二氮反应的热化学方程式
(4)25℃、101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ的热量,写出该反应的热化学方程式
(5)0.50L 2.00mol/LH2SO4溶液与2.0L 1.00mol/LKOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H=
17.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) △H1=-57.3 kJ/mol。
(1)下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是 (填序号)。
A.稀硫酸与氢氧化钡溶液
B.盐酸与氢氧化钠溶液
C.浓硫酸与氢氧化钠固体
D.硫酸氢钠溶液与氢氧化钾溶液
E.氢氧化镁溶于稀盐酸
(2)若稀硫酸与氢氧化钡稀溶液反应生成1 mol H2O(l),则反应放出的热量 (填“大于”“等于”或“小于”)57.3kJ,原因是 (从化学键的角度简单解释即可)。
(3)若稀硫酸与氢氧化钠固体反应生成1 mol H2O(l),则反应放出的热量 (填“大于”“等于”或“小于”)57.3 kJ,原因是 。
(4)醋酸(CH3COOH)是一种常见弱酸,在水溶液中不能完全电离,而酸碱的中和反应是酸电离出的H+与碱电离出的OH-结合生成H2O的反应。醋酸与氢氧化钠稀溶液反应的离子方程式为CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H2O(l) △H2=a kJ/mol,则△H1和△H2的大小关系为△H1 △H2(填“>”“=”或“<”)。
18.回答下列问题。
(1)已知:、燃烧热分别为、,和的混合气体(标准状况下)完全燃烧生成和液态水时放出的热量,则混合气体中和的物质的量之比是 。(整数比)
(2)某些共价键的键能数据如下表(单位:):
共价键
键能 436 243 194 432 299 153 946 463 391
把分解为气态原子时,需要 (填“吸收”或“放出”)243kJ能量。由表中所列化学键形成的单质分子中,最稳定的是 ;
(3)发射火箭时用气态肼作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知完全发生上述反应放出的热量,热化学方程式是: 。
19.我国发射宇宙飞船的 “神舟”系列火箭用偏二甲肼(C2H8N2)作燃料,液态四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式: 。
(2)该反应是 (填“放热”或“吸热”)反应,反应物的总能量 (填“大于”、“小于”或“等于”)生成物的总能量,断开化学键 的总能量 (填“大于”、“小于”或“等于”)形成化学键 的总能量。
20.某同学进行图1实验,以检验化学反应中的能量变化.请回答下列问题:
实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是 热反应(填“放”或“吸”),Ba(OH)2 8H2O与NH4Cl的反应ΔH 0,反应过程 (填“①”或“②”)的能量变化可用图2表示。
21.有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 B C D E F
原子半径/nm 0.186 0.143 0.102 0.099 0.074
主要化合价 +1 +3 +6、-2 +7、-1 -2
根据上述信息回答以下问题。
(1)D在元素周期表中的位置 ;E的离子结构示意图 。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由 。
(3)用电子式表示B的单质与D的单质形成化合物的过程 。
(4)下列各项比较,正确的是 。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因 。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式 。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为 。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式 。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论 。
22.已知一定条件下,金刚石转化为石墨释放出能量,则金刚石比石墨稳定性 (填“强”、“弱”),等质量的金刚石和石墨充分燃烧均生成二氧化碳, 放出热量多。
23. 的氯气和焦炭、 固体完全反应,生成 液体和一种还原性的气体,放出热量,写出该反应的热化学方程式 。
24.焓与焓变
(1)焓(H):是一个与内能有关的 。
(2)焓变():在恒压下,化学反应过程中 的热量称为该反应的焓变。常用单位kJ/mol或kJ·mol-1。
25.从微观角度理解反应热的实质
以H2(g)+Cl2(g)=2HCl(g)反应的能量变化为例说明,如图所示:
由图可知:
化学键 反应中能量变化
断裂或形成1mol化学键的能量变化 断裂或形成化学键的总能量变化
H—H 吸收 kJ 共吸收 kJ
Cl—Cl 吸收 kJ
H—Cl 放出 kJ 共放出 kJ
结论 H2(g)+Cl2(g)=2HCl(g)的反应热ΔH=
①图示:化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:
其中, 表示反应物断裂化学键吸收的总热量, 表示生成物形成化学键放出的总热量,E1与E2的差值表示 。上述反应过程表示该反应为 反应。
②焓变计算公式:ΔH=E总(断键)-E总(成键)
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 D C C C A A A A A D
题号 11 12 13 14 15
答案 C A C D C
1.D
【详解】A.以太阳能为驱动力,在室温条件下可将氮气转化为氨气,能量变化是光能转化为化学能,A正确;
B.图中氢离子可能得到电子发生还原反应生成副产物氢气,B正确;
C.由图,总反应为氮气和水在光催化作用下生成氨气和氧气,C正确;
D.氮化合价由0变为-3得到氨气,则上产生,上产生1mol氨气,为22.4L(标准状况),D错误;
故选D。
2.C
【详解】由图可知,所示的应该为放热反应。
①灼热的炭与二氧化碳的反应 ②盐酸与碳酸氢钠的反应 ⑤氢氧化钡与氯化铵的反应均为吸热反应;
③氢气与氯气的反应④铁片与盐酸的反应⑥ 铜与浓硝酸反应均为放热反应;
故符合图像所示的为③④⑥;
答案选C。
3.C
【详解】A.铝热反应为放热反应,反应物的总能量高于生成物的总能量,A正确;
B.的反应本质为,加入固体,平衡不移动,B正确;
C.氨水中,,加水稀释促进一水合氨的电离,导致增大,而减小,所以的值增大,C错误;
D.已知:①,②,由于③H2O(l)=H2O(g) ,则反应②放出的热量>2×反应①,反应放出的热量<反应②,相关物质的能量可用图2表示,D正确;
故选C。
4.C
【详解】A.两个或多个分子互相作用,生成一个加成产物的反应称为加成反应,故反应①、②均为加成反应,A正确;
B.反应①、②的Ⅰ步反应物总能量低于生成物总能量,均为吸热反应,B正确;
C.根据反应进程可知, CH3CHClCH3的总能量低于CH3CH2CH2Cl,能量越低越稳定,故 CH3CHClCH3比CH3CH2CH2Cl稳定,C错误;
D.CH3CH2CH2Cl与CH3CHClCH3具有相同的分子式不同的结构式,互为同分异构体,D正确;
答案选C。
5.A
【详解】A.反应放出的热量和所用酸以及碱的量的多少有关,中和热是强酸和强碱的稀溶液反应生成1mol水时放出的热,与酸碱的用量无关,则将50mL0.55mol/LNaOH溶液与50mL0.50mol/L盐酸改为50mL0.65mol/LNaOH溶液与50mL0.60mol/L盐酸时放热增多,但所得中和热的数值保持不变,故A项正确;
B.酸碱恰好反应完全时放热最多,所以测定中和反应热的实验中,混合溶液温度最高时的温度为终止温度,故B项错误;
C.测盐酸溶液温度的温度计未洗涤立马测定氢氧化钠溶液的温度时,所测NaOH溶液的温度偏高,温度差偏小,反应热数值偏小,但中和热△H为负值,所以测得的△H偏大,故C项错误;
D.一水合氨是弱碱,电离吸热,实验中使用相同浓度的氨水替代氢氧化钠溶液时,测得中和热数值偏小,故D项错误;
故本题选A。
6.A
【详解】A.气态的硫的能量比固态硫的高,故反应①放出的热量比反应②的多,则由图3可知,反应①的△H1小于反应②的△H2,A正确;
B.由于锌粒与稀硫酸反应生成了H2,使注射器的活塞右移,故将图1虚线框框中的装置换为图2装置,若注射器的活塞右移,不能说明锌粒和稀硫酸的反应为放热反应,B错误;
C.很多物质溶解过程也是放热的,故向图l的试管A中加入某一固体和液体,若注射器的活塞右移,不能说明A中发生了放热反应,C错误;
D.反应①+反应②≠过程③,故由图3可知,△H3≠△H1+△H2,应该是反应②=过程③+反应①,即△H2=△H3+△H1,D错误;
故合理选项是A。
7.A
【详解】A.催化剂改变反应历程,降低活化能,提高活化百分数,A正确;
B.加入催化剂后,反应①的活化能为,反应②的活化能小于E2,B错误;
C.由图可知,Cl是反应的催化剂,催化剂改变反应速率,但不能提高反应物的反应率,B错误;
D.反应物总能量大于生成物的总能量,总反应是放热反应,升高温度正逆反应速率均会升高,D错误;
故选A。
8.A
【详解】A.将一块铁片放入浓硫酸中,片刻后取出,用蒸馏水冲洗后浸入CuSO4溶液,铁片表面无红色铜析出,说明铁遇浓硫酸发生钝化,故选A;
B.将铁锈溶于浓盐酸,再向溶液中滴入几滴酸性KMnO4溶液,氯离子也能被高锰酸钾溶液氧化,高锰酸钾溶液褪色,不能证明铁锈中含有二价铁,故不选B;
C.Al(OH)3和氨水不反应,故不选C;
D.用0.100 0 mol·L-1 NaOH溶液滴定25.00 mL未知浓度的盐酸,用温度传感器采集锥形瓶内溶液的温度数据,热量散失过多,不能测定中和反应的反应热,故不选D;
答案选A。
9.A
【分析】氨气催化氧化得到NO,NO与氧气反应生成NO2,NO2与水反应生成HNO3。
【详解】A.工业制硝酸选择氨气氧化制得NO,由“信息”可知,氮气与氧气反应是吸热反应,从能源角度考虑不选择氮气氧化制得NO,A错误;
B.适当的温度和载体可使催化剂活性最大,以提高NO生成速率,B正确;
C.Na2CO3溶液呈碱性,为避免硝酸工业尾气中的氮氧化物污染环境,常用Na2CO3溶液吸收尾气,C正确;
D.由“信息”可知,氨气催化氧化放出大量的热,氨氧化法制硝酸产生的大量余热可以用于发电,实现能源高效利用、绿色低碳发展,D正确;
故选A。
10.D
【分析】图中可知反应物总能量高于生成物总能量,为放热反应。
【详解】A.碳酸钙受热分解反应是吸热反应,故A错误;
B.稀盐酸与碳酸氢钠溶液的反应是吸热反应,故B错误;
C.与晶体反应是吸热反应,故C错误;
D.钠与水的反应是放热反应,故D正确;
故答案为:D。
11.C
【详解】A.吸热反应或放热反应,与是否需要加热等反应条件无关,A错误;
B.能量越低越稳定,图中C物质具有的能量比X低,所以C物质比X稳定,由图只能看出A和B的总能量,无法确定二者具体的能量大小,所以无法判断这两种物质与其他物质的稳定性高低,B错误;
C.由图可以看出,A和B的总能量大于C的总能量,C正确;
D.由图可以看出第一步A+B→X,反应物总能量低于生成物总能量,属于吸热反应,第二步X→C,反应物总能量高于生成物总能量,属于放热反应,D错误;
故选C。
12.A
【分析】ΔH=生成物的总能量-反应物的总能量,根据图1和图2可以看出反应的催化剂为为Zn+,ZnO+为中间产物,以此做题。
【详解】A.根据流程图可以看出反应过程中CO变为CO2,N2O变成N2,总反应为CO(g)+N2O(g)=CO2(g)+N2(g),生成物的总能量小于反应物的总能量,差值为361.22kJ/mol,因此该反应的 ΔH= 361.22kJ mol 1,故A正确;
B.能量越低越稳定,所以稳定性:IM1
D.根据图1和图2结合,可以看出反应的催化剂为Zn+,ZnO+为中间产物,故D错误;
故选A。
13.C
【详解】A.由反应②可知,氢气的燃烧热为,A项错误;
B.由于为放热过程,故反应 ,B项错误;
C.根据盖斯定律(-2×②―①)可得 ,C项正确;
D.分子内无非极性键,故反应②无非极性键的断裂,只有非极性键的形成,D项错误;
故选C。
14.D
【分析】根据图像分析,此反应属于吸热反应,产物总能量高于反应物总能量。
【详解】A.1 mol A2和1 mol B2反应生成2mol AB,每生成2mol AB(g)吸收(a一b)kJ的热量,A项错误;
B.断裂1 mol A一A 键和1 mol B-B键,吸收a kJ能量,B项错误;
C.依据题图可知,反应物的总能量低于反应产物的总能量,C项错误;
D.反应能量变化=反应产物的总能量-反应物的总能量,所以生成1mol AB吸收的能量为0.5(a一b)kJ· mol-1,D项正确;
故答案选D。
15.C
【详解】A.焓变△H=生成物具有的能量-反应物具有的能量,只与物质的起始状态有关,与反应条件无关,所以同温同压下,在光照和点燃条件下的△H相等,故A正确;
B.化学键断裂吸热,化学键形成放热,是化学反应中能量变化的主要原因,故B正确;
C.天然气属于不可再生能源,故C错误;
D.在电能和热能的作用下,用空气和水作原料成功地合成了氨气,电能转化为了化学能,故D正确;
答案选C。
16.(1)<
(2)<
(3)2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol
(4)CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1
(5)-57.3kJ /mol
【详解】(1)物质的能量越高,该物质越不稳定,C(s,石墨)=C(s,金刚石) △H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故答案为:<;
(2)C的燃烧为放热反应,则△H < 0,完全燃烧放出较多能量,放出的能量越多△H越小,则△H1<△H2,故答案为:< ;
(3)①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol;②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol,由盖斯定律②×2 -①得到2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol,故答案为:2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol;
(4)1molCO为28g,14gCO在足量的O2中充分燃烧,放出141.3kJ 的热,则1molCO完全燃烧放出282.6kJ热量,CO的燃烧热为△H =-282.6kJ·mol-1,该反应的热化学方程式为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1,故答案为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1;
(5)0.50L 2.00mol/ L H2SO4溶液与2.00L 1.00mol/ L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为- 11.46kJ/mol,中和热为- 57.3kJ/mol,故答案为:-57.3kJ /mol。
17. BD 大于 生成BaSO4沉淀时有新化学键的形成,会放出更多的热量 大于 氢氧化钠固体溶解放热 <
【分析】(1)H+(aq)+OH-(aq)=H2O(l)表示强酸、强碱反应产生可溶性盐和1 mol水;
(2) H+(aq)+OH-(aq)=H2O(l)表示强酸、强碱反应产生可溶性盐和1 mol水放出的热量;
【详解】(1)H+(aq)+OH-(aq)=H2O(l)表示强酸、强碱反应产生可溶性盐和1 mol水;
A.稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀水,硫酸钡不能拆分为离子,所以离子方程式不是H++OH-=H2O,A错误;
B.盐酸与氢氧化钠溶液反应生成NaCl和水,离子方程式为H++OH-=H2O,B正确;
C.浓硫酸与氢氧化钠固体不是离子反应,不能用离子方程式H++OH-=H2O表示,C错误;
D.硫酸氢钠溶液与氢氧化钾溶液反应生成硫酸钠、硫酸钾和水,离子方程式为H++OH-=H2O,D正确;
E.氢氧化镁溶于稀盐酸生成氯化镁和水,氢氧化镁是难溶物质,不能拆分为离子,所以不能用离子方程式H++OH-=H2O表示,E错误;
故合理选项是BD;
(2)稀硫酸与氢氧化钡稀溶液反应生成硫酸钡沉淀和水,反应中除了中和热以外,还有形成沉淀过程放出的热量,所以若稀硫酸与氢氧化钡稀溶液反应生成1 mol H2O(l),则反应放出的热量大于57.3 kJ;
(3)氢氧化钠固体溶解会放热,所以稀硫酸与氢氧化钠固体反应生成1 mol H2O(l),则反应放出的热量大于57.3 kJ;
(4)醋酸是弱酸,电离时会吸热,反应放热越多,反应热越小,则醋酸与氢氧化钠稀溶液反应生成1 mol水放出的热量小于57.3 kJ,则△H1<△H2。
【点睛】本题考查了化学反应中的能量变化、反应热的计算与比较。注意理解中和热的概念、把握热化学方程式的书写方法。
18.(1)1:3
(2) 吸收 N2
(3)
【详解】(1)设氢气与甲烷物质的量分别是x、y,混合气体总物质的量为,则x+y=5mol,,解得x=1.25mol,y=3.75mol,则混合气体中和的物质的量之比是;
(2)化学键断裂要吸收能量,由表中数据可知,把1molCl2分解为气态原子时,需吸收243kJ能量;因键能越大越稳定,所以最稳定的是氮气;
(3)1molN2H4(g)和二氧化氮完全反应生成氮气和气态水,放出568kJ的热量,其热化学方程式为: 。
19. C2H8N2+2N2O42CO2↑+3N2↑+4H2O 放热 大于 吸收 小于 放出
【分析】(1)偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体,据此写出化学方程式;
(2)该反应能提供飞船飞行所需的能量,据此分析反应吸放热和反应物的总能量、生成物的总能量之间的关系。
【详解】(1)偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体,根据电子守恒、原子守恒,可得该反应的化学方程式为:C2H8N2+2N2O42CO2↑+3N2↑+4H2O;
(2)该反应能提供飞船飞行所需的能量,说明此反应为放热反应,则反应物的总能量大于生成物的总能量,断开化学键所吸收的总能量小于形成化学键放出的总能量。
【点睛】本题考查了化学方程式的书写和反应吸、放热的判断的知识,应注意的是反应吸放反应还是放热反应取决于反应物和生成物的总能量的相对大小或断键吸收能量和成键放出能量的相对大小。
20. 放 > ①
【分析】结合实验现象分析反应中的能量变化,根据反应物的总能量与生成物的总能量相对大小确定反应是吸热或放热反应。
【详解】通过实验测出,反应后①烧杯中的温度升高,则Al跟盐酸的反应是放热反应,而②烧杯中的温度降低,则Ba(OH)2 8H2O跟NH4Cl的反应是吸热反应,即ΔH>0;根据图2数据可知,该反应中,反应物总能量大于生成物总能量,则该反应为放热反应,可表示反应①的能量变化。
【点睛】考查化学反应中的吸热反应与放热反应,明确化学反应中能量变化,反应物、生成物总能量与吸热反应、放热反应的关系为解答关键,特别注意吸热反应的ΔH>0,这是易错点。
21.(1) 第三周期,第ⅥA族
(2)氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构)
(3)
(4)①
(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒
(6)2Al+2OH-+2H2O=2AlO +3H2↑
(7)2Al+Fe2O3Al2O3+2Fe
(8)Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol
(9)NH3 + H3O+=NH+ H2O
【分析】已知A的单质是最清洁的能源物质,A是H;根据元素的原子半径及主要化合价可知D一定是S,E一定是Cl,F一定是O,则B一定是Na,C一定是Al。
【详解】(1)S在元素周期表中的位置是第三周期第ⅥA族;Cl-离子结构示意图为。故答案为:第三周期,第ⅥA族;;
(2)由于氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构),因此有人主张把它放在第ⅦA族。故答案为:氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构);
(3)B的单质与D的单质形成的化合物是离子化合物硫化钠,其形成过程可表示为。故答案为:;
(4)①水分子间存在氢键,则氢化物的沸点:D低于F,正确;②离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A~F元素的简单离子半径:S的最大,错误;③氯元素非金属性强于硫,气态氢化物稳定性:E比D稳定,错误;④钠的金属性强于铝,最高价氧化物对应的水化物碱性:B大于C,错误,答案选①;故答案为:①;
(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒。故答案为:Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒;
(6)铝单质与B的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑。故答案为:2Al+2OH-+2H2O=2AlO +3H2↑;
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,即铝与氧化铁发生的铝热反应,该反应的化学方程式为2Al+Fe2O3Al2O3+2Fe。故答案为:2Al+Fe2O3Al2O3+2Fe;
(8)已知铁的燃烧热为375kJ/mol,则表示其燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)ΔH=-375kJ/mol。故答案为:Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol;
(9)根据反应NH3+H3O+=NH+H2O可说明NH3结合质子的能力强于水。故答案为:NH3 + H3O+=NH+ H2O;
22. 弱 金刚石
【详解】一定条件下,金刚石转化为石墨释放出能量,则金刚石的能量高于石墨的能量,又物质能量越低越稳定,故金刚石比石墨稳定性弱;金刚石和石墨充分燃烧生成二氧化碳均是放热反应,金刚石的能量更高,故放出的热量更多。
23.
【详解】与焦炭、 完全反应,生成一种还原性气体和TiCl4,放热4.28 kJ,由质量守恒可知还原性气体为 ,反应的化学方程式为, 氯气反应放出的热量为,所以热化学方程式为。
24.(1)物理量
(2)吸收或释放
【详解】(1)焓(H):是一个与内能有关的物理量;
(2)焓变():在恒压下,化学反应过程中吸收或释放的热量称为该反应的焓变,常用单位kJ/mol或kJ·mol-1。
25. 436 243 679 431 862 -183kJ·mol-1 E1 E2 反应热 放热
【详解】化学键断裂吸收能量,化学键形成放出能量。根据图示,1molH—H键断裂吸收436kJ能量,1molCl—Cl键断裂吸收243kJ能量,1molH—H键和1molCl—Cl键断裂共吸收679kJ能量;1molH—Cl键形成放出431kJ能量,2molH—Cl键形成共放出862kJ能量,故H2(g)+Cl2(g)=2HCl(g)的反应热ΔH=679-862=-183kJ·mol-1。
①根据图示,E1表示反应物断裂化学键吸收的总热量,E2表示生成物形成化学键放出的总热量,E1与E2的差值表示反应热。上述反应过程表示该反应为放热反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
