1.2反应热的计算同步练习 2024-2025学年高二上学期化学人教版(2019)选择性必修1(含答案)
文档属性
| 名称 | 1.2反应热的计算同步练习 2024-2025学年高二上学期化学人教版(2019)选择性必修1(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 21:17:12 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
1.2反应热的计算
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于化学反应的反应热的描述中正确的是
A.反应物的总能量低于生成物的总能量时,发生放热反应
B.和反应的中和热,则和反应的中和热
C.同温同压下,在光照和点燃条件下的相同
D.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
2.化学反应 的能量变化如下图,下列叙述中正确的是
A.催化剂可以降低反应活化能,提高活化分子百分数
B.每形成1mol A-B键,释放b kJ能量
C.该反应中旧键断裂释放的总能量低于新键形成吸收的总能量
D.该反应正反应的活化能为120
3.使用丙烯可将汽车尾气中的还原为除去。主要反应为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
反应Ⅳ:
则为
A. B.
C. D.
4.研究、等大气污染气体的处理及利用具有重要意义。已知:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ: 等于
A. B. C. D.
5.碘与氢气反应的相关热化学方程式为;,;。下列有关的大小判断正确的是
A. B.
C. D.不能判断
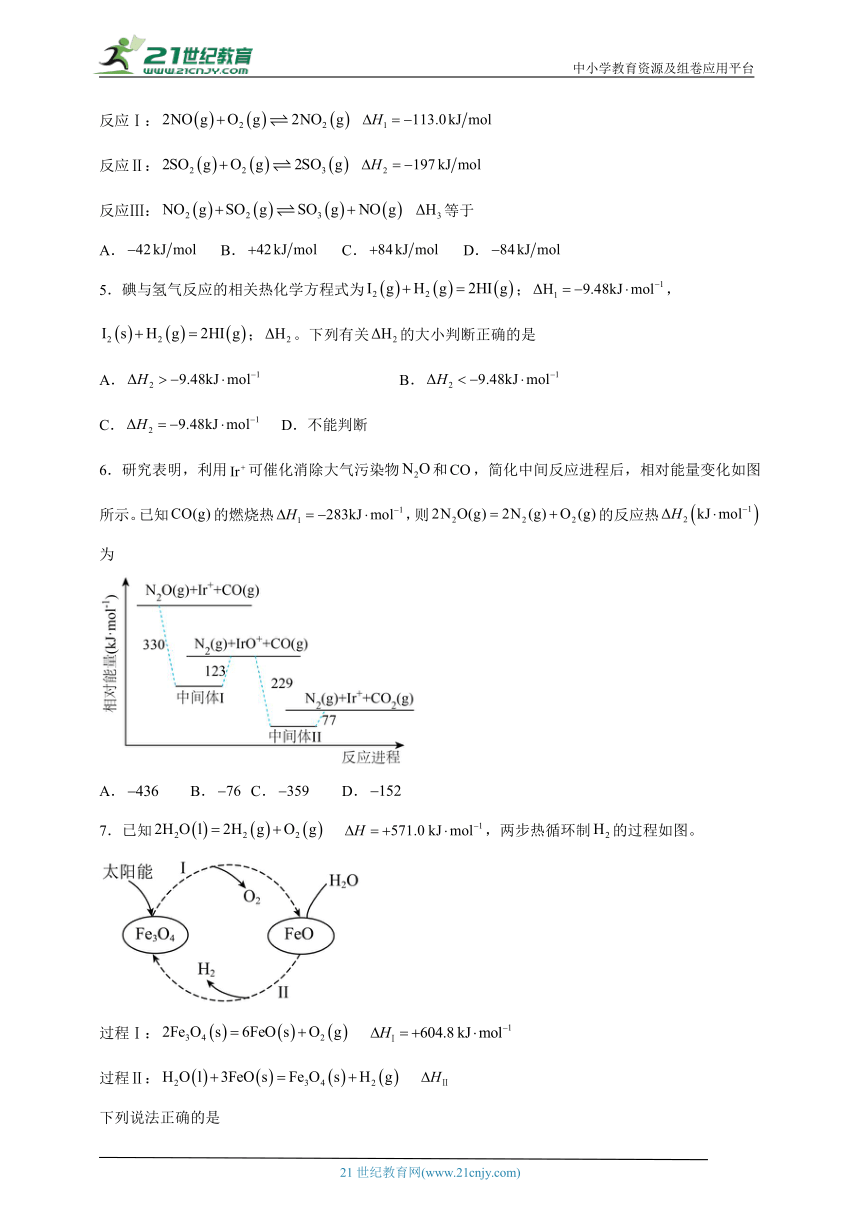
6.研究表明,利用可催化消除大气污染物和,简化中间反应进程后,相对能量变化如图所示。已知的燃烧热,则的反应热为
A. B. C. D.
7.已知 ,两步热循环制的过程如图。
过程Ⅰ:
过程Ⅱ:
下列说法正确的是
A.该制氢过程中FeO为催化剂
B.整个过程中能量转化形式只存在太阳能转化为化学能
C.过程Ⅰ每吸收302.4kJ,则转移电子的物质的量为2mol
D.根据盖斯定律
8.已知:①
②
③
则和反应生成液氨的热化学方程式为
A.
B.
C.
D.
9.下列有关化学反应与能量变化的说法正确的是
A.如图所示的化学反应中,生成物的能量之和大于反应物的能量之和
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C.金刚石比石墨能量高,则金刚石稳定性较好
D.同温同压下,能量变化如图所示,则该反应为放热反应
10.下列说法正确的是
A.31g白磷固体比31g红磷固体能量多bkJ,白磷,s(红磷,s) ,所以白磷比红磷稳定
B.500℃、30MPa下, ;将1.5molH2和过量的N2在此条件下充分反应,放出热量46.2kJ
C.H2的燃烧热为,则
D.稀氢氟酸溶液与稀氢氧化钠溶液反应生成1mol水时的反应热大于
11.下列各组热化学方程式中,Q1<Q2的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 kJ·mol-1
CH4(g)+O2(g)=CO(g)+2H2O(g) ΔH=-Q2 kJ·mol-1
B.S(g)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
C.H2(g)+Br2(g)=2HBr(g) ΔH=-Q1 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1
D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
12.气态含氮化合物及其相关反应是新型科研热点。
已知:①
②
③
下列关系式正确的是
A. B.
C. D.
13.下列关于热化学反应的描述正确的是
A. ,则含1mol 的溶液与含1mol NaOH的稀溶液混合,放出热量为57.3kJ
B.甲烷的燃烧热,则
C.500℃、30MPa下, ,将1.5mol 和过量的在此条件下充分反应,放出热量46.2kJ
D.同温同压下,在光照或点燃条件下的的数值相同
14.已知热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,下列说法错误的是
A.H2的燃烧热为285.8 kJ·mol-1
B.能量图:
C.2H2(g)+O2(g)=2H2O(g) ΔH>-571.6 kJ·mol-1
D.1 mol H2和2 mol H2的燃烧热相同
15.某同学在如图所示装置中用50mL 盐酸与50mL NaOH溶液进行中和反应从而求的,下列说法正确的是
A.在测定中和反应反应热的实验中,只需要测定并记录2次温度
B.若简易量热计不盖杯盖,生成1mol 时所测得中和反应反热将偏大
C.为了实验的严谨性,与必须相同
D.为了保证实验反应充分,氢氧化钠溶液应该缓慢倒入量热计内筒的盐酸中
二、填空题
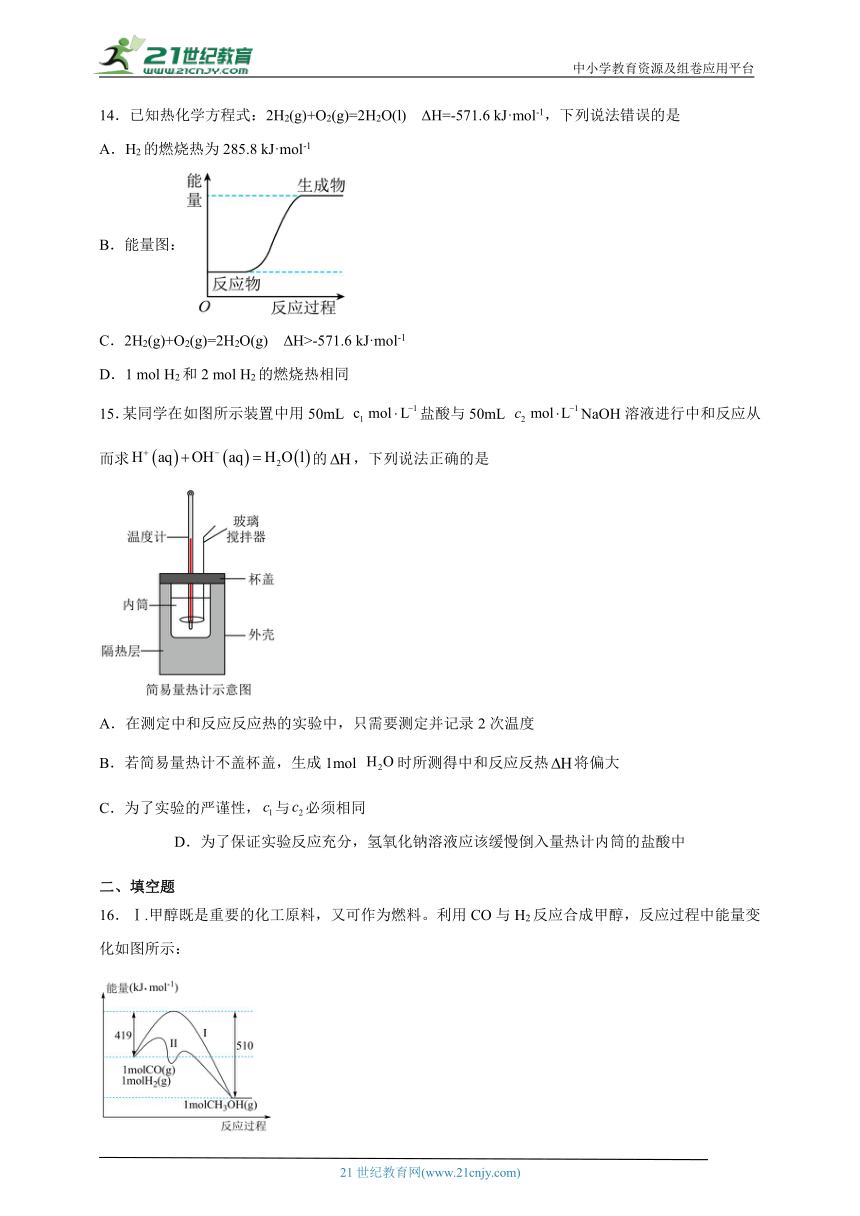
16.Ⅰ.甲醇既是重要的化工原料,又可作为燃料。利用CO与H2反应合成甲醇,反应过程中能量变化如图所示:
(1)请写出CO与反应合成甲醇的热化学方程式 。
(2)该反应中相关的化学键键能数据如表所示,则CO中C≡O的键能为 。
化学键 H-H C-O H-O C-H
键能 436 343 465 413
(3)图中曲线Ⅰ和Ⅱ所对应的反应路径,比较容易发生的是 (填“Ⅰ”或“Ⅱ”).
(4)常温常压下,一定质量的液态甲醇完全燃烧生成二氧化碳和液态水,放出QkJ的热量,其燃烧生成的用过量饱和石灰水吸收可得沉淀,则甲醇燃烧热的热化学方程式为 。
Ⅱ.实验室常取的NaOH溶液与的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。
(5)从下图实验装置可知,缺少的一种仪器名称是 。
(6)上述实验数值结果比小,原因可能是 。
a.实验装置保温、隔热效果差
b.用量筒量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
17.(1)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
化学方程式 焓变ΔH/(kJ·mol-1)
甲烷 氧化 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1
CH4(g)+O2(g)=CO2(g)+2H2(g) -322.0
蒸汽 重整 CH4(g)+H2O(g)=CO(g)+3H2(g) 206.2
CH4(g)+2H2O(g)=CO2(g)+4H2(g) 165.0
①反应CO(g)+H2O(g)=CO2(g)+H2(g)的ΔH= kJ·mol 1。
②1 mol甲烷完全燃烧的反应热为ΔH2,则ΔH2 (填“>”“<”或“=”)ΔH1。
(2)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)22(t-BuNO) ΔH。实验测得该反应的ΔH=+50.5 kJ·mol 1,活化能Ea=90.4 kJ·mol 1。下列能量关系图合理的是 。
(3)汽车尾气中主要含有CO、NO2、SO2、CO2,目前采用的是在汽车排气装置中安装一个净化器可以有效地将尾气中的有害气体转化。如:CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol 1(a>0),2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol 1(b>0)。则用标准状况下的3.36 L CO还原NO2至N2(CO完全反应)的整个过程中放出的热量为 (用含有a和b的代数式表示) kJ。
18.按要求填空。
(1)分别写出下图原电池装置1和2的正极反应方程式: 。
(2)①汽车发动机工作时会引发和反应,其能量变化示意图如下。
写出该反应的热化学方程式: 。
②在25℃、101kpa下,气体在足量的氧气中完全燃烧后,恢复至原状态,每转移1mol电子放出热量190kJ,写出该反应的热化学方程式: 。
19.在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和过氧化氢的结构式 肼 ,过氧化氢 。
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 。
(3)写出肼和双氧水反应的热化学方程式 。
(4)已知H2O(l)═H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
(5)已知:
N2 (g)+2O2(g)=2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ/mol
则肼与NO2完全反应的热化学方程式为 。
20.(1)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是 。
(2)降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)N2O4(g) ΔH1 2NO2(g)N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。
②N2O4与O2、H2O化合的化学方程式是 。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是 。
21.完成下列问题。
(1)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H=-394kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式 。
(2)键能是断裂1mol共价键所吸收的能量。已知N≡N键能为946kJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol,则H—H键的键能是 。
(3)25℃,1.01×105Pa时8g甲烷完全燃烧,当恢复至原状态时,放出445kJ热量,此反应的热化学方程式为: 。
22.完成下列问题
(1)断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能。下表列出了一些化学键的键能E:
化学键 H-H O=O O-H
E/kJ·mol-1 436 x 463
请回答下列问题:
①下图表示某反应的能量变化关系,则此反应为 (填“吸热”或“放热”)反应,其中ΔH= (用含有a、b的关系式表示)。
②若上图示中表示反应H2(g)+O2(g)=H2O(g) ΔH=-242 kJ·mol-1,则b= kJ·mol-1,x= kJ·mol-1。
(2)已知下列反应:
2CO(g)+O2(g)=2CO2(g ) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+O2(g) ΔH=-266 kJ·mol-1
试回答:
①CO的燃烧热ΔH= 。
②在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为 。
23.物质的摩尔燃烧焓是指在一定温度和压强条件下,1mol物质完全氧化为同温下的指定产物时的焓变,其中物质中所含的N元素氧化为N2(g)、H元素氧化为H2O(l)、C元素氧化为CO2(g)。
已知:①几种物质的摩尔燃烧焓:
物质 石墨(s) H2(g) CO(g)
△H/(kJ·mol—1) -393.5 -285.8 -283.0
②298k,101kPa时,部分化学键键能:
化学键 CO O=O C=O C-O
E/(kJ·mol-1) a 498 745 351
③H2O(l)=H2O(g) △H=+44.0kJ/mol
回答下列问题:
(1)计算反应2CO(g)+O2(g)=2CO2(g)的焓变△H1= kJ·mol-1,由此可求CO的化学键CO键能a= kJ·mol-1。
(2)已知相同条件下,石墨比金刚石稳定,则1mol金刚石的燃烧放热 393.5kJ(填“>”、“<”、“=”)。
(3)写出常温下氢气燃烧的热化学方程式 ,则反应CO(g)+H2O(g)=CO2(g)+H2(g)的焓变△H2= kJ·mol-1。
24.研究和深度开发CO2的综合应用,实现碳循环是解决温室问题的有效途径,对构建生态文明社会具有重要意义,CO2可实现以下转化:
①
②
已知的正反应的活化能为ckJ·mol-1,则逆反应的活化能为 kJ·mol-1.(用含a、b、c代数式表示)
25.回答下列问题:
(1)已知化学反应的能量变化如图所示:
①该反应的 0(填“大于”“小于”或“等于”)。
②写出该反应的热化学方程式 。
(2)联氨(又称肼,,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①
②
③
④
上述反应热效应之间的关系式为 ,联氨和可作为火箭推进剂的主要原因为 。(至少答两条)
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C A B A A C C A D D
题号 11 12 13 14 15
答案 C A D B B
1.C
【详解】A.反应物的总能量低于生成物的总能量时,发生吸热反应,故A错误;
B.中和热是强酸和强碱的稀溶液发生中和反应生成1mol液态水时放出的热量,但H2SO4和Ba(OH)2反应时得到硫酸钡沉淀也有生成热,故B错误;
C.反应热与反应物和生成物的总能量相对大小有关,与反应条件和途径无关,故C正确;
D.固态硫变为气态硫需要吸收热量,则等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故D错误。
答案选C。
2.A
【详解】A.催化剂可以降低反应活化能,是活化分子的数目增加,提高活化分子百分数,A正确;
B.由图知,每形成2mol A-B键,释放b kJ能量,B错误;
C.由图知,该反应为放热反应,故该反应中旧键断裂吸收的总能量低于新键形成释放的总能量,C错误;
D.由图知,该反应正反应的活化能为,D错误;
故选A。
3.B
【详解】反应Ⅱ+反应Ⅳ9-反应Ⅰ得到:,根据盖斯定律可计算出,==,答案选B。
4.A
【详解】利用盖斯定律将Ⅱ×-Ⅰ×得,综上所述故选A。
5.A
【详解】两个热化学方程式的区别是I2的状态不同导致 H不同,气态I2的能量高于固态I2的能量,反应过程中放热更多,故>,故选A;
6.C
【详解】由图可知反应物和最终产物的能量差为(330-123)+(229-77)=359kJ,此反应为放热反应,,选C。
7.C
【详解】A.由题图可知,Fe3O4参与反应,但反应前后质量不变,为整个过程的催化剂,FeO是中间产物,A错误;
B.过程I将太阳能转化为化学能,过程Ⅱ是放热反应,将化学能转化为热能,B错误 ;
C.根据氧元素化合价计算可知,生成1mol氧气,转移4mol电子,吸收,则过程Ⅰ每吸收302.4kJ,则转移电子的物质的量为2mol,C正确;
D.根据盖斯定律,,则,则,D错误;
答案选C。
8.A
【详解】根据盖斯定律,①×2+②×2+③×2得N2(g)+3H2(g)=2NH3(l),ΔH=2ΔH1+2ΔH2+2ΔH3=-2(b+c-a)kJ·mol-1,所以N2(g)和H2(g)反应生成液氨的热化学方程式是N2(g)+3H2(g)=2NH3(l)ΔH=-2(b+c-a)kJ·mol-1。
故选A。
9.D
【详解】A.根据图示可看出,生成物的能量之和小于反应物的能量之和,A错误;
B.相同条件下,液态水的能量低于气态水,则氢气和氧气反应生成液态水比生成等量气态水放出的热量多,B错误;
C.物质能量越低越稳定,金刚石比石墨能量高,则石墨稳定性较好,C错误;
D.同温同压下,若H2(g) + Cl2(g) = 2HCl(g) 能量变化如图所示,即反应物能量之和大于生成物能量之和,则该反应为放热反应,D正确。
答案为:D。
10.D
【详解】A.31g即=0.25mol白磷固体比31g红磷固体能量多bkJ,即说明白磷转化为红磷是一个放热反应,即白磷,s(红磷,s) ,能量越高越不稳定,所以红磷比白磷稳定,A错误;
B.500℃、30MPa下, ,由于上述反应是一个可逆反应,则将1.5molH2和过量的N2在此条件下充分反应,1.5molH2不可能完全反应,故放出热量小于46.2kJ,B错误;
C.已知燃烧热是指1mol纯物质与O2完全反应生成指定稳定的产物H对应的产物为液态水,故H2的燃烧热为,则 ,C错误;
D.由于HF是弱酸,在水溶液中部分电离,电离过程需要吸收热量,即稀氢氟酸溶液与稀氢氧化钠溶液反应生成1mol水时的反应热大于,D正确;
故答案为:D。
11.C
【详解】A.CO燃烧反应产生CO2气体会放出热量,说明物质完全燃烧放出的热量比不完全燃烧放出的热量更多,则生成CO2放出热量比反应产生CO气体放出的热量多,则放出热量:Q1>Q2,A错误;
B.反应物是气态S时含有的能量比反应物是固态S含有的能量多。而生成物的状态相同,故气态硫燃烧放出热量比固态S燃烧放出的热量多,则放出热量:Q1>Q2,B错误;
C.HCl比HBr稳定,物质的稳定性越强,其含有的能量就越低,反应放出热量多,放出热量:Q1<Q2,C正确;
D.CH3COOH是弱酸,其电离产生自由移动的离子的过程会吸收热量,导致发生酸碱中和反应时放出的热量比强酸与强碱反应放出的热量少,故反应放出热量:Q1>Q2,D错误;
故合理选项是C。
12.A
【详解】由盖斯定律可知,反应③=②-3×①,则,故答案选A。
13.D
【详解】A.是弱酸,电离需要吸热,1mol 的溶液与含1mol NaOH的稀溶液混合,放出热量小于57.3kJ,A错误;
B.甲烷的燃烧热,生成液态水放出热量为890.3kJ,则生成气态水放热少, ,B错误;
C.合成氨反应为可逆反应,1.5mol 和过量的在此条件下充分反应,放出热量小于46.2kJ,C错误;
D.同温同压下,在光照或点燃条件下的的数值相同,与反应条件无关,D正确;
答案选D。
14.B
【详解】A.已知热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,1molH2完全燃烧放出的热量为285.8 kJ,则H2的燃烧热为285.8 kJ·mol-1,故A项正确;
B.由热化学方程式可知,该反应为放热反应,反应物所具有的总能量高于生成物具有的总能量,故B项错误;
C.2H2(g)+O2(g)=2H2O(g)生成气态水,放出的热量比生成液态水小,ΔH>-571.6 kJ·mol-1,故C项正确;
D.燃烧热的概念就是1mol可燃物完全燃烧生成指定稳定的物质放出来的热量,所以不管是多少摩尔氢气,燃烧热都是一样的,故D项正确;
故本题选B。
15.B
【详解】A.在测定中和热的实验中,实验需要进行2~3次,每次实验要记录3次温度,所以至少需要测定并记录6次温度,故A错误;
B.若简易量热计不盖杯盖,生成1molH2O时,会有热量散失,所测得中和反应所放出的热量偏小,则ΔH将偏大,故B正确;
C.为了保证盐酸完全反应,需要使氢氧化钠溶液的浓度稍大,故C错误;
D.为了准确测定反应混合溶液的温度,实验中NaOH溶液迅速一次倒入装有盐酸的量热计内筒中,并立即盖上杯盖,以减少热量的损失,故D错误;
故选B。
16.(1)
(2)1084
(3)Ⅱ
(4)
(5)玻璃搅拌器
(6)acd
【详解】(1)由图像可以看出,反应物总能量大于生成物总能量,则该反应的正反应为放热反应, ,反应的热化学方程式为: ;
(2),解得CO中C≡O的键能为1084;
(3)图中曲线II的活化能小于曲线I的活化能,所以 曲线Ⅱ所对应的反应路径比较容易发生;
(4)由燃烧生成的用过量饱和石灰水吸收可得沉淀,可得,即一定质量的液态甲醇完全燃烧生成0.1molCO2和液态水,放出QkJ的热量, 则甲醇燃烧热的热化学方程式为: ;
(5)由图中实验装置可知,其中尚缺少的一种玻璃仪器为环形玻璃搅拌器;
(6)a.实验装置保温、隔热效果差,测得的中和热数字偏小,故a正确;
b.用量筒量取硫酸溶液时仰视读数,硫酸的物质的量偏大,生成的水偏多,测定值偏大,故b错误;
c.分多次把氢氧化钠溶解倒入盛有硫酸的小烧杯中,不能准确测定最高温度,使测定值偏小,故c正确;
d.用温度计测定氢氧化钠溶液起始温度后,直接测定硫酸溶液温度,温度差偏小,则测定值偏小,故d正确;
故答案为:acd。
17. -41.2 < D
【详解】(1)①由蒸汽重整的两个反应可知,利用第二个反应减去第一个反应则得出反应CO(g)+H2O(g)=CO2(g)+H2(g)的反应热为ΔH=(165.0-206.2) kJ·mol 1=-41.2 kJ·mol 1。
②1 mol甲烷完全燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2。生成液态水比生成气态水释放出的热量多,故ΔH2<ΔH1。
(2)由实验测得该反应的反应热ΔH=+50.5 kJ·mol 1,可知该反应是吸热反应,则反应物的总能量低于生成物的总能量,可排除能量关系图B和C。又依据活化能Ea=90.4 kJ·mol 1,Ea-ΔH<50.5 kJ·mol 1,能量关系图A中,Ea-ΔH>50.5 kJ·mol 1,Ea与ΔH的比例不对。而能量关系图D是合理的,故选D。
(3)已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol 1
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol 1
根据盖斯定律①×2+②即得4CO(g)+2NO2(g)=N2(g)+4CO2(g) ΔH=-(2a+b) kJ·mol 1,n(CO)=3.36L÷22.4L/mol=0.15 mol,所以放出的热量为×(2a+b) kJ= kJ。
【点睛】应用盖斯定律计算反应热时需要注意:热化学方程式同乘以某一个数时,反应热数值也必须乘上该数;热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减(带符号);将一个热化学方程式颠倒时,ΔH的“+”“-”号必须随之改变,但数值不变。
18.(1);
(2)
【解析】(1)
原电池装置1中正极是氢离子得电子生成氢气,正极反应式为;原电池装置2中正极是铜离子得电子生成铜,正极反应式为。
(2)
①焓变=反应物总键能-生成物总键能,该反应的热化学方程式为;
②在25℃、101kpa下,气体在足量的氧气中完全燃烧后,恢复至原状态,每转移1mol电子放出热量190kJ,1mol转移8mol电子,则1mol燃烧放热8×190kJ=1520 kJ,该反应的热化学方程式为。
19. H-O-O-H 产物为氮气和水,无污染 N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6kJ/mol 408.8kJ 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7KJ/mol
【详解】(1)N2H4中N原子之间形成1对共用电子对,N原子H原子质量形成1对共用电子对,结构式为;H2O2中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,结构式为H-O-O-H; (2)肼(N2H4)和H2O2反应,产物为氮气和水,无污染,突出的优点是:产物为氮气和水,无污染;(3)0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量,1mol液态肼放出的热量为=641.625kJ,该反应热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;(4)已知:①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,②H2O(l)═H2O(g)△H=+44KJ/mol,根据盖斯定律,①-②×4得N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.625kJ/mol,16g液态肼的物质的量为 =0.5mol,完全反应生成液态水时放出的热量为0.5mol×817.625kJ/mol=408.8kJ;(5)已知:Ⅰ、N2 (g)+2O2(g)=2NO2 (g)△H1=+67.7kJ/mol;Ⅱ、N2H4(g)+O2 (g)=N2(g)+2H2O (g)△H2=-543kJ/mol
根据盖斯定律,Ⅱ×2-Ⅰ得2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=2△H2-△H1=-1153.7KJ/mol。
20. NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ/mol A 2N2O4+O2+2H2O===4HNO3 4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1
【详解】试题分析:(1)每消耗3.8 g NaBH4(s)放热21.6 kJ,则消耗1mol NaBH4(s)放热216 kJ;(2) ①降低温度,将NO2(g)转化为N2O4(l),说明2NO2(g)N2O4(g)反应放热;2NO2(g)N2O4(l),气体变为液体放热。②N2O4与O2、H2O化合生成硝酸。(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体,根据元素守恒,黑色固体是氧化铜。
解析:(1)每消耗3.8 g NaBH4(s)放热21.6 kJ,则消耗1mol NaBH4(s)放热216 kJ,该反应的热化学方程式是NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ/mol;
(2) ①降低温度,将NO2(g)转化为N2O4(l),说明2NO2(g)N2O4(g)反应放热;2NO2(g)N2O4(l),气体变为液体放热,故A正确。
②N2O4与O2、H2O化合生成硝酸,反应方程式为2N2O4+O2+2H2O===4HNO3。(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体,根据元素守恒,黑色固体是氧化铜。
反应方程式为4CuCl+O2===2CuCl2+2CuO,每消耗1 mol CuCl(s),放热44.4 kJ,消耗4 mol CuCl(s),放热177.6 kJ,反应热化学方程式是4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1。
21.(1)C(s)+ H2O(g)= CO(g)+ H2(g) △H=+131 kJ·mol-1
(2)436 kJ/mol
(3)CH4(s)+2O2(g)= CO2(g)+ 2H2O(g) △H=-890 kJ/mol
【详解】(1)已知反应①C(s)+O2(g)=CO2(g) △H=-394kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1;由盖斯定律可知,①-②-③可得反应C(s)+ H2O(g)= CO(g)+ H2(g),则C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(s)+ H2O(g)= CO(g)+ H2(g) △H=-394 kJ·mol-1-(-566kJ·mol-1)- (-484kJ·mol-1)=+131 kJ·mol-1。
(2)设H—H键的键能为x kJ/mol,则946kJ/mol+3x kJ/mol-6391kJ/mol=-92kJ/mol,解得x=436 kJ/mol,则H—H键的键能是436 kJ/mol。
(3)8g甲烷的物质的量为0.5mol,则1mol甲烷完全燃烧放出的热量为445kJ2=890 kJ,则
此反应的热化学方程式为:CH4(s)+2O2(g)= CO2(g)+ 2H2O(g) △H=-890 kJ/mol。
22.(1) 放热 (a-b)kJ/mol 926 496
(2) -283kJ/mol CO(g)+Na2O2(s)=Na2CO3(s) H=-549kJ/mol
【详解】(1)①根据图像可知,反应物总能量大于生成物总能量,说明该反应为放热反应,即ΔH<0,ΔH=(a-b)kJ/mol,故答案为放热;(a-b)kJ/mol;
②根据ΔH=反应物的键能总和-生成物的键能总和=(436+×x-2×463)kJ/mol=-242kJ/mol,解得x=496,b代表氢原子和氧原子形成1mol气态水时放出的热量,即b为2×463=926;故答案为926;496;
(2)①CO的燃烧热指1molCO完全生成CO2时放出的热量,因此CO的燃烧热为=283kJ/mol,ΔH=-283kJ/mol;故答案为-283kJ/mol;
②CO与过氧化钠反应生成固体碳酸钠,a.2CO(g)+O2(g)=2CO2(g),b.Na2O2(s)+CO2(g)=Na2CO3(s)+O2(g),根据盖斯定律,得出有,CO与过氧化钠生成固体碳酸钠的ΔH=×[(-566)+2×(-266)]kJ/mol=-549kJ/mol,该反应的热化学方程式为CO(g)+Na2O2(s)=Na2CO3(s) ΔH=-549kJ/mol;故答案为CO(g)+Na2O2(s)=Na2CO3(s) ΔH=-549kJ/mol。
23. -566 958 > H2(g)+O2(g)=H2O(l) △H=-285.8kJ·mol-1 -41.2
【详解】(1)CO(g)的燃烧焓为-283.0kJ·mol-1,即1molCO完全反应生成二氧化碳时放出的热量为283.0kJ,则2molCO完全燃烧放出的热量为566kJ,2CO(g)+O2(g)=2CO2(g)的焓变△H1=-566kJ·mol-1,根据△H=反应物的键能和-生成物的键能和,可知△H1=2E(CO)+E(O=O)-4E(C=O)=2a+498-4×745=-566,解得:a=958;故答案为:-566;958;
(2)相同条件下,石墨比金刚石稳定,可知金刚石的能量高于石墨,则1mol金刚石的燃烧放热大于1mol石墨燃烧放热,即大于393.5kJ,故答案为:>;
(3)H2(g)的燃烧焓为-285.8kJ·mol-1,可得氢气燃烧的热化学方程式为:①H2(g)+O2(g)=H2O(l) △H3=-285.8kJ·mol-1;结合CO的燃烧热的热化学方程式:②CO(g)+O2(g)=CO2(g) △H4=-283.0kJ·mol-1,③H2O(l)=H2O(g) △H5=+44.0kJ/mol
反应CO(g)+H2O(g)=CO2(g)+H2(g)可由②-①-③得到,根据盖斯定律:△H2=△H4-△H3-△H5=-283.0kJ·mol-1-(-285.8kJ·mol-1)-(+44.0kJ/mol)=-41.2kJ/mol,故答案为:H2(g)+O2(g)=H2O(l) △H=-285.8kJ·mol-1;-41.2。
24.(c﹣a﹣b)
【详解】根据盖斯定律①+②可得的ΔH=(a+b)kJ·mol-1,焓变=正反应活化能-逆反应活化能,则逆反应活化能=正反应活化能-焓变=(c-a-b) kJ·mol-1。
25.(1) 大于 =+(a-b)kJ/mol
(2) 反应放热量大、产生大量气体、无污染
【详解】(1)①从图中看出,该反应为吸热反应,故大于0;
②反应物的总键能为akJ/mol;=+(a-b)kJ/mol,热化学方程式为=+(a-b)kJ/mol;
(2)根据盖斯定律可知,反应④=2③-2②-①,故;联氨和可作为火箭推进剂的主要原因为:反应放热量大、产生大量气体、无污染。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
1.2反应热的计算
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于化学反应的反应热的描述中正确的是
A.反应物的总能量低于生成物的总能量时,发生放热反应
B.和反应的中和热,则和反应的中和热
C.同温同压下,在光照和点燃条件下的相同
D.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
2.化学反应 的能量变化如下图,下列叙述中正确的是
A.催化剂可以降低反应活化能,提高活化分子百分数
B.每形成1mol A-B键,释放b kJ能量
C.该反应中旧键断裂释放的总能量低于新键形成吸收的总能量
D.该反应正反应的活化能为120
3.使用丙烯可将汽车尾气中的还原为除去。主要反应为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
反应Ⅳ:
则为
A. B.
C. D.
4.研究、等大气污染气体的处理及利用具有重要意义。已知:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ: 等于
A. B. C. D.
5.碘与氢气反应的相关热化学方程式为;,;。下列有关的大小判断正确的是
A. B.
C. D.不能判断
6.研究表明,利用可催化消除大气污染物和,简化中间反应进程后,相对能量变化如图所示。已知的燃烧热,则的反应热为
A. B. C. D.
7.已知 ,两步热循环制的过程如图。
过程Ⅰ:
过程Ⅱ:
下列说法正确的是
A.该制氢过程中FeO为催化剂
B.整个过程中能量转化形式只存在太阳能转化为化学能
C.过程Ⅰ每吸收302.4kJ,则转移电子的物质的量为2mol
D.根据盖斯定律
8.已知:①
②
③
则和反应生成液氨的热化学方程式为
A.
B.
C.
D.
9.下列有关化学反应与能量变化的说法正确的是
A.如图所示的化学反应中,生成物的能量之和大于反应物的能量之和
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C.金刚石比石墨能量高,则金刚石稳定性较好
D.同温同压下,能量变化如图所示,则该反应为放热反应
10.下列说法正确的是
A.31g白磷固体比31g红磷固体能量多bkJ,白磷,s(红磷,s) ,所以白磷比红磷稳定
B.500℃、30MPa下, ;将1.5molH2和过量的N2在此条件下充分反应,放出热量46.2kJ
C.H2的燃烧热为,则
D.稀氢氟酸溶液与稀氢氧化钠溶液反应生成1mol水时的反应热大于
11.下列各组热化学方程式中,Q1<Q2的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 kJ·mol-1
CH4(g)+O2(g)=CO(g)+2H2O(g) ΔH=-Q2 kJ·mol-1
B.S(g)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
C.H2(g)+Br2(g)=2HBr(g) ΔH=-Q1 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1
D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
12.气态含氮化合物及其相关反应是新型科研热点。
已知:①
②
③
下列关系式正确的是
A. B.
C. D.
13.下列关于热化学反应的描述正确的是
A. ,则含1mol 的溶液与含1mol NaOH的稀溶液混合,放出热量为57.3kJ
B.甲烷的燃烧热,则
C.500℃、30MPa下, ,将1.5mol 和过量的在此条件下充分反应,放出热量46.2kJ
D.同温同压下,在光照或点燃条件下的的数值相同
14.已知热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,下列说法错误的是
A.H2的燃烧热为285.8 kJ·mol-1
B.能量图:
C.2H2(g)+O2(g)=2H2O(g) ΔH>-571.6 kJ·mol-1
D.1 mol H2和2 mol H2的燃烧热相同
15.某同学在如图所示装置中用50mL 盐酸与50mL NaOH溶液进行中和反应从而求的,下列说法正确的是
A.在测定中和反应反应热的实验中,只需要测定并记录2次温度
B.若简易量热计不盖杯盖,生成1mol 时所测得中和反应反热将偏大
C.为了实验的严谨性,与必须相同
D.为了保证实验反应充分,氢氧化钠溶液应该缓慢倒入量热计内筒的盐酸中
二、填空题
16.Ⅰ.甲醇既是重要的化工原料,又可作为燃料。利用CO与H2反应合成甲醇,反应过程中能量变化如图所示:
(1)请写出CO与反应合成甲醇的热化学方程式 。
(2)该反应中相关的化学键键能数据如表所示,则CO中C≡O的键能为 。
化学键 H-H C-O H-O C-H
键能 436 343 465 413
(3)图中曲线Ⅰ和Ⅱ所对应的反应路径,比较容易发生的是 (填“Ⅰ”或“Ⅱ”).
(4)常温常压下,一定质量的液态甲醇完全燃烧生成二氧化碳和液态水,放出QkJ的热量,其燃烧生成的用过量饱和石灰水吸收可得沉淀,则甲醇燃烧热的热化学方程式为 。
Ⅱ.实验室常取的NaOH溶液与的硫酸溶液置于下图所示的简易装置中进行中和反应反应热的测定。
(5)从下图实验装置可知,缺少的一种仪器名称是 。
(6)上述实验数值结果比小,原因可能是 。
a.实验装置保温、隔热效果差
b.用量筒量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
17.(1)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
化学方程式 焓变ΔH/(kJ·mol-1)
甲烷 氧化 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1
CH4(g)+O2(g)=CO2(g)+2H2(g) -322.0
蒸汽 重整 CH4(g)+H2O(g)=CO(g)+3H2(g) 206.2
CH4(g)+2H2O(g)=CO2(g)+4H2(g) 165.0
①反应CO(g)+H2O(g)=CO2(g)+H2(g)的ΔH= kJ·mol 1。
②1 mol甲烷完全燃烧的反应热为ΔH2,则ΔH2 (填“>”“<”或“=”)ΔH1。
(2)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)22(t-BuNO) ΔH。实验测得该反应的ΔH=+50.5 kJ·mol 1,活化能Ea=90.4 kJ·mol 1。下列能量关系图合理的是 。
(3)汽车尾气中主要含有CO、NO2、SO2、CO2,目前采用的是在汽车排气装置中安装一个净化器可以有效地将尾气中的有害气体转化。如:CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol 1(a>0),2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol 1(b>0)。则用标准状况下的3.36 L CO还原NO2至N2(CO完全反应)的整个过程中放出的热量为 (用含有a和b的代数式表示) kJ。
18.按要求填空。
(1)分别写出下图原电池装置1和2的正极反应方程式: 。
(2)①汽车发动机工作时会引发和反应,其能量变化示意图如下。
写出该反应的热化学方程式: 。
②在25℃、101kpa下,气体在足量的氧气中完全燃烧后,恢复至原状态,每转移1mol电子放出热量190kJ,写出该反应的热化学方程式: 。
19.在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和过氧化氢的结构式 肼 ,过氧化氢 。
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 。
(3)写出肼和双氧水反应的热化学方程式 。
(4)已知H2O(l)═H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
(5)已知:
N2 (g)+2O2(g)=2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ/mol
则肼与NO2完全反应的热化学方程式为 。
20.(1)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是 。
(2)降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)N2O4(g) ΔH1 2NO2(g)N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。
②N2O4与O2、H2O化合的化学方程式是 。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是 。
21.完成下列问题。
(1)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H=-394kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式 。
(2)键能是断裂1mol共价键所吸收的能量。已知N≡N键能为946kJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol,则H—H键的键能是 。
(3)25℃,1.01×105Pa时8g甲烷完全燃烧,当恢复至原状态时,放出445kJ热量,此反应的热化学方程式为: 。
22.完成下列问题
(1)断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能。下表列出了一些化学键的键能E:
化学键 H-H O=O O-H
E/kJ·mol-1 436 x 463
请回答下列问题:
①下图表示某反应的能量变化关系,则此反应为 (填“吸热”或“放热”)反应,其中ΔH= (用含有a、b的关系式表示)。
②若上图示中表示反应H2(g)+O2(g)=H2O(g) ΔH=-242 kJ·mol-1,则b= kJ·mol-1,x= kJ·mol-1。
(2)已知下列反应:
2CO(g)+O2(g)=2CO2(g ) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+O2(g) ΔH=-266 kJ·mol-1
试回答:
①CO的燃烧热ΔH= 。
②在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为 。
23.物质的摩尔燃烧焓是指在一定温度和压强条件下,1mol物质完全氧化为同温下的指定产物时的焓变,其中物质中所含的N元素氧化为N2(g)、H元素氧化为H2O(l)、C元素氧化为CO2(g)。
已知:①几种物质的摩尔燃烧焓:
物质 石墨(s) H2(g) CO(g)
△H/(kJ·mol—1) -393.5 -285.8 -283.0
②298k,101kPa时,部分化学键键能:
化学键 CO O=O C=O C-O
E/(kJ·mol-1) a 498 745 351
③H2O(l)=H2O(g) △H=+44.0kJ/mol
回答下列问题:
(1)计算反应2CO(g)+O2(g)=2CO2(g)的焓变△H1= kJ·mol-1,由此可求CO的化学键CO键能a= kJ·mol-1。
(2)已知相同条件下,石墨比金刚石稳定,则1mol金刚石的燃烧放热 393.5kJ(填“>”、“<”、“=”)。
(3)写出常温下氢气燃烧的热化学方程式 ,则反应CO(g)+H2O(g)=CO2(g)+H2(g)的焓变△H2= kJ·mol-1。
24.研究和深度开发CO2的综合应用,实现碳循环是解决温室问题的有效途径,对构建生态文明社会具有重要意义,CO2可实现以下转化:
①
②
已知的正反应的活化能为ckJ·mol-1,则逆反应的活化能为 kJ·mol-1.(用含a、b、c代数式表示)
25.回答下列问题:
(1)已知化学反应的能量变化如图所示:
①该反应的 0(填“大于”“小于”或“等于”)。
②写出该反应的热化学方程式 。
(2)联氨(又称肼,,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①
②
③
④
上述反应热效应之间的关系式为 ,联氨和可作为火箭推进剂的主要原因为 。(至少答两条)
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C A B A A C C A D D
题号 11 12 13 14 15
答案 C A D B B
1.C
【详解】A.反应物的总能量低于生成物的总能量时,发生吸热反应,故A错误;
B.中和热是强酸和强碱的稀溶液发生中和反应生成1mol液态水时放出的热量,但H2SO4和Ba(OH)2反应时得到硫酸钡沉淀也有生成热,故B错误;
C.反应热与反应物和生成物的总能量相对大小有关,与反应条件和途径无关,故C正确;
D.固态硫变为气态硫需要吸收热量,则等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故D错误。
答案选C。
2.A
【详解】A.催化剂可以降低反应活化能,是活化分子的数目增加,提高活化分子百分数,A正确;
B.由图知,每形成2mol A-B键,释放b kJ能量,B错误;
C.由图知,该反应为放热反应,故该反应中旧键断裂吸收的总能量低于新键形成释放的总能量,C错误;
D.由图知,该反应正反应的活化能为,D错误;
故选A。
3.B
【详解】反应Ⅱ+反应Ⅳ9-反应Ⅰ得到:,根据盖斯定律可计算出,==,答案选B。
4.A
【详解】利用盖斯定律将Ⅱ×-Ⅰ×得,综上所述故选A。
5.A
【详解】两个热化学方程式的区别是I2的状态不同导致 H不同,气态I2的能量高于固态I2的能量,反应过程中放热更多,故>,故选A;
6.C
【详解】由图可知反应物和最终产物的能量差为(330-123)+(229-77)=359kJ,此反应为放热反应,,选C。
7.C
【详解】A.由题图可知,Fe3O4参与反应,但反应前后质量不变,为整个过程的催化剂,FeO是中间产物,A错误;
B.过程I将太阳能转化为化学能,过程Ⅱ是放热反应,将化学能转化为热能,B错误 ;
C.根据氧元素化合价计算可知,生成1mol氧气,转移4mol电子,吸收,则过程Ⅰ每吸收302.4kJ,则转移电子的物质的量为2mol,C正确;
D.根据盖斯定律,,则,则,D错误;
答案选C。
8.A
【详解】根据盖斯定律,①×2+②×2+③×2得N2(g)+3H2(g)=2NH3(l),ΔH=2ΔH1+2ΔH2+2ΔH3=-2(b+c-a)kJ·mol-1,所以N2(g)和H2(g)反应生成液氨的热化学方程式是N2(g)+3H2(g)=2NH3(l)ΔH=-2(b+c-a)kJ·mol-1。
故选A。
9.D
【详解】A.根据图示可看出,生成物的能量之和小于反应物的能量之和,A错误;
B.相同条件下,液态水的能量低于气态水,则氢气和氧气反应生成液态水比生成等量气态水放出的热量多,B错误;
C.物质能量越低越稳定,金刚石比石墨能量高,则石墨稳定性较好,C错误;
D.同温同压下,若H2(g) + Cl2(g) = 2HCl(g) 能量变化如图所示,即反应物能量之和大于生成物能量之和,则该反应为放热反应,D正确。
答案为:D。
10.D
【详解】A.31g即=0.25mol白磷固体比31g红磷固体能量多bkJ,即说明白磷转化为红磷是一个放热反应,即白磷,s(红磷,s) ,能量越高越不稳定,所以红磷比白磷稳定,A错误;
B.500℃、30MPa下, ,由于上述反应是一个可逆反应,则将1.5molH2和过量的N2在此条件下充分反应,1.5molH2不可能完全反应,故放出热量小于46.2kJ,B错误;
C.已知燃烧热是指1mol纯物质与O2完全反应生成指定稳定的产物H对应的产物为液态水,故H2的燃烧热为,则 ,C错误;
D.由于HF是弱酸,在水溶液中部分电离,电离过程需要吸收热量,即稀氢氟酸溶液与稀氢氧化钠溶液反应生成1mol水时的反应热大于,D正确;
故答案为:D。
11.C
【详解】A.CO燃烧反应产生CO2气体会放出热量,说明物质完全燃烧放出的热量比不完全燃烧放出的热量更多,则生成CO2放出热量比反应产生CO气体放出的热量多,则放出热量:Q1>Q2,A错误;
B.反应物是气态S时含有的能量比反应物是固态S含有的能量多。而生成物的状态相同,故气态硫燃烧放出热量比固态S燃烧放出的热量多,则放出热量:Q1>Q2,B错误;
C.HCl比HBr稳定,物质的稳定性越强,其含有的能量就越低,反应放出热量多,放出热量:Q1<Q2,C正确;
D.CH3COOH是弱酸,其电离产生自由移动的离子的过程会吸收热量,导致发生酸碱中和反应时放出的热量比强酸与强碱反应放出的热量少,故反应放出热量:Q1>Q2,D错误;
故合理选项是C。
12.A
【详解】由盖斯定律可知,反应③=②-3×①,则,故答案选A。
13.D
【详解】A.是弱酸,电离需要吸热,1mol 的溶液与含1mol NaOH的稀溶液混合,放出热量小于57.3kJ,A错误;
B.甲烷的燃烧热,生成液态水放出热量为890.3kJ,则生成气态水放热少, ,B错误;
C.合成氨反应为可逆反应,1.5mol 和过量的在此条件下充分反应,放出热量小于46.2kJ,C错误;
D.同温同压下,在光照或点燃条件下的的数值相同,与反应条件无关,D正确;
答案选D。
14.B
【详解】A.已知热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,1molH2完全燃烧放出的热量为285.8 kJ,则H2的燃烧热为285.8 kJ·mol-1,故A项正确;
B.由热化学方程式可知,该反应为放热反应,反应物所具有的总能量高于生成物具有的总能量,故B项错误;
C.2H2(g)+O2(g)=2H2O(g)生成气态水,放出的热量比生成液态水小,ΔH>-571.6 kJ·mol-1,故C项正确;
D.燃烧热的概念就是1mol可燃物完全燃烧生成指定稳定的物质放出来的热量,所以不管是多少摩尔氢气,燃烧热都是一样的,故D项正确;
故本题选B。
15.B
【详解】A.在测定中和热的实验中,实验需要进行2~3次,每次实验要记录3次温度,所以至少需要测定并记录6次温度,故A错误;
B.若简易量热计不盖杯盖,生成1molH2O时,会有热量散失,所测得中和反应所放出的热量偏小,则ΔH将偏大,故B正确;
C.为了保证盐酸完全反应,需要使氢氧化钠溶液的浓度稍大,故C错误;
D.为了准确测定反应混合溶液的温度,实验中NaOH溶液迅速一次倒入装有盐酸的量热计内筒中,并立即盖上杯盖,以减少热量的损失,故D错误;
故选B。
16.(1)
(2)1084
(3)Ⅱ
(4)
(5)玻璃搅拌器
(6)acd
【详解】(1)由图像可以看出,反应物总能量大于生成物总能量,则该反应的正反应为放热反应, ,反应的热化学方程式为: ;
(2),解得CO中C≡O的键能为1084;
(3)图中曲线II的活化能小于曲线I的活化能,所以 曲线Ⅱ所对应的反应路径比较容易发生;
(4)由燃烧生成的用过量饱和石灰水吸收可得沉淀,可得,即一定质量的液态甲醇完全燃烧生成0.1molCO2和液态水,放出QkJ的热量, 则甲醇燃烧热的热化学方程式为: ;
(5)由图中实验装置可知,其中尚缺少的一种玻璃仪器为环形玻璃搅拌器;
(6)a.实验装置保温、隔热效果差,测得的中和热数字偏小,故a正确;
b.用量筒量取硫酸溶液时仰视读数,硫酸的物质的量偏大,生成的水偏多,测定值偏大,故b错误;
c.分多次把氢氧化钠溶解倒入盛有硫酸的小烧杯中,不能准确测定最高温度,使测定值偏小,故c正确;
d.用温度计测定氢氧化钠溶液起始温度后,直接测定硫酸溶液温度,温度差偏小,则测定值偏小,故d正确;
故答案为:acd。
17. -41.2 < D
【详解】(1)①由蒸汽重整的两个反应可知,利用第二个反应减去第一个反应则得出反应CO(g)+H2O(g)=CO2(g)+H2(g)的反应热为ΔH=(165.0-206.2) kJ·mol 1=-41.2 kJ·mol 1。
②1 mol甲烷完全燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2。生成液态水比生成气态水释放出的热量多,故ΔH2<ΔH1。
(2)由实验测得该反应的反应热ΔH=+50.5 kJ·mol 1,可知该反应是吸热反应,则反应物的总能量低于生成物的总能量,可排除能量关系图B和C。又依据活化能Ea=90.4 kJ·mol 1,Ea-ΔH<50.5 kJ·mol 1,能量关系图A中,Ea-ΔH>50.5 kJ·mol 1,Ea与ΔH的比例不对。而能量关系图D是合理的,故选D。
(3)已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol 1
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol 1
根据盖斯定律①×2+②即得4CO(g)+2NO2(g)=N2(g)+4CO2(g) ΔH=-(2a+b) kJ·mol 1,n(CO)=3.36L÷22.4L/mol=0.15 mol,所以放出的热量为×(2a+b) kJ= kJ。
【点睛】应用盖斯定律计算反应热时需要注意:热化学方程式同乘以某一个数时,反应热数值也必须乘上该数;热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减(带符号);将一个热化学方程式颠倒时,ΔH的“+”“-”号必须随之改变,但数值不变。
18.(1);
(2)
【解析】(1)
原电池装置1中正极是氢离子得电子生成氢气,正极反应式为;原电池装置2中正极是铜离子得电子生成铜,正极反应式为。
(2)
①焓变=反应物总键能-生成物总键能,该反应的热化学方程式为;
②在25℃、101kpa下,气体在足量的氧气中完全燃烧后,恢复至原状态,每转移1mol电子放出热量190kJ,1mol转移8mol电子,则1mol燃烧放热8×190kJ=1520 kJ,该反应的热化学方程式为。
19. H-O-O-H 产物为氮气和水,无污染 N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6kJ/mol 408.8kJ 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7KJ/mol
【详解】(1)N2H4中N原子之间形成1对共用电子对,N原子H原子质量形成1对共用电子对,结构式为;H2O2中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,结构式为H-O-O-H; (2)肼(N2H4)和H2O2反应,产物为氮气和水,无污染,突出的优点是:产物为氮气和水,无污染;(3)0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量,1mol液态肼放出的热量为=641.625kJ,该反应热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;(4)已知:①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,②H2O(l)═H2O(g)△H=+44KJ/mol,根据盖斯定律,①-②×4得N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.625kJ/mol,16g液态肼的物质的量为 =0.5mol,完全反应生成液态水时放出的热量为0.5mol×817.625kJ/mol=408.8kJ;(5)已知:Ⅰ、N2 (g)+2O2(g)=2NO2 (g)△H1=+67.7kJ/mol;Ⅱ、N2H4(g)+O2 (g)=N2(g)+2H2O (g)△H2=-543kJ/mol
根据盖斯定律,Ⅱ×2-Ⅰ得2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=2△H2-△H1=-1153.7KJ/mol。
20. NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ/mol A 2N2O4+O2+2H2O===4HNO3 4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1
【详解】试题分析:(1)每消耗3.8 g NaBH4(s)放热21.6 kJ,则消耗1mol NaBH4(s)放热216 kJ;(2) ①降低温度,将NO2(g)转化为N2O4(l),说明2NO2(g)N2O4(g)反应放热;2NO2(g)N2O4(l),气体变为液体放热。②N2O4与O2、H2O化合生成硝酸。(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体,根据元素守恒,黑色固体是氧化铜。
解析:(1)每消耗3.8 g NaBH4(s)放热21.6 kJ,则消耗1mol NaBH4(s)放热216 kJ,该反应的热化学方程式是NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ/mol;
(2) ①降低温度,将NO2(g)转化为N2O4(l),说明2NO2(g)N2O4(g)反应放热;2NO2(g)N2O4(l),气体变为液体放热,故A正确。
②N2O4与O2、H2O化合生成硝酸,反应方程式为2N2O4+O2+2H2O===4HNO3。(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体,根据元素守恒,黑色固体是氧化铜。
反应方程式为4CuCl+O2===2CuCl2+2CuO,每消耗1 mol CuCl(s),放热44.4 kJ,消耗4 mol CuCl(s),放热177.6 kJ,反应热化学方程式是4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1。
21.(1)C(s)+ H2O(g)= CO(g)+ H2(g) △H=+131 kJ·mol-1
(2)436 kJ/mol
(3)CH4(s)+2O2(g)= CO2(g)+ 2H2O(g) △H=-890 kJ/mol
【详解】(1)已知反应①C(s)+O2(g)=CO2(g) △H=-394kJ·mol-1;②2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1;由盖斯定律可知,①-②-③可得反应C(s)+ H2O(g)= CO(g)+ H2(g),则C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(s)+ H2O(g)= CO(g)+ H2(g) △H=-394 kJ·mol-1-(-566kJ·mol-1)- (-484kJ·mol-1)=+131 kJ·mol-1。
(2)设H—H键的键能为x kJ/mol,则946kJ/mol+3x kJ/mol-6391kJ/mol=-92kJ/mol,解得x=436 kJ/mol,则H—H键的键能是436 kJ/mol。
(3)8g甲烷的物质的量为0.5mol,则1mol甲烷完全燃烧放出的热量为445kJ2=890 kJ,则
此反应的热化学方程式为:CH4(s)+2O2(g)= CO2(g)+ 2H2O(g) △H=-890 kJ/mol。
22.(1) 放热 (a-b)kJ/mol 926 496
(2) -283kJ/mol CO(g)+Na2O2(s)=Na2CO3(s) H=-549kJ/mol
【详解】(1)①根据图像可知,反应物总能量大于生成物总能量,说明该反应为放热反应,即ΔH<0,ΔH=(a-b)kJ/mol,故答案为放热;(a-b)kJ/mol;
②根据ΔH=反应物的键能总和-生成物的键能总和=(436+×x-2×463)kJ/mol=-242kJ/mol,解得x=496,b代表氢原子和氧原子形成1mol气态水时放出的热量,即b为2×463=926;故答案为926;496;
(2)①CO的燃烧热指1molCO完全生成CO2时放出的热量,因此CO的燃烧热为=283kJ/mol,ΔH=-283kJ/mol;故答案为-283kJ/mol;
②CO与过氧化钠反应生成固体碳酸钠,a.2CO(g)+O2(g)=2CO2(g),b.Na2O2(s)+CO2(g)=Na2CO3(s)+O2(g),根据盖斯定律,得出有,CO与过氧化钠生成固体碳酸钠的ΔH=×[(-566)+2×(-266)]kJ/mol=-549kJ/mol,该反应的热化学方程式为CO(g)+Na2O2(s)=Na2CO3(s) ΔH=-549kJ/mol;故答案为CO(g)+Na2O2(s)=Na2CO3(s) ΔH=-549kJ/mol。
23. -566 958 > H2(g)+O2(g)=H2O(l) △H=-285.8kJ·mol-1 -41.2
【详解】(1)CO(g)的燃烧焓为-283.0kJ·mol-1,即1molCO完全反应生成二氧化碳时放出的热量为283.0kJ,则2molCO完全燃烧放出的热量为566kJ,2CO(g)+O2(g)=2CO2(g)的焓变△H1=-566kJ·mol-1,根据△H=反应物的键能和-生成物的键能和,可知△H1=2E(CO)+E(O=O)-4E(C=O)=2a+498-4×745=-566,解得:a=958;故答案为:-566;958;
(2)相同条件下,石墨比金刚石稳定,可知金刚石的能量高于石墨,则1mol金刚石的燃烧放热大于1mol石墨燃烧放热,即大于393.5kJ,故答案为:>;
(3)H2(g)的燃烧焓为-285.8kJ·mol-1,可得氢气燃烧的热化学方程式为:①H2(g)+O2(g)=H2O(l) △H3=-285.8kJ·mol-1;结合CO的燃烧热的热化学方程式:②CO(g)+O2(g)=CO2(g) △H4=-283.0kJ·mol-1,③H2O(l)=H2O(g) △H5=+44.0kJ/mol
反应CO(g)+H2O(g)=CO2(g)+H2(g)可由②-①-③得到,根据盖斯定律:△H2=△H4-△H3-△H5=-283.0kJ·mol-1-(-285.8kJ·mol-1)-(+44.0kJ/mol)=-41.2kJ/mol,故答案为:H2(g)+O2(g)=H2O(l) △H=-285.8kJ·mol-1;-41.2。
24.(c﹣a﹣b)
【详解】根据盖斯定律①+②可得的ΔH=(a+b)kJ·mol-1,焓变=正反应活化能-逆反应活化能,则逆反应活化能=正反应活化能-焓变=(c-a-b) kJ·mol-1。
25.(1) 大于 =+(a-b)kJ/mol
(2) 反应放热量大、产生大量气体、无污染
【详解】(1)①从图中看出,该反应为吸热反应,故大于0;
②反应物的总键能为akJ/mol;=+(a-b)kJ/mol,热化学方程式为=+(a-b)kJ/mol;
(2)根据盖斯定律可知,反应④=2③-2②-①,故;联氨和可作为火箭推进剂的主要原因为:反应放热量大、产生大量气体、无污染。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
