2.3氧化还原反应同步练习 2024-2025学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3氧化还原反应同步练习 2024-2025学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 21:24:31 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2.3氧化还原反应
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知常温下在溶液中能发生如下反应:①16H++10Z—+2XO=2X2++5Z2+8H2O,②2M2++R2=2M3++2R-,③2R-+Z2=R2+2Z-。由此判断,下列说法中正确的是
A.各粒子氧化性由强到弱的顺序是XO>Z2>R2>M3+
B.各粒子还原性由强到弱的顺序是X2+>Z->R->M2+
C.Z元素在①③反应中发生还原反应
D.Z2+2M2+=2M3++2Z-不可以进行
2.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,下列反应在水溶液中可能发生的是
A.3Cl2+6FeI2=2FeCl3+4FeI3
B.I2+2KCl=2KI+Cl2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
D.3FeCl2+I2=2FeCl3+FeI2
3.如图是一个综合处理含尾气的工艺流程。
已知“吸收”步骤和“氧化”步骤发生的反应分别为:
①;
②。
若每步反应都完全,下列说法不正确的是
A.“吸收”步骤中为氧化剂
B.由反应过程可推知氧化性的强弱顺序:
C.处理含体积分数为0.336%的尾气,反应①中转移电子数
D.溶液在上述流程中可以循环使用
4.下列关于氧化还原反应的说法正确的是
A.银针验毒的原理为,X为还原产物
B.浓HCl和制氯气的反应中,参与反应的HCl中体现酸性和氧化性各占一半
C.可以防止亚铁离子转化成三价铁离子,主要原因是具有较强的还原性
D.与水反应,氧化剂和还原剂的物质的量之比为2∶1
5.在aR2++bH++O2=cR3++dH2O的离子方程式中,对c和R3+判断正确的是
A.c=4,R3+是氧化产物 B.c=2b,R3+是氧化产物
C.c=d,R3+是还原产物 D.3c=2a+b,R3+是还原产物
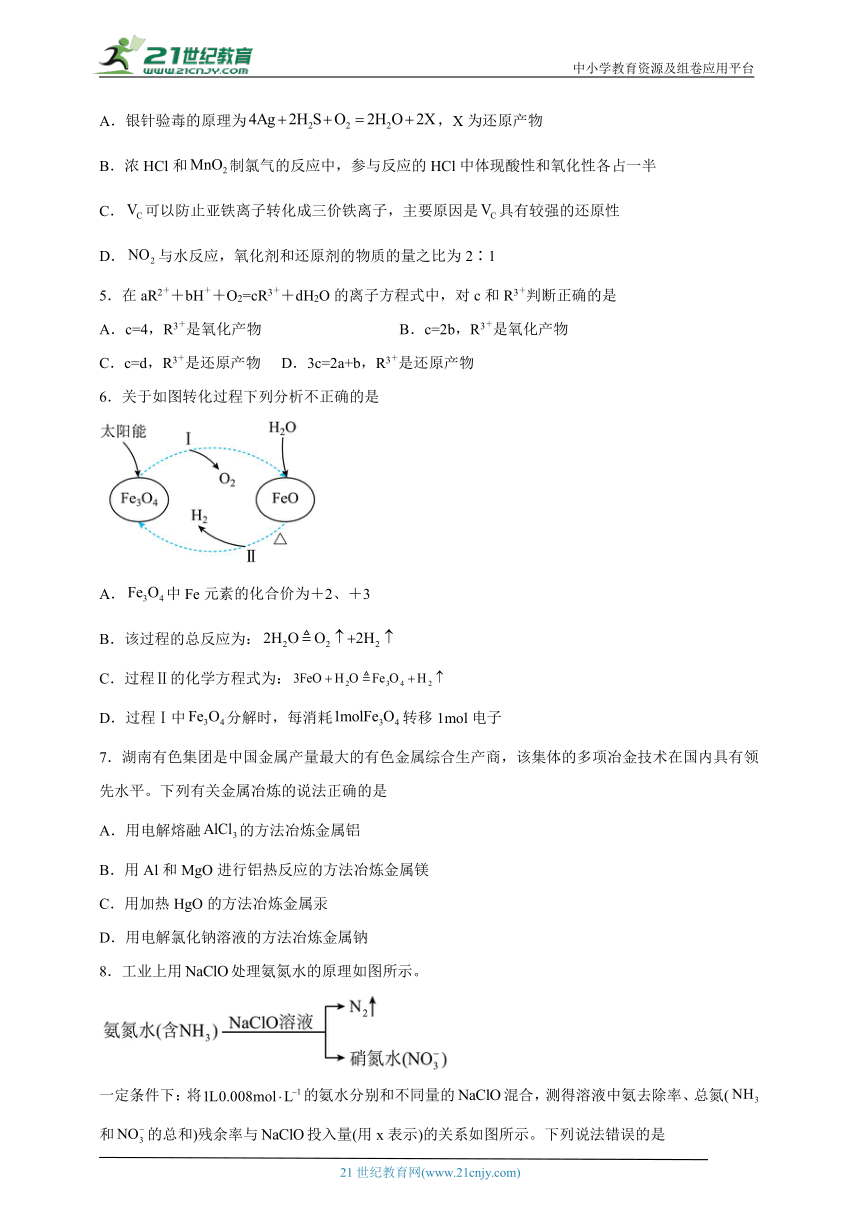
6.关于如图转化过程下列分析不正确的是
A.中Fe元素的化合价为+2、+3
B.该过程的总反应为:
C.过程Ⅱ的化学方程式为:
D.过程Ⅰ中分解时,每消耗转移1mol电子
7.湖南有色集团是中国金属产量最大的有色金属综合生产商,该集体的多项冶金技术在国内具有领先水平。下列有关金属冶炼的说法正确的是
A.用电解熔融的方法冶炼金属铝
B.用Al和MgO进行铝热反应的方法冶炼金属镁
C.用加热HgO的方法冶炼金属汞
D.用电解氯化钠溶液的方法冶炼金属钠
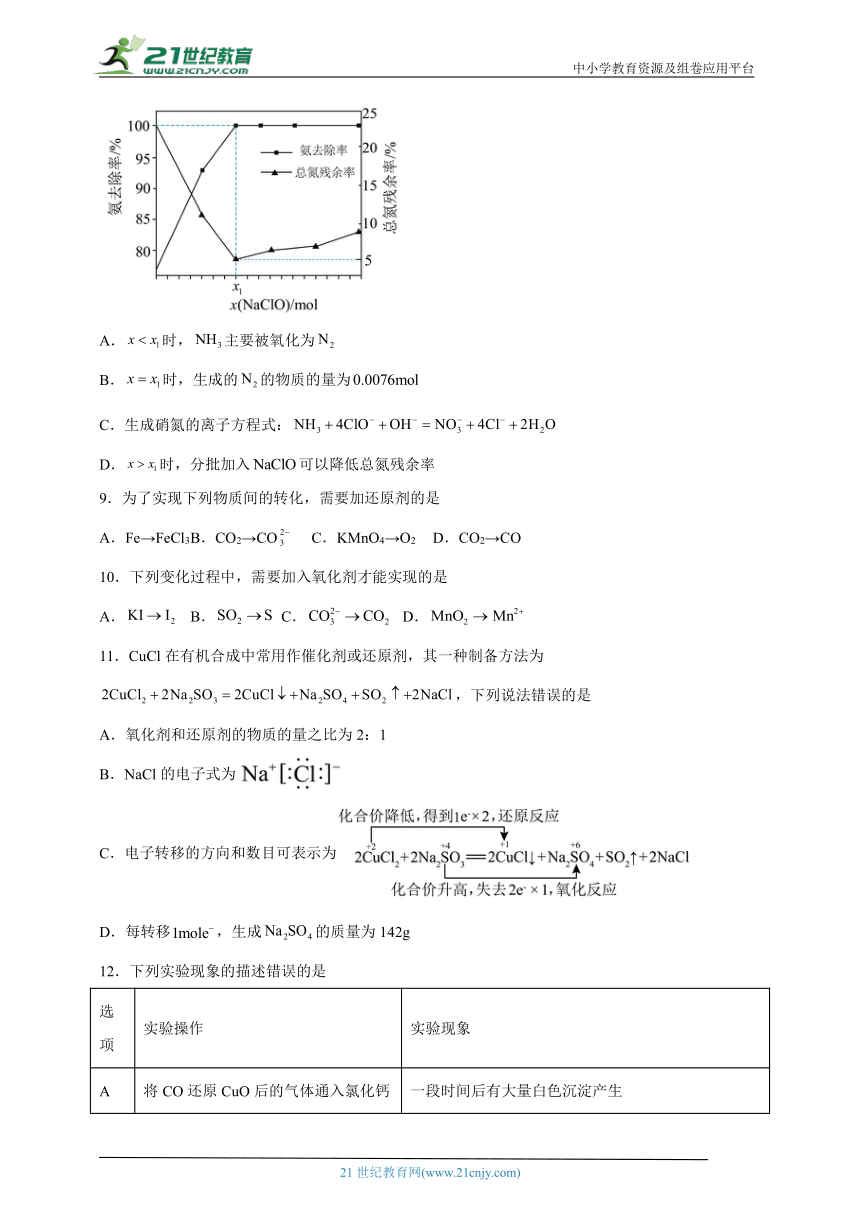
8.工业上用处理氨氮水的原理如图所示。
一定条件下:将的氨水分别和不同量的混合,测得溶液中氨去除率、总氮(和的总和)残余率与投入量(用x表示)的关系如图所示。下列说法错误的是
A.时,主要被氧化为
B.时,生成的的物质的量为
C.生成硝氮的离子方程式:
D.时,分批加入可以降低总氮残余率
9.为了实现下列物质间的转化,需要加还原剂的是
A.Fe→FeCl3 B.CO2→CO C.KMnO4→O2 D.CO2→CO
10.下列变化过程中,需要加入氧化剂才能实现的是
A. B. C. D.
11.CuCl在有机合成中常用作催化剂或还原剂,其一种制备方法为,下列说法错误的是
A.氧化剂和还原剂的物质的量之比为2:1
B.NaCl的电子式为
C.电子转移的方向和数目可表示为
D.每转移,生成的质量为142g
12.下列实验现象的描述错误的是
选项 实验操作 实验现象
A 将CO还原CuO后的气体通入氯化钙溶液中 一段时间后有大量白色沉淀产生
B 取适量溶于稀硫酸中 溶液变蓝色,并有大量气泡产生
C 将一小块钠投入滴有酚酞的水中 钠浮在水面上,并熔化成小球、快速游动、嘶嘶作响、溶液变红色
D 点燃氢气后伸入装有氯气的集气瓶中 氢气能安静地燃烧,发出苍白色火焰,瓶口上方有白雾
A.A B.B C.C D.D
13.近年来,全球性环境污染给人类带来的伤害日益加剧。WuLing教授团队在APPLCATALB-EN VIRON期刊上发表一种金属有机骨架材料[MIL-68(Fe)]在可见光照射下激发产生光生空穴()和电子(),能高效降解工业污水中的有害物质和有机染料(MG)。其工作原理如图所示,下列说法错误的是
A.该金属有机骨架材料能量转化与硅相似
B.光生空穴具有强氧化性,能将有机物(MG)氧化成无毒的和
C.在该过程中,每生成,理论上需要提供3mol电子
D.MIL-68(Fe)处理污水有毒物,是一种温和、绿色的方法
14.化学与生产、生活密切相关,下列说法不正确的是
A.铝热反应可用于焊接铁轨
B.过氧化钠可用作呼吸面具的供氧剂
C.清晨在密林中看到的一缕缕光束,属于丁达尔现象
D.为防止中秋月饼被氧化,常在包装袋中放入生石灰
15.物质的性质决定用途,下列两者对应关系不正确的是
A.小苏打受热易分解,可用于治疗胃酸过多
B.氧化钙易吸水,可用作干燥剂
C.维生素C具有还原性,可用作食品抗氧化剂
D.过氧化钠能与二氧化碳反应生成氧气,可作潜水艇中的供氧剂
二、填空题
16.填空计算,不用写计算过程。
(1)一定量的液态化合物XY2在一定量的氧气(标准状况)中恰好完全燃烧,反应的化学方程式为XY2(l)+3O2(g)=XO2(g)+2YO2(g)。冷却后,在标准状况下测得生成物的体积为672mL,密度为2.56g·L-1,则:反应前O2的体积是 mL。化合物XY2的摩尔质量是 g/mol。
(2)用98%(密度为1.84g/cm3)的浓硫酸配制1mol/L的稀硫酸200mL需浓硫酸 mL。(保留小数点后一位)
(3)用1mol·L-1的Na2SO3溶液60mL恰好将一定物质的量的XO,还原,已知氧化产物为,而元素X在还原产物中的化合价为+4,则反应的XO的物质的量是 mol。
17.实验室可以用重铬酸钾制取氯气,反应无需加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高,反应的化学方程式如下(未配平):
K2Cr2O7 + HCl → KCl + CrCl3+Cl2↑ + H2O
(1)配平上述化学反应方程式;
(2)该反应中,氧化剂是 ,还原产物是 。从氧化性、还原性 和酸碱性的角度分析,该反应中 HCl 表现的性质是 ,表现 出各性质的物质的量之比是 。
(3)当反应生成氯气 0.1 mol 时,转移电子的数目为 。
18.把19.2g的Cu放入500mL2mol·L-1稀硝酸中,发生如下反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,充分反应,Cu完全溶解。
(1)写出Cu与稀硝酸反应的离子方程式: ,用单线桥标出电子转移 。
(2)还原剂是 ,被还原的元素是 ,还原产物是 ,氧化剂与还原剂的物质的量比为 。
(3)转移的电子的数目为 (用含NA的式子表示),被还原的HNO3为 mol,反应后溶液中c(H+)为 。(体积变化忽略不计)
19.从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
(1)根据图中信息,写出任意两种氯的氧化物的化学式 。
(2)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子方程式: 。
②浓盐酸可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式: 。
(3)Cl2既具有氧化性,又具有还原性,请结合如图说明原因: 。潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,也体现了还原性。写出反应的化学方程式: 。
20.金属热还原法广泛用于冶金过程中。用金属A(或其合金)作还原剂在高温下将另一种金属B的化合物还原以制取金属B(或其合金)的方法,通常是按还原剂来命名。
(1)用铝作还原剂还原Cr2O3生产金属铬,称为铝热法,化学方程式为 。
(2)用硅作还原剂还原V2O5冶炼钒,称为硅热法,化学方程式为 。
(3)试写出用镁热法还原TiCl4生产金属钛的化学方程式: 。
21.按要求写出或完成下列方程式。(共15分)
(1)HNO3的电离方程式: 。
(2)Na2CO3的电离方程式: 。
(3)Zn与HCl反应的离子方程式: 。
(4)HCl和NaOH反应的离子方程式: 。
(5)将下列方程式配平: 。
_______KMnO4+_______HCl(浓) _______KCl+_______MnCl2+_______H2O+_______Cl2↑
22.氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是 (填字母)。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用下图表达。
试写出有水参加的符合反应类型Ⅳ的一个化学方程式: ,其中水为 剂。
(3)过氧化氢俗称双氧水,医疗上利用它的杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),可经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试写出生成物A的化学式: ,并阐明H2O2被称为绿色氧化剂的理由: 。
(4)氯化铵常用于焊接。如在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为CuO+NH4ClCu+CuCl2+N2↑+H2O(未配平)。
①配平此氧化还原反应方程式 CuO+ NH4Cl Cu+ CuCl2+ N2↑+ H2O。
②该反应中,被氧化的元素是 (填元素名称),氧化剂是 (填化学式)。
23.钠是很活泼的金属,在空气中燃烧的产物是Na2O2。Na2O的制取可以通过如下反应完成:
Na+NaNO3 Na2O+N2↑(未配平)。请回答下列问题:
(1)钠在空气中燃烧的反应方程式: 。
(2)在上述反应中,N2有何作用? 。
(3)制取Na2O时由于设备密封性不好而进入了少量空气,导致制得的Na2O产品中含有Na2O2杂质。某学生设计了实验来测定该样品中Na2O的质量分数,实验数据如下:24.8 g Na2O在氧气中充分灼烧后所得固体质量为28.0 g,该样品中Na2O的质量分数为 。
24.医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题: H++ MnO+ H2C2O4= CO2↑+ Mn2++
(1)配平上述离子方程式,在横线上填上正确的系数并在中填上所需的微粒。
(2)该反应中,若生成1molCO2,则转移电子的数目为 。
(3)测定血钙含量的方法为:取2mL血液,用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①溶解CaC2O4沉淀时不能用稀盐酸,原因是 。
②若消耗了5.0×10-5mol·L-1的KMnO4溶液20.00mL,则100mL该血液中含钙 g。
25.已知反应:
①
②
③
④
⑤
(1)上述反应中,属于置换反应的是 (填序号,下同);同一元素之间发生氧化还原的是 。
(2)反应②中氧化剂是 (填化学式,下同);反应③中氧化产物是 。
(3)在反应④中,每生成1个分子时,转移的电子数为 。
(4)配平反应⑤并用双线桥法标出反应⑤中电子转移的方向和数目 。
(5)反应⑤中氧化剂与还原剂的质量之比为(填最简整数比) 。
(6)已知有下列两个反应:①;②,、、的氧化性由强到弱的顺序为 。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B C A D C B D A
题号 11 12 13 14 15
答案 D A C D A
1.A
【详解】A.氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,反应16H++10Z-+2=2X2++5Z2+8H2O中,氧化性:>Z2;反应2M2++R2=2M3++2R-中,氧化性:R2>M3+;反应2R-+Z2=R2+2Z-中,氧化性:Z2>R2,即氧化性顺序是>Z2>R2 >M3+,故A项正确;
B.根据反应2M2++R2=2M3++2R-,可得还原性顺序是R-<M2+,根据反应2R-+Z2=R2++2Z-,可得还原性顺序是Z-<R-,根据反应:16H++10Z-+2=2X2++5Z2+8H2O,可得还原性顺序是:X2+<Z-,即还原性强弱顺序为:X2+<Z-<R-<M2+,故B项错误;
C.Z元素在①中化合价升高,发生氧化反应,在③中化合价降低,发生还原反应,故C项错误;
D.氧化性顺序是>Z2>R2>M3+,Z2+2M2+ =2M3++2 Z-可以进行,故D项错误;
故本题选A。
2.C
【分析】根据题干可知氧化性强弱关系:,据此解答。
【详解】A. 根据反应可知氧化性:,但氧化性,则还原性,应先还原,A错误;
B. 根据反应可知氧化性:,与题干不符,B错误;
C. 根据反应可知氧化性:,与题干相符,C正确;
D. 根据反应可知氧化性:,与题干不符,D错误。
答案为:C。
3.B
【详解】A.“吸收”步骤中的Fe化合价由+3价变为+2价,化合价降低,作氧化剂,A错误;
B.氧化剂的氧化性大于氧化产物的氧化性,反应①氧化性:Fe3+>;反应②氧化性:O2>Fe3+,故氧化性强弱为O2>Fe3+>,B正确;
C.100L含SO2体积分数为0.336%的尾气,SO2体积为0.336L,未给定状态,无法计算其物质的量,因此无法计算转移电子物质的量,C错误;
D.根据流程可知,反应①消耗,反应②生成,因此溶液在上述流程中可以循环使用,D错误;
故选B。
4.C
【详解】A.根据原子守恒,X的化学式为,为Ag失电子,故为氧化产物,A错误;
B.浓HCl和制氯气的反应方程式为,该反应中4 mol HCl参加反应,参与反应的HCl中体现酸性和还原性各占一半,B错误;
C.即维生素C具有较强的还原性,可以防止亚铁离子转化成三价铁离子,C正确;
D.该反应中N元素的化合价由+4价变为+5价和+3价,所以生成硝酸的二氧化氮是还原剂,生成NO的二氧化氮是氧化剂,所以氧化剂和还原剂的物质的量之比为1∶2,D错误;
答案选C。
5.A
【详解】该反应中R元素化合价由+2价变为+3价、O元素化合价由0价变为-2价,所以R2+是还原剂、R3+是氧化产物,根据O原子守恒得d=2,根据H原子守恒得b=4,根据电荷守恒得2a+4=3c,根据R原子守恒得a=c,所以得a=c=b=4,故本题选A。
6.D
【详解】A.的化学式可以改写为Fe2O3 FeO,则中Fe元素的化合价为+2、+3,A正确;
B.过程Ⅰ:2(s)=6FeO(s)+O2g)过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+(s),则该过程总反应为2H2OO2↑+2H2↑,B正确;
C.过程Ⅱ中FeO与水反应生成四氧化三铁和氢气,反应化学方程式为3FeO+H2O+H2↑,C正确;
D.过程Ⅰ:2(s)=6FeO(s)+O2(g)当有2mol分解时,生成1mol氧气,转移4mol电子,则每消耗转移2mol电子,D错误;
故选D。
7.C
【详解】A.工业上是电解熔融氧化铝获取金属铝,故A错误;
B.金属镁比铝活泼,不可以使用铝热反应的方法冶炼金属镁,故B错误;
C.金属汞相对不活泼,所以可以使用加热HgO的方法冶炼金属汞,故C正确;
D.用电解熔融氯化钠的方法冶炼金属钠,故D错误;
答案选C。
8.B
【分析】发生的反应:①和②,
【详解】A.,投入量少主要发生①,A正确;
B.x1时,氨的去除率为100%、总氮残留率为5%,n()=,95%的氨气参与反应①、有5%的氨气参与反应②,反应①生成的n()=,B错误;
C.生成硝氮的离子方程式:,C正确;
D.时,分批加入,使氨气优先尽可能的多转化成氮气,可以降低总氮残余率,D正确;
故选B。
9.D
【详解】A.铁元素的化合价由中的0变化到中的+3,化合价升高,不需要加还原剂,故A项错误;
B.碳元素和氧元素的化合价都未改变,不需要加还原剂,故B项错误;
C.氧元素的化合价由中的-2变化到中的0,化合价升高,不需要加还原剂,故C项错误;
D.碳元素的化合价由中的+4变化到中的+2,化合价降低,需要加还原剂,故D项正确;
故本题选D。
10.A
【详解】A.,I元素化合价升高,失电子,发生氧化反应,需要加入氧化剂,A正确;
B.,S元素化合价降低,得电子,发生还原反应,需加入还原剂,B错误;
C.,化合价不变,不是氧化还原反应,不需要加入氧化剂,C错误;
D.,化合价降低,发生还原反应,需加入还原剂,D错误;
故选A。
11.D
【分析】该反应CuCl2中铜化合价降低,被还原,则CuCl2是氧化剂,Na2SO3中硫元素化合价升高,被氧化,则Na2SO3是还原剂;
【详解】A.该反应中CuCl2是氧化剂,Na2SO3是还原剂,参加反应的Na2SO3一部分化合价保持不变,故氧化剂和还原剂的物质的量之比为2∶1,故A项正确;
B.NaCl为离子化合物,其电子式为,故B项正确;
C.利用双线桥表示电子转移情况时2CuCl2到2CuCl,得到2×e-,Na2SO3到Na2SO4时失去1×2e-,故C项正确;
D.每转移1mole-,生成0.5molNa2SO4,其质量为71g,故D项错误;
故本题选D。
12.A
【详解】A.CO还原CuO后的气体是CO2,CO2与H2O生成碳酸,碳酸不与氯化钙反应,A错误;
B.与稀硫酸反应会生成硫酸铜,二氧化碳和水,故溶液变蓝色,并有大量气泡产生,B正确;
C.钠与水反应生成氢氧化钠和氢气,钠投入滴有酚酞的水中,现象是钠浮在水面上,并熔化成小球、快速游动、嘶嘶作响、溶液变红色,C正确;
D.H2在Cl2中安静地燃烧,发出苍白色火焰,在瓶口形成白雾,D正确;
答案选A。
13.C
【详解】A.MIL-68(Fe)在可见光照射下,产生光生空穴()和电子(),与硅(半导体)一致,A正确;
B.由图可知,光生空穴分别将MG和氧化和还原,B正确;
C.根据原理图分析,,共需得到6 mol电子,当生成,理论上需要提供1.5 mol电子,C错误;
D.从反应原理图可知,整个过程中利用光使催化剂产生光生空穴和电子对,并用于降解污染物,体现了绿色化学思想,D正确
故选C。
14.D
【详解】A.铝热反应常用于焊接铁轨,该反应中Al作还原剂,且反应为放热反应,A正确;
B.过氧化钠和二氧化碳、水反应放出氧气,过氧化钠可用作呼吸面具的供氧剂,B正确;
C.清晨,当太阳照射在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,这就是丁达尔现象,C正确;
D.生石灰具有吸水性,可防止食品受潮,做干燥剂;生石灰不具有还原性,不能防止被氧化,D错误;
故选D。
15.A
【详解】A.小苏打显碱性,可用于治疗胃酸过多,A错误;
B.氧化钙易吸水,并与水反应生成氢氧化钙,可吸收气体中或密闭环境中的水分,所以可用作干燥剂,B正确;
C.食品中含有的Fe2+等易被空气中的氧气氧化,维生素C具有还原性,且对人体无害,可用作食品抗氧化剂,C正确;
D.过氧化钠能与二氧化碳反应生成氧气,同时可吸收人体呼出的二氧化碳和水蒸气,可作潜水艇中的供氧剂,D正确;
故选A。
16.(1) 672 76
(2)10.9
(3)0.04
【详解】(1)反应生成的XO2和YO2气体:总质量:0.672L×2.56g/L=1.72g,总物质的量:=0.03mol,参加反应的O2物质的量0.03mol,标准状况下的体积为0.03mol×22.4L/mol=0.672L=672mL。由化学反应中的质量守恒定律得,参加反应的XY2的质量为:1.72g-0.03mol×32g/mol=0.76g,由化学方程式知,参加反应的XY2与O2分子数之比为1:3,即参加反应的XY2与O2物质的量之比为1:3,参加反应的XY2的物质的量为0.01mol,化合物XY2的摩尔质量是=76g/mol。
(2)98%(密度为1.84g/cm3)的浓硫酸中H2SO4的物质的量浓度为c(H2SO4)==18.4mol/L。配制1mol/L的稀硫酸200mL需浓硫酸的体积为≈10.9mL。
(3)已知Na2SO3与XO发生氧化还原反应生成,S元素化合价从+4升高为+6,n(Na2SO3)=cV=1mol/L×0.06L=0.06mol,X元素化合价从+7降为+4,由得失电子守恒列式:0.06mol×2=n(XO)×3,n(XO)=0.04mol。
17. K2Cr2O7+14HCl= 2KCl+2CrCl3+3Cl2↑ + 7H2O K2Cr2O7 CrCl3 酸性和还原性(还原性和酸性) 4:3(3:4) 0.2NA(或 1.204×1023)
【分析】(1)氧化剂为K2Cr2O7,因为HCl一部分表现出还原性,一部分表现出酸性,所以应使用Cl2进行配平。Cr由+6价降低为+3价,1mol K2Cr2O7得到6mol电子,Cl由-1价升高到0价,生成1molCl2失去2mol电子,依据得失电子总数相等,K2Cr2O7—3Cl2,再利用质量守恒,即可配平此反应的方程式。
(2)该反应中,氧化剂是含有化合价降低元素的反应物,还原产物是含有化合价降低元素的生成物。从氧化性、还原性 和酸碱性的角度分析,该反应中 HCl 表现的性质是:生成CrCl3,表现出酸性;生成Cl2,表现出还原性。依据方程式中的化学计量数,可确定二者的数目关系。
(3)当反应生成氯气 0.1 mol 时,转移电子的数目为0.1 mol×2×NA。
【详解】(1)氧化剂为K2Cr2O7,因为HCl一部分表现出还原性,一部分表现出酸性,所以应使用Cl2进行配平。Cr由+6价降低为+3价,1mol K2Cr2O7得到6mol电子,Cl由-1价升高到0价,生成1molCl2失去2mol电子,依据得失电子总数相等,K2Cr2O7—3Cl2,再利用质量守恒,即可配平此反应的方程式K2Cr2O7+14HCl= 2KCl+2CrCl3+3Cl2↑+7H2O。答案为:K2Cr2O7+14HCl= 2KCl+2CrCl3+3Cl2↑+7H2O;
(2)该反应中,氧化剂是含有化合价降低元素的反应物,所以为K2Cr2O7;还原产物是含有化合价降低元素的生成物,所以为CrCl3。从氧化性、还原性和酸碱性的角度分析,该反应中 HCl 表现的性质是酸性和还原性;生成2molCrCl3和2molKCl,表现出酸性,对应HCl为8mol;生成Cl2,表现出还原性,对应HCl为6mol。依据方程式中的化学计量数,可确定二者的数目关系为8:6=4:3。答案为:K2Cr2O7;CrCl3;酸性和还原性;4:3(3:4);
(3)当反应生成氯气 0.1 mol 时,转移电子的数目为0.1 mol×2×NA=0.2NA。答案为:0.2NA。
18. 3Cu+2+8H+=3Cu2++2NO↑+4H2O Cu N NO 2∶3 0.6NA 0.2mol 0.4mol·L-1
【详解】(1)根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可知Cu与稀硝酸反应的离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O,Cu元素的化合价由0价升高为+2价,N元素的化合价降低3价,反应中转移6个电子,用单线桥法表示电子得失的方向和数目为;
(2)铜失去电子,被氧化,还原剂是Cu,氮元素化合价降低,被还原的元素是N,还原产物是NO,根据(1)中分析可知氧化剂与还原剂的物质的量比为2∶3。
(3)19.2g的Cu的物质的量是19.2g÷64g/mol=0.3mol,500mL2mol·L-1稀硝酸中硝酸的物质的量是1mol,根据方程式可知硝酸过量,铜完全反应,转移的电子的物质的量是0.3mol×2=0.6mol,其数目为0.6NA,根据电子得失守恒可知被还原的HNO3为0.6mol÷3=0.2mol,消耗硝酸的物质的量是0.8mol,剩余硝酸是1mol-0.8mol=0.2mol,则反应后溶液中c(H+)=0.2mol÷0.5L=0.4mol·L-1。
19. Cl2O、Cl2O3、ClO2、Cl2O5、Cl2O7等中任意两种 Zn+2H+=Zn2++H2↑、Fe+2H+=Fe2++H2↑等任写一个 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O Cl2中Cl元素的化合价为0价,氯元素还有-1价以及+1价等价态,因此Cl2中Cl元素的化合价既可以升高,来体现氯气的还原性,也可以降低,来体现氯气的氧化性 2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O
【详解】(1)根据图中信息可知氯元素的常见正化合价有、、、、等,因此氯的氧化物的化学式有、、、、等;
(2)①金属与盐酸反应生成氢气体现氯化氢的氧化性,例如、等;
②浓盐酸可作为还原剂在加热条件下与发生反应制备,该反应的化学方程式为;
(3)中元素的化合价为0价,氯元素还有价以及价等价态,因此中元素的化合价可以升高,体现氯气的还原性;中元素的化合价也可以降低,体现氯气的氧化性,即既具有氧化性,又具有还原性;潮湿的与混合制取少量的反应中,既体现了氧化性(还原产物是氯化钠),也体现了还原性(氧化产物是),因此根据原子守恒和得失电子守恒可知反应的化学方程式为:。
20.(1)2Al+Cr2O32Cr+Al2O3
(2)2V2O5+5Si5SiO2+4V
(3)TiCl4+2MgTi+2MgCl2
【详解】(1)Al和Cr2O3反应生成Cr和Al2O3,故化学方程式为2Al+Cr2O32Cr+Al2O3。
(2)Si和V2O5反应生成V和SiO2,故化学方程式为2V2O5+5Si5SiO2+4V。
(3)Mg和TiCl4反应生成Ti和MgCl2,故化学方程式为TiCl4+2MgTi+2MgCl2。
21.(1)HNO3=H++
(2)Na2CO3=2Na++
(3)Zn+2H+=Zn2++H2↑
(4)H++OH-=H2O
(5)2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
【详解】(1)HNO3是一元强酸,在水中完全电离产生H+、,故HNO3的电离方程式:HNO3=H++;
(2)Na2CO3是可溶性盐,在水中完全电离产生Na+、,故Na2CO3的电离方程式:Na2CO3=2Na++;
(3)Zn与HCl反应产生ZnCl2、H2,该反应的离子方程式:Zn+2H+=Zn2++H2↑;
(4)HCl和NaOH反应产生NaCl、H2O,该反应的离子方程式:H++OH-=H2O;
(5)在反应_______KMnO4+_______HCl(浓) _______KCl+_______MnCl2+_______H2O+_______Cl2↑中,Mn元素的化合价由反应前KMnO4中+7价变为反应后MnCl2中的+2价,化合价降低5价;Cl元素的化合价由反应前HCl中的-1价变为反应后Cl2的0价,化合价升高1×2=2价,化合价升降最小公倍数是10,所以KMnO4、MnCl2的吸收是2,HCl(浓)的系数是10,Cl2的系数是5;根据K元素守恒,可知KCl的系数是2,再根据Cl元素守恒,可知HCl的系数应该为10+6=16,最后根据H、O元素守恒,可知H2O的系数是8,则配平后的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑。
22. BC 2Na+2H2O=2NaOH+H2↑(答案合理即可) 氧化 KHCO3 H2O2作氧化剂,其还原产物是H2O,H2O没有毒性及污染性 4 2 3 1 1 4 氮 CuO
【分析】化合价有变化的反应是氧化还原反应,所含元素化合价升高是氧化反应,所含元素化合价升高的反应物是还原剂,还原剂失去电子、具有还原性,所含元素化合价降低是还原反应,所含元素化合价降低的反应物是氧化剂,氧化剂得到电子、具有氧化性,得失电子数相等;基本反应类型中,置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,据此回答;
【详解】(1)A.煤的形成发生复杂的物理化学变化,碳元素的化合价一定变化,为氧化还原反应;B.太阳能电池是通过光电效应直接把光能转化成电能的装置,没有化学变化;C.简单机械织布,为物理变化;D.烧制陶瓷发生复杂的物理化学变化,存在氧化过程,涉及氧化还原反应,如涉及碳的燃烧等,故答案为BC;
(2)由图可知,Ⅳ为氧化还原反应,且属于置换反应,如2Na+2H2O =2NaOH+H2↑,水中H元素的化合价降低,则水为氧化剂;
(3)由反应KCN+H2O2+H2O = A+NH3↑遵循元素、原子守恒可知,生成物A应该是KHCO3;双氧水作氧化剂,还原产物是水,环保无污染,同时不会向溶液中引入杂质离子,故H2O2被称为绿色氧化剂;
(4)①Cu元素的化合价由+2价降低为0价,N元素的化合价由-3价升高为0价,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而Cu得到2个电子,根据得失电子守恒,NH4Cl的化学计量数为2,铜的化学计量数为3,再结合原子守恒可知,化学方程式为4CuO+2NH4Cl 3Cu+CuCl2+N2+4H2O;②N元素失去电子被氧化,Cu元素得到电子被还原,则CuO为氧化剂。
23. 2Na + O2 Na2O2 做保护气,可防止Na2O被氧化成Na2O2 50%
【详解】(1)钠在空气中燃烧生成过氧化钠,方程式为:2Na + O2 Na2O2;
(2)Na2O易被空气中的氧气氧化,N2的作用是:做保护气,可防止Na2O被氧化成Na2O2;
(3)设样品中Na2O的质量为x,由题意可知,
2Na2O+O22Na2O2m
262 32
X 28.0g-24.8g=3.2g
,解得x=12.4g,氧化钠样品中Na2O的质量分数为= 50%。
24. 6 2 5 10 2 8H2O NA或者6.02×1023 KMnO4会氧化Cl- 0.005或者5×10-3
【详解】(1)根据元素守恒可知,生成物中还含有水。该反应中Mn元素化合价由+7价变为+2价,C元素化合价由+3价变为+4价,转移电子总数为10,所以MnO、H2C2O4的计量数分别是2、5,再结合原子守恒配平方程式为6H++2MnO+5H2C2O4=10CO2↑+2Mn2++8H2O;
(2)根据方程式系数及第(1)题化合价变化分析,生成10molCO2时,转移电子为10mol,则生成1molCO2时,转移电子为1mol,数目为NA;
(3)①HCl具有还原性,能被酸性高锰酸钾溶液氧化而造成误差,所以不能用盐酸代替;
②由CaC2O4+H2SO4=CaSO4+H2C2O4和5H2C2O4+2KMnO4+3H2SO4=K2SO4+10CO2↑+2MnSO4 +8H2O,可以得到关系式5Ca2+~2MnO,所以n(Ca2+)=n(KMnO4)=×5.0×10-5mol·L-1 ×0.02L=2.5×10-6mol,100mL含有的Ca2+的质量为50×2.5×10-6mol×40g/mol=0.005g;
25.(1) ②④ ③⑤
(2) F2 HNO3
(3)2
(4)
(5)49:73
(6)Co2O3>Cl2>Fe3+
【详解】(1)①,反应中没有元素化合价变化,属于复分解反应;
②,该反应中F、O元素化合价变化,属于氧化还原反应,也是置换反应;
③,该反应中只有N元素化合价变化,属于氧化还原反应;
④,该反应中Na、H元素化合价变化,属于氧化还原反应,也是置换反应;
⑤,该反应中只有Cl元素化合价变化,属于氧化还原反应,配平后为;综上所述,属于置换反应的是②④;其中同一元素之间发生氧化还原的是③⑤,故填②④;③⑤;
(2)对于反应,中F元素化合价降低,被还原,属于氧化剂;对于反应,中N元素化合价既升高也降低,既是氧化剂也是还原剂,其中的氧化产物为,故填;;
(3)对于反应,转移电子数为2,每生成1mol转移2mol电子,则每生成1个分子时,转移的电子数为2,故填2;
(4)对于反应,配平后为,其用双线桥法可表示为,故填;
(5)对于配平后的反应,氧化剂为,还原剂为HCl,其中有6molHCl参与反应时,有5molHCl被氧化,则该反应中氧化剂与还原剂的质量之比为49:73,故填49:73;
(6)根据氧化还原反应的规律,氧化性:氧化剂>氧化产物,对于反应,其中Cl元素化合价降低,氯气作氧化剂,Fe元素化合价升高,亚铁离子作还原剂,其氧化产物为,氧化性:;对于反应,其中Cl元素化合价升高,HCl作还原剂,其氧化产物为,Co元素化合价降低,作氧化剂,氧化性:,综上所述,氧化性:,故填。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.3氧化还原反应
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知常温下在溶液中能发生如下反应:①16H++10Z—+2XO=2X2++5Z2+8H2O,②2M2++R2=2M3++2R-,③2R-+Z2=R2+2Z-。由此判断,下列说法中正确的是
A.各粒子氧化性由强到弱的顺序是XO>Z2>R2>M3+
B.各粒子还原性由强到弱的顺序是X2+>Z->R->M2+
C.Z元素在①③反应中发生还原反应
D.Z2+2M2+=2M3++2Z-不可以进行
2.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,下列反应在水溶液中可能发生的是
A.3Cl2+6FeI2=2FeCl3+4FeI3
B.I2+2KCl=2KI+Cl2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
D.3FeCl2+I2=2FeCl3+FeI2
3.如图是一个综合处理含尾气的工艺流程。
已知“吸收”步骤和“氧化”步骤发生的反应分别为:
①;
②。
若每步反应都完全,下列说法不正确的是
A.“吸收”步骤中为氧化剂
B.由反应过程可推知氧化性的强弱顺序:
C.处理含体积分数为0.336%的尾气,反应①中转移电子数
D.溶液在上述流程中可以循环使用
4.下列关于氧化还原反应的说法正确的是
A.银针验毒的原理为,X为还原产物
B.浓HCl和制氯气的反应中,参与反应的HCl中体现酸性和氧化性各占一半
C.可以防止亚铁离子转化成三价铁离子,主要原因是具有较强的还原性
D.与水反应,氧化剂和还原剂的物质的量之比为2∶1
5.在aR2++bH++O2=cR3++dH2O的离子方程式中,对c和R3+判断正确的是
A.c=4,R3+是氧化产物 B.c=2b,R3+是氧化产物
C.c=d,R3+是还原产物 D.3c=2a+b,R3+是还原产物
6.关于如图转化过程下列分析不正确的是
A.中Fe元素的化合价为+2、+3
B.该过程的总反应为:
C.过程Ⅱ的化学方程式为:
D.过程Ⅰ中分解时,每消耗转移1mol电子
7.湖南有色集团是中国金属产量最大的有色金属综合生产商,该集体的多项冶金技术在国内具有领先水平。下列有关金属冶炼的说法正确的是
A.用电解熔融的方法冶炼金属铝
B.用Al和MgO进行铝热反应的方法冶炼金属镁
C.用加热HgO的方法冶炼金属汞
D.用电解氯化钠溶液的方法冶炼金属钠
8.工业上用处理氨氮水的原理如图所示。
一定条件下:将的氨水分别和不同量的混合,测得溶液中氨去除率、总氮(和的总和)残余率与投入量(用x表示)的关系如图所示。下列说法错误的是
A.时,主要被氧化为
B.时,生成的的物质的量为
C.生成硝氮的离子方程式:
D.时,分批加入可以降低总氮残余率
9.为了实现下列物质间的转化,需要加还原剂的是
A.Fe→FeCl3 B.CO2→CO C.KMnO4→O2 D.CO2→CO
10.下列变化过程中,需要加入氧化剂才能实现的是
A. B. C. D.
11.CuCl在有机合成中常用作催化剂或还原剂,其一种制备方法为,下列说法错误的是
A.氧化剂和还原剂的物质的量之比为2:1
B.NaCl的电子式为
C.电子转移的方向和数目可表示为
D.每转移,生成的质量为142g
12.下列实验现象的描述错误的是
选项 实验操作 实验现象
A 将CO还原CuO后的气体通入氯化钙溶液中 一段时间后有大量白色沉淀产生
B 取适量溶于稀硫酸中 溶液变蓝色,并有大量气泡产生
C 将一小块钠投入滴有酚酞的水中 钠浮在水面上,并熔化成小球、快速游动、嘶嘶作响、溶液变红色
D 点燃氢气后伸入装有氯气的集气瓶中 氢气能安静地燃烧,发出苍白色火焰,瓶口上方有白雾
A.A B.B C.C D.D
13.近年来,全球性环境污染给人类带来的伤害日益加剧。WuLing教授团队在APPLCATALB-EN VIRON期刊上发表一种金属有机骨架材料[MIL-68(Fe)]在可见光照射下激发产生光生空穴()和电子(),能高效降解工业污水中的有害物质和有机染料(MG)。其工作原理如图所示,下列说法错误的是
A.该金属有机骨架材料能量转化与硅相似
B.光生空穴具有强氧化性,能将有机物(MG)氧化成无毒的和
C.在该过程中,每生成,理论上需要提供3mol电子
D.MIL-68(Fe)处理污水有毒物,是一种温和、绿色的方法
14.化学与生产、生活密切相关,下列说法不正确的是
A.铝热反应可用于焊接铁轨
B.过氧化钠可用作呼吸面具的供氧剂
C.清晨在密林中看到的一缕缕光束,属于丁达尔现象
D.为防止中秋月饼被氧化,常在包装袋中放入生石灰
15.物质的性质决定用途,下列两者对应关系不正确的是
A.小苏打受热易分解,可用于治疗胃酸过多
B.氧化钙易吸水,可用作干燥剂
C.维生素C具有还原性,可用作食品抗氧化剂
D.过氧化钠能与二氧化碳反应生成氧气,可作潜水艇中的供氧剂
二、填空题
16.填空计算,不用写计算过程。
(1)一定量的液态化合物XY2在一定量的氧气(标准状况)中恰好完全燃烧,反应的化学方程式为XY2(l)+3O2(g)=XO2(g)+2YO2(g)。冷却后,在标准状况下测得生成物的体积为672mL,密度为2.56g·L-1,则:反应前O2的体积是 mL。化合物XY2的摩尔质量是 g/mol。
(2)用98%(密度为1.84g/cm3)的浓硫酸配制1mol/L的稀硫酸200mL需浓硫酸 mL。(保留小数点后一位)
(3)用1mol·L-1的Na2SO3溶液60mL恰好将一定物质的量的XO,还原,已知氧化产物为,而元素X在还原产物中的化合价为+4,则反应的XO的物质的量是 mol。
17.实验室可以用重铬酸钾制取氯气,反应无需加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高,反应的化学方程式如下(未配平):
K2Cr2O7 + HCl → KCl + CrCl3+Cl2↑ + H2O
(1)配平上述化学反应方程式;
(2)该反应中,氧化剂是 ,还原产物是 。从氧化性、还原性 和酸碱性的角度分析,该反应中 HCl 表现的性质是 ,表现 出各性质的物质的量之比是 。
(3)当反应生成氯气 0.1 mol 时,转移电子的数目为 。
18.把19.2g的Cu放入500mL2mol·L-1稀硝酸中,发生如下反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,充分反应,Cu完全溶解。
(1)写出Cu与稀硝酸反应的离子方程式: ,用单线桥标出电子转移 。
(2)还原剂是 ,被还原的元素是 ,还原产物是 ,氧化剂与还原剂的物质的量比为 。
(3)转移的电子的数目为 (用含NA的式子表示),被还原的HNO3为 mol,反应后溶液中c(H+)为 。(体积变化忽略不计)
19.从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
(1)根据图中信息,写出任意两种氯的氧化物的化学式 。
(2)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子方程式: 。
②浓盐酸可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式: 。
(3)Cl2既具有氧化性,又具有还原性,请结合如图说明原因: 。潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,也体现了还原性。写出反应的化学方程式: 。
20.金属热还原法广泛用于冶金过程中。用金属A(或其合金)作还原剂在高温下将另一种金属B的化合物还原以制取金属B(或其合金)的方法,通常是按还原剂来命名。
(1)用铝作还原剂还原Cr2O3生产金属铬,称为铝热法,化学方程式为 。
(2)用硅作还原剂还原V2O5冶炼钒,称为硅热法,化学方程式为 。
(3)试写出用镁热法还原TiCl4生产金属钛的化学方程式: 。
21.按要求写出或完成下列方程式。(共15分)
(1)HNO3的电离方程式: 。
(2)Na2CO3的电离方程式: 。
(3)Zn与HCl反应的离子方程式: 。
(4)HCl和NaOH反应的离子方程式: 。
(5)将下列方程式配平: 。
_______KMnO4+_______HCl(浓) _______KCl+_______MnCl2+_______H2O+_______Cl2↑
22.氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是 (填字母)。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用下图表达。
试写出有水参加的符合反应类型Ⅳ的一个化学方程式: ,其中水为 剂。
(3)过氧化氢俗称双氧水,医疗上利用它的杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),可经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试写出生成物A的化学式: ,并阐明H2O2被称为绿色氧化剂的理由: 。
(4)氯化铵常用于焊接。如在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为CuO+NH4ClCu+CuCl2+N2↑+H2O(未配平)。
①配平此氧化还原反应方程式 CuO+ NH4Cl Cu+ CuCl2+ N2↑+ H2O。
②该反应中,被氧化的元素是 (填元素名称),氧化剂是 (填化学式)。
23.钠是很活泼的金属,在空气中燃烧的产物是Na2O2。Na2O的制取可以通过如下反应完成:
Na+NaNO3 Na2O+N2↑(未配平)。请回答下列问题:
(1)钠在空气中燃烧的反应方程式: 。
(2)在上述反应中,N2有何作用? 。
(3)制取Na2O时由于设备密封性不好而进入了少量空气,导致制得的Na2O产品中含有Na2O2杂质。某学生设计了实验来测定该样品中Na2O的质量分数,实验数据如下:24.8 g Na2O在氧气中充分灼烧后所得固体质量为28.0 g,该样品中Na2O的质量分数为 。
24.医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题: H++ MnO+ H2C2O4= CO2↑+ Mn2++
(1)配平上述离子方程式,在横线上填上正确的系数并在中填上所需的微粒。
(2)该反应中,若生成1molCO2,则转移电子的数目为 。
(3)测定血钙含量的方法为:取2mL血液,用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①溶解CaC2O4沉淀时不能用稀盐酸,原因是 。
②若消耗了5.0×10-5mol·L-1的KMnO4溶液20.00mL,则100mL该血液中含钙 g。
25.已知反应:
①
②
③
④
⑤
(1)上述反应中,属于置换反应的是 (填序号,下同);同一元素之间发生氧化还原的是 。
(2)反应②中氧化剂是 (填化学式,下同);反应③中氧化产物是 。
(3)在反应④中,每生成1个分子时,转移的电子数为 。
(4)配平反应⑤并用双线桥法标出反应⑤中电子转移的方向和数目 。
(5)反应⑤中氧化剂与还原剂的质量之比为(填最简整数比) 。
(6)已知有下列两个反应:①;②,、、的氧化性由强到弱的顺序为 。
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B C A D C B D A
题号 11 12 13 14 15
答案 D A C D A
1.A
【详解】A.氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,反应16H++10Z-+2=2X2++5Z2+8H2O中,氧化性:>Z2;反应2M2++R2=2M3++2R-中,氧化性:R2>M3+;反应2R-+Z2=R2+2Z-中,氧化性:Z2>R2,即氧化性顺序是>Z2>R2 >M3+,故A项正确;
B.根据反应2M2++R2=2M3++2R-,可得还原性顺序是R-<M2+,根据反应2R-+Z2=R2++2Z-,可得还原性顺序是Z-<R-,根据反应:16H++10Z-+2=2X2++5Z2+8H2O,可得还原性顺序是:X2+<Z-,即还原性强弱顺序为:X2+<Z-<R-<M2+,故B项错误;
C.Z元素在①中化合价升高,发生氧化反应,在③中化合价降低,发生还原反应,故C项错误;
D.氧化性顺序是>Z2>R2>M3+,Z2+2M2+ =2M3++2 Z-可以进行,故D项错误;
故本题选A。
2.C
【分析】根据题干可知氧化性强弱关系:,据此解答。
【详解】A. 根据反应可知氧化性:,但氧化性,则还原性,应先还原,A错误;
B. 根据反应可知氧化性:,与题干不符,B错误;
C. 根据反应可知氧化性:,与题干相符,C正确;
D. 根据反应可知氧化性:,与题干不符,D错误。
答案为:C。
3.B
【详解】A.“吸收”步骤中的Fe化合价由+3价变为+2价,化合价降低,作氧化剂,A错误;
B.氧化剂的氧化性大于氧化产物的氧化性,反应①氧化性:Fe3+>;反应②氧化性:O2>Fe3+,故氧化性强弱为O2>Fe3+>,B正确;
C.100L含SO2体积分数为0.336%的尾气,SO2体积为0.336L,未给定状态,无法计算其物质的量,因此无法计算转移电子物质的量,C错误;
D.根据流程可知,反应①消耗,反应②生成,因此溶液在上述流程中可以循环使用,D错误;
故选B。
4.C
【详解】A.根据原子守恒,X的化学式为,为Ag失电子,故为氧化产物,A错误;
B.浓HCl和制氯气的反应方程式为,该反应中4 mol HCl参加反应,参与反应的HCl中体现酸性和还原性各占一半,B错误;
C.即维生素C具有较强的还原性,可以防止亚铁离子转化成三价铁离子,C正确;
D.该反应中N元素的化合价由+4价变为+5价和+3价,所以生成硝酸的二氧化氮是还原剂,生成NO的二氧化氮是氧化剂,所以氧化剂和还原剂的物质的量之比为1∶2,D错误;
答案选C。
5.A
【详解】该反应中R元素化合价由+2价变为+3价、O元素化合价由0价变为-2价,所以R2+是还原剂、R3+是氧化产物,根据O原子守恒得d=2,根据H原子守恒得b=4,根据电荷守恒得2a+4=3c,根据R原子守恒得a=c,所以得a=c=b=4,故本题选A。
6.D
【详解】A.的化学式可以改写为Fe2O3 FeO,则中Fe元素的化合价为+2、+3,A正确;
B.过程Ⅰ:2(s)=6FeO(s)+O2g)过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+(s),则该过程总反应为2H2OO2↑+2H2↑,B正确;
C.过程Ⅱ中FeO与水反应生成四氧化三铁和氢气,反应化学方程式为3FeO+H2O+H2↑,C正确;
D.过程Ⅰ:2(s)=6FeO(s)+O2(g)当有2mol分解时,生成1mol氧气,转移4mol电子,则每消耗转移2mol电子,D错误;
故选D。
7.C
【详解】A.工业上是电解熔融氧化铝获取金属铝,故A错误;
B.金属镁比铝活泼,不可以使用铝热反应的方法冶炼金属镁,故B错误;
C.金属汞相对不活泼,所以可以使用加热HgO的方法冶炼金属汞,故C正确;
D.用电解熔融氯化钠的方法冶炼金属钠,故D错误;
答案选C。
8.B
【分析】发生的反应:①和②,
【详解】A.,投入量少主要发生①,A正确;
B.x1时,氨的去除率为100%、总氮残留率为5%,n()=,95%的氨气参与反应①、有5%的氨气参与反应②,反应①生成的n()=,B错误;
C.生成硝氮的离子方程式:,C正确;
D.时,分批加入,使氨气优先尽可能的多转化成氮气,可以降低总氮残余率,D正确;
故选B。
9.D
【详解】A.铁元素的化合价由中的0变化到中的+3,化合价升高,不需要加还原剂,故A项错误;
B.碳元素和氧元素的化合价都未改变,不需要加还原剂,故B项错误;
C.氧元素的化合价由中的-2变化到中的0,化合价升高,不需要加还原剂,故C项错误;
D.碳元素的化合价由中的+4变化到中的+2,化合价降低,需要加还原剂,故D项正确;
故本题选D。
10.A
【详解】A.,I元素化合价升高,失电子,发生氧化反应,需要加入氧化剂,A正确;
B.,S元素化合价降低,得电子,发生还原反应,需加入还原剂,B错误;
C.,化合价不变,不是氧化还原反应,不需要加入氧化剂,C错误;
D.,化合价降低,发生还原反应,需加入还原剂,D错误;
故选A。
11.D
【分析】该反应CuCl2中铜化合价降低,被还原,则CuCl2是氧化剂,Na2SO3中硫元素化合价升高,被氧化,则Na2SO3是还原剂;
【详解】A.该反应中CuCl2是氧化剂,Na2SO3是还原剂,参加反应的Na2SO3一部分化合价保持不变,故氧化剂和还原剂的物质的量之比为2∶1,故A项正确;
B.NaCl为离子化合物,其电子式为,故B项正确;
C.利用双线桥表示电子转移情况时2CuCl2到2CuCl,得到2×e-,Na2SO3到Na2SO4时失去1×2e-,故C项正确;
D.每转移1mole-,生成0.5molNa2SO4,其质量为71g,故D项错误;
故本题选D。
12.A
【详解】A.CO还原CuO后的气体是CO2,CO2与H2O生成碳酸,碳酸不与氯化钙反应,A错误;
B.与稀硫酸反应会生成硫酸铜,二氧化碳和水,故溶液变蓝色,并有大量气泡产生,B正确;
C.钠与水反应生成氢氧化钠和氢气,钠投入滴有酚酞的水中,现象是钠浮在水面上,并熔化成小球、快速游动、嘶嘶作响、溶液变红色,C正确;
D.H2在Cl2中安静地燃烧,发出苍白色火焰,在瓶口形成白雾,D正确;
答案选A。
13.C
【详解】A.MIL-68(Fe)在可见光照射下,产生光生空穴()和电子(),与硅(半导体)一致,A正确;
B.由图可知,光生空穴分别将MG和氧化和还原,B正确;
C.根据原理图分析,,共需得到6 mol电子,当生成,理论上需要提供1.5 mol电子,C错误;
D.从反应原理图可知,整个过程中利用光使催化剂产生光生空穴和电子对,并用于降解污染物,体现了绿色化学思想,D正确
故选C。
14.D
【详解】A.铝热反应常用于焊接铁轨,该反应中Al作还原剂,且反应为放热反应,A正确;
B.过氧化钠和二氧化碳、水反应放出氧气,过氧化钠可用作呼吸面具的供氧剂,B正确;
C.清晨,当太阳照射在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,这就是丁达尔现象,C正确;
D.生石灰具有吸水性,可防止食品受潮,做干燥剂;生石灰不具有还原性,不能防止被氧化,D错误;
故选D。
15.A
【详解】A.小苏打显碱性,可用于治疗胃酸过多,A错误;
B.氧化钙易吸水,并与水反应生成氢氧化钙,可吸收气体中或密闭环境中的水分,所以可用作干燥剂,B正确;
C.食品中含有的Fe2+等易被空气中的氧气氧化,维生素C具有还原性,且对人体无害,可用作食品抗氧化剂,C正确;
D.过氧化钠能与二氧化碳反应生成氧气,同时可吸收人体呼出的二氧化碳和水蒸气,可作潜水艇中的供氧剂,D正确;
故选A。
16.(1) 672 76
(2)10.9
(3)0.04
【详解】(1)反应生成的XO2和YO2气体:总质量:0.672L×2.56g/L=1.72g,总物质的量:=0.03mol,参加反应的O2物质的量0.03mol,标准状况下的体积为0.03mol×22.4L/mol=0.672L=672mL。由化学反应中的质量守恒定律得,参加反应的XY2的质量为:1.72g-0.03mol×32g/mol=0.76g,由化学方程式知,参加反应的XY2与O2分子数之比为1:3,即参加反应的XY2与O2物质的量之比为1:3,参加反应的XY2的物质的量为0.01mol,化合物XY2的摩尔质量是=76g/mol。
(2)98%(密度为1.84g/cm3)的浓硫酸中H2SO4的物质的量浓度为c(H2SO4)==18.4mol/L。配制1mol/L的稀硫酸200mL需浓硫酸的体积为≈10.9mL。
(3)已知Na2SO3与XO发生氧化还原反应生成,S元素化合价从+4升高为+6,n(Na2SO3)=cV=1mol/L×0.06L=0.06mol,X元素化合价从+7降为+4,由得失电子守恒列式:0.06mol×2=n(XO)×3,n(XO)=0.04mol。
17. K2Cr2O7+14HCl= 2KCl+2CrCl3+3Cl2↑ + 7H2O K2Cr2O7 CrCl3 酸性和还原性(还原性和酸性) 4:3(3:4) 0.2NA(或 1.204×1023)
【分析】(1)氧化剂为K2Cr2O7,因为HCl一部分表现出还原性,一部分表现出酸性,所以应使用Cl2进行配平。Cr由+6价降低为+3价,1mol K2Cr2O7得到6mol电子,Cl由-1价升高到0价,生成1molCl2失去2mol电子,依据得失电子总数相等,K2Cr2O7—3Cl2,再利用质量守恒,即可配平此反应的方程式。
(2)该反应中,氧化剂是含有化合价降低元素的反应物,还原产物是含有化合价降低元素的生成物。从氧化性、还原性 和酸碱性的角度分析,该反应中 HCl 表现的性质是:生成CrCl3,表现出酸性;生成Cl2,表现出还原性。依据方程式中的化学计量数,可确定二者的数目关系。
(3)当反应生成氯气 0.1 mol 时,转移电子的数目为0.1 mol×2×NA。
【详解】(1)氧化剂为K2Cr2O7,因为HCl一部分表现出还原性,一部分表现出酸性,所以应使用Cl2进行配平。Cr由+6价降低为+3价,1mol K2Cr2O7得到6mol电子,Cl由-1价升高到0价,生成1molCl2失去2mol电子,依据得失电子总数相等,K2Cr2O7—3Cl2,再利用质量守恒,即可配平此反应的方程式K2Cr2O7+14HCl= 2KCl+2CrCl3+3Cl2↑+7H2O。答案为:K2Cr2O7+14HCl= 2KCl+2CrCl3+3Cl2↑+7H2O;
(2)该反应中,氧化剂是含有化合价降低元素的反应物,所以为K2Cr2O7;还原产物是含有化合价降低元素的生成物,所以为CrCl3。从氧化性、还原性和酸碱性的角度分析,该反应中 HCl 表现的性质是酸性和还原性;生成2molCrCl3和2molKCl,表现出酸性,对应HCl为8mol;生成Cl2,表现出还原性,对应HCl为6mol。依据方程式中的化学计量数,可确定二者的数目关系为8:6=4:3。答案为:K2Cr2O7;CrCl3;酸性和还原性;4:3(3:4);
(3)当反应生成氯气 0.1 mol 时,转移电子的数目为0.1 mol×2×NA=0.2NA。答案为:0.2NA。
18. 3Cu+2+8H+=3Cu2++2NO↑+4H2O Cu N NO 2∶3 0.6NA 0.2mol 0.4mol·L-1
【详解】(1)根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可知Cu与稀硝酸反应的离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O,Cu元素的化合价由0价升高为+2价,N元素的化合价降低3价,反应中转移6个电子,用单线桥法表示电子得失的方向和数目为;
(2)铜失去电子,被氧化,还原剂是Cu,氮元素化合价降低,被还原的元素是N,还原产物是NO,根据(1)中分析可知氧化剂与还原剂的物质的量比为2∶3。
(3)19.2g的Cu的物质的量是19.2g÷64g/mol=0.3mol,500mL2mol·L-1稀硝酸中硝酸的物质的量是1mol,根据方程式可知硝酸过量,铜完全反应,转移的电子的物质的量是0.3mol×2=0.6mol,其数目为0.6NA,根据电子得失守恒可知被还原的HNO3为0.6mol÷3=0.2mol,消耗硝酸的物质的量是0.8mol,剩余硝酸是1mol-0.8mol=0.2mol,则反应后溶液中c(H+)=0.2mol÷0.5L=0.4mol·L-1。
19. Cl2O、Cl2O3、ClO2、Cl2O5、Cl2O7等中任意两种 Zn+2H+=Zn2++H2↑、Fe+2H+=Fe2++H2↑等任写一个 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O Cl2中Cl元素的化合价为0价,氯元素还有-1价以及+1价等价态,因此Cl2中Cl元素的化合价既可以升高,来体现氯气的还原性,也可以降低,来体现氯气的氧化性 2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O
【详解】(1)根据图中信息可知氯元素的常见正化合价有、、、、等,因此氯的氧化物的化学式有、、、、等;
(2)①金属与盐酸反应生成氢气体现氯化氢的氧化性,例如、等;
②浓盐酸可作为还原剂在加热条件下与发生反应制备,该反应的化学方程式为;
(3)中元素的化合价为0价,氯元素还有价以及价等价态,因此中元素的化合价可以升高,体现氯气的还原性;中元素的化合价也可以降低,体现氯气的氧化性,即既具有氧化性,又具有还原性;潮湿的与混合制取少量的反应中,既体现了氧化性(还原产物是氯化钠),也体现了还原性(氧化产物是),因此根据原子守恒和得失电子守恒可知反应的化学方程式为:。
20.(1)2Al+Cr2O32Cr+Al2O3
(2)2V2O5+5Si5SiO2+4V
(3)TiCl4+2MgTi+2MgCl2
【详解】(1)Al和Cr2O3反应生成Cr和Al2O3,故化学方程式为2Al+Cr2O32Cr+Al2O3。
(2)Si和V2O5反应生成V和SiO2,故化学方程式为2V2O5+5Si5SiO2+4V。
(3)Mg和TiCl4反应生成Ti和MgCl2,故化学方程式为TiCl4+2MgTi+2MgCl2。
21.(1)HNO3=H++
(2)Na2CO3=2Na++
(3)Zn+2H+=Zn2++H2↑
(4)H++OH-=H2O
(5)2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
【详解】(1)HNO3是一元强酸,在水中完全电离产生H+、,故HNO3的电离方程式:HNO3=H++;
(2)Na2CO3是可溶性盐,在水中完全电离产生Na+、,故Na2CO3的电离方程式:Na2CO3=2Na++;
(3)Zn与HCl反应产生ZnCl2、H2,该反应的离子方程式:Zn+2H+=Zn2++H2↑;
(4)HCl和NaOH反应产生NaCl、H2O,该反应的离子方程式:H++OH-=H2O;
(5)在反应_______KMnO4+_______HCl(浓) _______KCl+_______MnCl2+_______H2O+_______Cl2↑中,Mn元素的化合价由反应前KMnO4中+7价变为反应后MnCl2中的+2价,化合价降低5价;Cl元素的化合价由反应前HCl中的-1价变为反应后Cl2的0价,化合价升高1×2=2价,化合价升降最小公倍数是10,所以KMnO4、MnCl2的吸收是2,HCl(浓)的系数是10,Cl2的系数是5;根据K元素守恒,可知KCl的系数是2,再根据Cl元素守恒,可知HCl的系数应该为10+6=16,最后根据H、O元素守恒,可知H2O的系数是8,则配平后的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑。
22. BC 2Na+2H2O=2NaOH+H2↑(答案合理即可) 氧化 KHCO3 H2O2作氧化剂,其还原产物是H2O,H2O没有毒性及污染性 4 2 3 1 1 4 氮 CuO
【分析】化合价有变化的反应是氧化还原反应,所含元素化合价升高是氧化反应,所含元素化合价升高的反应物是还原剂,还原剂失去电子、具有还原性,所含元素化合价降低是还原反应,所含元素化合价降低的反应物是氧化剂,氧化剂得到电子、具有氧化性,得失电子数相等;基本反应类型中,置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,据此回答;
【详解】(1)A.煤的形成发生复杂的物理化学变化,碳元素的化合价一定变化,为氧化还原反应;B.太阳能电池是通过光电效应直接把光能转化成电能的装置,没有化学变化;C.简单机械织布,为物理变化;D.烧制陶瓷发生复杂的物理化学变化,存在氧化过程,涉及氧化还原反应,如涉及碳的燃烧等,故答案为BC;
(2)由图可知,Ⅳ为氧化还原反应,且属于置换反应,如2Na+2H2O =2NaOH+H2↑,水中H元素的化合价降低,则水为氧化剂;
(3)由反应KCN+H2O2+H2O = A+NH3↑遵循元素、原子守恒可知,生成物A应该是KHCO3;双氧水作氧化剂,还原产物是水,环保无污染,同时不会向溶液中引入杂质离子,故H2O2被称为绿色氧化剂;
(4)①Cu元素的化合价由+2价降低为0价,N元素的化合价由-3价升高为0价,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而Cu得到2个电子,根据得失电子守恒,NH4Cl的化学计量数为2,铜的化学计量数为3,再结合原子守恒可知,化学方程式为4CuO+2NH4Cl 3Cu+CuCl2+N2+4H2O;②N元素失去电子被氧化,Cu元素得到电子被还原,则CuO为氧化剂。
23. 2Na + O2 Na2O2 做保护气,可防止Na2O被氧化成Na2O2 50%
【详解】(1)钠在空气中燃烧生成过氧化钠,方程式为:2Na + O2 Na2O2;
(2)Na2O易被空气中的氧气氧化,N2的作用是:做保护气,可防止Na2O被氧化成Na2O2;
(3)设样品中Na2O的质量为x,由题意可知,
2Na2O+O22Na2O2m
262 32
X 28.0g-24.8g=3.2g
,解得x=12.4g,氧化钠样品中Na2O的质量分数为= 50%。
24. 6 2 5 10 2 8H2O NA或者6.02×1023 KMnO4会氧化Cl- 0.005或者5×10-3
【详解】(1)根据元素守恒可知,生成物中还含有水。该反应中Mn元素化合价由+7价变为+2价,C元素化合价由+3价变为+4价,转移电子总数为10,所以MnO、H2C2O4的计量数分别是2、5,再结合原子守恒配平方程式为6H++2MnO+5H2C2O4=10CO2↑+2Mn2++8H2O;
(2)根据方程式系数及第(1)题化合价变化分析,生成10molCO2时,转移电子为10mol,则生成1molCO2时,转移电子为1mol,数目为NA;
(3)①HCl具有还原性,能被酸性高锰酸钾溶液氧化而造成误差,所以不能用盐酸代替;
②由CaC2O4+H2SO4=CaSO4+H2C2O4和5H2C2O4+2KMnO4+3H2SO4=K2SO4+10CO2↑+2MnSO4 +8H2O,可以得到关系式5Ca2+~2MnO,所以n(Ca2+)=n(KMnO4)=×5.0×10-5mol·L-1 ×0.02L=2.5×10-6mol,100mL含有的Ca2+的质量为50×2.5×10-6mol×40g/mol=0.005g;
25.(1) ②④ ③⑤
(2) F2 HNO3
(3)2
(4)
(5)49:73
(6)Co2O3>Cl2>Fe3+
【详解】(1)①,反应中没有元素化合价变化,属于复分解反应;
②,该反应中F、O元素化合价变化,属于氧化还原反应,也是置换反应;
③,该反应中只有N元素化合价变化,属于氧化还原反应;
④,该反应中Na、H元素化合价变化,属于氧化还原反应,也是置换反应;
⑤,该反应中只有Cl元素化合价变化,属于氧化还原反应,配平后为;综上所述,属于置换反应的是②④;其中同一元素之间发生氧化还原的是③⑤,故填②④;③⑤;
(2)对于反应,中F元素化合价降低,被还原,属于氧化剂;对于反应,中N元素化合价既升高也降低,既是氧化剂也是还原剂,其中的氧化产物为,故填;;
(3)对于反应,转移电子数为2,每生成1mol转移2mol电子,则每生成1个分子时,转移的电子数为2,故填2;
(4)对于反应,配平后为,其用双线桥法可表示为,故填;
(5)对于配平后的反应,氧化剂为,还原剂为HCl,其中有6molHCl参与反应时,有5molHCl被氧化,则该反应中氧化剂与还原剂的质量之比为49:73,故填49:73;
(6)根据氧化还原反应的规律,氧化性:氧化剂>氧化产物,对于反应,其中Cl元素化合价降低,氯气作氧化剂,Fe元素化合价升高,亚铁离子作还原剂,其氧化产物为,氧化性:;对于反应,其中Cl元素化合价升高,HCl作还原剂,其氧化产物为,Co元素化合价降低,作氧化剂,氧化性:,综上所述,氧化性:,故填。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
