弱电解质的电离
图片预览





文档简介
课件14张PPT。第一节 弱电解质的电离【复习】电解质与非电解质电解质:非电解质:在水溶液或熔融状态下,能够导电的化合物在水溶液和熔融状态下都不能导电的化合物判断
熔融状态下,能导电的物质一定是电解质。
2、熔融状态下,不能导电的化合物一定不是电解质
3、溶于水能导电的物质一定是电解质主要包括:酸、碱、盐、金属氧化物、水
如:HCl、NaOH、CaCO3、H2O、 CaO等主要包括:大多数有机物、非金属氧化物、NH3。比如C2H5OH(乙醇)、蔗糖、 SO3 、 CO2等应 用
思 考 1.能导电的物质都是电解质吗?一种化合物不是电解质就是非电解质吗?
提示:电解质概念的前提必须是化合物,像金属单质和电解质溶液均导电,但它们都不是化合物,所以它们既不是电解质,也不是非电解质,如果是一种化合物,它不是电解质就是非电解质。提示:BaSO4难溶于水,因此溶液中离子浓度很小,很难测出其溶液的导电性,但BaSO4熔融时能够导电,所以BaSO4是电解质。2.BaSO4的水溶液几乎不导电,则BaSO4为非电解质,正确吗?应 用
思 考 练习:
把下列物质分类
(1)电解质
(2)非电解质
(3)既不是电解质也不是非电解质
①NaCl固体 ②BaSO4 ③冰醋酸 ④CO2 ⑤Cu
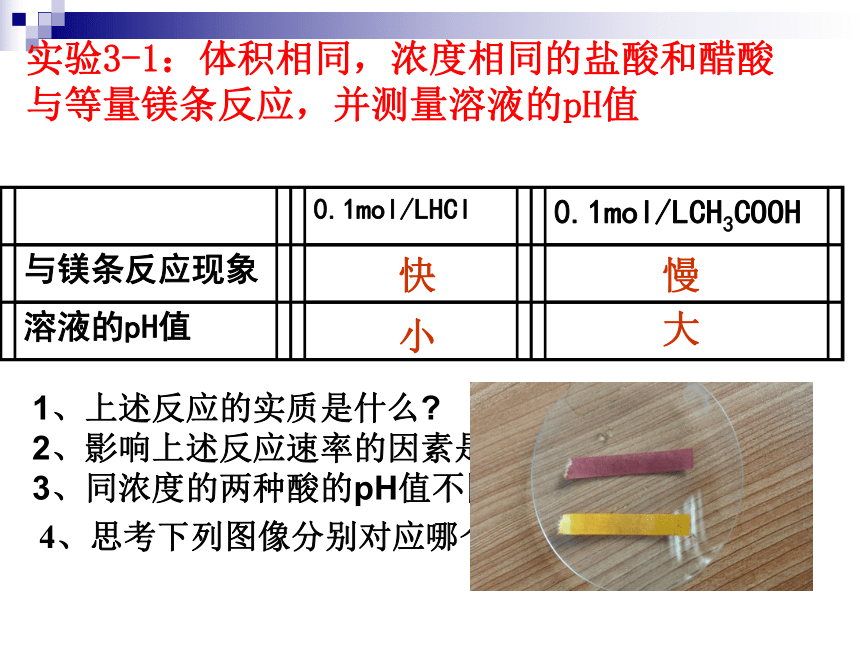
⑥NaOH溶液 ⑦Na2O ⑧NH3·H2O ⑨NH3 ⑩酒精 判断是否为电解质的关键:什么是电离?是否电解质的电离程度都相同?记住常见类型,进行分类判断① ②③⑦⑧④⑨⑩⑤⑥实验3-1:体积相同,浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH值 快慢小大1、上述反应的实质是什么?
2、影响上述反应速率的因素是什么?
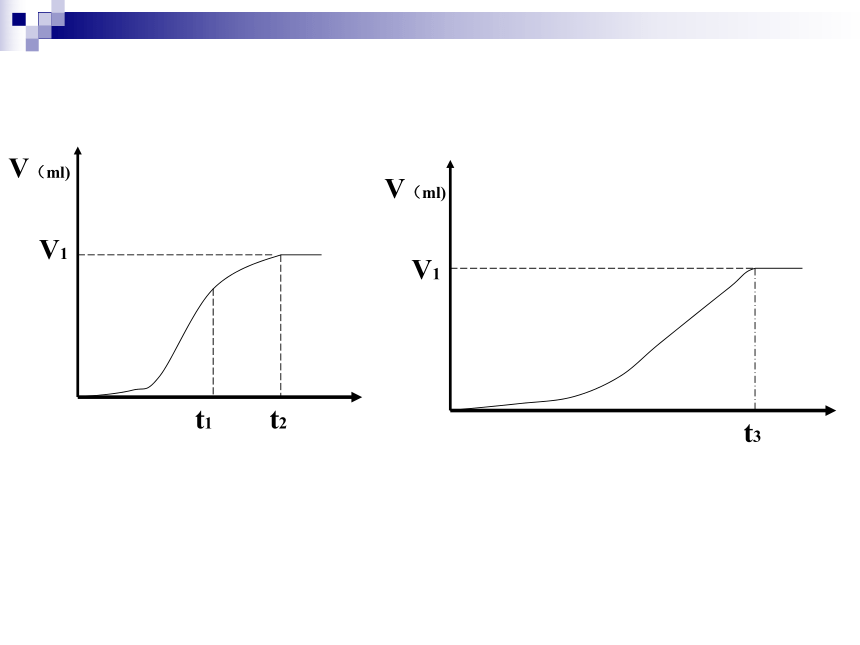
3、同浓度的两种酸的pH值不同说明了什么?4、思考下列图像分别对应哪个现象?一、强电解质和弱电解质1、电离:电解质溶于水(或熔化时)离解为自由移动的离子的过程。(电离吸热)2、强电解质、弱电解质溶质阴离子、阳离子溶质分子、阴阳离子强酸、强碱、绝大数盐、活泼金属氧化物H2O、弱酸、弱碱、个别盐(AlCl3、(CH3COO)2Pb)完全电离部分电离记住:6大强酸,四大强碱!!!!A、溶液的导电能力 B、溶解性
C、电离程度 D、化学键类型 C练习、判断下列物质哪些属于强电解质:
哪些为弱电解质:
A、MgCl2 B、H2S C、Fe(OH)3 D、HCl
E、Ca(OH)2 F、HClO G、KHCO3 H、CaCO3
I、H2O讨论:1、电解质的强弱与其溶解性有无关系?2、强电解质溶液的导电能力一定强于弱电解质溶液吗?
A D E G HB C F I 3、判断强弱电解质的依据是( )溶液导电能力主要取决于离子浓度大小和离子所带的电荷 !3.根据“醋酸比盐酸溶液的导电性弱”可以证明醋酸为弱电解质吗?提示:不可以。溶液的导电性与溶液中自由离子的浓度及离子所带的电荷有关。强电解质的导电性不一定强,弱电解质的导电性不一定弱,但若是相同条件(温度和浓度)下,因HCl为强电解质完全电离,溶液中c(H+)大,所以导电性强,因此可利用相同条件下醋酸比盐酸溶液的导电性弱来证明醋酸为弱电解质。应 用
思 考提示:强、弱电解质的判断标准不是导电能力的强弱,而是看其在水溶液中是否能够完全电离。BaSO4、CaCO3、AgCl这些物质溶解度虽然很小,但溶解的那部分却完全电离,所以是强电解质。4.BaSO4、CaCO3、AgCl等物质均难溶于水,它们的“水溶液”不能导电,它们是强电解质吗?
应 用
思 考要点2 强弱电解质电离方程式的书写
电离方程式的书写如下:
1.强电解质
_______电离,符号用“________”,如HCl===
_____________________________________________________;完全=H++Cl-===CH3COO-+NH + ===Ba2++2OH-部分 CH3COO-+H+NH + +OH- (2)多元弱酸分步电离,以第一步电离为主,如H2CO3:
____________________________________________________________________ ____。
(3)多元弱碱用一步电离表示,如Cu(OH)2:________________________________________________________________________。
H2CO3 H++HCO -HCO- H++CO2 - Cu2++2OH-《学案》P47 三、特殊物质电离方程式的书写例4、变4例1~3、变1~3
熔融状态下,能导电的物质一定是电解质。
2、熔融状态下,不能导电的化合物一定不是电解质
3、溶于水能导电的物质一定是电解质主要包括:酸、碱、盐、金属氧化物、水
如:HCl、NaOH、CaCO3、H2O、 CaO等主要包括:大多数有机物、非金属氧化物、NH3。比如C2H5OH(乙醇)、蔗糖、 SO3 、 CO2等应 用
思 考 1.能导电的物质都是电解质吗?一种化合物不是电解质就是非电解质吗?
提示:电解质概念的前提必须是化合物,像金属单质和电解质溶液均导电,但它们都不是化合物,所以它们既不是电解质,也不是非电解质,如果是一种化合物,它不是电解质就是非电解质。提示:BaSO4难溶于水,因此溶液中离子浓度很小,很难测出其溶液的导电性,但BaSO4熔融时能够导电,所以BaSO4是电解质。2.BaSO4的水溶液几乎不导电,则BaSO4为非电解质,正确吗?应 用
思 考 练习:
把下列物质分类
(1)电解质
(2)非电解质
(3)既不是电解质也不是非电解质
①NaCl固体 ②BaSO4 ③冰醋酸 ④CO2 ⑤Cu
⑥NaOH溶液 ⑦Na2O ⑧NH3·H2O ⑨NH3 ⑩酒精 判断是否为电解质的关键:什么是电离?是否电解质的电离程度都相同?记住常见类型,进行分类判断① ②③⑦⑧④⑨⑩⑤⑥实验3-1:体积相同,浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH值 快慢小大1、上述反应的实质是什么?
2、影响上述反应速率的因素是什么?
3、同浓度的两种酸的pH值不同说明了什么?4、思考下列图像分别对应哪个现象?一、强电解质和弱电解质1、电离:电解质溶于水(或熔化时)离解为自由移动的离子的过程。(电离吸热)2、强电解质、弱电解质溶质阴离子、阳离子溶质分子、阴阳离子强酸、强碱、绝大数盐、活泼金属氧化物H2O、弱酸、弱碱、个别盐(AlCl3、(CH3COO)2Pb)完全电离部分电离记住:6大强酸,四大强碱!!!!A、溶液的导电能力 B、溶解性
C、电离程度 D、化学键类型 C练习、判断下列物质哪些属于强电解质:
哪些为弱电解质:
A、MgCl2 B、H2S C、Fe(OH)3 D、HCl
E、Ca(OH)2 F、HClO G、KHCO3 H、CaCO3
I、H2O讨论:1、电解质的强弱与其溶解性有无关系?2、强电解质溶液的导电能力一定强于弱电解质溶液吗?
A D E G HB C F I 3、判断强弱电解质的依据是( )溶液导电能力主要取决于离子浓度大小和离子所带的电荷 !3.根据“醋酸比盐酸溶液的导电性弱”可以证明醋酸为弱电解质吗?提示:不可以。溶液的导电性与溶液中自由离子的浓度及离子所带的电荷有关。强电解质的导电性不一定强,弱电解质的导电性不一定弱,但若是相同条件(温度和浓度)下,因HCl为强电解质完全电离,溶液中c(H+)大,所以导电性强,因此可利用相同条件下醋酸比盐酸溶液的导电性弱来证明醋酸为弱电解质。应 用
思 考提示:强、弱电解质的判断标准不是导电能力的强弱,而是看其在水溶液中是否能够完全电离。BaSO4、CaCO3、AgCl这些物质溶解度虽然很小,但溶解的那部分却完全电离,所以是强电解质。4.BaSO4、CaCO3、AgCl等物质均难溶于水,它们的“水溶液”不能导电,它们是强电解质吗?
应 用
思 考要点2 强弱电解质电离方程式的书写
电离方程式的书写如下:
1.强电解质
_______电离,符号用“________”,如HCl===
_____________________________________________________;完全=H++Cl-===CH3COO-+NH + ===Ba2++2OH-部分 CH3COO-+H+NH + +OH- (2)多元弱酸分步电离,以第一步电离为主,如H2CO3:
____________________________________________________________________ ____。
(3)多元弱碱用一步电离表示,如Cu(OH)2:________________________________________________________________________。
H2CO3 H++HCO -HCO- H++CO2 - Cu2++2OH-《学案》P47 三、特殊物质电离方程式的书写例4、变4例1~3、变1~3
