弱电解质的电离平衡
图片预览






文档简介
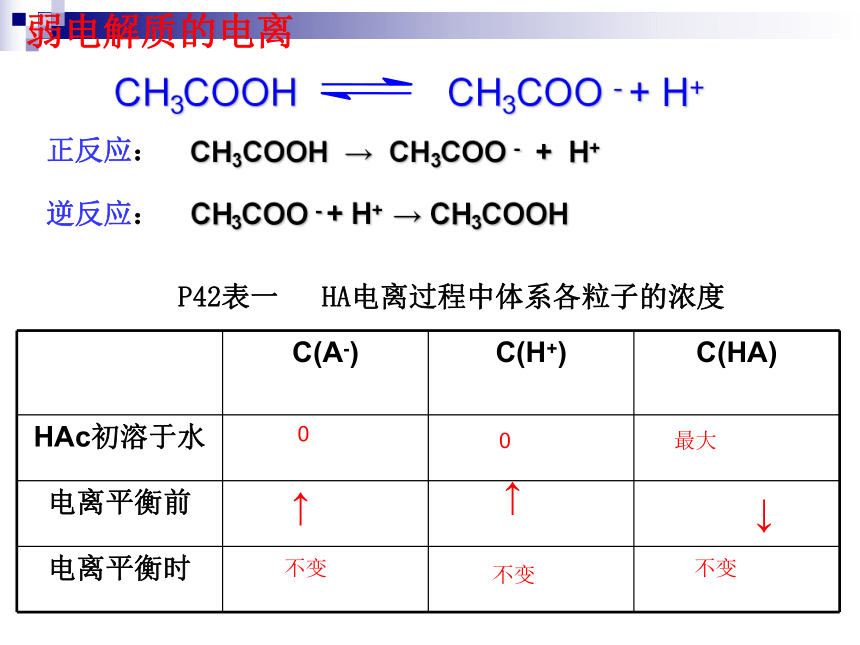
课件18张PPT。第一节 弱电解质的电离【课堂练习】请写出H2SO4、、HClO、H2CO3、H3PO4 Ba(OH)2、 Cu(OH)2在水溶液中的电离方程式。 CH3COOH CH3COO - + H+弱电解质的电离 CH3COO - + H+ → CH3COOH CH3COOH → CH3COO - + H+正反应:逆反应:P42表一 HA电离过程中体系各粒子的浓度最大00↑↑↓不变不变不变电离平衡状态建立反应速率V(电离)V(结合)V(电离) = V(结合) 电离平衡状态弱电解质电离平衡状态建立示意图时间弱电解质达到平衡后,还会继续电离吗?电离平衡 1.定义:2.特点: 在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态—动 电离平衡是一种动态平衡 定 条件不变,溶液中各种分子、离子的浓度不变,溶液里既有离子又有分子 变 条件改变时,电离平衡发生移动。 等 V电离=V结合= 0逆 弱电解质的电离是可逆的电离平衡和化学平衡一样,当外界条件改变时符合勒沙特列原理。二、弱电解质的电离平衡D3.影响电离平衡的因素温度:电离过程是吸热过程,温度越高,K越大,平衡向电离方向移动浓度:弱电解质浓度越大,平衡正移,但电离程度变小。加水稀释,电离平衡向电离方向移动,电离程度增大。加入其它电解质:②外因加入与弱电解质电离出的离子相同的离子,电离平衡逆向移动,电离程度减小加入与弱电解质电离出的离子反应的离子,电离平衡正向移动,电离程度增大①内因:电解质的本性。电解质越弱,电离程度越小。“越热越电离”“越稀越电离”“同离子效应”“离子反应效应”平衡移动规律— 勒沙特列原理加相同浓度的醋酸溶液外界条件对电离平衡的影响:正向移动↑↑↓↑↑逆向移动↑↓↑↑↓正向移动↓↑↓↓↑逆向移动↓↑↑↓↓正向移动↑↑↑↑↓正向移动↓↓↓↑↑不移动不变不变不变↑不变左右右右左左不移动↑↑↑↑↑↑↓↓↓↓↓↓↓不变【例?】 在CH3COOH??CH3COO-+H+的电离平衡中,要使电离平衡右移,且pH减小,应采取的措施( )
A.加NaOH(s) B.加浓盐酸
C.加蒸馏水 D.加热D【例?】 将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )
A.CH3COOH电离程度变大
B.溶液pH减小
C.溶液的导电能力减弱
D.溶液中c(H+)减小D电离平衡常数1、概念
在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是 一个常数,这个常数叫电离平衡常数
通常用K表示。酸用Ka表示,碱用Kb表示2、表示方法AB A+ + B-练习:
写出HAc (醋酸简写)、
NH3·H2O的电离平衡常数的表达式注:c 指平衡时各组分的浓度;K无单位K只受温度影响。相同温度下,弱酸(碱)的电离平衡常数越大,其酸(碱)性越强。填空:1、电离平衡常数K值越大,表示弱电解质的电离程度______ 。
2、电离平衡常数的意义:判断弱酸、弱碱的相对强弱。当温度相同时,弱酸的K值越大,则弱酸酸性_____。
3、温度升高电离平衡常数____,浓度改变电离常数_______。越大越强变大不变左右右右左左不移动↑↑↑↑↑↑↓↓↓↓↓↓↓不变P49 应用思考:变2中K的变化情况K只受温度影响。B解析:电离平衡常数越大,电离程度越大,同浓度时,电离产生的c(H+)越大,pH越小。下表是常见弱酸的电离平衡常数(25℃) CH3COOH ? CH3COO-+H+K=1.76×10-5H2S ? H++HS-HCO3- ? H++ CO32-K1=4.31×10-7H2CO3 ? H++HCO3-HS- ? H++ S2-K2=1.1×10-12H3PO4 ? H++H2PO4-H2PO4 ? H++HPO42-HPO4 ? H++PO43-K2=6.23×10-8K3=2.2×10-13 K2=5.61×10-11K1=9.1×10-8K1=7.5×10-3多元弱酸的电离:第一步电离产生的H+对第二步、第三步电离产生抑制,一般K1 》?K2 》??K3 ,
所以多元弱酸(弱碱)分步电离,酸性(碱性)主要由第一步电离决定 作业金榜学案P51 例3;P52 例4,变4
课时训练1-10,下节课评讲
明早交第二章综合练习卷!
A.加NaOH(s) B.加浓盐酸
C.加蒸馏水 D.加热D【例?】 将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )
A.CH3COOH电离程度变大
B.溶液pH减小
C.溶液的导电能力减弱
D.溶液中c(H+)减小D电离平衡常数1、概念
在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是 一个常数,这个常数叫电离平衡常数
通常用K表示。酸用Ka表示,碱用Kb表示2、表示方法AB A+ + B-练习:
写出HAc (醋酸简写)、
NH3·H2O的电离平衡常数的表达式注:c 指平衡时各组分的浓度;K无单位K只受温度影响。相同温度下,弱酸(碱)的电离平衡常数越大,其酸(碱)性越强。填空:1、电离平衡常数K值越大,表示弱电解质的电离程度______ 。
2、电离平衡常数的意义:判断弱酸、弱碱的相对强弱。当温度相同时,弱酸的K值越大,则弱酸酸性_____。
3、温度升高电离平衡常数____,浓度改变电离常数_______。越大越强变大不变左右右右左左不移动↑↑↑↑↑↑↓↓↓↓↓↓↓不变P49 应用思考:变2中K的变化情况K只受温度影响。B解析:电离平衡常数越大,电离程度越大,同浓度时,电离产生的c(H+)越大,pH越小。下表是常见弱酸的电离平衡常数(25℃) CH3COOH ? CH3COO-+H+K=1.76×10-5H2S ? H++HS-HCO3- ? H++ CO32-K1=4.31×10-7H2CO3 ? H++HCO3-HS- ? H++ S2-K2=1.1×10-12H3PO4 ? H++H2PO4-H2PO4 ? H++HPO42-HPO4 ? H++PO43-K2=6.23×10-8K3=2.2×10-13 K2=5.61×10-11K1=9.1×10-8K1=7.5×10-3多元弱酸的电离:第一步电离产生的H+对第二步、第三步电离产生抑制,一般K1 》?K2 》??K3 ,
所以多元弱酸(弱碱)分步电离,酸性(碱性)主要由第一步电离决定 作业金榜学案P51 例3;P52 例4,变4
课时训练1-10,下节课评讲
明早交第二章综合练习卷!
