第二节 化学电源
图片预览




文档简介
课件17张PPT。普通干电池手机电池钮扣电池笔记本电脑
专用电池 摄像机
专用电池 “神六”用
太阳能电池第二节 化学电源
普宁市华侨中学
庄秀文 黄钢标课程标准导航
1.了解化学电源的种类及其工作原理,知道化学电源在生产、生活和国防中的实际应用。
2.认识化学能与电能相互转化的实际意义及其重要作用。
3.掌握一次电池、二次电池、燃料电池的反应原理,会书写电极反应式。
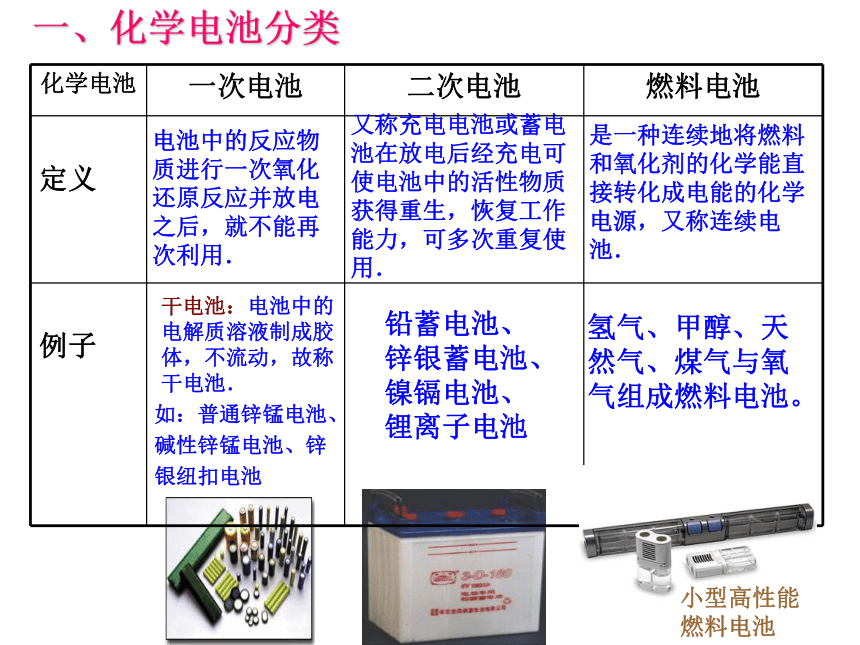
一、化学电池分类电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用.又称充电电池或蓄电池在放电后经充电可使电池中的活性物质获得重生,恢复工作能力,可多次重复使用.是一种连续地将燃料和氧化剂的化学能直接转化成电能的化学电源,又称连续电池.干电池: 电池中的电解质溶液制成胶体,不流动,故称干电池.铅蓄电池、
锌银蓄电池、
镍镉电池、
锂离子电池
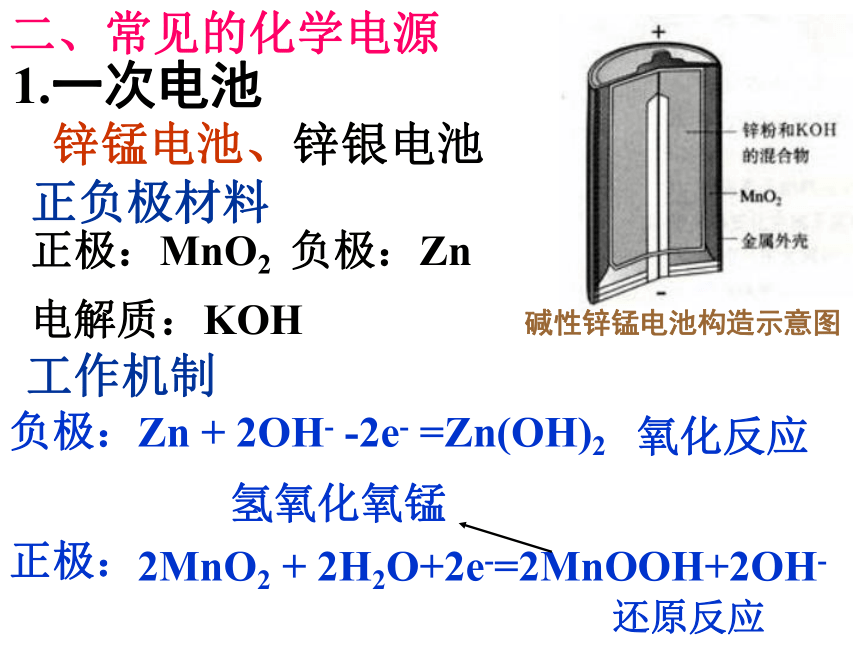
氢气、甲醇、天然气、煤气与氧气组成燃料电池。如:普通锌锰电池、碱性锌锰电池、锌银纽扣电池小型高性能燃料电池 1.一次电池锌锰电池、锌银电池正负极材料正极:MnO2负极:Zn工作机制负极:Zn + 2OH- -2e- =Zn(OH)2正极:2MnO2 + 2H2O+2e-=2MnOOH+2OH-氢氧化氧锰碱性锌锰电池构造示意图 氧化反应 还原反应电解质:KOH二、常见的化学电源总反应:Zn + 2MnO2 + 2H2O =2MnOOH+Zn(OH)2优缺点简析缺点:多数只能一次使用,不能充电;价格较贵优点: 比能量和储存时间有所提高,适用于大电流
和连续放电典例1(江苏高考)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是
A? 电池工作时,锌失去电子
B? 电池正极电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路中每通过0?2 mol电子,锌的质量理论上减小6?5 g C锌银电池(纽扣电池:Zn-Ag2O-KOH)正极:Ag2O + H2O+ 2e- =2Ag+2OH-负极:Zn +2OH- —2e- =ZnO+H2O总反应: Zn+Ag2O=ZnO+2Ag2.二次电池铅蓄电池、镍镉电池、镍氢电池、锂离子电池……铅蓄电池正负极材料正极:PbO2负极:Pb工作机制电解质:H2SO4溶液铅蓄电池为典型的可充电电池,其电极反应分为放电和充电两个过程放电过程总反应:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l) Pb(s) + SO42- (aq)-2e- =PbSO4 (s)正极:PbO2(s) + 4H+(aq)+SO42- (aq)+2e- =2PbSO4 (s)
+2H2O(l) 氧化反应 还原反应负极:①放电过程铅蓄电池充电的反应则是上述反应的逆过程2PbSO4(s)+2H2O(l) Pb(s)+PbO2(s)+2H2SO4(aq)①充电过程PbSO4 (s) +2e- =Pb(s) + SO42- (aq) 还原反应阴极:阳极:2PbSO4 (s)+2H2O(l) -2e- = PbO2(s) + H+(aq)
+ SO42-(aq)
氧化反应接电源负极接电源正极充电过程总反应:2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq)铅蓄电池的充放电过程:1.铁镍蓄电池又称爱迪生电池,放电时的总反应为
Fe(OH)2+2Ni(OH)2 Fe+Ni2O3+3H2O 下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为
Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为
2Ni(OH)2+2OH--2e-===Ni2O3+3H2O能力提升1C3.燃料电池氢氧燃料电池,烃、肼、甲醇、氨、煤气燃料电池……酸性氢氧燃料电池1、正负极材料正极室:通氧气负极室:通氢气电解质:H2SO4溶液(氧化剂)(燃料)使用铂电极2、工作机制2H2 - 4e- = 2H+负极:正极:O2 + 4H+ +4e- = 2H2O总反应:2H2 + O2 = 2H2O3、优缺点简析缺点:体积较大、附属设备较多优点:能量转换率高、清洁、对环境友好其它燃料电池三、电极反应式的书写总式【小组协作学习】
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、甲醇等。
(1)请写出将图中的甲烷燃料电池中
a极的电极反应式
b极的电极反应式
此时电池内总的反应式:
(2)如果把电解质溶液改为稀硫酸,写出电极反应式
典例3 如图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2—→2CO2+4H2O。下列说法正确的是
A.左电极为电池的负极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通人的物质的空气
C.负极反应式为:CH3OH+H2O-6e → CO2十6H+
D.正极反应式为:O2+2H2O十4e-→ 4OH-作业:完成《全优课堂》75—77页
专用电池 摄像机
专用电池 “神六”用
太阳能电池第二节 化学电源
普宁市华侨中学
庄秀文 黄钢标课程标准导航
1.了解化学电源的种类及其工作原理,知道化学电源在生产、生活和国防中的实际应用。
2.认识化学能与电能相互转化的实际意义及其重要作用。
3.掌握一次电池、二次电池、燃料电池的反应原理,会书写电极反应式。
一、化学电池分类电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用.又称充电电池或蓄电池在放电后经充电可使电池中的活性物质获得重生,恢复工作能力,可多次重复使用.是一种连续地将燃料和氧化剂的化学能直接转化成电能的化学电源,又称连续电池.干电池: 电池中的电解质溶液制成胶体,不流动,故称干电池.铅蓄电池、
锌银蓄电池、
镍镉电池、
锂离子电池
氢气、甲醇、天然气、煤气与氧气组成燃料电池。如:普通锌锰电池、碱性锌锰电池、锌银纽扣电池小型高性能燃料电池 1.一次电池锌锰电池、锌银电池正负极材料正极:MnO2负极:Zn工作机制负极:Zn + 2OH- -2e- =Zn(OH)2正极:2MnO2 + 2H2O+2e-=2MnOOH+2OH-氢氧化氧锰碱性锌锰电池构造示意图 氧化反应 还原反应电解质:KOH二、常见的化学电源总反应:Zn + 2MnO2 + 2H2O =2MnOOH+Zn(OH)2优缺点简析缺点:多数只能一次使用,不能充电;价格较贵优点: 比能量和储存时间有所提高,适用于大电流
和连续放电典例1(江苏高考)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是
A? 电池工作时,锌失去电子
B? 电池正极电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路中每通过0?2 mol电子,锌的质量理论上减小6?5 g C锌银电池(纽扣电池:Zn-Ag2O-KOH)正极:Ag2O + H2O+ 2e- =2Ag+2OH-负极:Zn +2OH- —2e- =ZnO+H2O总反应: Zn+Ag2O=ZnO+2Ag2.二次电池铅蓄电池、镍镉电池、镍氢电池、锂离子电池……铅蓄电池正负极材料正极:PbO2负极:Pb工作机制电解质:H2SO4溶液铅蓄电池为典型的可充电电池,其电极反应分为放电和充电两个过程放电过程总反应:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l) Pb(s) + SO42- (aq)-2e- =PbSO4 (s)正极:PbO2(s) + 4H+(aq)+SO42- (aq)+2e- =2PbSO4 (s)
+2H2O(l) 氧化反应 还原反应负极:①放电过程铅蓄电池充电的反应则是上述反应的逆过程2PbSO4(s)+2H2O(l) Pb(s)+PbO2(s)+2H2SO4(aq)①充电过程PbSO4 (s) +2e- =Pb(s) + SO42- (aq) 还原反应阴极:阳极:2PbSO4 (s)+2H2O(l) -2e- = PbO2(s) + H+(aq)
+ SO42-(aq)
氧化反应接电源负极接电源正极充电过程总反应:2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq)铅蓄电池的充放电过程:1.铁镍蓄电池又称爱迪生电池,放电时的总反应为
Fe(OH)2+2Ni(OH)2 Fe+Ni2O3+3H2O 下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为
Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为
2Ni(OH)2+2OH--2e-===Ni2O3+3H2O能力提升1C3.燃料电池氢氧燃料电池,烃、肼、甲醇、氨、煤气燃料电池……酸性氢氧燃料电池1、正负极材料正极室:通氧气负极室:通氢气电解质:H2SO4溶液(氧化剂)(燃料)使用铂电极2、工作机制2H2 - 4e- = 2H+负极:正极:O2 + 4H+ +4e- = 2H2O总反应:2H2 + O2 = 2H2O3、优缺点简析缺点:体积较大、附属设备较多优点:能量转换率高、清洁、对环境友好其它燃料电池三、电极反应式的书写总式【小组协作学习】
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、甲醇等。
(1)请写出将图中的甲烷燃料电池中
a极的电极反应式
b极的电极反应式
此时电池内总的反应式:
(2)如果把电解质溶液改为稀硫酸,写出电极反应式
典例3 如图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2—→2CO2+4H2O。下列说法正确的是
A.左电极为电池的负极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通人的物质的空气
C.负极反应式为:CH3OH+H2O-6e → CO2十6H+
D.正极反应式为:O2+2H2O十4e-→ 4OH-作业:完成《全优课堂》75—77页
