第三节 盐类的水解
图片预览







文档简介
课件21张PPT。练一练:25oC时,pH=5的NH4Cl溶液与pH=5的HCl溶液中,由水电离的c(H+)之比是
( )
A、104:1 B、10-5:1
C、1:1 D、109:1A第三章 水溶液中的离子平衡第三节 盐类的水解
(第二课时)在等浓度的Na2CO3和NaHCO3溶液中各滴加两滴酚酞。 ①根据现象判断:
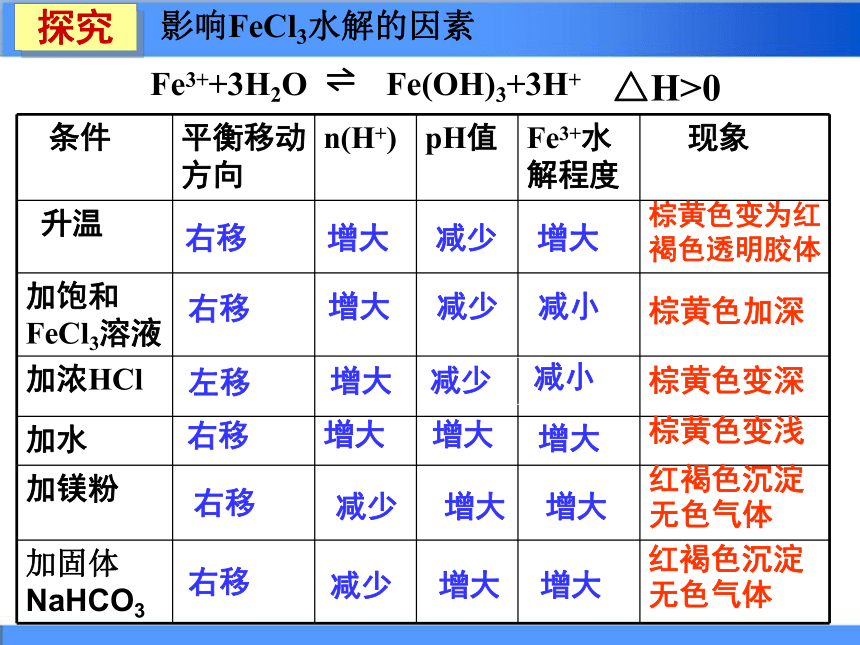
溶液碱性:________>________水解程度:________>________ Na2CO3NaHCO3Na2CO3NaHCO3一、影响盐类水解的因素盐本身的性质(1)盐的离子对应的酸或碱越弱,则水解程度越大。(2)正盐离子比其对应酸式盐离子的水解程度大。1、内因:1、相同物质的量浓度的NaX、NaY、NaZ三种溶液的pH分别为7、8、9,则相同物质的量浓度的 HX、HY、HZ的酸性强弱顺序为 。HX>HY>HZ 2、已知K(HNO3) > K(CH3COOH) > K(HClO), 请推测 NaClO、CH3COONa、NaNO3溶液pH由 大到小的顺序是: 。NaClO > CH3COONa > NaNO3减少右移右移右移右移左移增大增大增大增大减少减少减少增大减小增大增大减小增大增大棕黄色变为红褐色透明胶体棕黄色加深 棕黄色变浅红褐色沉淀
无色气体棕黄色变深探究Fe3++3H2O ? Fe(OH)3+3H+ 影响FeCl3水解的因素右移减少增大增大红褐色沉淀
无色气体△H>02、外因——符合勒夏特列原理1、温度:2、浓度:3、外加酸、碱溶液越稀,水解程度越大.水解反应是吸热过程,升温促进水解越弱越水解,越热越水解,越稀越水解P69
要点一水解呈酸性的盐溶液,加碱会促进水解,加酸会抑制水解,反之亦然。4、外加盐加入与盐的水解性质相反的盐会促进盐的水解。有些甚至“双水解”例:FeCl3溶液与NaHCO3溶液反应水解的相互促进——双水解Fe3++3H2O ? Fe(OH)3+3H+
HCO3-+H2O ? H2CO3 +OH-总式:Fe3+ + 3HCO3- = Fe (OH)3↓+3CO2↑以上为“完全双水解”,进行得非常彻底,故用“=”
连接,且打上了“↑”、“↓ ”符号。但并不是所有
的弱酸弱碱盐水解都能进行“完全双水解”。
如:(NH4)2CO3 、NH4HCO3、CH3COONH4常见完全双水解(生成难溶物)
Al3+与AlO2-、HCO3-、CO32-、S2-、HS-、ClO-
Fe3+与AlO2-、HCO3-、CO32-
NH4+与SiO32-P67 右下角
特别提示(3)1、为什么纯碱可去污,热纯碱水去油污能力更强? 油脂可以在碱性条件下水解,碱性越强,油污更易水解除去。CO32-+H2O HCO3- +OH- ΔH>0HCO3-+H2O H2CO3 +OH- ΔH>0二、盐类水解的应用 P69
要点二,1《农业谚语》
人粪尿,
草木灰,
都是庄稼好粪肥.
灰混粪,
粪混灰,
粪灰相混损粪肥.
要保粪灰有肥分,
灰别混粪,
粪别混灰2、草木灰不宜与铵态氮肥混合施用 草木灰的成分:K2CO3,水解呈碱性CO32-+H2O HCO3- +OH-HCO3-+H2O H2CO3 +OH-铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+,混施后,两种盐双水解,以至生成大量的NH3·H2O,进一步分解成NH3逸出,从而降低肥效。“粪灰相混损粪肥”P69
要点二,23、如何配制和保存易水解的盐溶液?Cu2++2H2O ? Cu(OH)2+2H+问题1:配制CuCl2溶液,为防止出现浑浊,应加少量的______ 稀盐酸配制Fe2(SO4)3溶液,要先加少量的 。注意:配制易水解的金属盐溶液应加少量的______________同种酸问题2:盛放Na2S 、Na2CO3的试剂瓶能否用玻璃塞?稀H2SO4P69
要点二,3P69 应用思考1, 24、明矾 [或Al2(SO4)3] 的净水原理?Al3++3H2O Al(OH)3(胶体)+3H+二、盐类水解的应用 P69
要点二,45、泡沫灭火器的原理——应用双水解Al3++3H2O Al(OH)3+3H+
HCO3-+H2O H2CO3 +OH-外:NaHCO3溶液内:Al2(SO4)3溶液总式:Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑P69
要点二,5 教材P58
如用TiCl4制备TiO2的反应可表示如下:
TiCl4+(x+2)H2O(过量) TiO2·xH2 O + 4HCl
制备时加入大量的水,同时加热。
类似的方法可用来制备SnO 、SnO2、 Sn2O3、Sb2O3。6、利用盐类的水解制备某些氧化物P69
要点二,67、加热蒸发可水解的盐溶液得到的产物 思考1:把FeCl3溶液蒸干灼烧,最后得到的固体产物是Fe2O3为什么? Al2(SO4)3溶液加热蒸发后得到固体又是什么?FeCl3+3H2O Fe(OH)3+3HCl(1)加热促进水解
(2)HCl挥发由于H2SO4是高沸点酸,不易挥发,加热最终只是把水蒸去,因此仍得Al2(SO4)3固体。 Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4思考2:如何从FeCl3溶液制得FeCl3固体呢?在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解。P70 五8、除杂为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氨水 B.氢氧化钠
C. 碳酸钠 D. 碳酸镁 D9、金属镁与水反应比较困难,若加一些NH4Cl马上产生大量气体?为什么?总方程式:
Mg+2NH4Cl=MgCl2+2NH3 ↑ +2H2 ↑ “焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。(即用“焊药”除铁锈)NH4++H2O NH3?H2O + H+Mg+ 2H+ = Mg2+ + H2↑水解反应的平衡常数叫做水解平衡常数或水解常数,用Kh表示。
Kh=Kw/Ka或Kh=Kw/Kb;
K数值越大,水解趋势越大。水解平衡常数 Kh(课本P58)ANa+ Cl-NH4+HSO4-HCO3-作业:《学案》P70-71 5、7、10先不做,明天课前查!
( )
A、104:1 B、10-5:1
C、1:1 D、109:1A第三章 水溶液中的离子平衡第三节 盐类的水解
(第二课时)在等浓度的Na2CO3和NaHCO3溶液中各滴加两滴酚酞。 ①根据现象判断:
溶液碱性:________>________水解程度:________>________ Na2CO3NaHCO3Na2CO3NaHCO3一、影响盐类水解的因素盐本身的性质(1)盐的离子对应的酸或碱越弱,则水解程度越大。(2)正盐离子比其对应酸式盐离子的水解程度大。1、内因:1、相同物质的量浓度的NaX、NaY、NaZ三种溶液的pH分别为7、8、9,则相同物质的量浓度的 HX、HY、HZ的酸性强弱顺序为 。HX>HY>HZ 2、已知K(HNO3) > K(CH3COOH) > K(HClO), 请推测 NaClO、CH3COONa、NaNO3溶液pH由 大到小的顺序是: 。NaClO > CH3COONa > NaNO3减少右移右移右移右移左移增大增大增大增大减少减少减少增大减小增大增大减小增大增大棕黄色变为红褐色透明胶体棕黄色加深 棕黄色变浅红褐色沉淀
无色气体棕黄色变深探究Fe3++3H2O ? Fe(OH)3+3H+ 影响FeCl3水解的因素右移减少增大增大红褐色沉淀
无色气体△H>02、外因——符合勒夏特列原理1、温度:2、浓度:3、外加酸、碱溶液越稀,水解程度越大.水解反应是吸热过程,升温促进水解越弱越水解,越热越水解,越稀越水解P69
要点一水解呈酸性的盐溶液,加碱会促进水解,加酸会抑制水解,反之亦然。4、外加盐加入与盐的水解性质相反的盐会促进盐的水解。有些甚至“双水解”例:FeCl3溶液与NaHCO3溶液反应水解的相互促进——双水解Fe3++3H2O ? Fe(OH)3+3H+
HCO3-+H2O ? H2CO3 +OH-总式:Fe3+ + 3HCO3- = Fe (OH)3↓+3CO2↑以上为“完全双水解”,进行得非常彻底,故用“=”
连接,且打上了“↑”、“↓ ”符号。但并不是所有
的弱酸弱碱盐水解都能进行“完全双水解”。
如:(NH4)2CO3 、NH4HCO3、CH3COONH4常见完全双水解(生成难溶物)
Al3+与AlO2-、HCO3-、CO32-、S2-、HS-、ClO-
Fe3+与AlO2-、HCO3-、CO32-
NH4+与SiO32-P67 右下角
特别提示(3)1、为什么纯碱可去污,热纯碱水去油污能力更强? 油脂可以在碱性条件下水解,碱性越强,油污更易水解除去。CO32-+H2O HCO3- +OH- ΔH>0HCO3-+H2O H2CO3 +OH- ΔH>0二、盐类水解的应用 P69
要点二,1《农业谚语》
人粪尿,
草木灰,
都是庄稼好粪肥.
灰混粪,
粪混灰,
粪灰相混损粪肥.
要保粪灰有肥分,
灰别混粪,
粪别混灰2、草木灰不宜与铵态氮肥混合施用 草木灰的成分:K2CO3,水解呈碱性CO32-+H2O HCO3- +OH-HCO3-+H2O H2CO3 +OH-铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+,混施后,两种盐双水解,以至生成大量的NH3·H2O,进一步分解成NH3逸出,从而降低肥效。“粪灰相混损粪肥”P69
要点二,23、如何配制和保存易水解的盐溶液?Cu2++2H2O ? Cu(OH)2+2H+问题1:配制CuCl2溶液,为防止出现浑浊,应加少量的______ 稀盐酸配制Fe2(SO4)3溶液,要先加少量的 。注意:配制易水解的金属盐溶液应加少量的______________同种酸问题2:盛放Na2S 、Na2CO3的试剂瓶能否用玻璃塞?稀H2SO4P69
要点二,3P69 应用思考1, 24、明矾 [或Al2(SO4)3] 的净水原理?Al3++3H2O Al(OH)3(胶体)+3H+二、盐类水解的应用 P69
要点二,45、泡沫灭火器的原理——应用双水解Al3++3H2O Al(OH)3+3H+
HCO3-+H2O H2CO3 +OH-外:NaHCO3溶液内:Al2(SO4)3溶液总式:Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑P69
要点二,5 教材P58
如用TiCl4制备TiO2的反应可表示如下:
TiCl4+(x+2)H2O(过量) TiO2·xH2 O + 4HCl
制备时加入大量的水,同时加热。
类似的方法可用来制备SnO 、SnO2、 Sn2O3、Sb2O3。6、利用盐类的水解制备某些氧化物P69
要点二,67、加热蒸发可水解的盐溶液得到的产物 思考1:把FeCl3溶液蒸干灼烧,最后得到的固体产物是Fe2O3为什么? Al2(SO4)3溶液加热蒸发后得到固体又是什么?FeCl3+3H2O Fe(OH)3+3HCl(1)加热促进水解
(2)HCl挥发由于H2SO4是高沸点酸,不易挥发,加热最终只是把水蒸去,因此仍得Al2(SO4)3固体。 Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4思考2:如何从FeCl3溶液制得FeCl3固体呢?在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解。P70 五8、除杂为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氨水 B.氢氧化钠
C. 碳酸钠 D. 碳酸镁 D9、金属镁与水反应比较困难,若加一些NH4Cl马上产生大量气体?为什么?总方程式:
Mg+2NH4Cl=MgCl2+2NH3 ↑ +2H2 ↑ “焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。(即用“焊药”除铁锈)NH4++H2O NH3?H2O + H+Mg+ 2H+ = Mg2+ + H2↑水解反应的平衡常数叫做水解平衡常数或水解常数,用Kh表示。
Kh=Kw/Ka或Kh=Kw/Kb;
K数值越大,水解趋势越大。水解平衡常数 Kh(课本P58)ANa+ Cl-NH4+HSO4-HCO3-作业:《学案》P70-71 5、7、10先不做,明天课前查!
