江苏省苏州市第三中学校2024-2025学年高二上学期10月月考化学试题(PDF版,无答案)
文档属性
| 名称 | 江苏省苏州市第三中学校2024-2025学年高二上学期10月月考化学试题(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 819.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-11 07:33:37 | ||
图片预览


文档简介
2024-2025学年第一学期高二化学十月采点
相对原子质量:Li 7
一、单项单选题:本部分包括 13 题,每题 3 分,共计 39 分。每题只有一个选项最符合题意。
1.“碳达峰、碳中和”事关中华民族永续发展和构建人类命运共同体。下列措施对实现“碳达峰、
碳中和”不.具有直接贡献的是
A.植树造林 B.开发核能 C.燃煤脱硫 D.节约用电
2.最新报道:科学家首次用 X 射线激光技术观察到 CO 与 O 在催化剂表面形成化学键的过程。
反应过程的示意图如下:
下列说法正确的是
A.CO 和 O 生成 CO2是吸热反应
B.在该过程中,CO 断键形成 C 和 O
C.CO 和 O 生成了具有共价键的 CO2
D.状态Ⅰ→状态Ⅲ表示 CO 与 O2 反应的过程
3.下列说法正确的是
-1
A.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-801.3 kJ·mol
-
结论:CH4的燃烧热为
1
801.3 kJ·mol
1
B.Sn(灰,s) Sn(白,s) ΔH=+ -2.1 kJ·mol (灰锡为粉末状)
结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
+ - -
C.稀溶液中有: 1H (aq)+OH (aq)===H2O(l) ΔH=-57.3 kJ·mol
结论:将盐酸与氨水的稀溶液混合后,若生成 1 mol H2O,则会放出 57.3 kJ 的能量
-
D.C(石墨, + 1s) O2(g)===CO2(g) ΔH=-393.5 kJ·mol
-
C(金刚石,s)+ 1O2(g)===CO2(g) ΔH=-395 kJ·mol
结论:相同条件下金刚石比石墨稳定
4.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
-
① 1C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol
-
② 1CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol
{#{QQABZYQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
-
③ 1CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol
-
④ 12CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol
A.反应①、②为反应③提供原料气
B.反应③也是 CO2资源化利用的方法之一
1 1 d -
C.反应 1CH3OH(g)=== CH3OCH3(g)+ H2O(l)的 ΔH= kJ·mol 2 2 2
-
D.反应 12CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的 ΔH=(2b+2c+d) kJ·mol
5.断裂 1 mol 化学键所需的能量如下:
化学键 N—N O==O N≡N N—H
-
键能 1/kJ·mol 154 500 942 a
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如
图所示, 则下列说法错误的是
A.N2比 O2稳定
B.N2H4(g)+O2(g)===N2(g)+2H2O(g)
-
ΔH=- 1534 kJ·mol
C.表中的 a=194
-
D.图中的 1ΔH3=+2 218 kJ·mol
+ +
6.实验发现, 3298 K 时,在氯化铁酸性溶液中加少量锌粒后,Fe 立即被还原成 2Fe 。某夏令营
兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说
法正确的是
- +
A.该原电池的正极反应是 2Zn-2e ===Zn
B.左烧杯中溶液的红色逐渐褪去
C.该电池铂电极上立即有气泡出现
+ +
D.该电池总反应为 + 3 + 23Zn 2Fe ===2Fe 3Zn
7.某种熔融碳酸盐燃料电池以 Li2CO3、K2CO3 为电解质、以 CH4 为燃料时,该电池工作原理如
图。下列说法正确的是
A.a 为 CH4,b 为 CO2
2
B. -CO3 向正极移动
C.此电池在常温下也能工作
2
D.正极的电极反应式:O2+2CO2+
- -
4e ===2CO3
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
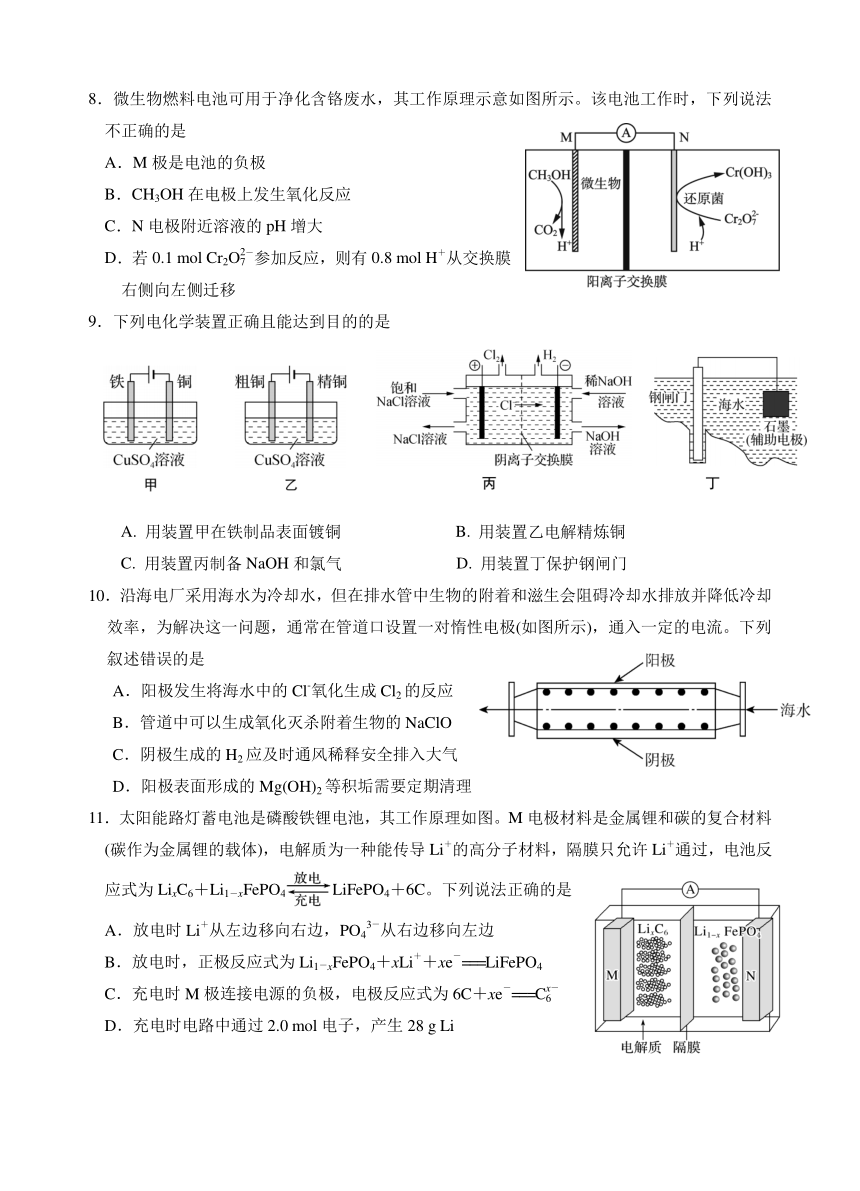
8.微生物燃料电池可用于净化含铬废水,其工作原理示意如图所示。该电池工作时,下列说法
不正确的是
A.M 极是电池的负极
B.CH3OH 在电极上发生氧化反应
C.N 电极附近溶液的 pH 增大
2
D.若 - +0.1 mol Cr2O7 参加反应,则有 0.8 mol H 从交换膜
右侧向左侧迁移
9.下列电化学装置正确且能达到目的的是
A. 用装置甲在铁制品表面镀铜 B. 用装置乙电解精炼铜
C. 用装置丙制备 NaOH 和氯气 D. 用装置丁保护钢闸门
10.沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却
效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列
叙述错误的是
A.阳极发生将海水中的 -Cl 氧化生成 Cl2 的反应
B.管道中可以生成氧化灭杀附着生物的 NaClO
C.阴极生成的 H2 应及时通风稀释安全排入大气
D.阳极表面形成的 Mg(OH)2 等积垢需要定期清理
11.太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M 电极材料是金属锂和碳的复合材料
(碳作为金属锂的载体),电解质为一种能传导 +Li 的高分子材料,隔膜只允许 +Li 通过,电池反
应式为 LixC6+Li1-xFePO4 LiFePO4+6C。下列说法正确的是
+
.放电时 从左边移向右边, 3
-
A Li PO4 从右边移向左边
+ -
B.放电时,正极反应式为 Li1-xFePO4+xLi +xe ===LiFePO4
- -
C.充电时 M 极连接电源的负极,电极反应式为 6C+ xxe ===C6
D.充电时电路中通过 2.0 mol 电子,产生 28 g Li
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
12.用甲醚(CH3OCH3)燃料电池电解 Na2SO4 溶液制取 NaOH 溶液和硫酸的装置如下图所示。下
列说法正确的是
+
A.通入甲醚的电极反应式为 -CH3OCH3+12e +3H2O=2CO2↑+12H
B.膜 a、膜 b 依次为阳离子交换膜和阴离子交换膜
C.M 为硫酸、N 为 NaOH
D.反应的甲醚与生成气体 Y 的物质的量之比为 1:3
13.有机物 Z 是合成药物的中间体,Z 的合成路线如下。下列说法正确的是
A.1 mol X 最多能与 2 mol NaOH 反应
B.Y 不存在顺反异构体
C.Z 分子中含有 2 个手性碳原子
D.可以用 NaHCO3溶液鉴别化合物 Y 和 Z
二、非选择题:共 4 题,共 61 分。
+ -
14.(12 分)(1)在微生物作用的条件下,NH4 经过两步反应被氧化成 NO3 。两步反应的能量变
化示意如图:
①第一步反应是_______(填“放热”或“吸热”)反应,判断依据是____________________。
+ -
②1 mol NH4 (aq)全部氧化成 NO3 (aq)的热化学方程式是___________________________。
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
(2)已知:
-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol ①
1 -1
Na2O2(s)+CO2(g)===Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol ② 2
则 CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,生成的 O2为______________L(标况)。
(3)有科学家预言,氢能将成为 21 世纪的主要能源,而且是一种理想的绿色能源。若 1 mol 氢
-
气完全燃烧生成 1 mol 气态水放出 241 kJ 的热量,已知 H—O 键能为 1463 kJ·mol ,O==O 键能为
-1 -1
498 kJ·mol ,计算 H—H 键能为__________________kJ·mol 。
(4)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金 Mg2Ni,已知:
-1
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5 kJ·mol ;
-1
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2=-64.4 kJ·mol ;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3。
-
则 1ΔH3=________kJ·mol 。
15.(18 分)(1)通过电化学循环法可将 H2S 转化为 H2SO4 和 H2(如图所示)。其中氧化过程发生
如下两步反应:H2S+H2SO4===SO2↑+S↓+2H2O、S+O2===SO2。
①电极 a 上发生电极反应式:_________________________________________。
②理论上 1 mol H2S 参加反应可产生 H2的物质的量为________。
(2)FeS2 是 Li/FeS2 电池(如图 1)的正极活性物质,Li/FeS2 电池的负极是金属 Li,电解液是含锂
2
盐的有机溶液。电池放电反应: + -FeS2+4Li===Fe+4Li +2S 。该反应可认为分两步进行:
2
第 1 步:FeS2+
+ -
2Li===2Li +FeS2 ,则第 2 步正极的电极反应式: 。
图 1 图 2 图 3
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
(3)如图 2 为钠硫高能电池的结构示意图,该电池的工作温度为 320 ℃ 左右,电池的反应式:
2Na+xS===Na2Sx,正极的电极反应式:____________________。
M(由 Na2O 和 Al2O3制得)的两个作用:________________________。
(4)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图 3 所示,
该电池从浓缩海水中提取 LiCl 的同时又获得了电能。
①X 为________极,Y 极反应式:_______________________________。
+
②Y 极生成 1 mol Cl2 时,________ mol Li 移向________(填“X”或“Y”)极。
16.(16 分)(1)CH4可作为燃料使用,用 CH4 和 O2组合形成的质子交换膜燃料电池的结构示
意图如图。电池总反应:CH4+2O2===CO2+2H2O,则 c 电极
是________(填“正极”或“负极”),c 电极的电极反应式:
______________________________________。
(2)CO2 甲烷化是实现碳平衡阶段的中坚力量。 1902 年,Paul
Sabatier 首次报道了 CO2 的甲烷化。在一定的温度和压力条件
下, 将按一定比例混合的 CO2和 H2 通过装有金属 Ni 的反应器,可得到 CH4。
已知: CH4和 H2的标准燃烧热 ΔH 分别为-890.3 kJ/mol、-285.8 kJ/mol。
由题可知,CO2甲烷化反应:CO2(g)+4H2(g) CH4(g)+2H2O(l)的 ΔH= kJ/mol。
图 1 图 2
(3)近年来,生物电催化技术运用微生物电解池实现了 CO2 的甲烷化,其工作原理如图 1 所示。
① 微生物电解池实现 CO2甲烷化的阴极反应式为 。
② 3 如果处理有机物[(CH2O)n]产生标准状况下 112 m 的 CH4,则理论上导线中通过的电子的物
质的量为 。
(4)沼气的主要成分是 CH4,还含有 CO2、H2S 等。Jo De Vrieze 等设计了利用膜电解法脱除沼
气中的 CO2和 H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图 2 所示。
①需控制电解槽中阴极室 pH>7,其目的:___________________________。
2
②阳极室逸出 CO2 和________(填化学式);H2S 在阳极上转化为
-
SO4 而除去,其电极反应
式:
{#{QQABZYQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
17.(15 分)有机物 I 是一种药物合成的中间体,其合成路线如下:
(1)B C 的反应类型为 。
(2)流程中设计 E F 的目的是 。
(3)A B 得到的产物若不经提纯,依据 B 到 E 的合成路线会生成一种与 E 互为同分异构体
的副产物 X,X 的结构简式为 。
(4)B 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
① 含有手性碳原子,与 FeCl3 溶液发生显色反应且能使 Br2 的 CCl4 溶液褪色;
② 碱性条件下水解后酸化生成两种有机产物,产物之一分子中只有两种不同化学环境的氢原
子。
(5)写出以苯、甲苯、 为原料制备 的合成路线流程图(无机
试剂和有机溶剂任用,合成路线示例见本题题干)。
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
相对原子质量:Li 7
一、单项单选题:本部分包括 13 题,每题 3 分,共计 39 分。每题只有一个选项最符合题意。
1.“碳达峰、碳中和”事关中华民族永续发展和构建人类命运共同体。下列措施对实现“碳达峰、
碳中和”不.具有直接贡献的是
A.植树造林 B.开发核能 C.燃煤脱硫 D.节约用电
2.最新报道:科学家首次用 X 射线激光技术观察到 CO 与 O 在催化剂表面形成化学键的过程。
反应过程的示意图如下:
下列说法正确的是
A.CO 和 O 生成 CO2是吸热反应
B.在该过程中,CO 断键形成 C 和 O
C.CO 和 O 生成了具有共价键的 CO2
D.状态Ⅰ→状态Ⅲ表示 CO 与 O2 反应的过程
3.下列说法正确的是
-1
A.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-801.3 kJ·mol
-
结论:CH4的燃烧热为
1
801.3 kJ·mol
1
B.Sn(灰,s) Sn(白,s) ΔH=+ -2.1 kJ·mol (灰锡为粉末状)
结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
+ - -
C.稀溶液中有: 1H (aq)+OH (aq)===H2O(l) ΔH=-57.3 kJ·mol
结论:将盐酸与氨水的稀溶液混合后,若生成 1 mol H2O,则会放出 57.3 kJ 的能量
-
D.C(石墨, + 1s) O2(g)===CO2(g) ΔH=-393.5 kJ·mol
-
C(金刚石,s)+ 1O2(g)===CO2(g) ΔH=-395 kJ·mol
结论:相同条件下金刚石比石墨稳定
4.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
-
① 1C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol
-
② 1CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol
{#{QQABZYQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
-
③ 1CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol
-
④ 12CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol
A.反应①、②为反应③提供原料气
B.反应③也是 CO2资源化利用的方法之一
1 1 d -
C.反应 1CH3OH(g)=== CH3OCH3(g)+ H2O(l)的 ΔH= kJ·mol 2 2 2
-
D.反应 12CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的 ΔH=(2b+2c+d) kJ·mol
5.断裂 1 mol 化学键所需的能量如下:
化学键 N—N O==O N≡N N—H
-
键能 1/kJ·mol 154 500 942 a
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如
图所示, 则下列说法错误的是
A.N2比 O2稳定
B.N2H4(g)+O2(g)===N2(g)+2H2O(g)
-
ΔH=- 1534 kJ·mol
C.表中的 a=194
-
D.图中的 1ΔH3=+2 218 kJ·mol
+ +
6.实验发现, 3298 K 时,在氯化铁酸性溶液中加少量锌粒后,Fe 立即被还原成 2Fe 。某夏令营
兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说
法正确的是
- +
A.该原电池的正极反应是 2Zn-2e ===Zn
B.左烧杯中溶液的红色逐渐褪去
C.该电池铂电极上立即有气泡出现
+ +
D.该电池总反应为 + 3 + 23Zn 2Fe ===2Fe 3Zn
7.某种熔融碳酸盐燃料电池以 Li2CO3、K2CO3 为电解质、以 CH4 为燃料时,该电池工作原理如
图。下列说法正确的是
A.a 为 CH4,b 为 CO2
2
B. -CO3 向正极移动
C.此电池在常温下也能工作
2
D.正极的电极反应式:O2+2CO2+
- -
4e ===2CO3
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
8.微生物燃料电池可用于净化含铬废水,其工作原理示意如图所示。该电池工作时,下列说法
不正确的是
A.M 极是电池的负极
B.CH3OH 在电极上发生氧化反应
C.N 电极附近溶液的 pH 增大
2
D.若 - +0.1 mol Cr2O7 参加反应,则有 0.8 mol H 从交换膜
右侧向左侧迁移
9.下列电化学装置正确且能达到目的的是
A. 用装置甲在铁制品表面镀铜 B. 用装置乙电解精炼铜
C. 用装置丙制备 NaOH 和氯气 D. 用装置丁保护钢闸门
10.沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却
效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列
叙述错误的是
A.阳极发生将海水中的 -Cl 氧化生成 Cl2 的反应
B.管道中可以生成氧化灭杀附着生物的 NaClO
C.阴极生成的 H2 应及时通风稀释安全排入大气
D.阳极表面形成的 Mg(OH)2 等积垢需要定期清理
11.太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M 电极材料是金属锂和碳的复合材料
(碳作为金属锂的载体),电解质为一种能传导 +Li 的高分子材料,隔膜只允许 +Li 通过,电池反
应式为 LixC6+Li1-xFePO4 LiFePO4+6C。下列说法正确的是
+
.放电时 从左边移向右边, 3
-
A Li PO4 从右边移向左边
+ -
B.放电时,正极反应式为 Li1-xFePO4+xLi +xe ===LiFePO4
- -
C.充电时 M 极连接电源的负极,电极反应式为 6C+ xxe ===C6
D.充电时电路中通过 2.0 mol 电子,产生 28 g Li
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
12.用甲醚(CH3OCH3)燃料电池电解 Na2SO4 溶液制取 NaOH 溶液和硫酸的装置如下图所示。下
列说法正确的是
+
A.通入甲醚的电极反应式为 -CH3OCH3+12e +3H2O=2CO2↑+12H
B.膜 a、膜 b 依次为阳离子交换膜和阴离子交换膜
C.M 为硫酸、N 为 NaOH
D.反应的甲醚与生成气体 Y 的物质的量之比为 1:3
13.有机物 Z 是合成药物的中间体,Z 的合成路线如下。下列说法正确的是
A.1 mol X 最多能与 2 mol NaOH 反应
B.Y 不存在顺反异构体
C.Z 分子中含有 2 个手性碳原子
D.可以用 NaHCO3溶液鉴别化合物 Y 和 Z
二、非选择题:共 4 题,共 61 分。
+ -
14.(12 分)(1)在微生物作用的条件下,NH4 经过两步反应被氧化成 NO3 。两步反应的能量变
化示意如图:
①第一步反应是_______(填“放热”或“吸热”)反应,判断依据是____________________。
+ -
②1 mol NH4 (aq)全部氧化成 NO3 (aq)的热化学方程式是___________________________。
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
(2)已知:
-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol ①
1 -1
Na2O2(s)+CO2(g)===Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol ② 2
则 CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,生成的 O2为______________L(标况)。
(3)有科学家预言,氢能将成为 21 世纪的主要能源,而且是一种理想的绿色能源。若 1 mol 氢
-
气完全燃烧生成 1 mol 气态水放出 241 kJ 的热量,已知 H—O 键能为 1463 kJ·mol ,O==O 键能为
-1 -1
498 kJ·mol ,计算 H—H 键能为__________________kJ·mol 。
(4)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金 Mg2Ni,已知:
-1
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5 kJ·mol ;
-1
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2=-64.4 kJ·mol ;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3。
-
则 1ΔH3=________kJ·mol 。
15.(18 分)(1)通过电化学循环法可将 H2S 转化为 H2SO4 和 H2(如图所示)。其中氧化过程发生
如下两步反应:H2S+H2SO4===SO2↑+S↓+2H2O、S+O2===SO2。
①电极 a 上发生电极反应式:_________________________________________。
②理论上 1 mol H2S 参加反应可产生 H2的物质的量为________。
(2)FeS2 是 Li/FeS2 电池(如图 1)的正极活性物质,Li/FeS2 电池的负极是金属 Li,电解液是含锂
2
盐的有机溶液。电池放电反应: + -FeS2+4Li===Fe+4Li +2S 。该反应可认为分两步进行:
2
第 1 步:FeS2+
+ -
2Li===2Li +FeS2 ,则第 2 步正极的电极反应式: 。
图 1 图 2 图 3
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
(3)如图 2 为钠硫高能电池的结构示意图,该电池的工作温度为 320 ℃ 左右,电池的反应式:
2Na+xS===Na2Sx,正极的电极反应式:____________________。
M(由 Na2O 和 Al2O3制得)的两个作用:________________________。
(4)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图 3 所示,
该电池从浓缩海水中提取 LiCl 的同时又获得了电能。
①X 为________极,Y 极反应式:_______________________________。
+
②Y 极生成 1 mol Cl2 时,________ mol Li 移向________(填“X”或“Y”)极。
16.(16 分)(1)CH4可作为燃料使用,用 CH4 和 O2组合形成的质子交换膜燃料电池的结构示
意图如图。电池总反应:CH4+2O2===CO2+2H2O,则 c 电极
是________(填“正极”或“负极”),c 电极的电极反应式:
______________________________________。
(2)CO2 甲烷化是实现碳平衡阶段的中坚力量。 1902 年,Paul
Sabatier 首次报道了 CO2 的甲烷化。在一定的温度和压力条件
下, 将按一定比例混合的 CO2和 H2 通过装有金属 Ni 的反应器,可得到 CH4。
已知: CH4和 H2的标准燃烧热 ΔH 分别为-890.3 kJ/mol、-285.8 kJ/mol。
由题可知,CO2甲烷化反应:CO2(g)+4H2(g) CH4(g)+2H2O(l)的 ΔH= kJ/mol。
图 1 图 2
(3)近年来,生物电催化技术运用微生物电解池实现了 CO2 的甲烷化,其工作原理如图 1 所示。
① 微生物电解池实现 CO2甲烷化的阴极反应式为 。
② 3 如果处理有机物[(CH2O)n]产生标准状况下 112 m 的 CH4,则理论上导线中通过的电子的物
质的量为 。
(4)沼气的主要成分是 CH4,还含有 CO2、H2S 等。Jo De Vrieze 等设计了利用膜电解法脱除沼
气中的 CO2和 H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图 2 所示。
①需控制电解槽中阴极室 pH>7,其目的:___________________________。
2
②阳极室逸出 CO2 和________(填化学式);H2S 在阳极上转化为
-
SO4 而除去,其电极反应
式:
{#{QQABZYQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
17.(15 分)有机物 I 是一种药物合成的中间体,其合成路线如下:
(1)B C 的反应类型为 。
(2)流程中设计 E F 的目的是 。
(3)A B 得到的产物若不经提纯,依据 B 到 E 的合成路线会生成一种与 E 互为同分异构体
的副产物 X,X 的结构简式为 。
(4)B 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
① 含有手性碳原子,与 FeCl3 溶液发生显色反应且能使 Br2 的 CCl4 溶液褪色;
② 碱性条件下水解后酸化生成两种有机产物,产物之一分子中只有两种不同化学环境的氢原
子。
(5)写出以苯、甲苯、 为原料制备 的合成路线流程图(无机
试剂和有机溶剂任用,合成路线示例见本题题干)。
{#{QQABYZQaYoExgggAC4IgAIJbJAACAYA4hqCEEwwUU+aCCkkMQsQJkCAgAJAcgAEQBgVGCADFKAARMCACAIANyIRFKNA=B}C#}A=}#}
同课章节目录
