江西省宜春市宜丰县2015年人教版必修一第二章化学物质及其变化第二节离子反应 同步练习卷【解析版,含答案】
文档属性
| 名称 | 江西省宜春市宜丰县2015年人教版必修一第二章化学物质及其变化第二节离子反应 同步练习卷【解析版,含答案】 |  | |
| 格式 | zip | ||
| 文件大小 | 96.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-20 08:44:28 | ||
图片预览



文档简介
一、选择题
1、下列反应的离子方程式正确的是( )
( http: / / www.21cnjy.com )
2、下列离子方程式正确的是( )
A.向Ag(NH3)2OH溶液中加足量氢溴酸:Ag(NH3) 2++OH-+3H+===Ag++2NH4++H2O
B.Ba(HCO3)2溶液与Ba(OH)2溶液任意比混合:Ba2++HCO3—+OH-===BaCO3↓+H2O
C.将Fe(OH)3粉末加入HI溶液中:Fe(OH)3+3H+===Fe3++3H2O
D.向NH4HCO3溶液中加入足量Na[Al(OH)4]溶液:NH4++[Al(OH)4]-===NH3·H2O+Al(OH)3↓
3、下列表示对应化学反应的离子方程式正确的是( )
A.用KIO3 氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-NH3↑+H2O
C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O
4、下列微粒中不能破坏水的电离平衡的是( ( http: / / www.21cnjy.com ) )
A. Na HSO4 B. Al3+ C. CO32- D. K+
5、下列离子方程式正确的是( )
A.向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2→2Fe3++2Cl-
B.向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O→CaSO3↓+2HClO
C.向硫酸氢钠溶液中滴加氢氧化钡至中性:H++SO+Ba2++OH-→BaSO4↓+H2O
D.将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+→Fe3++3H2O
6、下列离子方程式书写正确的是( )
A. FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B. 稀盐酸与小苏打溶液混合:CO+2H+=CO2+H2O
C. 鸡蛋壳溶于食醋:CaCO3+2H+=Ca2++CO2+H2O
D. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3+3NH
7、向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )
( http: / / www.21cnjy.com )
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)=6 mol·L-1
C.当通入Cl22 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2====2Fe3++I2+4Cl-
D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
8、下列反应的离子方程式正确的是( )
A.用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
B.将银片投入到浓硝酸溶液中:Ag+4H++2N03-=Ag++2NO+2H20
C.向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HC03-+20H-=CaCO3+CO3-+2H20
D.用烧碱溶液吸收氯气:C12+20H-=Cl-+ClO-+H20
9、下列离子方程式中,正确的是( )
A.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+ ==BaSO4↓
B.碳酸氢钙溶液跟稀硝酸反应:HCO3—+H+ == H2O + CO2↑
C.偏铝酸钠的水溶液显碱性:AlO+2H2O Al(OH)3↓+OH–
D.电解饱和食盐水: 2Cl—+2H+H2↑+C12↑
10、某溶液中可能含有以下6种离子中的几种 ( http: / / www.21cnjy.com ):NH4+、A13+、Mg2+、CO32﹣、Cl﹣、SO42﹣,为确认溶液的组成,现取100mL分成三等份溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58g,同时收集到气体0.03mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99g.
由此可知,下列关于原溶液组成的正确结论是( )
A.溶液中SO42﹣的浓度是0.3 mol/L B. 溶液中一定含有A13+和NH4+
C.一定不存在Mg2+,可能存在A13+ D. 一定存在Cl﹣ 可能含CO32﹣
11、某溶液中可能含有K+、NH、Ba2+、SO、I-、CO。分别取样:①用pH计测试,溶液显弱酸性 ②加氯水和CCl4振荡后静置,下层呈无色 为确定该溶液的组成,还需检验的离子是( )
A.K+
B.SO
C.Ba2+
D.NH
12、某无色透明溶液,能与Al作用放出H2,此溶液中可以大量共存的离子组是( )
A.OH-、Mg2+、Ba2+、Cl-
B.SO42—、Na+、HCO3—、K+
C.NO3—、Na+、Cl-、Ba2+
D.Cu2+、H+、SO42—、NO3—
二、非选择题
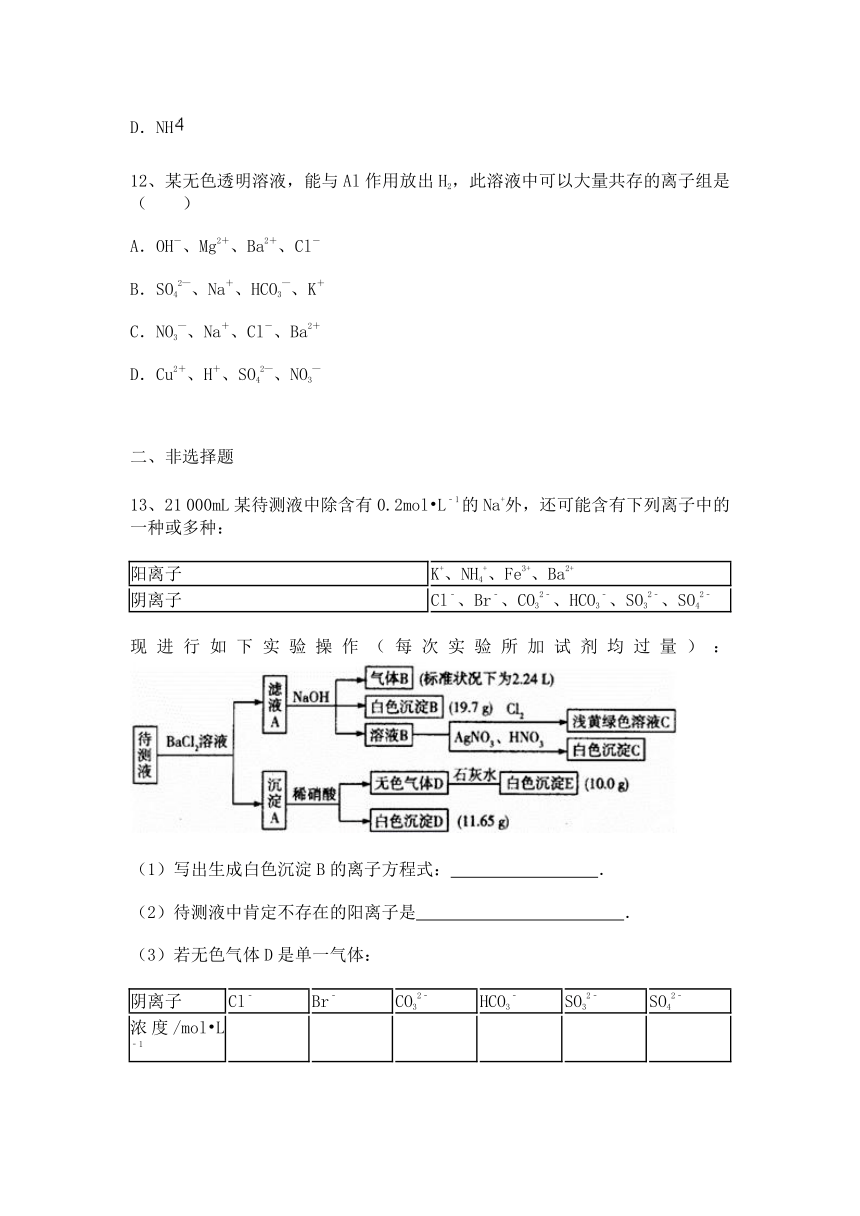
13、21 000mL某待测液中除含有0.2mol L﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 K+、NH4+、Fe3+、Ba2+
阴离子 Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣
现进行如下实验操作(每次实验所加试剂均过量): ( http: / / www.21cnjy.com )
(1)写出生成白色沉淀B的离子方程式: .
(2)待测液中肯定不存在的阳离子是 .
(3)若无色气体D是单一气体:
阴离子 Cl﹣ Br﹣ CO32﹣ HCO3﹣ SO32﹣ SO42﹣
浓度/mol L﹣1
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是 .
②沉淀A中能与稀硝酸反应的成分是 (写化学式).
14、某溶液中含有X﹣、Y2﹣、Z2﹣三种常见的无机离子.如图所示,发生了一系列化学反应.第④步反应生成的白色沉淀中含Y2﹣.
( http: / / www.21cnjy.com )
(1)判断X﹣、Y2﹣、Z2﹣分别为 、 、 (写离子符号).
(2)写出④、⑤步反应的离子方程式.
④ ;
⑤ .
15、有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 K+ Na+ Cu2+ Al3+
阴离子 SO42﹣ HCO3﹣ NO3﹣ OH﹣
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D .
(2)将含1mol A的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物为 .
(3)C常用作净水剂,用离子方程式表示其净水原理 .
(4)在A溶液中加入少量澄清石灰水,其离子方程式为 .
(5)向20mL 2mol/L C溶液中加 ( http: / / www.21cnjy.com )入30mLE 溶液,充分反应后得到0.78g沉淀,则C溶液的物质的量浓度是 mol/L.
16、某工业废水中可能含有如下几种阴阳离子:
阳离子 Fe3+、Al3+、Fe2+、Ba2+、Na+
阴离子 Cl-、CO32-、NO3-、SO42-、SiO32-
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废 ( http: / / www.21cnjy.com )水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)Al + X + OH- =AlO2-+ NH3 + N2 + 。该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe ( http: / / www.21cnjy.com )3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
参考答案
1、【答案】C
【解析】在A选项中因为可逆符号;B选项中钡离子和硫酸根离子的比例该是1:1;D选项中深沉的的应该是碳酸氢根。
2、【答案】B
【解析】A项,AgBr难溶于水,反 ( http: / / www.21cnjy.com )应中应该生成AgBr沉淀,错;C项,由于Fe3+具有强氧化性,而I-具有强还原性,反应中应有Fe2+与I2生成,错;D项,反应中HCO3—作酸用,应有CO32—生成,错。
3、【答案】C
4、【答案】D
【解析】NaHSO4电离出H+,抑制水的电离平衡;Al3+、CO32-水解,促进水的电离平衡
5、【答案】A
6、【答案】D
7、【答案】B
【解析】还原性强弱顺序为:I->F ( http: / / www.21cnjy.com )e2+>Br-,所以Cl2最先氧化I-,然后氧化Fe2+,最后氧化Br-。图中AB线段表示I-的变化情况,氧化I-需氯气1 mol,则I-为2 mol;BC线段表示Fe3+的变化情况,氧化Fe2+需氯气2 mol,则Fe2+为4 mol;DE线段表示Br-的变化情况,氧化Br-需氯气3 mol,则Br-为6 mol。当通入Cl22 mol时,氧化的I-和Fe2+均为2 mol,所以C中的离子方程式是正确的。因不知溶液的体积,则B错误。
8、【答案】D
9、【答案】B
10、【答案】A
【解析】(1)向第一份溶液中加入AgNO3溶液有沉淀产生,说明溶液中可能存在CO32﹣、Cl﹣、SO42﹣中的一种或几种;
(2)生成的沉淀为氢氧化镁,物质的量为=0.01mol,溶液中一定存在Mg2+,一定不存在CO32﹣;生成的气体为氨气,说明溶液中一定存在NH4+;
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化),得到沉淀6.99g,沉淀为硫酸钡,说明溶液中一定存在SO42﹣,n(SO42﹣)= mol=0.03mol,
根据溶液电中性,负电荷物质的量为n(﹣)=2 ( http: / / www.21cnjy.com )n(SO42﹣)=0.06mol,正电荷的物质的量为n(+)=n(NH4+)+2n(Mg2+)=0.03mol+0.01mol×2=0.05mol,显然在无法确定是否含有氯离子情况下,负电荷物质的量大于正电荷,所以溶液中一定存在A13+,
A、根据以上分析可知,溶液中SO42﹣的浓度是=0.3 mol/L,故A正确;
B、根据溶液电中性可知,溶液中一定存在铝离子,根据生成了氨气可知,溶液中一定存在铵离子,故B错误;
C、溶液中一定存在镁离子和铝离子,故C错误;
D、溶液中一定不存在碳酸根离子,故D错误
11、【答案】A
【解析】根据①可知溶液中不含CO;根据②可知溶液中不含I-;溶液中至少要含有一种阴离子,即SO。SO与Ba2+不能大量共存,则不含Ba2+。溶液呈弱酸性,则含有NH。只有K+不能确定,还需要加以检验
12、【答案】C
【解析】与Al反应放出H2 ( http: / / www.21cnjy.com ),此溶液可以是强酸性也可以是强碱性溶液,应分两种情况考虑。选项A中Mg2+与OH-反应生成Mg(OH)2沉淀而不能大量共存;B中HCO3—既能与H+反应又能与OH-反应,而使其在强酸性或强碱性溶液中均不能大量存在;D中Cu2+有颜色,与题意不符。
13、【考点】无机物的推断;离子方程式的书写.
【专题】推断题;离子反应专题.
【分析】(1)(2)待测 ( http: / / www.21cnjy.com )液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣,可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH ( http: / / www.21cnjy.com )溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3﹣,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br﹣,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl﹣,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣;
(3)若无色气体D是单一气体,则D为C ( http: / / www.21cnjy.com )O2,E为CaCO3,溶液中含有CO32﹣,白色沉淀D只能为BaSO4,溶液中一定没有SO32﹣,一定含有SO42﹣,计算B(碳酸钡)、E(碳酸钙)、硫酸钡的物质的量,根据离子守恒计算各离子的浓度;
根据电荷守恒判断是否含有钾离子,若溶液含有K+,当溶液中没有Cl﹣,K+离子浓度最小,根据电荷守恒计算;
(4)若无色气体D是混合气体,只能 ( http: / / www.21cnjy.com )为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32﹣,不能确定是否含有SO42﹣,沉淀A中一定含有BaCO3,BaSO3.
【解答】解:待测液和氯化钡溶液反应得到沉 ( http: / / www.21cnjy.com )淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣,可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaO ( http: / / www.21cnjy.com )H溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3﹣,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br﹣,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl﹣,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣;
(1)由上述分析可知,白色沉淀B为碳酸 ( http: / / www.21cnjy.com )钡,是由HCO3﹣、Ba2+、OH﹣反应生成,反应离子方程式为:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O,
故答案为:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O;
(2)由上述分析可知,溶液中一定没有的阳离子是:Fe3+、Ba2+,
故答案为:Fe3+、Ba2+;
(3)①由上述分析可知,不能确定原溶液中是否含有Cl﹣,溶液中一定没有Br﹣.
若无色气体D是单一气体,则D为 ( http: / / www.21cnjy.com )CO2,E为CaCO3,溶液中含有CO32﹣,白色沉淀D只能为BaSO4,溶液中一定没有SO32﹣,一定含有SO42﹣,
B(碳酸钡)的物质的量==0.1mol,则n(HCO3﹣)=0.1mol,故c(HCO3﹣)==0.1mol/L,
E(碳酸钙)的物质的量==0.1mol,则n(CO32﹣)=0.1mol,故c(CO32﹣)==0.1mol/L,
D(硫酸钡)的物质的量==0.05mol,则n(SO42﹣)=0.05mol,故c(SO42﹣)==0.05mol/L,
故答案为:
阴离子 Cl﹣ Br﹣ CO32﹣ HCO3﹣ SO32﹣ SO42﹣
浓度/mol L﹣1 ? 0 0.1 0.1 0 0.05
②n(NH4+)=n(NH3)==0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3﹣)=0.1mol/L,c(CO32﹣)=0.1mol/L,c(SO42﹣)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,当溶液中没有Cl﹣,K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L﹣0.3mol.L=0.1mol/L,
故答案为:存在;K+离子最小浓度为0.1mol/L;
(4)由上述分析可知,溶液中一定含有CO32﹣、HCO3﹣,不能确定原溶液中是否含有Cl﹣,溶液中一定没有Br﹣.
若无色气体D是混合气体,只能为CO2、 ( http: / / www.21cnjy.com )NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32﹣,不能确定是否含有SO42﹣,沉淀A中一定含有BaCO3,BaSO3,
①待测液中一定含有的阴离子是CO32﹣、HCO3﹣、SO32﹣,故答案为:CO32﹣、HCO3﹣、SO32﹣;
②沉淀A中BaCO3,BaSO3能与稀硝酸反应,故答案为:BaCO3、BaSO3.
【点评】本题考查了离子的推断、检验,熟悉物 ( http: / / www.21cnjy.com )质的性质是解本题关键,根据实验过程中反应现象、离子共存条件来确定溶液中存在的离子,注意根据溶液中电荷守恒确定钾离子是否存在,同时考查学生综合运用知识解决问题的能力,题目难度较大.
14、【考点】常见离子的检验方法.
【专题】物质检验鉴别题.
【分析】溶液中加入硝酸钡后产 ( http: / / www.21cnjy.com )生白色沉淀,白色沉淀中加入盐酸沉淀部分溶解,说明沉淀中含有硫酸钡和碳酸钡,碳酸钡与盐酸反应能产生无色无味的气体二氧化碳,二氧化碳与石灰水反应能生成白色沉淀碳酸钙,故溶液中含有硫酸根离子和碳酸根离子;滤液中加入硝酸银产生不溶于硝酸的白色沉淀,说明溶液中含有氯离子,氯离子与银离子结合生成氯化银不溶于硝酸.据此分析解答.
【解答】解:溶液中加入硝酸钡后产生白色 ( http: / / www.21cnjy.com )沉淀,白色沉淀中加入盐酸沉淀部分溶解,说明沉淀中含有硫酸钡和碳酸钡,碳酸钡与盐酸反应能产生无色无味的气体二氧化碳,二氧化碳与石灰水反应能生成白色沉淀碳酸钙,故溶液中含有硫酸根离子和碳酸根离子;滤液中加入硝酸银产生不溶于硝酸的白色沉淀,说明溶液中含有氯离子,氯离子与银离子结合生成氯化银不溶于硝酸;
(1)由上述分析可知X﹣为氯离子,Y2﹣和Z2﹣为硫酸根离子和碳酸根离子,符号分别为 Cl﹣、SO42﹣、CO32﹣;
故答案为:Cl﹣;SO42﹣(CO32﹣);CO32﹣(SO42﹣);
(2)④反应为盐酸中的氢离子与碳酸钡反应生成二氧化碳的过程,离子方程式为BaCO3+2H+═Ba2++CO2↑+H2O;
⑤步反应为二氧化碳与石灰水反应,离子方程式Ca2++2OH﹣+CO2═CaCO3↓+H2O,
故答案为:BaCO3+2H+=Ba2++CO2+H2O;CO2+2OH﹣+Ca2+=CaCO3+H2O.
【点评】本题考查无机物的推断,侧重于考查学生的综合分析能力,把握白色沉淀及离子之间的反应逐一分析推断为解答的关键,题目难度不大.
15、【答案】(1)KNO3;CuSO4;
(2)Na2CO3;
(3)Al3++3H2OAl(OH)3(胶体)+3H+;
(4)Ca2++2HCO3﹣+2OH﹣=CaCO3↓+2H2O+CO32﹣;
(5)1和5;
【解析】①将它们溶于水后,D为蓝色溶液,说明D中含有离子Cu2+;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解,由以上离子可以看出,应为Al3+与OH﹣的反应,则E中含有
OH﹣,C中含有Al3+;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃),说明只有B、C中含有K+;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,则A含有HCO3﹣,C、D中产生白色沉淀该沉淀为
BaSO4,说明C、D中含有SO42﹣;
⑤将B、D两溶液混合,未见沉淀或气体生成,说明二者没有发生任何反应,则B为KNO3,
综上所述A、B、C、D、E五种常见化合物分别为:NaHCO3、KNO3、KAl(SO4)2,CuSO4,NaOH;
(1)B、D化合物分别为:KNO3、CuSO4,故答案为:KNO3;CuSO4;
(2)因NaHCO3和NaOH等物质的量反应生成碳酸钠和水,所以反应后溶液蒸干,得到一种化合物为Na2CO3,
故答案为:Na2CO3;
(3)铝离子能够发生水解生成氢氧化铝胶体和酸,离子方程式:Al3++3H2OAl(OH)3(胶体)+3H+,
故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;
(4)根据NaHCO3与少量澄清石灰水,即两者的物质的量之比为2:1,方程式为:2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+
Na2CO3,离子方程式为:Ca2++ ( http: / / www.21cnjy.com )2HCO3﹣+2OH﹣=CaCO3↓+2H2O+CO32﹣,故答案为:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+2H2O+CO32﹣;
(5)20mL2mol/LAlCl3完全转化为沉淀的质量为0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH﹣=Al(OH)3↓ ( http: / / www.21cnjy.com )和Al(OH)3+OH﹣=AlO2﹣+H2O,可知NaOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,
设NaOH的浓度为c,当NaOH不足时,
Al3++3OH﹣=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
=
解得 c═1mol/L,
当NaOH使Al(OH)3部分溶解时,设NaOH的物质的量为x,根据反应:
Al3++3OH﹣=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3 +OH﹣=AlO2﹣+H2O
78g 1mol
(3.12﹣0.78)g (x﹣0.12mol)
=
解得:x=0.15mol,
则NaOH的物质的量浓度为:c==5mol/L,
故答案为:1和5;
16、【答案】(1)NO3- SO42-; Ba2+ (2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)16Al + 9NO3-+ 7OH- ( http: / / www.21cnjy.com )=16AlO2- + NH3↑+ 4N2↑+ 2H2O;NH3 、N2 ; 9.6g (4)2
【解析】向试管中滴加浓盐酸,有少量的 ( http: / / www.21cnjy.com )无色气体生成,气体遇空气立即变为红棕色,该气体是NO,红棕色气体是NO2,这说明在反应中硝酸根被还原为NO,因此一定含有NO3-、Fe2+,则CO32-、SiO32-一定不存在;若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成,该沉淀是硫酸钡,所以一定含有硫酸根,则一定没有钡离子;若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成,该沉淀是氢氧化铁,但由于亚铁离子被还原生成了铁离子,所以不能确定是否含有离子。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成,该沉淀是氢氧化铝,则一定含有铝离子。
(1)该废水中一定含有的阴离子是NO3-、SO42-,一定不含有的阳离子是Ba2+;
(2)所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(3)设氨气是1mol,则氮气是4mol,氨气和氮气均是还原产物,则根据电子守恒,N 得到(40+8)e-,故 Al 失去 48 e-,系数为 16 根据 N 原子守恒得到系数 9,根据电荷守恒得到系数 7,最后为水,即16Al + 9NO3-+ 7OH- =16AlO2- + NH3↑+ 4N2↑+ 2H2O;若除去0.2mol X离子,则消耗铝的质量是×0.2mol×27g/mol=9.6g。
(4)Ksp(沉淀平衡常数)=[Fe3 ( http: / / www.21cnjy.com )+][OH-]3=1.0×10-2 [OH-]3=1.0×10-38,所以[OH-]=10-12,则[H+]=10-2。所以pH=2。
1、下列反应的离子方程式正确的是( )
( http: / / www.21cnjy.com )
2、下列离子方程式正确的是( )
A.向Ag(NH3)2OH溶液中加足量氢溴酸:Ag(NH3) 2++OH-+3H+===Ag++2NH4++H2O
B.Ba(HCO3)2溶液与Ba(OH)2溶液任意比混合:Ba2++HCO3—+OH-===BaCO3↓+H2O
C.将Fe(OH)3粉末加入HI溶液中:Fe(OH)3+3H+===Fe3++3H2O
D.向NH4HCO3溶液中加入足量Na[Al(OH)4]溶液:NH4++[Al(OH)4]-===NH3·H2O+Al(OH)3↓
3、下列表示对应化学反应的离子方程式正确的是( )
A.用KIO3 氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-NH3↑+H2O
C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O
4、下列微粒中不能破坏水的电离平衡的是( ( http: / / www.21cnjy.com ) )
A. Na HSO4 B. Al3+ C. CO32- D. K+
5、下列离子方程式正确的是( )
A.向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2→2Fe3++2Cl-
B.向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O→CaSO3↓+2HClO
C.向硫酸氢钠溶液中滴加氢氧化钡至中性:H++SO+Ba2++OH-→BaSO4↓+H2O
D.将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+→Fe3++3H2O
6、下列离子方程式书写正确的是( )
A. FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B. 稀盐酸与小苏打溶液混合:CO+2H+=CO2+H2O
C. 鸡蛋壳溶于食醋:CaCO3+2H+=Ca2++CO2+H2O
D. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3+3NH
7、向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )
( http: / / www.21cnjy.com )
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)=6 mol·L-1
C.当通入Cl22 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2====2Fe3++I2+4Cl-
D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
8、下列反应的离子方程式正确的是( )
A.用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
B.将银片投入到浓硝酸溶液中:Ag+4H++2N03-=Ag++2NO+2H20
C.向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HC03-+20H-=CaCO3+CO3-+2H20
D.用烧碱溶液吸收氯气:C12+20H-=Cl-+ClO-+H20
9、下列离子方程式中,正确的是( )
A.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+ ==BaSO4↓
B.碳酸氢钙溶液跟稀硝酸反应:HCO3—+H+ == H2O + CO2↑
C.偏铝酸钠的水溶液显碱性:AlO+2H2O Al(OH)3↓+OH–
D.电解饱和食盐水: 2Cl—+2H+H2↑+C12↑
10、某溶液中可能含有以下6种离子中的几种 ( http: / / www.21cnjy.com ):NH4+、A13+、Mg2+、CO32﹣、Cl﹣、SO42﹣,为确认溶液的组成,现取100mL分成三等份溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58g,同时收集到气体0.03mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99g.
由此可知,下列关于原溶液组成的正确结论是( )
A.溶液中SO42﹣的浓度是0.3 mol/L B. 溶液中一定含有A13+和NH4+
C.一定不存在Mg2+,可能存在A13+ D. 一定存在Cl﹣ 可能含CO32﹣
11、某溶液中可能含有K+、NH、Ba2+、SO、I-、CO。分别取样:①用pH计测试,溶液显弱酸性 ②加氯水和CCl4振荡后静置,下层呈无色 为确定该溶液的组成,还需检验的离子是( )
A.K+
B.SO
C.Ba2+
D.NH
12、某无色透明溶液,能与Al作用放出H2,此溶液中可以大量共存的离子组是( )
A.OH-、Mg2+、Ba2+、Cl-
B.SO42—、Na+、HCO3—、K+
C.NO3—、Na+、Cl-、Ba2+
D.Cu2+、H+、SO42—、NO3—
二、非选择题
13、21 000mL某待测液中除含有0.2mol L﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 K+、NH4+、Fe3+、Ba2+
阴离子 Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣
现进行如下实验操作(每次实验所加试剂均过量): ( http: / / www.21cnjy.com )
(1)写出生成白色沉淀B的离子方程式: .
(2)待测液中肯定不存在的阳离子是 .
(3)若无色气体D是单一气体:
阴离子 Cl﹣ Br﹣ CO32﹣ HCO3﹣ SO32﹣ SO42﹣
浓度/mol L﹣1
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是 .
②沉淀A中能与稀硝酸反应的成分是 (写化学式).
14、某溶液中含有X﹣、Y2﹣、Z2﹣三种常见的无机离子.如图所示,发生了一系列化学反应.第④步反应生成的白色沉淀中含Y2﹣.
( http: / / www.21cnjy.com )
(1)判断X﹣、Y2﹣、Z2﹣分别为 、 、 (写离子符号).
(2)写出④、⑤步反应的离子方程式.
④ ;
⑤ .
15、有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 K+ Na+ Cu2+ Al3+
阴离子 SO42﹣ HCO3﹣ NO3﹣ OH﹣
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D .
(2)将含1mol A的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物为 .
(3)C常用作净水剂,用离子方程式表示其净水原理 .
(4)在A溶液中加入少量澄清石灰水,其离子方程式为 .
(5)向20mL 2mol/L C溶液中加 ( http: / / www.21cnjy.com )入30mLE 溶液,充分反应后得到0.78g沉淀,则C溶液的物质的量浓度是 mol/L.
16、某工业废水中可能含有如下几种阴阳离子:
阳离子 Fe3+、Al3+、Fe2+、Ba2+、Na+
阴离子 Cl-、CO32-、NO3-、SO42-、SiO32-
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废 ( http: / / www.21cnjy.com )水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)Al + X + OH- =AlO2-+ NH3 + N2 + 。该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe ( http: / / www.21cnjy.com )3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
参考答案
1、【答案】C
【解析】在A选项中因为可逆符号;B选项中钡离子和硫酸根离子的比例该是1:1;D选项中深沉的的应该是碳酸氢根。
2、【答案】B
【解析】A项,AgBr难溶于水,反 ( http: / / www.21cnjy.com )应中应该生成AgBr沉淀,错;C项,由于Fe3+具有强氧化性,而I-具有强还原性,反应中应有Fe2+与I2生成,错;D项,反应中HCO3—作酸用,应有CO32—生成,错。
3、【答案】C
4、【答案】D
【解析】NaHSO4电离出H+,抑制水的电离平衡;Al3+、CO32-水解,促进水的电离平衡
5、【答案】A
6、【答案】D
7、【答案】B
【解析】还原性强弱顺序为:I->F ( http: / / www.21cnjy.com )e2+>Br-,所以Cl2最先氧化I-,然后氧化Fe2+,最后氧化Br-。图中AB线段表示I-的变化情况,氧化I-需氯气1 mol,则I-为2 mol;BC线段表示Fe3+的变化情况,氧化Fe2+需氯气2 mol,则Fe2+为4 mol;DE线段表示Br-的变化情况,氧化Br-需氯气3 mol,则Br-为6 mol。当通入Cl22 mol时,氧化的I-和Fe2+均为2 mol,所以C中的离子方程式是正确的。因不知溶液的体积,则B错误。
8、【答案】D
9、【答案】B
10、【答案】A
【解析】(1)向第一份溶液中加入AgNO3溶液有沉淀产生,说明溶液中可能存在CO32﹣、Cl﹣、SO42﹣中的一种或几种;
(2)生成的沉淀为氢氧化镁,物质的量为=0.01mol,溶液中一定存在Mg2+,一定不存在CO32﹣;生成的气体为氨气,说明溶液中一定存在NH4+;
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化),得到沉淀6.99g,沉淀为硫酸钡,说明溶液中一定存在SO42﹣,n(SO42﹣)= mol=0.03mol,
根据溶液电中性,负电荷物质的量为n(﹣)=2 ( http: / / www.21cnjy.com )n(SO42﹣)=0.06mol,正电荷的物质的量为n(+)=n(NH4+)+2n(Mg2+)=0.03mol+0.01mol×2=0.05mol,显然在无法确定是否含有氯离子情况下,负电荷物质的量大于正电荷,所以溶液中一定存在A13+,
A、根据以上分析可知,溶液中SO42﹣的浓度是=0.3 mol/L,故A正确;
B、根据溶液电中性可知,溶液中一定存在铝离子,根据生成了氨气可知,溶液中一定存在铵离子,故B错误;
C、溶液中一定存在镁离子和铝离子,故C错误;
D、溶液中一定不存在碳酸根离子,故D错误
11、【答案】A
【解析】根据①可知溶液中不含CO;根据②可知溶液中不含I-;溶液中至少要含有一种阴离子,即SO。SO与Ba2+不能大量共存,则不含Ba2+。溶液呈弱酸性,则含有NH。只有K+不能确定,还需要加以检验
12、【答案】C
【解析】与Al反应放出H2 ( http: / / www.21cnjy.com ),此溶液可以是强酸性也可以是强碱性溶液,应分两种情况考虑。选项A中Mg2+与OH-反应生成Mg(OH)2沉淀而不能大量共存;B中HCO3—既能与H+反应又能与OH-反应,而使其在强酸性或强碱性溶液中均不能大量存在;D中Cu2+有颜色,与题意不符。
13、【考点】无机物的推断;离子方程式的书写.
【专题】推断题;离子反应专题.
【分析】(1)(2)待测 ( http: / / www.21cnjy.com )液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣,可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH ( http: / / www.21cnjy.com )溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3﹣,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br﹣,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl﹣,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣;
(3)若无色气体D是单一气体,则D为C ( http: / / www.21cnjy.com )O2,E为CaCO3,溶液中含有CO32﹣,白色沉淀D只能为BaSO4,溶液中一定没有SO32﹣,一定含有SO42﹣,计算B(碳酸钡)、E(碳酸钙)、硫酸钡的物质的量,根据离子守恒计算各离子的浓度;
根据电荷守恒判断是否含有钾离子,若溶液含有K+,当溶液中没有Cl﹣,K+离子浓度最小,根据电荷守恒计算;
(4)若无色气体D是混合气体,只能 ( http: / / www.21cnjy.com )为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32﹣,不能确定是否含有SO42﹣,沉淀A中一定含有BaCO3,BaSO3.
【解答】解:待测液和氯化钡溶液反应得到沉 ( http: / / www.21cnjy.com )淀A,则溶液中可能含有CO32﹣、SO32﹣、SO42﹣,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32﹣,可能存在SO32﹣、SO42﹣中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaO ( http: / / www.21cnjy.com )H溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3﹣,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br﹣,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl﹣,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl﹣;
(1)由上述分析可知,白色沉淀B为碳酸 ( http: / / www.21cnjy.com )钡,是由HCO3﹣、Ba2+、OH﹣反应生成,反应离子方程式为:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O,
故答案为:HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O;
(2)由上述分析可知,溶液中一定没有的阳离子是:Fe3+、Ba2+,
故答案为:Fe3+、Ba2+;
(3)①由上述分析可知,不能确定原溶液中是否含有Cl﹣,溶液中一定没有Br﹣.
若无色气体D是单一气体,则D为 ( http: / / www.21cnjy.com )CO2,E为CaCO3,溶液中含有CO32﹣,白色沉淀D只能为BaSO4,溶液中一定没有SO32﹣,一定含有SO42﹣,
B(碳酸钡)的物质的量==0.1mol,则n(HCO3﹣)=0.1mol,故c(HCO3﹣)==0.1mol/L,
E(碳酸钙)的物质的量==0.1mol,则n(CO32﹣)=0.1mol,故c(CO32﹣)==0.1mol/L,
D(硫酸钡)的物质的量==0.05mol,则n(SO42﹣)=0.05mol,故c(SO42﹣)==0.05mol/L,
故答案为:
阴离子 Cl﹣ Br﹣ CO32﹣ HCO3﹣ SO32﹣ SO42﹣
浓度/mol L﹣1 ? 0 0.1 0.1 0 0.05
②n(NH4+)=n(NH3)==0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3﹣)=0.1mol/L,c(CO32﹣)=0.1mol/L,c(SO42﹣)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,当溶液中没有Cl﹣,K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L﹣0.3mol.L=0.1mol/L,
故答案为:存在;K+离子最小浓度为0.1mol/L;
(4)由上述分析可知,溶液中一定含有CO32﹣、HCO3﹣,不能确定原溶液中是否含有Cl﹣,溶液中一定没有Br﹣.
若无色气体D是混合气体,只能为CO2、 ( http: / / www.21cnjy.com )NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32﹣,不能确定是否含有SO42﹣,沉淀A中一定含有BaCO3,BaSO3,
①待测液中一定含有的阴离子是CO32﹣、HCO3﹣、SO32﹣,故答案为:CO32﹣、HCO3﹣、SO32﹣;
②沉淀A中BaCO3,BaSO3能与稀硝酸反应,故答案为:BaCO3、BaSO3.
【点评】本题考查了离子的推断、检验,熟悉物 ( http: / / www.21cnjy.com )质的性质是解本题关键,根据实验过程中反应现象、离子共存条件来确定溶液中存在的离子,注意根据溶液中电荷守恒确定钾离子是否存在,同时考查学生综合运用知识解决问题的能力,题目难度较大.
14、【考点】常见离子的检验方法.
【专题】物质检验鉴别题.
【分析】溶液中加入硝酸钡后产 ( http: / / www.21cnjy.com )生白色沉淀,白色沉淀中加入盐酸沉淀部分溶解,说明沉淀中含有硫酸钡和碳酸钡,碳酸钡与盐酸反应能产生无色无味的气体二氧化碳,二氧化碳与石灰水反应能生成白色沉淀碳酸钙,故溶液中含有硫酸根离子和碳酸根离子;滤液中加入硝酸银产生不溶于硝酸的白色沉淀,说明溶液中含有氯离子,氯离子与银离子结合生成氯化银不溶于硝酸.据此分析解答.
【解答】解:溶液中加入硝酸钡后产生白色 ( http: / / www.21cnjy.com )沉淀,白色沉淀中加入盐酸沉淀部分溶解,说明沉淀中含有硫酸钡和碳酸钡,碳酸钡与盐酸反应能产生无色无味的气体二氧化碳,二氧化碳与石灰水反应能生成白色沉淀碳酸钙,故溶液中含有硫酸根离子和碳酸根离子;滤液中加入硝酸银产生不溶于硝酸的白色沉淀,说明溶液中含有氯离子,氯离子与银离子结合生成氯化银不溶于硝酸;
(1)由上述分析可知X﹣为氯离子,Y2﹣和Z2﹣为硫酸根离子和碳酸根离子,符号分别为 Cl﹣、SO42﹣、CO32﹣;
故答案为:Cl﹣;SO42﹣(CO32﹣);CO32﹣(SO42﹣);
(2)④反应为盐酸中的氢离子与碳酸钡反应生成二氧化碳的过程,离子方程式为BaCO3+2H+═Ba2++CO2↑+H2O;
⑤步反应为二氧化碳与石灰水反应,离子方程式Ca2++2OH﹣+CO2═CaCO3↓+H2O,
故答案为:BaCO3+2H+=Ba2++CO2+H2O;CO2+2OH﹣+Ca2+=CaCO3+H2O.
【点评】本题考查无机物的推断,侧重于考查学生的综合分析能力,把握白色沉淀及离子之间的反应逐一分析推断为解答的关键,题目难度不大.
15、【答案】(1)KNO3;CuSO4;
(2)Na2CO3;
(3)Al3++3H2OAl(OH)3(胶体)+3H+;
(4)Ca2++2HCO3﹣+2OH﹣=CaCO3↓+2H2O+CO32﹣;
(5)1和5;
【解析】①将它们溶于水后,D为蓝色溶液,说明D中含有离子Cu2+;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解,由以上离子可以看出,应为Al3+与OH﹣的反应,则E中含有
OH﹣,C中含有Al3+;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃),说明只有B、C中含有K+;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,则A含有HCO3﹣,C、D中产生白色沉淀该沉淀为
BaSO4,说明C、D中含有SO42﹣;
⑤将B、D两溶液混合,未见沉淀或气体生成,说明二者没有发生任何反应,则B为KNO3,
综上所述A、B、C、D、E五种常见化合物分别为:NaHCO3、KNO3、KAl(SO4)2,CuSO4,NaOH;
(1)B、D化合物分别为:KNO3、CuSO4,故答案为:KNO3;CuSO4;
(2)因NaHCO3和NaOH等物质的量反应生成碳酸钠和水,所以反应后溶液蒸干,得到一种化合物为Na2CO3,
故答案为:Na2CO3;
(3)铝离子能够发生水解生成氢氧化铝胶体和酸,离子方程式:Al3++3H2OAl(OH)3(胶体)+3H+,
故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;
(4)根据NaHCO3与少量澄清石灰水,即两者的物质的量之比为2:1,方程式为:2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+
Na2CO3,离子方程式为:Ca2++ ( http: / / www.21cnjy.com )2HCO3﹣+2OH﹣=CaCO3↓+2H2O+CO32﹣,故答案为:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+2H2O+CO32﹣;
(5)20mL2mol/LAlCl3完全转化为沉淀的质量为0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH﹣=Al(OH)3↓ ( http: / / www.21cnjy.com )和Al(OH)3+OH﹣=AlO2﹣+H2O,可知NaOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,
设NaOH的浓度为c,当NaOH不足时,
Al3++3OH﹣=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
=
解得 c═1mol/L,
当NaOH使Al(OH)3部分溶解时,设NaOH的物质的量为x,根据反应:
Al3++3OH﹣=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3 +OH﹣=AlO2﹣+H2O
78g 1mol
(3.12﹣0.78)g (x﹣0.12mol)
=
解得:x=0.15mol,
则NaOH的物质的量浓度为:c==5mol/L,
故答案为:1和5;
16、【答案】(1)NO3- SO42-; Ba2+ (2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)16Al + 9NO3-+ 7OH- ( http: / / www.21cnjy.com )=16AlO2- + NH3↑+ 4N2↑+ 2H2O;NH3 、N2 ; 9.6g (4)2
【解析】向试管中滴加浓盐酸,有少量的 ( http: / / www.21cnjy.com )无色气体生成,气体遇空气立即变为红棕色,该气体是NO,红棕色气体是NO2,这说明在反应中硝酸根被还原为NO,因此一定含有NO3-、Fe2+,则CO32-、SiO32-一定不存在;若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成,该沉淀是硫酸钡,所以一定含有硫酸根,则一定没有钡离子;若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成,该沉淀是氢氧化铁,但由于亚铁离子被还原生成了铁离子,所以不能确定是否含有离子。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成,该沉淀是氢氧化铝,则一定含有铝离子。
(1)该废水中一定含有的阴离子是NO3-、SO42-,一定不含有的阳离子是Ba2+;
(2)所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(3)设氨气是1mol,则氮气是4mol,氨气和氮气均是还原产物,则根据电子守恒,N 得到(40+8)e-,故 Al 失去 48 e-,系数为 16 根据 N 原子守恒得到系数 9,根据电荷守恒得到系数 7,最后为水,即16Al + 9NO3-+ 7OH- =16AlO2- + NH3↑+ 4N2↑+ 2H2O;若除去0.2mol X离子,则消耗铝的质量是×0.2mol×27g/mol=9.6g。
(4)Ksp(沉淀平衡常数)=[Fe3 ( http: / / www.21cnjy.com )+][OH-]3=1.0×10-2 [OH-]3=1.0×10-38,所以[OH-]=10-12,则[H+]=10-2。所以pH=2。
