4.1原电池—高二化学人教版(2019)选修一课时优化训练(含解析)
文档属性
| 名称 | 4.1原电池—高二化学人教版(2019)选修一课时优化训练(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 945.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-12 10:01:09 | ||
图片预览



文档简介
原电池—高二化学人教版(2019)选修一课时优化训练
一、单选题
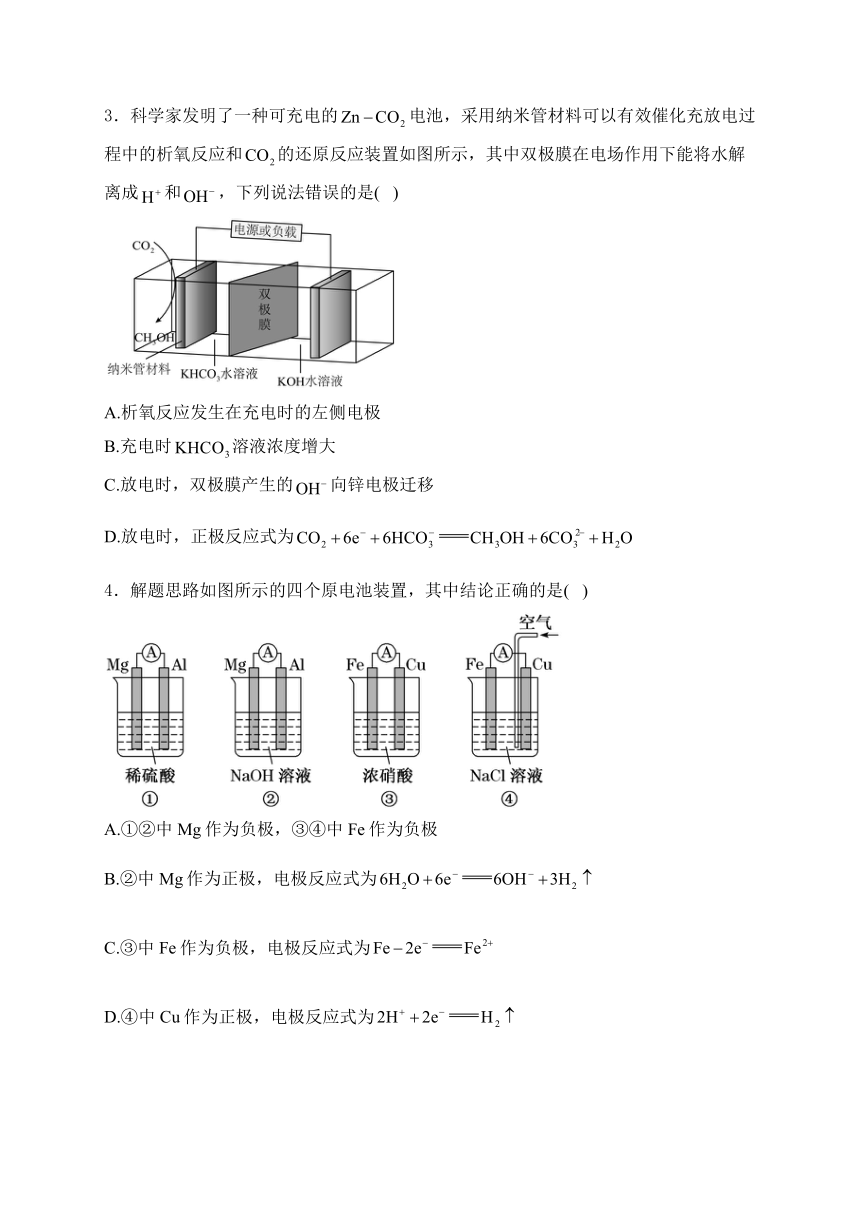
1.已知:。下列说法不正确的是( )
A.分子的共价键是键,分子的共价键是键
B.燃烧生成的HCl气体与空气中的水蒸气结合呈雾状
C.停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟
D.可通过原电池将与反应的化学能转化为电能
2.下列四个常用电化学装置的叙述正确的是( )
图Ⅰ水果电池 图Ⅱ干电池 图Ⅲ铅蓄电池 图Ⅳ氢氧燃料电池
A.图Ⅰ所示电池中,电子从锌片流出经导线流向铜片,再通过番茄内部流回锌片
B.图Ⅱ所示干电池中锌作负极,发生还原反应
C.图Ⅲ所示电池为二次电池,放电时负极的电极反应式为
D.图Ⅳ所示电池中从m处通入,a电极为正极,电极反应式为
3.科学家发明了一种可充电的电池,采用纳米管材料可以有效催化充放电过程中的析氧反应和的还原反应装置如图所示,其中双极膜在电场作用下能将水解离成和,下列说法错误的是( )
A.析氧反应发生在充电时的左侧电极
B.充电时溶液浓度增大
C.放电时,双极膜产生的向锌电极迁移
D.放电时,正极反应式为
4.解题思路如图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为
C.③中Fe作为负极,电极反应式为
D.④中Cu作为正极,电极反应式为
5.纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和,用KOH溶液作电解质溶液,电池的总反应为。关于该电池的下列叙述不正确的是( )
A.正极反应为
B.Zn极发生氧化反应,极发生还原反应
C.使用时电子由Zn极经外电路流向极,Zn是负极
D.使用时溶液中电流的方向是由极流向Zn极
6.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法正确的是( )
A.该装置是原电池,b极是负极
B.该电池工作时,应选用质子交换膜
C.该电池工作时,电子从a经电流表(A)流向b,离子从右侧经交换膜向左侧迁移
D.a极发生的反应为
7.“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
A.c极上发生的电极反应是:
B.当有0.1mol电子转移时,b极产生1.12L气体Y(标准状况下)
C.装置I与装置II的电解质溶液中,氢离子运动方向相反
D.RFC系统工作过程中只存在3种形式的能量转化
8.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀溶液
D.A是Ag,B是Fe,C为稀溶液
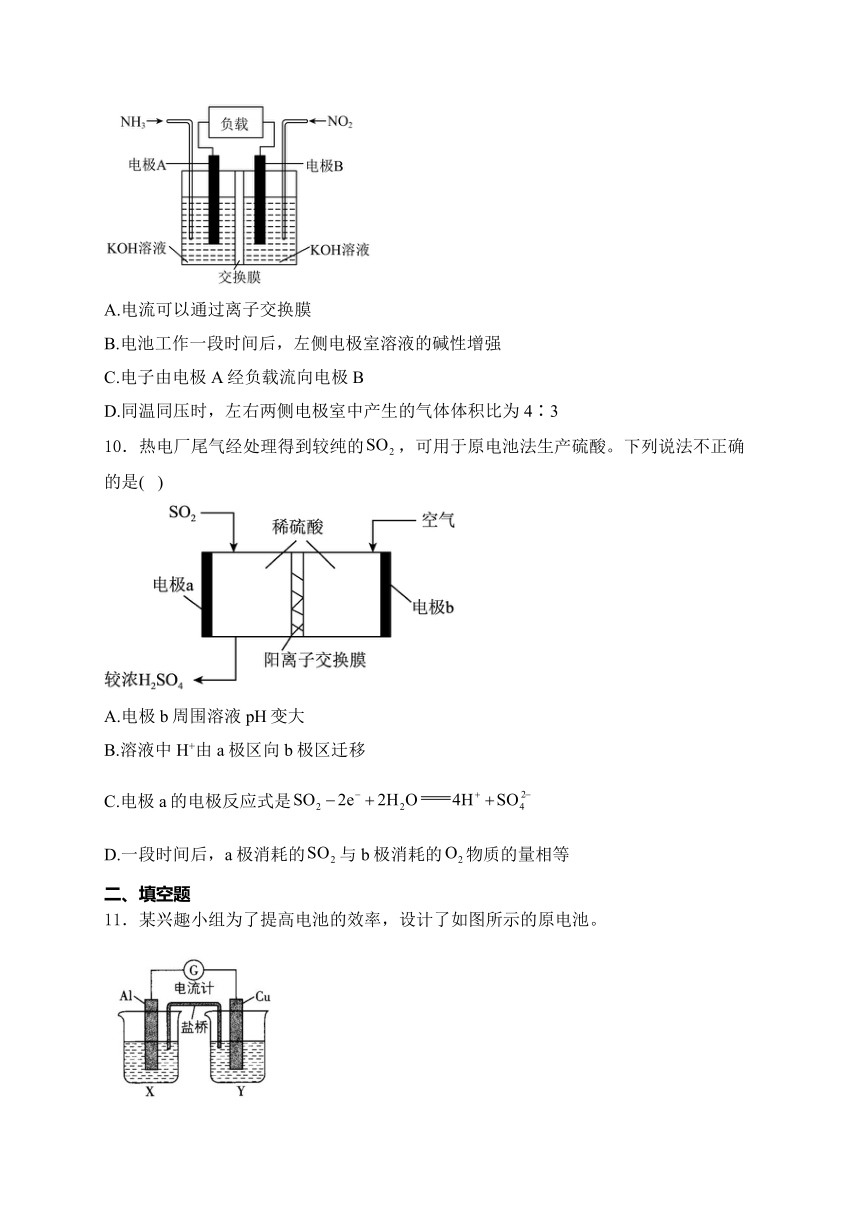
9.为有效降低含氮化物的排放量,又能充分利用化学能,合作小组利用反应设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。下列说法错误的是( )
A.电流可以通过离子交换膜
B.电池工作一段时间后,左侧电极室溶液的碱性增强
C.电子由电极A经负载流向电极B
D.同温同压时,左右两侧电极室中产生的气体体积比为4∶3
10.热电厂尾气经处理得到较纯的,可用于原电池法生产硫酸。下列说法不正确的是( )
A.电极b周围溶液pH变大
B.溶液中H+由a极区向b极区迁移
C.电极a的电极反应式是
D.一段时间后,a极消耗的与b极消耗的物质的量相等
二、填空题
11.某兴趣小组为了提高电池的效率,设计了如图所示的原电池。
请回答下列问题:
(1)若X是溶液,Y是稀硫酸,写出电极名称及电极反应式:
A1片:___________,__________________;
Cu片:___________,__________________。
(2)若X是浓硝酸,Y是NaCl溶液,写出电极名称及电极反应式:
A1片:___________,__________________;
Cu片:___________,__________________。
12.电化学在生活中的应用广泛,请根据电化学原理回答下列问题。
(1)图甲中,电流表指针发生偏转,Zn作负极,则A电极上发生的电极反应式为__________;反应进行一段时间后溶液酸性将_______(填“增强”“减弱”或“基本不变”)。
(2)可作为燃料使用,图乙为燃料电池的结构示意图,电池总反应为,则电极d是______(填“正极”或“负极”),电极c的电极反应式为____________。
(3)某原电池装置初始状态如图丙所示,电池总反应为。
当电路中转移时,交换膜左侧溶液中减少_____mol离子。交换膜右侧溶液中_____(填“>”“<”或“=”)(忽略溶液体积变化,溶于水)。
13.我国科研团队首次在月球上发现的新矿物命名为“嫦娥石”,嫦娥石的一种伴生矿物为方石英,其晶体结构和金刚石相似,嫦娥石的另一种伴生矿物为陨硫铁,主要成分为FeS, FeS可用于制备净水剂。
已知:①
②
③
④
(1)FeS煅烧可生成和,该反应的热化学方程式为__________________。
(2)在一密闭容器中加入一定量的,只发生反应:,下列指施能提高平衡转化率的是______(填标号)。
A.加入
B.使液化并及时分离
C.选择合适的催化剂并加入
D.保持压强不变充入氦气
(3)温度为,压强为时,在体积可变的密闭容器中加入一定量的固体,只发生反应:,达到平衡后,的物质的量为0.1 mol,此时压强平衡常数_______(列出计算式)。[提示:用分压计算的平衡常数为,分压=总压×气体物质的量分数]保持温度和压强不变,向容器中充入Ar,随着通入Ar的量增大,的量增大的原因是____________。若测得平衡状态下与的关系如图甲所示,为0.1 mol时,的物质的量为____________。
(4)嫦娥石中的阴离子结构单元为,的VSEPR模型名称为______。采用新型电池作为动力的汽车有极好的加速性能,这种电池中的铁元素与嫦娥石阴离子中铁元素价态_____(填“相同”或“不同”)。新型磷酸铁锂电池广泛应用于移动电源、电动汽车等领域,放电时正极材料为,写出该电池放电时正极的电极反应式:____________________。
(5)嫦娥石的一种伴生矿物为方石英,其晶体结构与金刚石类似,晶胞结构如图丙所示,Si-O键长为a nm,若A原子的原子坐标为(0,1,1),C原子的原子坐标为(0,0,0),则白球E原子的原子坐标为________。∠AED=109°28',晶胞的边长为________cm(列出计算式即可)。
三、实验题
14.高锰酸钾()是一种常用的氧化剂。回答下列问题:
Ⅰ.某实验小组用未知浓度的酸性溶液滴定的标准草酸()溶液,测定溶液的浓度(,)。实验步骤如下:
准确量取20.00mL标准草酸溶液于锥形瓶中,并加入适量硫酸,用未知浓度的溶液进行滴定,记录所用体积,平行滴定三次。消耗溶液体积如下表所示:
实验编号 初始读数/mL 最终读数/mL
1 1.20 21.15
2 1.21 24.25
3 2.11 22.16
(1)溶液应装入__________(填“酸式”或“碱式”)滴定管中。
(2)滴定终点的现象是______________________________。
(3)该溶液的物质的量浓度为__________;若锥形瓶用草酸溶液润洗,会导致测定结果__________(填“偏大”或“偏小”)。
Ⅱ.该实验小组运用所学电化学知识设计了如图装置。
(4)盐桥的作用除了形成闭合回路、将反应物隔开外,还能__________。
(5)闭合开关K并反应一段时间后,盛放酸性溶液的烧杯中的实验现象为____________________;该电池的负极电极反应式为______________________________。
参考答案
1.答案:A
解析:分子中两个Cl原子的p轨道头碰头重叠,为p—pσ键,A错误;燃烧生成的HCl气体与空气中的水蒸气结合形成盐酸小液滴,故瓶口有白雾,B正确;用蘸有浓氨水的玻璃棒靠近集气瓶口,与HCl形成固体小颗粒,产生白烟,C正确;该反应为自发的氧化还原反应,可设计成原电池,将化学能转化为电能,D正确。
2.答案:C
解析:A.图Ⅰ所示电池中锌是负极,铜是正极,电子从锌片流出经导线流向铜片,电子不能通过溶液传递,A错误;
B.图Ⅱ所示干电池中锌作负极,发生失去电子的氧化反应,B错误;
C.图Ⅲ所示电池为二次电池,放电时铅是负极,负极的电极反应式为,C正确;
D.图Ⅳ所示电池中氢离移向b电极,b电极是正极,a电极是负极,从n处通入,电极反应式为,D错误;
答案选C。
3.答案:B
解析:A.由解题思路可知,充电时,与直流电源正极相连的纳米管材料电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,所以析氧反应发生在充电时的左侧电极,故A正确;
B.由解题思路可知,充电时,与直流电源正极相连的纳米管材料电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,氢离子与溶液中的碳酸氢根离子反应生成二氧化碳和水使碳酸氢根离子浓度减小,故B错误;
C.由解题思路可知,放电时,双极膜中水离解出的氢氧根离子向锌电极迁移,故C正确;
D.由解题思路可知,放电时,纳米管材料电极为原电池的正极,碳酸氢根离子作用下二氧化碳在正极得到电子发生还原反应生成甲醇、碳酸根离子和水,电极反应式为,故D正确;
故选B。
4.答案:B
解析:②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应,失去电子,故Al作负极,③中Fe在浓硝酸中易钝化,Cu和浓硝酸反应失去电子,故Cu作负极,A、C项错误;
②中电池总反应为,负极反应式为,二者相减得到正极反应式为,B项正确;
④中Cu作正极,电极反应式为,D项错误。
5.答案:D
解析:银元素的化合价降低被还原,为正极,正极反应为,故A正确;Zn失电子作负极,发生氧化反应,得电子作正极,发生还原反应,故B正确;Zn作负极,作正极,所以电子由Zn极经外电路流向极,C正确;溶液中离子的定向移动形成电流,使用时溶液中电流的方向是由Zn极流向极,故D不正确。
6.答案:B
解析:由题意,利用一种微生物将废水中有机物[主要成分是]的化学能转化为电能的装置,即为原电池,由图中;b极通极为有机物,则b极为正极,氧气发生还原反应,A错误;该电池工作时,氢离子通过交换膜移向正极,故应选用质子交换膜,B正确;该电池工作时,电子从负极a经电流表(A)流向正极b,离子从左侧经交换膜向右侧迁移,C错误;负极电极反应为,D错误。
7.答案:A
解析:A.根据解题思路,c极上发生的电极反应是:,故A正确;
B.当有0.1mol电子转移时,b极产生0.56L气体氧气(标准状况下),故B错误;
C.a是阴极,b是阳极,装置I氢离子由b移向a;c是正极,d是负极,氢离子由d到c,运动方向相同,故C错误;
D.RFC系统工作过程中只存在光能、电能、化学能、热能的等形式的能量转化,故D错误;故选A。
8.答案:D
解析:该原电池中,A极逐渐变粗,说明A上发生还原反应,A作正极;B极逐渐变细,说明B失电子发生氧化反应,B作负极,则B的活泼性大于A的活泼性,所以排除AC选项;A极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属银,所以D符合题意;
答案选D。
9.答案:B
解析:A.电流通过离子交换膜才能形成闭合回路,A正确;
B.负极反应式为,消耗氢氧根离子的同时生成水,因此电池工作一段时间后,左侧电极室溶液的碱性减弱,B错误;
C.电极A为负极,电极B为正极,电子从电极A经负载流向电极B,C正确;
D.正极反应式为,负极反应式为,转移相同数量的电子时,正极上产生的气体与负极上产生的气体体积比为3∶4,即左右两侧电极室产生的气体体积比为4∶3,D正确;
故选B。
10.答案:D
解析:由题干图示可知,电极a作负极,发生的电极反应为:,b电极为正极,发生的电极反应为:,左侧区域产生的经过阳离子交换膜进入右侧区域,据此解题思路解题。
A.由解题思路可知,b电极为正极,发生的电极反应为:,则电极b周围溶液pH变大,A正确;
B.由解题思路可知,溶液中由a极区向b极区迁移,B正确;
C.由解题思路可知,电极a的电极反应式是,C正确;
D.根据得失电子总数相等可知,一段时间后,a极消耗的与b极消耗的物质的量的2倍,D错误;
故答案为:D。
11.答案:(1)负极;;正极;
(2)正极;;负极;
解析:(1)由装置可知,活泼金属Al为负极,发生失电子的氧化反应:;较不活泼金属Cu为正极,氢离子发生得电子的还原反应:。
(2)由于常温下浓硝酸能使Al钝化,此时Al为正极,正极上硝酸根离子得电子被还原:;Cu为负极,铜失电子被氧化:。
12.答案:(1);减弱
(2)正极;
(3)3a;>
解析:(1)Zn作负极,则A电极为正极,正极上得电子生成,正极反应式为,总反应为,则反应一段时间后溶液酸性减弱。
(2)题图乙中燃料电池工作时,发生失电子的反应生成得电子和穿过质子交换膜的结合生成,由题图乙中电子流向可知电极d为正极,电极c为负极,负极反应式为。
(3)Ag作负极,电极反应式为,当电路中转移时,消耗左侧溶液中,同时有通过交换膜进入右侧,故交换膜左侧溶液中减少离子;Pt电极为正极,电极反应式为,且通过交换膜进入右侧,故右侧溶液中。
13.答案:(1)
(2)BD
(3);该反应的正反应是气体分子数增大的反应,随着氩气通入量的增大,平衡体系中各气体的分压减小,平衡向正反应方向移动;0.7
(4)正四面体形;相同;
(5);
解析:(1)FeS煅烧生成和的化学方程式为;根据盖斯定律,③×3+④×4-①×4-②×2可得该反应的热化学方程式为。
(2)为固体,加入固体,平衡不移动,A不符合题意;使液化并及时分离,可使平衡正向移动,平衡转化率增大,B符合题意;催化剂不能使平衡移动,不改变平衡转化率,C不符合题意;该反应的正反应是气体分子数增大的反应,保持压强不变充入氦气,随着氦气通入量的增大,平衡向正反应方向移动,平衡转化率增大,D符合题意。
(3)根据可知,达到平衡后,当的物质的量为0.1 mol时,的物质的量为0.2mol,的物质的量为0.35 mol,气体的总物质的量为0.65 mol,此时压强平衡常数;该反应的正反应是气体分子数增大的反应,随着氩气通入量的增大,平衡体系中各气体的分压减小,平衡向正反应方向移动,的量增大。由图甲可知,时,,由化学方程式中的化学计量数可知。
(4)的价层电子对个数为4且不含孤电子对,根据价层电子对互斥理论可知的VSEPR模型为正四面体形;中铁元素的化合价为+2,中铁元素的化合价为+2,二者化合价相同。
(5)由晶胞结构图丙可知,若A原子的原子坐标为(0,1,1),C原子的原子坐标为(0,0,0),则白球E原子的原子坐标为;Si-O键长为,设晶胞边长为l,硅氧原子在体对角线上,硅氧键的键长为体对角线的,根据几何关系可知.
14.答案:Ⅰ.(1)酸式
(2)当滴入最后半滴高锰酸钾溶液时,溶液恰好由无色变为淡紫红色(或粉红色),且半分钟内不褪色
(3);偏小
Ⅱ.(4)平衡电荷
(5)溶液紫红色逐渐变浅;(或)
一、单选题
1.已知:。下列说法不正确的是( )
A.分子的共价键是键,分子的共价键是键
B.燃烧生成的HCl气体与空气中的水蒸气结合呈雾状
C.停止反应后,用蘸有浓氨水的玻璃棒靠近集气瓶口产生白烟
D.可通过原电池将与反应的化学能转化为电能
2.下列四个常用电化学装置的叙述正确的是( )
图Ⅰ水果电池 图Ⅱ干电池 图Ⅲ铅蓄电池 图Ⅳ氢氧燃料电池
A.图Ⅰ所示电池中,电子从锌片流出经导线流向铜片,再通过番茄内部流回锌片
B.图Ⅱ所示干电池中锌作负极,发生还原反应
C.图Ⅲ所示电池为二次电池,放电时负极的电极反应式为
D.图Ⅳ所示电池中从m处通入,a电极为正极,电极反应式为
3.科学家发明了一种可充电的电池,采用纳米管材料可以有效催化充放电过程中的析氧反应和的还原反应装置如图所示,其中双极膜在电场作用下能将水解离成和,下列说法错误的是( )
A.析氧反应发生在充电时的左侧电极
B.充电时溶液浓度增大
C.放电时,双极膜产生的向锌电极迁移
D.放电时,正极反应式为
4.解题思路如图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为
C.③中Fe作为负极,电极反应式为
D.④中Cu作为正极,电极反应式为
5.纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和,用KOH溶液作电解质溶液,电池的总反应为。关于该电池的下列叙述不正确的是( )
A.正极反应为
B.Zn极发生氧化反应,极发生还原反应
C.使用时电子由Zn极经外电路流向极,Zn是负极
D.使用时溶液中电流的方向是由极流向Zn极
6.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法正确的是( )
A.该装置是原电池,b极是负极
B.该电池工作时,应选用质子交换膜
C.该电池工作时,电子从a经电流表(A)流向b,离子从右侧经交换膜向左侧迁移
D.a极发生的反应为
7.“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
A.c极上发生的电极反应是:
B.当有0.1mol电子转移时,b极产生1.12L气体Y(标准状况下)
C.装置I与装置II的电解质溶液中,氢离子运动方向相反
D.RFC系统工作过程中只存在3种形式的能量转化
8.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀溶液
D.A是Ag,B是Fe,C为稀溶液
9.为有效降低含氮化物的排放量,又能充分利用化学能,合作小组利用反应设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。下列说法错误的是( )
A.电流可以通过离子交换膜
B.电池工作一段时间后,左侧电极室溶液的碱性增强
C.电子由电极A经负载流向电极B
D.同温同压时,左右两侧电极室中产生的气体体积比为4∶3
10.热电厂尾气经处理得到较纯的,可用于原电池法生产硫酸。下列说法不正确的是( )
A.电极b周围溶液pH变大
B.溶液中H+由a极区向b极区迁移
C.电极a的电极反应式是
D.一段时间后,a极消耗的与b极消耗的物质的量相等
二、填空题
11.某兴趣小组为了提高电池的效率,设计了如图所示的原电池。
请回答下列问题:
(1)若X是溶液,Y是稀硫酸,写出电极名称及电极反应式:
A1片:___________,__________________;
Cu片:___________,__________________。
(2)若X是浓硝酸,Y是NaCl溶液,写出电极名称及电极反应式:
A1片:___________,__________________;
Cu片:___________,__________________。
12.电化学在生活中的应用广泛,请根据电化学原理回答下列问题。
(1)图甲中,电流表指针发生偏转,Zn作负极,则A电极上发生的电极反应式为__________;反应进行一段时间后溶液酸性将_______(填“增强”“减弱”或“基本不变”)。
(2)可作为燃料使用,图乙为燃料电池的结构示意图,电池总反应为,则电极d是______(填“正极”或“负极”),电极c的电极反应式为____________。
(3)某原电池装置初始状态如图丙所示,电池总反应为。
当电路中转移时,交换膜左侧溶液中减少_____mol离子。交换膜右侧溶液中_____(填“>”“<”或“=”)(忽略溶液体积变化,溶于水)。
13.我国科研团队首次在月球上发现的新矿物命名为“嫦娥石”,嫦娥石的一种伴生矿物为方石英,其晶体结构和金刚石相似,嫦娥石的另一种伴生矿物为陨硫铁,主要成分为FeS, FeS可用于制备净水剂。
已知:①
②
③
④
(1)FeS煅烧可生成和,该反应的热化学方程式为__________________。
(2)在一密闭容器中加入一定量的,只发生反应:,下列指施能提高平衡转化率的是______(填标号)。
A.加入
B.使液化并及时分离
C.选择合适的催化剂并加入
D.保持压强不变充入氦气
(3)温度为,压强为时,在体积可变的密闭容器中加入一定量的固体,只发生反应:,达到平衡后,的物质的量为0.1 mol,此时压强平衡常数_______(列出计算式)。[提示:用分压计算的平衡常数为,分压=总压×气体物质的量分数]保持温度和压强不变,向容器中充入Ar,随着通入Ar的量增大,的量增大的原因是____________。若测得平衡状态下与的关系如图甲所示,为0.1 mol时,的物质的量为____________。
(4)嫦娥石中的阴离子结构单元为,的VSEPR模型名称为______。采用新型电池作为动力的汽车有极好的加速性能,这种电池中的铁元素与嫦娥石阴离子中铁元素价态_____(填“相同”或“不同”)。新型磷酸铁锂电池广泛应用于移动电源、电动汽车等领域,放电时正极材料为,写出该电池放电时正极的电极反应式:____________________。
(5)嫦娥石的一种伴生矿物为方石英,其晶体结构与金刚石类似,晶胞结构如图丙所示,Si-O键长为a nm,若A原子的原子坐标为(0,1,1),C原子的原子坐标为(0,0,0),则白球E原子的原子坐标为________。∠AED=109°28',晶胞的边长为________cm(列出计算式即可)。
三、实验题
14.高锰酸钾()是一种常用的氧化剂。回答下列问题:
Ⅰ.某实验小组用未知浓度的酸性溶液滴定的标准草酸()溶液,测定溶液的浓度(,)。实验步骤如下:
准确量取20.00mL标准草酸溶液于锥形瓶中,并加入适量硫酸,用未知浓度的溶液进行滴定,记录所用体积,平行滴定三次。消耗溶液体积如下表所示:
实验编号 初始读数/mL 最终读数/mL
1 1.20 21.15
2 1.21 24.25
3 2.11 22.16
(1)溶液应装入__________(填“酸式”或“碱式”)滴定管中。
(2)滴定终点的现象是______________________________。
(3)该溶液的物质的量浓度为__________;若锥形瓶用草酸溶液润洗,会导致测定结果__________(填“偏大”或“偏小”)。
Ⅱ.该实验小组运用所学电化学知识设计了如图装置。
(4)盐桥的作用除了形成闭合回路、将反应物隔开外,还能__________。
(5)闭合开关K并反应一段时间后,盛放酸性溶液的烧杯中的实验现象为____________________;该电池的负极电极反应式为______________________________。
参考答案
1.答案:A
解析:分子中两个Cl原子的p轨道头碰头重叠,为p—pσ键,A错误;燃烧生成的HCl气体与空气中的水蒸气结合形成盐酸小液滴,故瓶口有白雾,B正确;用蘸有浓氨水的玻璃棒靠近集气瓶口,与HCl形成固体小颗粒,产生白烟,C正确;该反应为自发的氧化还原反应,可设计成原电池,将化学能转化为电能,D正确。
2.答案:C
解析:A.图Ⅰ所示电池中锌是负极,铜是正极,电子从锌片流出经导线流向铜片,电子不能通过溶液传递,A错误;
B.图Ⅱ所示干电池中锌作负极,发生失去电子的氧化反应,B错误;
C.图Ⅲ所示电池为二次电池,放电时铅是负极,负极的电极反应式为,C正确;
D.图Ⅳ所示电池中氢离移向b电极,b电极是正极,a电极是负极,从n处通入,电极反应式为,D错误;
答案选C。
3.答案:B
解析:A.由解题思路可知,充电时,与直流电源正极相连的纳米管材料电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,所以析氧反应发生在充电时的左侧电极,故A正确;
B.由解题思路可知,充电时,与直流电源正极相连的纳米管材料电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,氢离子与溶液中的碳酸氢根离子反应生成二氧化碳和水使碳酸氢根离子浓度减小,故B错误;
C.由解题思路可知,放电时,双极膜中水离解出的氢氧根离子向锌电极迁移,故C正确;
D.由解题思路可知,放电时,纳米管材料电极为原电池的正极,碳酸氢根离子作用下二氧化碳在正极得到电子发生还原反应生成甲醇、碳酸根离子和水,电极反应式为,故D正确;
故选B。
4.答案:B
解析:②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应,失去电子,故Al作负极,③中Fe在浓硝酸中易钝化,Cu和浓硝酸反应失去电子,故Cu作负极,A、C项错误;
②中电池总反应为,负极反应式为,二者相减得到正极反应式为,B项正确;
④中Cu作正极,电极反应式为,D项错误。
5.答案:D
解析:银元素的化合价降低被还原,为正极,正极反应为,故A正确;Zn失电子作负极,发生氧化反应,得电子作正极,发生还原反应,故B正确;Zn作负极,作正极,所以电子由Zn极经外电路流向极,C正确;溶液中离子的定向移动形成电流,使用时溶液中电流的方向是由Zn极流向极,故D不正确。
6.答案:B
解析:由题意,利用一种微生物将废水中有机物[主要成分是]的化学能转化为电能的装置,即为原电池,由图中;b极通极为有机物,则b极为正极,氧气发生还原反应,A错误;该电池工作时,氢离子通过交换膜移向正极,故应选用质子交换膜,B正确;该电池工作时,电子从负极a经电流表(A)流向正极b,离子从左侧经交换膜向右侧迁移,C错误;负极电极反应为,D错误。
7.答案:A
解析:A.根据解题思路,c极上发生的电极反应是:,故A正确;
B.当有0.1mol电子转移时,b极产生0.56L气体氧气(标准状况下),故B错误;
C.a是阴极,b是阳极,装置I氢离子由b移向a;c是正极,d是负极,氢离子由d到c,运动方向相同,故C错误;
D.RFC系统工作过程中只存在光能、电能、化学能、热能的等形式的能量转化,故D错误;故选A。
8.答案:D
解析:该原电池中,A极逐渐变粗,说明A上发生还原反应,A作正极;B极逐渐变细,说明B失电子发生氧化反应,B作负极,则B的活泼性大于A的活泼性,所以排除AC选项;A极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属银,所以D符合题意;
答案选D。
9.答案:B
解析:A.电流通过离子交换膜才能形成闭合回路,A正确;
B.负极反应式为,消耗氢氧根离子的同时生成水,因此电池工作一段时间后,左侧电极室溶液的碱性减弱,B错误;
C.电极A为负极,电极B为正极,电子从电极A经负载流向电极B,C正确;
D.正极反应式为,负极反应式为,转移相同数量的电子时,正极上产生的气体与负极上产生的气体体积比为3∶4,即左右两侧电极室产生的气体体积比为4∶3,D正确;
故选B。
10.答案:D
解析:由题干图示可知,电极a作负极,发生的电极反应为:,b电极为正极,发生的电极反应为:,左侧区域产生的经过阳离子交换膜进入右侧区域,据此解题思路解题。
A.由解题思路可知,b电极为正极,发生的电极反应为:,则电极b周围溶液pH变大,A正确;
B.由解题思路可知,溶液中由a极区向b极区迁移,B正确;
C.由解题思路可知,电极a的电极反应式是,C正确;
D.根据得失电子总数相等可知,一段时间后,a极消耗的与b极消耗的物质的量的2倍,D错误;
故答案为:D。
11.答案:(1)负极;;正极;
(2)正极;;负极;
解析:(1)由装置可知,活泼金属Al为负极,发生失电子的氧化反应:;较不活泼金属Cu为正极,氢离子发生得电子的还原反应:。
(2)由于常温下浓硝酸能使Al钝化,此时Al为正极,正极上硝酸根离子得电子被还原:;Cu为负极,铜失电子被氧化:。
12.答案:(1);减弱
(2)正极;
(3)3a;>
解析:(1)Zn作负极,则A电极为正极,正极上得电子生成,正极反应式为,总反应为,则反应一段时间后溶液酸性减弱。
(2)题图乙中燃料电池工作时,发生失电子的反应生成得电子和穿过质子交换膜的结合生成,由题图乙中电子流向可知电极d为正极,电极c为负极,负极反应式为。
(3)Ag作负极,电极反应式为,当电路中转移时,消耗左侧溶液中,同时有通过交换膜进入右侧,故交换膜左侧溶液中减少离子;Pt电极为正极,电极反应式为,且通过交换膜进入右侧,故右侧溶液中。
13.答案:(1)
(2)BD
(3);该反应的正反应是气体分子数增大的反应,随着氩气通入量的增大,平衡体系中各气体的分压减小,平衡向正反应方向移动;0.7
(4)正四面体形;相同;
(5);
解析:(1)FeS煅烧生成和的化学方程式为;根据盖斯定律,③×3+④×4-①×4-②×2可得该反应的热化学方程式为。
(2)为固体,加入固体,平衡不移动,A不符合题意;使液化并及时分离,可使平衡正向移动,平衡转化率增大,B符合题意;催化剂不能使平衡移动,不改变平衡转化率,C不符合题意;该反应的正反应是气体分子数增大的反应,保持压强不变充入氦气,随着氦气通入量的增大,平衡向正反应方向移动,平衡转化率增大,D符合题意。
(3)根据可知,达到平衡后,当的物质的量为0.1 mol时,的物质的量为0.2mol,的物质的量为0.35 mol,气体的总物质的量为0.65 mol,此时压强平衡常数;该反应的正反应是气体分子数增大的反应,随着氩气通入量的增大,平衡体系中各气体的分压减小,平衡向正反应方向移动,的量增大。由图甲可知,时,,由化学方程式中的化学计量数可知。
(4)的价层电子对个数为4且不含孤电子对,根据价层电子对互斥理论可知的VSEPR模型为正四面体形;中铁元素的化合价为+2,中铁元素的化合价为+2,二者化合价相同。
(5)由晶胞结构图丙可知,若A原子的原子坐标为(0,1,1),C原子的原子坐标为(0,0,0),则白球E原子的原子坐标为;Si-O键长为,设晶胞边长为l,硅氧原子在体对角线上,硅氧键的键长为体对角线的,根据几何关系可知.
14.答案:Ⅰ.(1)酸式
(2)当滴入最后半滴高锰酸钾溶液时,溶液恰好由无色变为淡紫红色(或粉红色),且半分钟内不褪色
(3);偏小
Ⅱ.(4)平衡电荷
(5)溶液紫红色逐渐变浅;(或)
