4.5 实验活动制作简单的燃料电池—高二化学人教版(2019)选修一课时优化训练(含解析)
文档属性
| 名称 | 4.5 实验活动制作简单的燃料电池—高二化学人教版(2019)选修一课时优化训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 491.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-12 10:23:51 | ||
图片预览



文档简介
实验活动 制作简单的燃料电池—高二化学人教版(2019)选修一课时优化训练
一、单选题
1.下列事实不能用电化学原理解释的是( )
A.轮船水线以下的船壳上装一定数量的锌块
B.纯银制品在空气中变暗
C.纯锌与稀硫酸反应时,滴入少量的溶液后速率加快
D.镀锌铁(在铁上镀一层锌)比镀锡铁耐用
2.锂水电池是一种可用于鱼雷和潜艇的贮备电池。该电池的电极材料是Li和钢板,电解质为LiOH,使用时加水即可工作。下列有关该电池的说法正确的是( )
A.Li为负极,电池工作时,Li电极生成
B.钢板为正极,水在该电极被氧化
C.放电时,水中的向正极移动
D.电池工作时,水只起到溶剂作用,溶解电解质
3.下列关于气体摩尔体积的说法不正确的是( )
A.指单位物质的量的气体所占的体积
B.常用单位为或
C.常温常压下,1mol任何气体的体积均约为22.4L
D.其数值不是固定不变的,受温度和压强影响
4.100 mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( )
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
5.下列有关电化学的装置示意图正确的是( )
A.铜锌原电池 B.铜锌原电池
C.精炼铜 D.电解饱和食盐水
6.二氧化碳甲烷化的研究对缓解能源危机意义重大。以催化二氧化碳甲烷化的反应机理如图所示(与作用生成和)。下列说法不正确的是( )
A.被还原
B.放出能量
C.为中间产物
D.该反应的总方程式可表示为
7.2006年科学家们发明了一种能够给电子设备提供动力的新型燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合,从而省去了昂贵的燃料隔膜,其工作原理如图所示。下列说法中错误的是( )
A.该燃料电池可以提供清洁无污染的能源,具有广阔的发展空间
B.在高温环境中该电池无法正常工作.
C.右边的电极反应式为,该电极是电池的正极
D.为使电池持续工作,需要在两极不断通入和空气(氧气)
8.在冶金工业上,均不能用通常化学还原剂制得的金属组是( )
A.Na、Mg、Al B.Na、K、Zn C.Fe、Cu、Ag D.Na、Ca、Cu
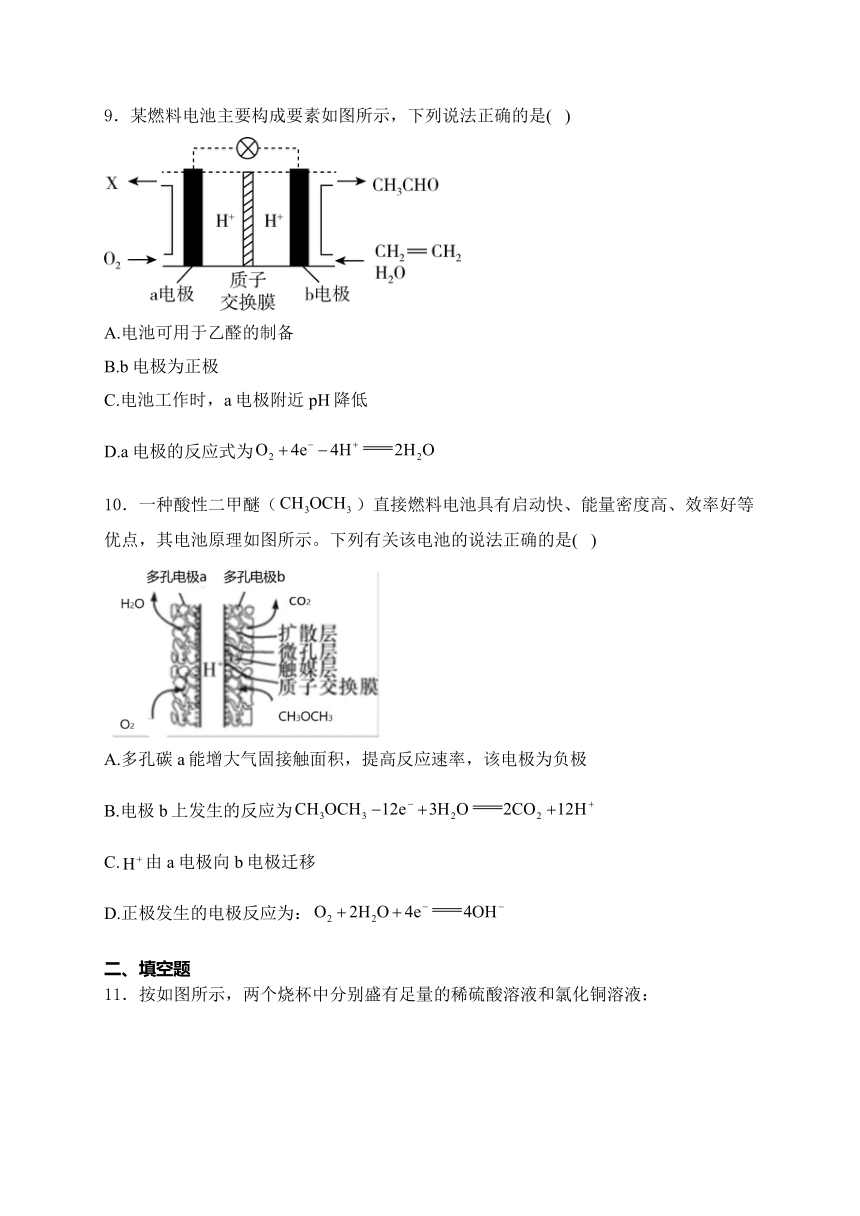
9.某燃料电池主要构成要素如图所示,下列说法正确的是( )
A.电池可用于乙醛的制备
B.b电极为正极
C.电池工作时,a电极附近pH降低
D.a电极的反应式为
10.一种酸性二甲醚()直接燃料电池具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法正确的是( )
A.多孔碳a能增大气固接触面积,提高反应速率,该电极为负极
B.电极b上发生的反应为
C.由a电极向b电极迁移
D.正极发生的电极反应为:
二、填空题
11.按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
(1)A、B两个装置中,属于原电池的是______(填标号)
(2)A池中,铜极为________极,发生_________反应 (填“氧化”“还原”),电极反应式为_______。
(3)B池中,左边C是_____极,电极反应式为:______;总反应式为________。
12.含氯化合物广泛用作水处理剂及漂白剂等。
已知:25℃时NaClO溶液中HClO、的物质的量分数随pH的分布如下图所示。
(1)工业上将通入的NaOH溶液中制备NaClO。
①该反应的离子方程式为_______;
②当溶液时,该溶液中主要存在的阴离子有______(填化学式);
③25℃时,反应的平衡常数K=________(填数值)。
(2)工业常用石灰乳和反应制取漂白粉,反应放热,温度过高时会发生副反应生成。反应过程中缓缓通入的目的是______。
(3)实验室将通入含水8%的固体中可制备,生成的气体仅为,该反应的化学方程式为_______。
13.研究的再利用有利于低碳减排的同时获得新的能源物质。如一定条件下,加氢可制得甲醇:。回答下列问题:
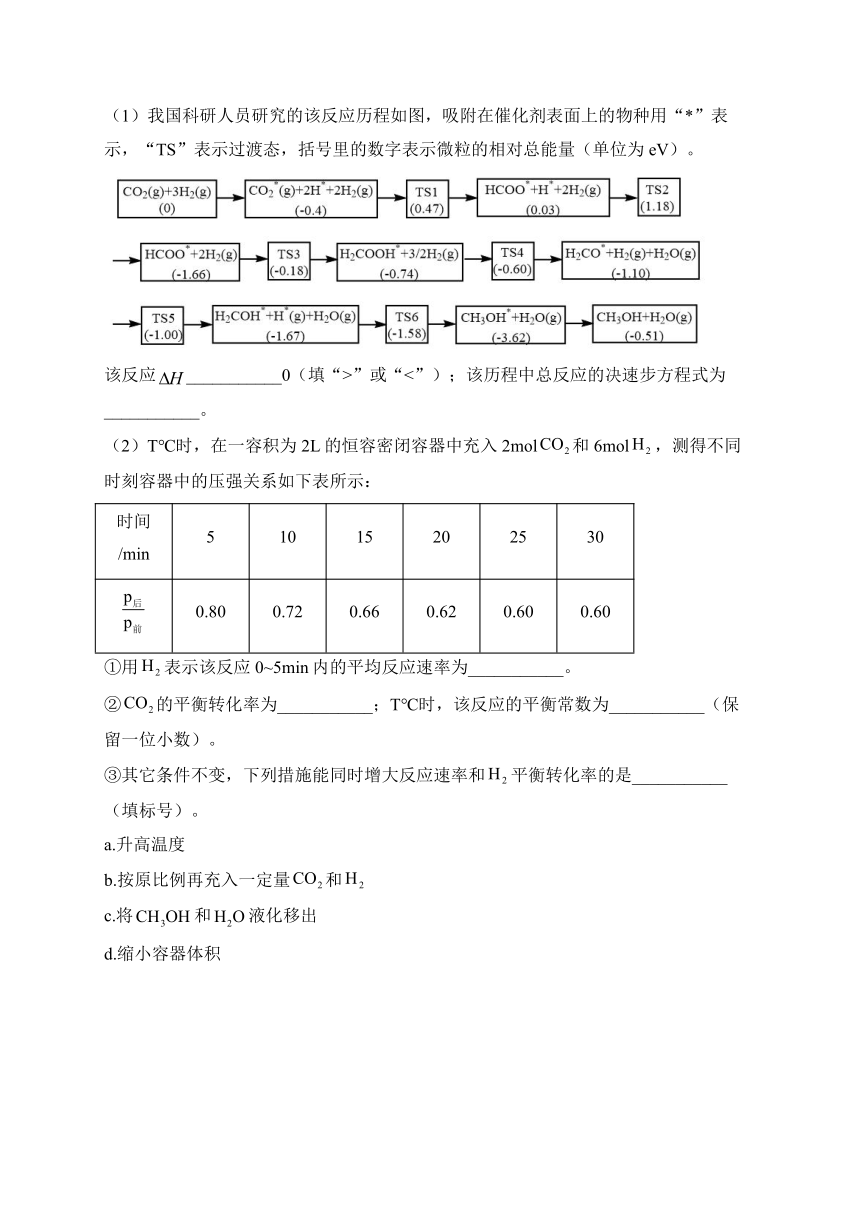
(1)我国科研人员研究的该反应历程如图,吸附在催化剂表面上的物种用“*”表示,“TS”表示过渡态,括号里的数字表示微粒的相对总能量(单位为eV)。
该反应___________0(填“>”或“<”);该历程中总反应的决速步方程式为___________。
(2)T℃时,在一容积为2L的恒容密闭容器中充入2mol和6mol,测得不同时刻容器中的压强关系如下表所示:
时间/min 5 10 15 20 25 30
0.80 0.72 0.66 0.62 0.60 0.60
①用表示该反应0~5min内的平均反应速率为___________。
②的平衡转化率为___________;T℃时,该反应的平衡常数为___________(保留一位小数)。
③其它条件不变,下列措施能同时增大反应速率和平衡转化率的是___________(填标号)。
a.升高温度
b.按原比例再充入一定量和
c.将和液化移出
d.缩小容器体积
参考答案
1.答案:B
解析:A.轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应可用电化学知识解释,A错误;
B.纯银制品在空气中变暗是因为和空气中的硫化物作用生成了硫化银,与电化学知识无关,B正确;
C.纯Zn和稀反应速率慢,滴入后,发生的反应,生成的Cu和Zn组成原电池,加快Zn与的反应速率;发生原电池反应而可用电化学知识解释,C错误;
D.镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀.所以,镀锌铁比镀锡铁耐用,发生原电池反应而可用电化学知识解释,D错误;
故选B。
2.答案:C
解析:A.Li为负极,负极反应为,不产生,正极才产生,A项错误;
B.钢板为正极,正极反应为,水被还原,B项错误;
C.电池工作时,阳离子移向正极,C项正确;
D.电池工作时,水既是溶剂又是氧化剂,D项错误;
故选C。
3.答案:C
解析:A、气体摩尔体积的概念是指一定条件下,单位物质的量的气体所占的体积,故A正确;
B、气体摩尔体积的常用单位为或,选项B正确;
C、标准状况下,1mol任何气体的体积均约为22.4L,选项C不正确;
D、气体摩尔体积受温度和压强的影响,其数值不是固定不变的,选项D正确。
故选C。
4.答案:B
解析:A.加入浓度稍高的盐酸会提高盐酸的浓度,从而加快反应速率,但是会增加生成氢气的总量,故A项错误;
B.加入氯化铜溶液,过量的锌片会置换出部分铜单质,与锌构成原电池且锌为负极可加快反应速率,且不影响氢气的生成量,故B项正确;
C.加入适量蒸馏水会稀释溶液,降低反应速率,故C项错误;
D.加入适量氯化钠溶液会稀释原溶液,降低反应速率,故D项错误;
故选B。
5.答案:D
解析:A.铜锌原电池中锌作负极,铜作正极,故A错误;
B.带有盐桥的铜锌原电池中,作负极锌的电解液为硫酸锌,做正极铜的电解液为硫酸铜,故B错误;
C.在精炼铜中,粗铜作阳极与电源正极相连,精铜作阴极,与电源的负极相连,电解液为硫酸铜溶液,故C错误;
D.电解饱和食盐水的阳极产生氯气,阴极产生氢气,故D正确;
故选D。
6.答案:B
解析:A.与作用生成和,的化合价由+4降至+3,的化合价由+2降至0,故被还原,故A正确;
B.,化学键断裂,吸收能量,故B错误;
C.由图知,催化二氧化碳甲烷化过程中生成的,又参与后续反应被消耗,故为中间产物,故C正确;
D.由图示反应机理知,该反应的总方程式可表示为,故D正确;
故选B。
7.答案:C
解析:A.该燃料电池总反应为,故可以提供清洁无污染的能源,具有广阔的发展空间,A正确;B.酶是蛋白质,在高温环境中该电池无法正常工作,B正确;C.右边的电极反应式为,则该反应为氧化反应,该电极是电池的负极,C错误;D.由于氢气和氧气不断消耗,为使电池持续工作,需要在两极不断通入和空气(氧气),D正确;故选C。
8.答案:A
解析:A.钠、镁、铝都是活泼金属,工业上采用电解其熔融盐或氧化物的方法治炼,故A正确;B.锌属于较活泼金属,工业上可以采用热还原法治炼,故B错误;C.银较不活泼,工业上可以采用热分解法治炼,故C错误;D.铜属于较不活泼金属,工业上可以采用热还原法治炼,故D错误;故选A。
9.答案:A
解析:A.该电池将乙烯和水转化为了乙醛,可用于乙醛的制备,故A符合题意;B.根据解题思路,a电极为正极,b电极为负极,故B不符合题意;C.电池工作时,氢离子移向正极,a电极的反应式为,a电极附近pH不变,故C不符合题意;D.根据解题思路,a电极为正极,正极发生还原反应,a电极的反应式为,故D不符合题意;答案选A。
10.答案:B
解析:A.采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,而该极是氧气放电,所以是正极,而不是负极,故A项错误;B.电极b是负极发生氧化反应,电极反应式为,故B项正确;C.阳离子向正极移动,所以由b电极向a电极迁移,故C项错误;D.正极是氧气得电子生成水,发生的电极反应为:,故D项错误;故选B。
11.答案:(1)A
(2)正极;还原;
(3)阳极;;
解析:(1)装置A中没有外接电源,是原电池;装置B有外接电源,属于电解池。故答案:A。
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,发生还原反应产生氢气,其反应的电极反应式为:,故答案:正极;还原;。
(3)左侧电极和电源的正极相连,作阳极,溶液中的氯离子放电,产生氯气。阳极离子放电,放出,电极反应方程式:。阴极是放电生成铜,所以总反应式为,故答案:阳极;;。
12.答案:(1);、;
(2)控制温度,减少副反应发生,提高产率;增加氯气与碱液接触时间,充分反应
(3)
解析:(1)①和氢氧化钠反应生成氯化钠,次氯酸钠和水,离子反应方程式为:;
②由图可知,当pH=9时,该溶液中主要存在的阴离子有;
③根据图中信息可知当pH=7.5时,,25℃时,,
的K==;
(2) 工业常用石灰乳和反应制取漂白粉,反应放热,温度过高时会发生副反应生成,反应过程中缓缓通入的目的是控制温度,减少副反应发生,提高产率;增加氯气与碱液接触时间,充分反应;
(3)与含水8%的固体中可制备,化学反应方程式为:;
13.答案:(1)<;
(2);80%;14.8;bd
解析:(1)该反应= 0.51eV,物质能量降低,反应放出热量,即<0;该历程中总反应的决速步主要是活化能的大小,活化能越大,反应速率越慢,因此总反应的决速步方程式为;故答案为:。
(2)
①5min时建立三段式,,解得x=0.8,用表示该反应0~5min内的平均反应速率;故答案为:。
②平衡时建立三段式,,解得y=1.6,的平衡转化率为;T℃时,该反应的平衡常数为;故答案为:80%;14.8。
③a.升高温度,反应速率增大,平衡逆向移动,氢气转化率降低,故a不符合题意;b.按原比例再充入一定量和,反应速率增大,相当于加压,平衡正向移动,氢气转化率增大,故b符合题意;c.将和液化移出,反应速率降低,故c不符合题意;d.缩小容器体积,浓度增大,反应速率增大,平衡正向移动,氢气转化率增大,故d符合题意;综上所述,答案为:bd。
一、单选题
1.下列事实不能用电化学原理解释的是( )
A.轮船水线以下的船壳上装一定数量的锌块
B.纯银制品在空气中变暗
C.纯锌与稀硫酸反应时,滴入少量的溶液后速率加快
D.镀锌铁(在铁上镀一层锌)比镀锡铁耐用
2.锂水电池是一种可用于鱼雷和潜艇的贮备电池。该电池的电极材料是Li和钢板,电解质为LiOH,使用时加水即可工作。下列有关该电池的说法正确的是( )
A.Li为负极,电池工作时,Li电极生成
B.钢板为正极,水在该电极被氧化
C.放电时,水中的向正极移动
D.电池工作时,水只起到溶剂作用,溶解电解质
3.下列关于气体摩尔体积的说法不正确的是( )
A.指单位物质的量的气体所占的体积
B.常用单位为或
C.常温常压下,1mol任何气体的体积均约为22.4L
D.其数值不是固定不变的,受温度和压强影响
4.100 mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( )
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
5.下列有关电化学的装置示意图正确的是( )
A.铜锌原电池 B.铜锌原电池
C.精炼铜 D.电解饱和食盐水
6.二氧化碳甲烷化的研究对缓解能源危机意义重大。以催化二氧化碳甲烷化的反应机理如图所示(与作用生成和)。下列说法不正确的是( )
A.被还原
B.放出能量
C.为中间产物
D.该反应的总方程式可表示为
7.2006年科学家们发明了一种能够给电子设备提供动力的新型燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合,从而省去了昂贵的燃料隔膜,其工作原理如图所示。下列说法中错误的是( )
A.该燃料电池可以提供清洁无污染的能源,具有广阔的发展空间
B.在高温环境中该电池无法正常工作.
C.右边的电极反应式为,该电极是电池的正极
D.为使电池持续工作,需要在两极不断通入和空气(氧气)
8.在冶金工业上,均不能用通常化学还原剂制得的金属组是( )
A.Na、Mg、Al B.Na、K、Zn C.Fe、Cu、Ag D.Na、Ca、Cu
9.某燃料电池主要构成要素如图所示,下列说法正确的是( )
A.电池可用于乙醛的制备
B.b电极为正极
C.电池工作时,a电极附近pH降低
D.a电极的反应式为
10.一种酸性二甲醚()直接燃料电池具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法正确的是( )
A.多孔碳a能增大气固接触面积,提高反应速率,该电极为负极
B.电极b上发生的反应为
C.由a电极向b电极迁移
D.正极发生的电极反应为:
二、填空题
11.按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
(1)A、B两个装置中,属于原电池的是______(填标号)
(2)A池中,铜极为________极,发生_________反应 (填“氧化”“还原”),电极反应式为_______。
(3)B池中,左边C是_____极,电极反应式为:______;总反应式为________。
12.含氯化合物广泛用作水处理剂及漂白剂等。
已知:25℃时NaClO溶液中HClO、的物质的量分数随pH的分布如下图所示。
(1)工业上将通入的NaOH溶液中制备NaClO。
①该反应的离子方程式为_______;
②当溶液时,该溶液中主要存在的阴离子有______(填化学式);
③25℃时,反应的平衡常数K=________(填数值)。
(2)工业常用石灰乳和反应制取漂白粉,反应放热,温度过高时会发生副反应生成。反应过程中缓缓通入的目的是______。
(3)实验室将通入含水8%的固体中可制备,生成的气体仅为,该反应的化学方程式为_______。
13.研究的再利用有利于低碳减排的同时获得新的能源物质。如一定条件下,加氢可制得甲醇:。回答下列问题:
(1)我国科研人员研究的该反应历程如图,吸附在催化剂表面上的物种用“*”表示,“TS”表示过渡态,括号里的数字表示微粒的相对总能量(单位为eV)。
该反应___________0(填“>”或“<”);该历程中总反应的决速步方程式为___________。
(2)T℃时,在一容积为2L的恒容密闭容器中充入2mol和6mol,测得不同时刻容器中的压强关系如下表所示:
时间/min 5 10 15 20 25 30
0.80 0.72 0.66 0.62 0.60 0.60
①用表示该反应0~5min内的平均反应速率为___________。
②的平衡转化率为___________;T℃时,该反应的平衡常数为___________(保留一位小数)。
③其它条件不变,下列措施能同时增大反应速率和平衡转化率的是___________(填标号)。
a.升高温度
b.按原比例再充入一定量和
c.将和液化移出
d.缩小容器体积
参考答案
1.答案:B
解析:A.轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应可用电化学知识解释,A错误;
B.纯银制品在空气中变暗是因为和空气中的硫化物作用生成了硫化银,与电化学知识无关,B正确;
C.纯Zn和稀反应速率慢,滴入后,发生的反应,生成的Cu和Zn组成原电池,加快Zn与的反应速率;发生原电池反应而可用电化学知识解释,C错误;
D.镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀.所以,镀锌铁比镀锡铁耐用,发生原电池反应而可用电化学知识解释,D错误;
故选B。
2.答案:C
解析:A.Li为负极,负极反应为,不产生,正极才产生,A项错误;
B.钢板为正极,正极反应为,水被还原,B项错误;
C.电池工作时,阳离子移向正极,C项正确;
D.电池工作时,水既是溶剂又是氧化剂,D项错误;
故选C。
3.答案:C
解析:A、气体摩尔体积的概念是指一定条件下,单位物质的量的气体所占的体积,故A正确;
B、气体摩尔体积的常用单位为或,选项B正确;
C、标准状况下,1mol任何气体的体积均约为22.4L,选项C不正确;
D、气体摩尔体积受温度和压强的影响,其数值不是固定不变的,选项D正确。
故选C。
4.答案:B
解析:A.加入浓度稍高的盐酸会提高盐酸的浓度,从而加快反应速率,但是会增加生成氢气的总量,故A项错误;
B.加入氯化铜溶液,过量的锌片会置换出部分铜单质,与锌构成原电池且锌为负极可加快反应速率,且不影响氢气的生成量,故B项正确;
C.加入适量蒸馏水会稀释溶液,降低反应速率,故C项错误;
D.加入适量氯化钠溶液会稀释原溶液,降低反应速率,故D项错误;
故选B。
5.答案:D
解析:A.铜锌原电池中锌作负极,铜作正极,故A错误;
B.带有盐桥的铜锌原电池中,作负极锌的电解液为硫酸锌,做正极铜的电解液为硫酸铜,故B错误;
C.在精炼铜中,粗铜作阳极与电源正极相连,精铜作阴极,与电源的负极相连,电解液为硫酸铜溶液,故C错误;
D.电解饱和食盐水的阳极产生氯气,阴极产生氢气,故D正确;
故选D。
6.答案:B
解析:A.与作用生成和,的化合价由+4降至+3,的化合价由+2降至0,故被还原,故A正确;
B.,化学键断裂,吸收能量,故B错误;
C.由图知,催化二氧化碳甲烷化过程中生成的,又参与后续反应被消耗,故为中间产物,故C正确;
D.由图示反应机理知,该反应的总方程式可表示为,故D正确;
故选B。
7.答案:C
解析:A.该燃料电池总反应为,故可以提供清洁无污染的能源,具有广阔的发展空间,A正确;B.酶是蛋白质,在高温环境中该电池无法正常工作,B正确;C.右边的电极反应式为,则该反应为氧化反应,该电极是电池的负极,C错误;D.由于氢气和氧气不断消耗,为使电池持续工作,需要在两极不断通入和空气(氧气),D正确;故选C。
8.答案:A
解析:A.钠、镁、铝都是活泼金属,工业上采用电解其熔融盐或氧化物的方法治炼,故A正确;B.锌属于较活泼金属,工业上可以采用热还原法治炼,故B错误;C.银较不活泼,工业上可以采用热分解法治炼,故C错误;D.铜属于较不活泼金属,工业上可以采用热还原法治炼,故D错误;故选A。
9.答案:A
解析:A.该电池将乙烯和水转化为了乙醛,可用于乙醛的制备,故A符合题意;B.根据解题思路,a电极为正极,b电极为负极,故B不符合题意;C.电池工作时,氢离子移向正极,a电极的反应式为,a电极附近pH不变,故C不符合题意;D.根据解题思路,a电极为正极,正极发生还原反应,a电极的反应式为,故D不符合题意;答案选A。
10.答案:B
解析:A.采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,而该极是氧气放电,所以是正极,而不是负极,故A项错误;B.电极b是负极发生氧化反应,电极反应式为,故B项正确;C.阳离子向正极移动,所以由b电极向a电极迁移,故C项错误;D.正极是氧气得电子生成水,发生的电极反应为:,故D项错误;故选B。
11.答案:(1)A
(2)正极;还原;
(3)阳极;;
解析:(1)装置A中没有外接电源,是原电池;装置B有外接电源,属于电解池。故答案:A。
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,发生还原反应产生氢气,其反应的电极反应式为:,故答案:正极;还原;。
(3)左侧电极和电源的正极相连,作阳极,溶液中的氯离子放电,产生氯气。阳极离子放电,放出,电极反应方程式:。阴极是放电生成铜,所以总反应式为,故答案:阳极;;。
12.答案:(1);、;
(2)控制温度,减少副反应发生,提高产率;增加氯气与碱液接触时间,充分反应
(3)
解析:(1)①和氢氧化钠反应生成氯化钠,次氯酸钠和水,离子反应方程式为:;
②由图可知,当pH=9时,该溶液中主要存在的阴离子有;
③根据图中信息可知当pH=7.5时,,25℃时,,
的K==;
(2) 工业常用石灰乳和反应制取漂白粉,反应放热,温度过高时会发生副反应生成,反应过程中缓缓通入的目的是控制温度,减少副反应发生,提高产率;增加氯气与碱液接触时间,充分反应;
(3)与含水8%的固体中可制备,化学反应方程式为:;
13.答案:(1)<;
(2);80%;14.8;bd
解析:(1)该反应= 0.51eV,物质能量降低,反应放出热量,即<0;该历程中总反应的决速步主要是活化能的大小,活化能越大,反应速率越慢,因此总反应的决速步方程式为;故答案为:。
(2)
①5min时建立三段式,,解得x=0.8,用表示该反应0~5min内的平均反应速率;故答案为:。
②平衡时建立三段式,,解得y=1.6,的平衡转化率为;T℃时,该反应的平衡常数为;故答案为:80%;14.8。
③a.升高温度,反应速率增大,平衡逆向移动,氢气转化率降低,故a不符合题意;b.按原比例再充入一定量和,反应速率增大,相当于加压,平衡正向移动,氢气转化率增大,故b符合题意;c.将和液化移出,反应速率降低,故c不符合题意;d.缩小容器体积,浓度增大,反应速率增大,平衡正向移动,氢气转化率增大,故d符合题意;综上所述,答案为:bd。
