2.3化学反应的方向—高二化学人教版(2019)选修一课时优化训练(含解析)
文档属性
| 名称 | 2.3化学反应的方向—高二化学人教版(2019)选修一课时优化训练(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 838.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-12 00:00:00 | ||
图片预览



文档简介
化学反应的方向—高二化学人教版(2019)选修一课时优化训练
一、单选题
1.将和通入密闭容器中发生反应,通过实验得到不同条件下达到平衡时Z的物质的量分数与温度和压强的关系如图。下列关于该反应的的判断正确的是( )
A. B.
C. D.
2.在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小
②减小体积使压强增大
③升高温度
④降低温度
⑤恒温恒容,再充入等量的和
⑥恒温恒压,再充入等量的和
⑦液化分离
⑧使用正催化剂
A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧
3.下列说法中正确的是( )
A.在室温下不能自发进行,说明该反应的
B.-10℃的水结成冰,可用熵判据来解释反应的自发性
C.能自发进行的反应一定能迅速发生
D.、的反应在低温时一定不能自发进行
4.下列对化学反应预测正确的是( )
选项 化学方程式 已知条件 预测
A 它一定是非自发反应
B ,自发反应 x可以等于3
C 自发反应 一定小于0
D 常温下自发进行
A.A B.B C.C D.D
5.实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A.所有的放热反应都是自发进行的
B.所有的自发反应都是放热的
C.焓变是影响反应是否具有自发性的一个重要因素
D.焓变是决定反应是否具有自发性的唯一因素
6.下列反应中,熵显著增大的反应是( )
A.
B.
C.
D.
7.相同温度和压强下,关于物质熵的大小比较,合理的是( )
A. B.
C. D.
8.在低温条件下,下列过程能自发进行的是( )
A. B.
C D.
9.在一定条件下,对于反应,C物质的含量与温度、压强的关系如图所示。下列判断正确的是( )
A. B.
C. D.
10.将机动车尾气中的转化为,
反应,
对该反应
下列说法正确的是( )
A.该反应在任何条件下都能自发进行
B.反应的平衡常数可表示为
C.其它条件不变,增大的值,的转化率下降
D.使用高效的催化剂可以降低反应的焓变
二、填空题
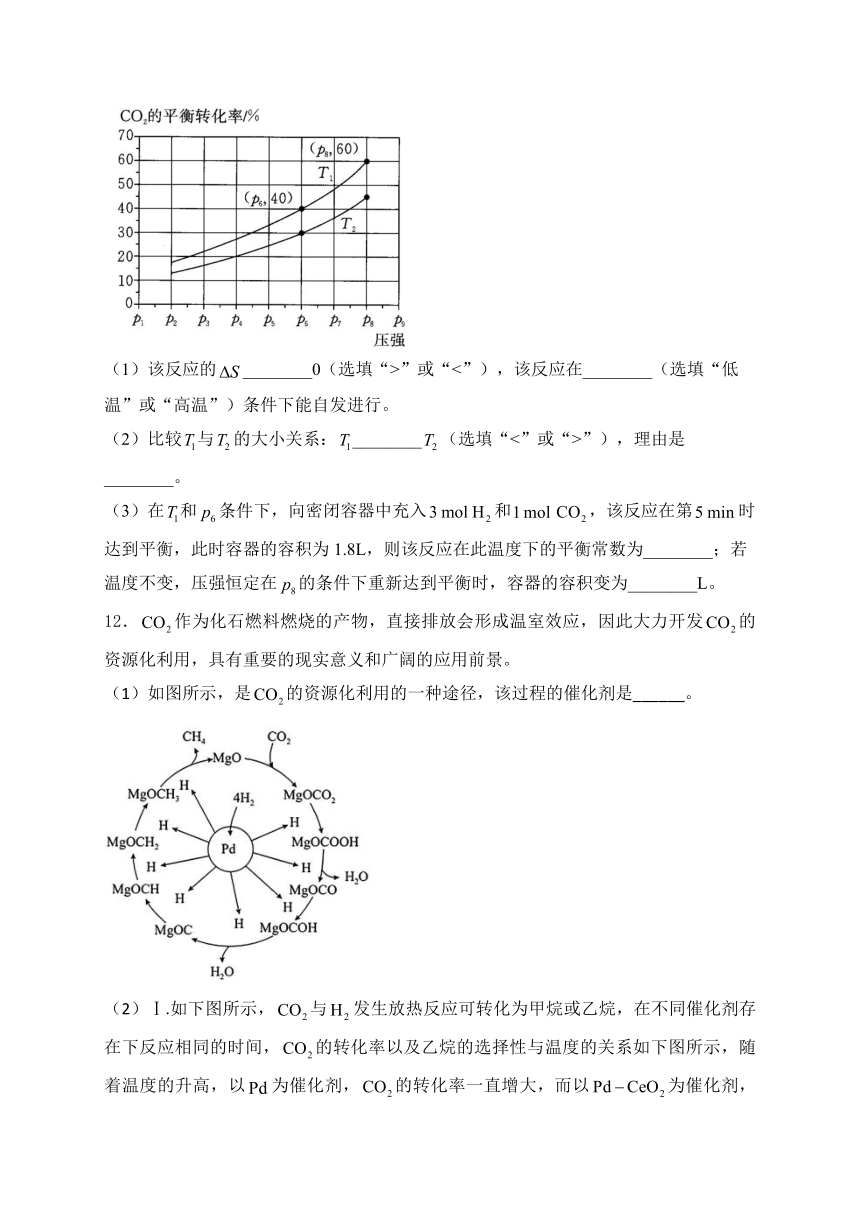
11.在恒压密闭容器中,充入一定量的与发生可逆反应:,实验测得在不同温度下,反应体系中的平衡转化率与压强的关系如图所示。
(1)该反应的________0(选填“>”或“<”),该反应在________(选填“低温”或“高温”)条件下能自发进行。
(2)比较与的大小关系:________(选填“<”或“>”),理由是________。
(3)在和条件下,向密闭容器中充入和,该反应在第时达到平衡,此时容器的容积为1.8L,则该反应在此温度下的平衡常数为________;若温度不变,压强恒定在的条件下重新达到平衡时,容器的容积变为________L。
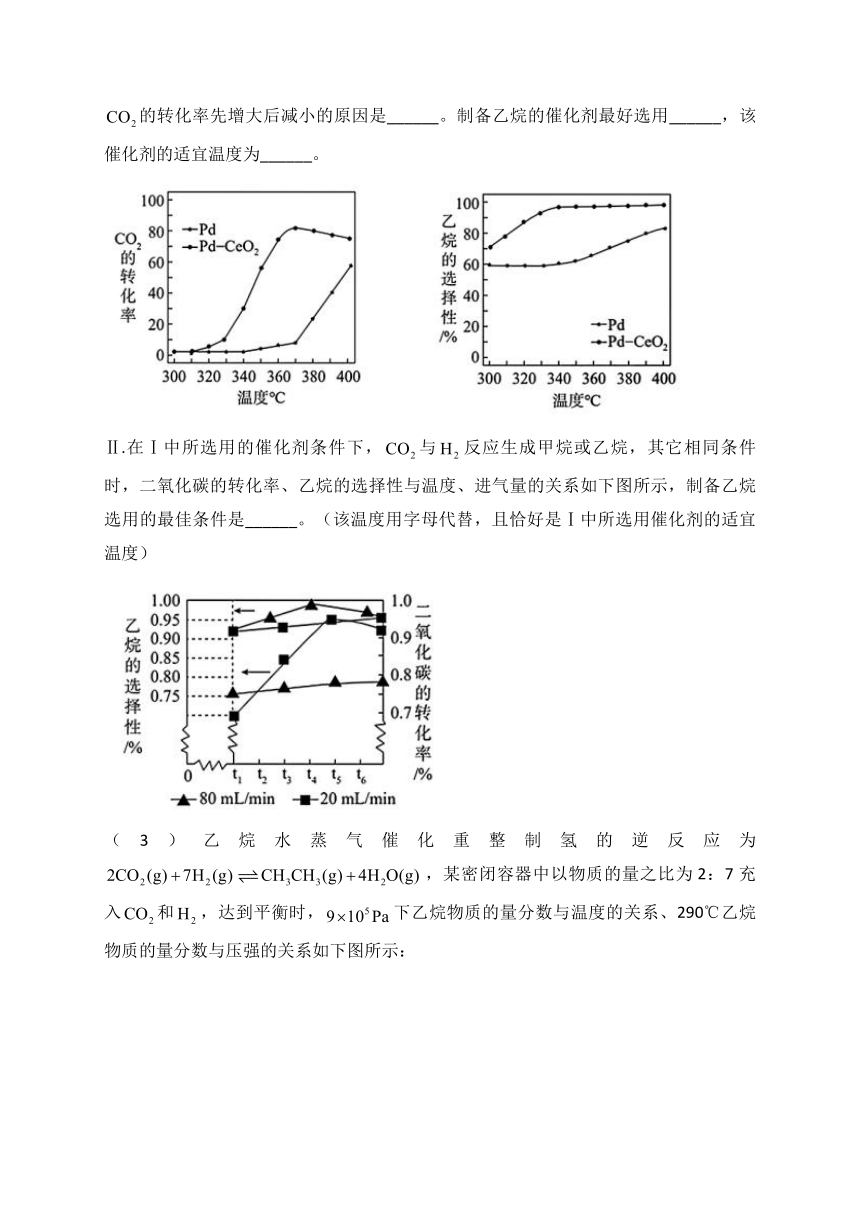
12.作为化石燃料燃烧的产物,直接排放会形成温室效应,因此大力开发的资源化利用,具有重要的现实意义和广阔的应用前景。
(1)如图所示,是的资源化利用的一种途径,该过程的催化剂是______。
(2)Ⅰ.如下图所示,与发生放热反应可转化为甲烷或乙烷,在不同催化剂存在下反应相同的时间,的转化率以及乙烷的选择性与温度的关系如下图所示,随着温度的升高,以为催化剂,的转化率一直增大,而以为催化剂,的转化率先增大后减小的原因是______。制备乙烷的催化剂最好选用______,该催化剂的适宜温度为______。
Ⅱ.在Ⅰ中所选用的催化剂条件下,与反应生成甲烷或乙烷,其它相同条件时,二氧化碳的转化率、乙烷的选择性与温度、进气量的关系如下图所示,制备乙烷选用的最佳条件是______。(该温度用字母代替,且恰好是Ⅰ中所选用催化剂的适宜温度)
(3)乙烷水蒸气催化重整制氢的逆反应为,某密闭容器中以物质的量之比为2:7充入和,达到平衡时,下乙烷物质的量分数与温度的关系、290℃乙烷物质的量分数与压强的关系如下图所示:
①在______(“高温”、“低温”、“任意温度”)自发。
②A、B、C、D、E中,处于相同状态下的两个点是______。
③达到平衡时的物质的量分数为0.12时,反应条件是______。
13.氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。
Ⅰ.甲醇-水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
物质
0 -393.5 -241.8 -200.7
则,该反应在_______(填“高温”“低温”或“任意温度”)下能自发进行。
Ⅱ.乙醇-水催化重整亦可获得,主要反应如下:
反应①:
反应②:
(2)向恒容密闭容器中充入1mol和3mol发生上述反应①和②,初始时体系压强为。平衡时的分布分数、的产率随温度的变化曲线如图所示。
①为提高氢气的平衡产率,可采取的措施为________(写出2条)。
②200℃以后,解释曲线a随温度变化趋势的原因:__________。
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内____,该温度下,反应②的____(保留小数点后两位)。
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:_______________,当转移1.2mol电子时,正极消耗的氧气的体积为L(标准状况下)。
三、实验题
14.甲醇是一种绿色能源和重要化工原料。已知:
反应 I :
反应Ⅱ:
(1)反应中能量变化如图1所示:
反应II中各物质相对能量如表所示(提示:相对能量可以表示物质的能量相对大小)。
物质
相对能量/() 393.5 0 283 151.5
则
(2)下列关于反应Ⅰ自发性判断合理的是 (填标号)
a.在任何温度下均能自发进行
b.在较高温度下能自发进行
c.在较低温度下能自发进行
d.在任何温度下均不能自发进行
(3)在恒容密闭容器中充入1 mol和 1,
已知反应过程中反应Ⅰ、Ⅱ均发生,测得不同温度下混合气体中平衡体积分数与温度(T)的关系如图2所示。
①下列情况表明两反应达到平衡状态的是 (填字母)。
a.混合气体的密度保持不变
b.混合气体平均摩尔质量保持不变
c.的浓度之比保持不变
②图2中,温度高于,平衡体积分数降低,其主要原因是 。
(4)在一定温度和催化剂作用下,向某恒容密闭容器中充入 1 mol和2 mol ,反应Ⅰ、II 均发生,平衡时测得混合气体中含x mol和y mol CO。反应I中的平衡转化率为 % (用含x和y的代数式表示,下同),反应Ⅱ的平衡常数为 。
(5) —种利用电化学方法将还原成的装置如图3所示。
光伏电池中a极为 (填“正”“负”“阴”或“阳”)极。阴极的电极反应式为 。
参考答案
1.答案:B
解析:由图可知,压强相同时升高温度,Z的物质的量分数减小,可知升高温度平衡逆向移动,正反应为放热反应,即;温度相同时增大压强,Z的物质的量分数增大,可知增大压强使平衡正向移动,正反应为气体总物质的量减小的反应,可知,答案选B。
2.答案:C
解析:①合成氨是气体体积减小的反应,增大体积使压强减小,化学反应速率减小,平衡向逆反应方向移动,氨的产率减小,①不符合题意;②合成氨是气体体积减小的反应,减小体积使压强增大,化学反应速率增大,平衡向正反应方向移动,氨的产率增大,②符合题意;③合成氨是放热反应,升高温度,化学反应速率增大,平衡向逆反应方向移动,氨的产率减小,③不符合题意;④合成氨是放热反应,降低温度,化学反应速率减小,平衡向正反应方向移动,氨的产率增大,④不符合题意;⑤恒温恒容,再充入等量和,反应物浓度增大,化学反应速率增大,平衡向正反应方向移动,氨的产率增大,⑤符合题意:⑥恒温恒压,再充入等量和,反应物浓度不变,化学反应速率不变,化学平衡不移动,氨的产率不变,⑥不符合题意;⑦及时分离产生的,生成物的浓度减小,化学反应速率减小,平衡向正反应方向移动,氨的产率增大,⑦不符合题意;⑧使用催化剂,化学反应速率增大,化学平衡不移动,氨的产率不变,⑧不符合题意。
3.答案:A
解析:A.由反应可知,,所以在室温下不能自发进行,说明该反应的,故A正确。B.由反应可知,、,根据可知,-10℃的水结成冰,不能只用熵判据来解释反应的自发性,故B错误;C.能否自发进行与反应速率无关,故C错误;D.根据可知,、的反应在低温时可能小于0,可能自发进行,故D错误;故答案:A。
4.答案:B
解析:由题给信息可知,该反应为熵增的吸热反应,高温条件下,反应能自发进行,A错误;若x等于3,该反应为熵减的放热反应,在低温条件下,反应能自发进行,B正确;由化学方程式可知,该反应为嫡增皮应,且反应能自发进行,说明,则反应的焓变可以大于0,也可以小于0,任何温度下均可自发进行,C错误;由化学方程式可知,该反应为熵减的反应,反应在常温下能自发进行,说明反应的,则反应的,D错误。
且的化学反应在任何温度下都能自发进行,且的化学反应能在低温条件下自发进行,且的化学反应能在高温条件下自发进行,且的化学反应不能自发进行。
5.答案:C
解析:多数能自发进行的反应都是放热反应,并不是所有自发进行的反应都是放热反应,如氯化铵晶体与氢氧化钡晶体的反应是自发进行的吸热反应,所以只能说焓变是影响反应是否具有自发性的一个重要因素,但不是唯一因素,C正确。
6.答案:C
解析:熵是衡量体系混乱度的物理量,通常情况下对于同一物质:。反应后气体分子数减少,为熵减反应,A不符合题意;反应后气体分子数减少,为熵减反应,B不符合题意;反应后气体分子数增多,为熵增反应,C符合题意;反应后气体分子数减少,为熵减反应,D不符合题意。
7.答案:B
解析:相同条件下,当气体物质的量相等时,气体分子中所含原子数越多,熵越大,即熵:,A项错误;相同状态下,物质的量越大,熵越大,即熵:,B项正确;在不同状态时的摘:固态<液态,即熵:,C项错误;从金刚石和石墨的结构组成上来看,金刚石的微观结构更有序,熵值更低,即熵:1molC(s,金刚石)影响物质熵的因素:①相同条件下,不同气态物质的分子中所含原子数越多,熵越大;②同一物质,一般来说不同状态时,熵:气态>液态>固态;③同一物质状态相同,其物质的量越多,熵越大。
8.答案:B
解析:
9.答案:A
解析:当T不变时,压强越大,C%越低,说明加压平衡左移,则m+n10.答案:C
解析:A.该反应为放热反应,即且反应前后气体分子数减少,故,,当温度较高时,,故该反应高温不自发,A错误;
B.反应的平衡常数可表示为,B错误;
C.其它条件不变,根据勒夏特列原理,增大的值,提高CO的转化率,NO的转化率降低,C正确;
D.催化剂可改变反应历程,但不能改变焓变,D错误;
11.答案:(1)<;低温
(2)<;该反应为放热反应,温度降低,化学平衡正向移动,的平衡转化率升高
(3)(或0148);(或0.533)
解析:(1)由方程式可知,该反应是反应前后气体分子数减少的可逆反应,因此该反应的,且,由于0时反应自发进行,所以该反应在低温下能自发进行。
(2)该反应为放热反应,温度降低,化学平衡正向移动,的平衡转化率升高,所以。
(3)该反应在和条件下平衡时,的平衡转化率是,则由方程式可知:
反应达到平衡时容器的容积为,所以的浓度分别是、,所以平衡常数;若温度不变,压强恒定在条件下重新达到平衡时,的平衡转化率是,则有:
温度不变,K不变,设此时容器的容积为,则,解得。
12.答案:(1)MgO和Pd
(2)①. 反应相同的时间,370℃时,以为催化剂时,反应已经达到平衡,升高温度平衡左移;以为催化剂时,反应速率较慢,反应未达到平衡,升高温度反应速率加快,反应相同时间转化率增大②. ③. 370℃④. 温度为,进气量为
(3)①. 低温②. D、E③. 290℃、或360℃、
解析:(1)由图可知,总反应为二氧化碳和氢气生成甲烷和水,从初始物二氧化碳、氢气的反应历程可知,氧化镁、Pd参与反应又生成,则氧化镁、Pd为催化剂;
(2)Ⅰ.升高温度反应速率加快,由图可知,反应相同的时间,370℃时,以为催化剂时,反应已经达到平衡,升高温度平衡左移;以为催化剂时,反应速率较慢,反应未达到平衡,升高温度反应速率加快,反应相同时间转化率增大,因此,随着温度的升高,以为催化剂,的转化率一直增大,而以为催化剂,的转化率先增大后减小。在相同条件下,以为催化剂时,反应速率快,因此,制备乙烷的催化剂最好选用。370℃时,二氧化碳的转化率最大,且乙烷的选择性也较高,因此,催化剂的适宜温度为370℃。
Ⅱ.进气量×二氧化碳的转化率×乙烷的选择性越大,乙烷的产量越高,条件越好,因此,制备乙烷选用的最佳条件是温度为、进气量为。
(3)①方法一:对于反应,增大压强,平衡正移,乙烷的物质的量分数增大,a曲线表示290℃乙烷物质的量分数与压强的关系;则曲线表示下乙烷物质的量分数与温度的关系,由可知,温度越高,乙烷的物质的量分数越低,因此正向放热,结合该反应熵减小,由可知该反应低温自发。
方法二:(2)Ⅰ已知“与发生放热反应可转化为甲烷或乙烷”,可知正向放热,结合该反应熵减小,由可知该反应低温自发。
②结合①解题思路,D、E均表示290℃、,因此,A、B、C、D、E中,处于相同状态下的两个点是、。
③达到平衡时的物质的量分数为0.12时,乙烷的物质的量分数为,因此反应条件是290℃、或360℃、。
13.答案:(1)+49;高温
(2)减小体系的压强、分离出升高温度,反应②正向进行程度大于反应①正向进行程度,中的含量降低1.50.60
(3);6.72
解析:
14.答案:(1) +8
(2)b
(3)①b、c;②温度高于,升温,反应D平衡向右移动程 度大于反应Ⅰ
(4);
(5)正;
解析:(1)依题图1可知,。依题表可知,。 (2)反应Ⅰ的,,根据反应可自发迸行知,该反应在较髙温度下能自发进行,故选b。(3)①在恒容条件下, 两反应中各物质都是气态,混合气体的密度始终不变,a错误;反应 时气体分子数发生改变,气体总质量不变,每气体的平均摩尔质量不 变时,表明反应达到平衡,b正确;体系中浓度之比保持不变时,表明反应达到平衡,c正确②两个反应都是吸热反应,前升温,反应Ⅰ平衡向右移动的程度更大,体积分数增大;当温度高于时,升温,反应Ⅱ平衡向右移动的程度更大,导致体积分数降低。(4)设达平衡时,转化了 a mol,列三段式得:
起始(mol) 1 2 0 0
转化(mol) a a a 3a
平衡(mol) 1-a 2-a a 3a
起始(mol) a 3a 0 2-a
转化(mol) y y y y
平衡(mol) a-y 3a-y y 2+y-a
则3a-y=x,解得。平衡时,转化率为。平衡时,,,,。反应Ⅱ是反应前后气体分子数相等的反应,则。(5)由题图3中物质转化知,发生氧化反应生成,左侧为阳极区,心侧为阴极 区。光伏电池中,a极为正极。阴极区发生还原反应生成,阴极的电极反应式为。
一、单选题
1.将和通入密闭容器中发生反应,通过实验得到不同条件下达到平衡时Z的物质的量分数与温度和压强的关系如图。下列关于该反应的的判断正确的是( )
A. B.
C. D.
2.在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小
②减小体积使压强增大
③升高温度
④降低温度
⑤恒温恒容,再充入等量的和
⑥恒温恒压,再充入等量的和
⑦液化分离
⑧使用正催化剂
A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧
3.下列说法中正确的是( )
A.在室温下不能自发进行,说明该反应的
B.-10℃的水结成冰,可用熵判据来解释反应的自发性
C.能自发进行的反应一定能迅速发生
D.、的反应在低温时一定不能自发进行
4.下列对化学反应预测正确的是( )
选项 化学方程式 已知条件 预测
A 它一定是非自发反应
B ,自发反应 x可以等于3
C 自发反应 一定小于0
D 常温下自发进行
A.A B.B C.C D.D
5.实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A.所有的放热反应都是自发进行的
B.所有的自发反应都是放热的
C.焓变是影响反应是否具有自发性的一个重要因素
D.焓变是决定反应是否具有自发性的唯一因素
6.下列反应中,熵显著增大的反应是( )
A.
B.
C.
D.
7.相同温度和压强下,关于物质熵的大小比较,合理的是( )
A. B.
C. D.
8.在低温条件下,下列过程能自发进行的是( )
A. B.
C D.
9.在一定条件下,对于反应,C物质的含量与温度、压强的关系如图所示。下列判断正确的是( )
A. B.
C. D.
10.将机动车尾气中的转化为,
反应,
对该反应
下列说法正确的是( )
A.该反应在任何条件下都能自发进行
B.反应的平衡常数可表示为
C.其它条件不变,增大的值,的转化率下降
D.使用高效的催化剂可以降低反应的焓变
二、填空题
11.在恒压密闭容器中,充入一定量的与发生可逆反应:,实验测得在不同温度下,反应体系中的平衡转化率与压强的关系如图所示。
(1)该反应的________0(选填“>”或“<”),该反应在________(选填“低温”或“高温”)条件下能自发进行。
(2)比较与的大小关系:________(选填“<”或“>”),理由是________。
(3)在和条件下,向密闭容器中充入和,该反应在第时达到平衡,此时容器的容积为1.8L,则该反应在此温度下的平衡常数为________;若温度不变,压强恒定在的条件下重新达到平衡时,容器的容积变为________L。
12.作为化石燃料燃烧的产物,直接排放会形成温室效应,因此大力开发的资源化利用,具有重要的现实意义和广阔的应用前景。
(1)如图所示,是的资源化利用的一种途径,该过程的催化剂是______。
(2)Ⅰ.如下图所示,与发生放热反应可转化为甲烷或乙烷,在不同催化剂存在下反应相同的时间,的转化率以及乙烷的选择性与温度的关系如下图所示,随着温度的升高,以为催化剂,的转化率一直增大,而以为催化剂,的转化率先增大后减小的原因是______。制备乙烷的催化剂最好选用______,该催化剂的适宜温度为______。
Ⅱ.在Ⅰ中所选用的催化剂条件下,与反应生成甲烷或乙烷,其它相同条件时,二氧化碳的转化率、乙烷的选择性与温度、进气量的关系如下图所示,制备乙烷选用的最佳条件是______。(该温度用字母代替,且恰好是Ⅰ中所选用催化剂的适宜温度)
(3)乙烷水蒸气催化重整制氢的逆反应为,某密闭容器中以物质的量之比为2:7充入和,达到平衡时,下乙烷物质的量分数与温度的关系、290℃乙烷物质的量分数与压强的关系如下图所示:
①在______(“高温”、“低温”、“任意温度”)自发。
②A、B、C、D、E中,处于相同状态下的两个点是______。
③达到平衡时的物质的量分数为0.12时,反应条件是______。
13.氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。
Ⅰ.甲醇-水催化重整可获得氢气。
(1)表中数据是该反应中相关物质的标准摩尔生成焓数据(标准摩尔生成焓是指在298.15K、100kPa下由稳定态单质生成1mol化合物时的焓变)。
物质
0 -393.5 -241.8 -200.7
则,该反应在_______(填“高温”“低温”或“任意温度”)下能自发进行。
Ⅱ.乙醇-水催化重整亦可获得,主要反应如下:
反应①:
反应②:
(2)向恒容密闭容器中充入1mol和3mol发生上述反应①和②,初始时体系压强为。平衡时的分布分数、的产率随温度的变化曲线如图所示。
①为提高氢气的平衡产率,可采取的措施为________(写出2条)。
②200℃以后,解释曲线a随温度变化趋势的原因:__________。
③温度为500℃时,反应经10min达到平衡,此时乙醇的转化率为60%,则0~10min内____,该温度下,反应②的____(保留小数点后两位)。
(3)乙醇燃料电池(电极材料a和b均为惰性电极)广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,写出负极的电极反应式:_______________,当转移1.2mol电子时,正极消耗的氧气的体积为L(标准状况下)。
三、实验题
14.甲醇是一种绿色能源和重要化工原料。已知:
反应 I :
反应Ⅱ:
(1)反应中能量变化如图1所示:
反应II中各物质相对能量如表所示(提示:相对能量可以表示物质的能量相对大小)。
物质
相对能量/() 393.5 0 283 151.5
则
(2)下列关于反应Ⅰ自发性判断合理的是 (填标号)
a.在任何温度下均能自发进行
b.在较高温度下能自发进行
c.在较低温度下能自发进行
d.在任何温度下均不能自发进行
(3)在恒容密闭容器中充入1 mol和 1,
已知反应过程中反应Ⅰ、Ⅱ均发生,测得不同温度下混合气体中平衡体积分数与温度(T)的关系如图2所示。
①下列情况表明两反应达到平衡状态的是 (填字母)。
a.混合气体的密度保持不变
b.混合气体平均摩尔质量保持不变
c.的浓度之比保持不变
②图2中,温度高于,平衡体积分数降低,其主要原因是 。
(4)在一定温度和催化剂作用下,向某恒容密闭容器中充入 1 mol和2 mol ,反应Ⅰ、II 均发生,平衡时测得混合气体中含x mol和y mol CO。反应I中的平衡转化率为 % (用含x和y的代数式表示,下同),反应Ⅱ的平衡常数为 。
(5) —种利用电化学方法将还原成的装置如图3所示。
光伏电池中a极为 (填“正”“负”“阴”或“阳”)极。阴极的电极反应式为 。
参考答案
1.答案:B
解析:由图可知,压强相同时升高温度,Z的物质的量分数减小,可知升高温度平衡逆向移动,正反应为放热反应,即;温度相同时增大压强,Z的物质的量分数增大,可知增大压强使平衡正向移动,正反应为气体总物质的量减小的反应,可知,答案选B。
2.答案:C
解析:①合成氨是气体体积减小的反应,增大体积使压强减小,化学反应速率减小,平衡向逆反应方向移动,氨的产率减小,①不符合题意;②合成氨是气体体积减小的反应,减小体积使压强增大,化学反应速率增大,平衡向正反应方向移动,氨的产率增大,②符合题意;③合成氨是放热反应,升高温度,化学反应速率增大,平衡向逆反应方向移动,氨的产率减小,③不符合题意;④合成氨是放热反应,降低温度,化学反应速率减小,平衡向正反应方向移动,氨的产率增大,④不符合题意;⑤恒温恒容,再充入等量和,反应物浓度增大,化学反应速率增大,平衡向正反应方向移动,氨的产率增大,⑤符合题意:⑥恒温恒压,再充入等量和,反应物浓度不变,化学反应速率不变,化学平衡不移动,氨的产率不变,⑥不符合题意;⑦及时分离产生的,生成物的浓度减小,化学反应速率减小,平衡向正反应方向移动,氨的产率增大,⑦不符合题意;⑧使用催化剂,化学反应速率增大,化学平衡不移动,氨的产率不变,⑧不符合题意。
3.答案:A
解析:A.由反应可知,,所以在室温下不能自发进行,说明该反应的,故A正确。B.由反应可知,、,根据可知,-10℃的水结成冰,不能只用熵判据来解释反应的自发性,故B错误;C.能否自发进行与反应速率无关,故C错误;D.根据可知,、的反应在低温时可能小于0,可能自发进行,故D错误;故答案:A。
4.答案:B
解析:由题给信息可知,该反应为熵增的吸热反应,高温条件下,反应能自发进行,A错误;若x等于3,该反应为熵减的放热反应,在低温条件下,反应能自发进行,B正确;由化学方程式可知,该反应为嫡增皮应,且反应能自发进行,说明,则反应的焓变可以大于0,也可以小于0,任何温度下均可自发进行,C错误;由化学方程式可知,该反应为熵减的反应,反应在常温下能自发进行,说明反应的,则反应的,D错误。
且的化学反应在任何温度下都能自发进行,且的化学反应能在低温条件下自发进行,且的化学反应能在高温条件下自发进行,且的化学反应不能自发进行。
5.答案:C
解析:多数能自发进行的反应都是放热反应,并不是所有自发进行的反应都是放热反应,如氯化铵晶体与氢氧化钡晶体的反应是自发进行的吸热反应,所以只能说焓变是影响反应是否具有自发性的一个重要因素,但不是唯一因素,C正确。
6.答案:C
解析:熵是衡量体系混乱度的物理量,通常情况下对于同一物质:。反应后气体分子数减少,为熵减反应,A不符合题意;反应后气体分子数减少,为熵减反应,B不符合题意;反应后气体分子数增多,为熵增反应,C符合题意;反应后气体分子数减少,为熵减反应,D不符合题意。
7.答案:B
解析:相同条件下,当气体物质的量相等时,气体分子中所含原子数越多,熵越大,即熵:,A项错误;相同状态下,物质的量越大,熵越大,即熵:,B项正确;在不同状态时的摘:固态<液态,即熵:,C项错误;从金刚石和石墨的结构组成上来看,金刚石的微观结构更有序,熵值更低,即熵:1molC(s,金刚石)
8.答案:B
解析:
9.答案:A
解析:当T不变时,压强越大,C%越低,说明加压平衡左移,则m+n
解析:A.该反应为放热反应,即且反应前后气体分子数减少,故,,当温度较高时,,故该反应高温不自发,A错误;
B.反应的平衡常数可表示为,B错误;
C.其它条件不变,根据勒夏特列原理,增大的值,提高CO的转化率,NO的转化率降低,C正确;
D.催化剂可改变反应历程,但不能改变焓变,D错误;
11.答案:(1)<;低温
(2)<;该反应为放热反应,温度降低,化学平衡正向移动,的平衡转化率升高
(3)(或0148);(或0.533)
解析:(1)由方程式可知,该反应是反应前后气体分子数减少的可逆反应,因此该反应的,且,由于0时反应自发进行,所以该反应在低温下能自发进行。
(2)该反应为放热反应,温度降低,化学平衡正向移动,的平衡转化率升高,所以。
(3)该反应在和条件下平衡时,的平衡转化率是,则由方程式可知:
反应达到平衡时容器的容积为,所以的浓度分别是、,所以平衡常数;若温度不变,压强恒定在条件下重新达到平衡时,的平衡转化率是,则有:
温度不变,K不变,设此时容器的容积为,则,解得。
12.答案:(1)MgO和Pd
(2)①. 反应相同的时间,370℃时,以为催化剂时,反应已经达到平衡,升高温度平衡左移;以为催化剂时,反应速率较慢,反应未达到平衡,升高温度反应速率加快,反应相同时间转化率增大②. ③. 370℃④. 温度为,进气量为
(3)①. 低温②. D、E③. 290℃、或360℃、
解析:(1)由图可知,总反应为二氧化碳和氢气生成甲烷和水,从初始物二氧化碳、氢气的反应历程可知,氧化镁、Pd参与反应又生成,则氧化镁、Pd为催化剂;
(2)Ⅰ.升高温度反应速率加快,由图可知,反应相同的时间,370℃时,以为催化剂时,反应已经达到平衡,升高温度平衡左移;以为催化剂时,反应速率较慢,反应未达到平衡,升高温度反应速率加快,反应相同时间转化率增大,因此,随着温度的升高,以为催化剂,的转化率一直增大,而以为催化剂,的转化率先增大后减小。在相同条件下,以为催化剂时,反应速率快,因此,制备乙烷的催化剂最好选用。370℃时,二氧化碳的转化率最大,且乙烷的选择性也较高,因此,催化剂的适宜温度为370℃。
Ⅱ.进气量×二氧化碳的转化率×乙烷的选择性越大,乙烷的产量越高,条件越好,因此,制备乙烷选用的最佳条件是温度为、进气量为。
(3)①方法一:对于反应,增大压强,平衡正移,乙烷的物质的量分数增大,a曲线表示290℃乙烷物质的量分数与压强的关系;则曲线表示下乙烷物质的量分数与温度的关系,由可知,温度越高,乙烷的物质的量分数越低,因此正向放热,结合该反应熵减小,由可知该反应低温自发。
方法二:(2)Ⅰ已知“与发生放热反应可转化为甲烷或乙烷”,可知正向放热,结合该反应熵减小,由可知该反应低温自发。
②结合①解题思路,D、E均表示290℃、,因此,A、B、C、D、E中,处于相同状态下的两个点是、。
③达到平衡时的物质的量分数为0.12时,乙烷的物质的量分数为,因此反应条件是290℃、或360℃、。
13.答案:(1)+49;高温
(2)减小体系的压强、分离出升高温度,反应②正向进行程度大于反应①正向进行程度,中的含量降低1.50.60
(3);6.72
解析:
14.答案:(1) +8
(2)b
(3)①b、c;②温度高于,升温,反应D平衡向右移动程 度大于反应Ⅰ
(4);
(5)正;
解析:(1)依题图1可知,。依题表可知,。 (2)反应Ⅰ的,,根据反应可自发迸行知,该反应在较髙温度下能自发进行,故选b。(3)①在恒容条件下, 两反应中各物质都是气态,混合气体的密度始终不变,a错误;反应 时气体分子数发生改变,气体总质量不变,每气体的平均摩尔质量不 变时,表明反应达到平衡,b正确;体系中浓度之比保持不变时,表明反应达到平衡,c正确②两个反应都是吸热反应,前升温,反应Ⅰ平衡向右移动的程度更大,体积分数增大;当温度高于时,升温,反应Ⅱ平衡向右移动的程度更大,导致体积分数降低。(4)设达平衡时,转化了 a mol,列三段式得:
起始(mol) 1 2 0 0
转化(mol) a a a 3a
平衡(mol) 1-a 2-a a 3a
起始(mol) a 3a 0 2-a
转化(mol) y y y y
平衡(mol) a-y 3a-y y 2+y-a
则3a-y=x,解得。平衡时,转化率为。平衡时,,,,。反应Ⅱ是反应前后气体分子数相等的反应,则。(5)由题图3中物质转化知,发生氧化反应生成,左侧为阳极区,心侧为阴极 区。光伏电池中,a极为正极。阴极区发生还原反应生成,阴极的电极反应式为。
