北京第三十五中学2024-2025学年高三10月月考化学试卷(PDF版,无答案)
文档属性
| 名称 | 北京第三十五中学2024-2025学年高三10月月考化学试卷(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 08:37:07 | ||
图片预览




文档简介
北京市第三十五中学 2024-2025 学年第一学期 10 月月考
高三化学 2024.10
行政班 教学班 姓名 学号
试卷说明:试卷分值 100 ,考试时间 90 分钟.I卷为选择题,共 14个小题,共 42分。II卷为主观题,
包括第 15至第 19 题,共 58 分。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56 I 127
第一部分
一.选择题(共 14个小题,每题 3分,共 42分。每小题只有一个正确选项,请.选.择.正.确.答.
案.填.在.机.读.卡.相.应.的.题.号.处.)
1.中国传统文化中包括许多科技知识。下列古语中不.涉.及.化学变化的是
千淘万漉虽辛苦,吹 熬胆矾(CuSO4 5H2O) 凡石灰(CaCO3), 丹砂(HgS)烧之成水
尽狂沙始到金 铁釜,久之亦化为铜 经火焚炼为用 银,积变又成丹砂
2.下列各组离子在指定溶液中一定能大量共存的是
A.无色透明溶液中:Cu2+、Al3+、HCO-3、SO2-4
B.能使品红褪色的溶液中:MnO-、Mg2+4 、I
-
、Ca2+
C.遇酚酞变红的溶液中:Na+、K+、SO2- -4 、F
D.与 Al反应能生成氢气的溶液中:NH +、Fe3+4 、NO-3、SO2-4
3.NA为阿伏加德罗常数的值。下列说法正确的是
A.56 g Fe 与足量稀 HNO3反应转移的电子数目为 2NA
B 标准状况下,5.6 L H2O所含 O-H键的数目为 0.5 NA
C.28 g乙烯和丙烯的混合气体中含有的碳原子数为 2NA
D.0.1 mol·L 1 NH4Cl溶液中,NH4+、NH3·H2O数目之和为 0.1NA
4.下列关于同主族元素 C、Si及其化合物的性质比较和原因分析不.正.确.的是
选项 性质比较 原因分析
A 熔点:CO2<SiO2 摩尔质量:CO2<SiO2
B 电负性:Se>33As 原子半径:Se<As
C 酸性:H2CO3>H2SiO3 非金属性:C>Si
D 热稳定性:CH4>SiH4 键能:C-H>Si-H
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
5. 下列方程式能准确解释相应事实的是
A.金属钠在空气中加热生成淡黄色固体:4Na + O2 === 2Na2O
B.向AlCl3溶液中加入过量氨水,产生白色沉淀:Al3+ + 3OH- ===Al(OH)3↓
C.和面时在小苏打中加少量醋酸,增强效果:
CH3COOH+HCO-3====CH3COO-+H2O+CO2↑
D.向 NaHSO4溶液中加入足量 Ba(OH)2溶液,得到白色沉淀:
2H++SO2-+Ba2+4 +2OH ====BaSO4↓+2H2O
6.“律动世界”国际化学元素周期表主题年活动报告中,提到了一种具有净水作用的物质,
它由 Q、W、X、Y、Z 五种原子序数依次增大的元素组成。该五种元素的性质或结构信
息如下表:
元素 信息
Q 基态原子只有一种形状的轨道填有电子,并容易形成共价键
W 基态原子有 5 个原子轨道填充有电子,有 2 个未成对电子
X 最高价氧化物对应的水化物与 Y、Z 最高价氧化物对应的水化物都能反应
Y 在元素周期表中位于第 3 周期、第ⅥA 族
Z 焰色反应为紫色
下列说法正确的是
A.电负性:Q < W < Y B.Y 易溶于水
C.简单离子半径:X < W < Z < Y D.这种物质只含离子键
7.西汉末年华佗创制的用于外科手术的麻醉药“麻沸散”中含有东莨菪碱,其结构简式如
图。下列关于该物质的说法不.正.确.的是
A.含有 3种含氧官能团
B.N的杂化方式为 sp3
C.不能发生消去反应
D.具有碱性,能与强酸反应
8.下列实验中,锥形瓶内均能产生气体。试管内不.能.产生沉淀的是
A B C D
试剂 a 浓盐酸 浓 H2SO4 浓氨水 稀 H2SO4
试剂 b KMnO4 少量蔗糖 CaO CaCO3粉末
试剂 c AgNO3 AlCl3 MgCl2 冷、浓氨盐水
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
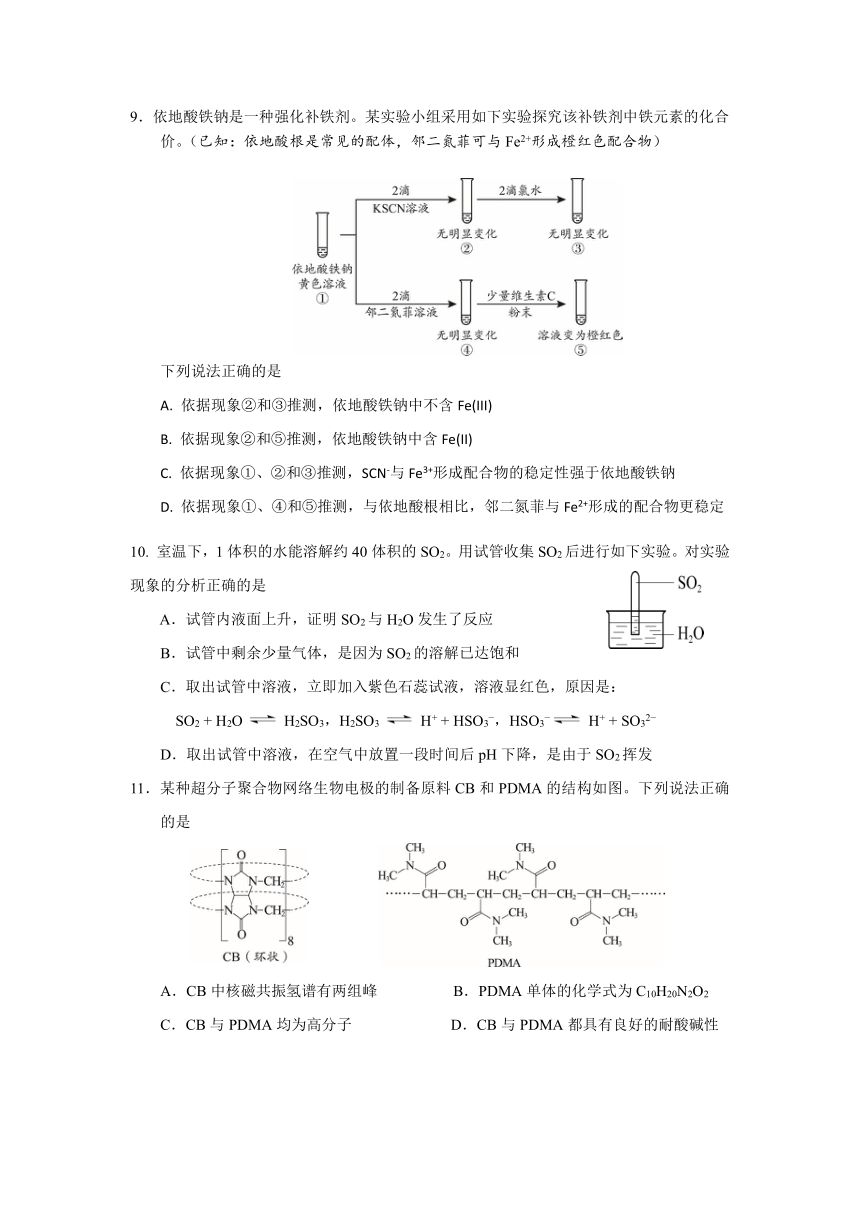
9.依地酸铁钠是一种强化补铁剂。某实验小组采用如下实验探究该补铁剂中铁元素的化合
价。(已知:依地酸根是常见的配体,邻二氮菲可与 Fe2+形成橙红色配合物)
下列说法正确的是
A. 依据现象②和③推测,依地酸铁钠中不含 Fe(III)
B. 依据现象②和⑤推测,依地酸铁钠中含 Fe(II)
C. 依据现象①、②和③推测,SCN-与 Fe3+形成配合物的稳定性强于依地酸铁钠
D. 依据现象①、④和⑤推测,与依地酸根相比,邻二氮菲与 Fe2+形成的配合物更稳定
10. 室温下,1体积的水能溶解约 40体积的 SO2。用试管收集 SO2后进行如下实验。对实验
现象的分析正确的是
A.试管内液面上升,证明 SO2与 H2O发生了反应
B.试管中剩余少量气体,是因为 SO2的溶解已达饱和
C.取出试管中溶液,立即加入紫色石蕊试液,溶液显红色,原因是:
SO2 + H2O H2SO3,H2SO3 H+ + HSO3 ,HSO3 H+ + SO32
D.取出试管中溶液,在空气中放置一段时间后 pH下降,是由于 SO2挥发
11.某种超分子聚合物网络生物电极的制备原料 CB 和 PDMA的结构如图。下列说法正确
的是
A.CB中核磁共振氢谱有两组峰 B.PDMA单体的化学式为 C10H20N2O2
C.CB与 PDMA均为高分子 D.CB与 PDMA都具有良好的耐酸碱性
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
12.常温下,将 4.0 g铁钉加入到 30 mL 4%的 CuSO4溶液中,一段时间后观察到铁钉表面
产生气泡,氧气含量和溶液 pH变化如下图所示。
下列说法不.正.确.的是
A.CuSO4溶液 pH<7的原因:Cu2+ + 2H2O Cu(OH)2 + 2H+
B.铁钉表面产生气泡的原因:Fe + 2H+===Fe2+ + H2↑
C.加入铁钉消耗 H+,Cu2+水解平衡正向移动,产生 Cu(OH)2沉淀
D.推测溶液 pH减小的原因:4Fe2+ + O2 + 10H2O ===4Fe(OH)3↓+ 8H+
13. 聚酰胺(PA)具有良好的力学性能,一种合成路线如下图所示。下列说法不.正.确.的是
A.Y中含有五元环 B.②是酯化反应
C.该合成路线中甲醇可循环使用 D.PA可发生水解反应重新生成 Z
14.为探究Na2SO3的性质,实验小组同学进行了如下实验:
下列说法一定正确的是
A.③和④中产生的气体成分完全相同
B.②和⑥中沉淀的主要成分不同
C.①→②和④→⑥均只发生了复分解反应
D.SO32-的还原性在酸性条件下增强
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
第二部分
15.水的性质与其结构密切相关,[FeF6]3-与金属离子或 NH+4 形成的化合物有广泛的用途。
(1)基态 Fe 原子的价层电子轨道表示式为_______
(2)钢铁表面成膜技术是钢铁防腐的重要方法。工业上利用某种转化液使钢铁表面形成致密
的K3[FeF6]膜以进行防腐,该转化液是含KF、HNO3、(NH4)2S2O8(或 H2O2)等物质的
溶液(pH ≈ 2)。 S2O82-的结构如下:
①比较 O原子和 S原子的第一电离能大小,从原子结构的角度说明理由:_______。
②下列说法正确的是_______(填字母)。
a.(NH4)2S2O8能将 Fe2+氧化为 Fe3+的可能原因是含有“-O-O-”结构
b.依据结构分析,(NH4)2S2O8中硫元素的化合价为+7价
c.S2O2-8中“S-O-O”在一条直线上
③ 转化液 pH过小时,不易得到 K3[FeF6],原因是_______。
(3)对于水分子中的共价键,依据原子轨道重叠的方式判断,属于 键;H2O 的
O-H 键是由 O的 轨道与 H 的 1S 轨道重叠形成的。
(4)水分子的 VSEPR 的模型名称为 ,H +3O 的电子式为 ;
判断 H O+3 和 H2O 的键角大小:H3O+ H2O(填“>”或“<”),解释原因:
(5)下列事实可用“水分子间存在氢键”解释的是 (填字母序号)。
a.常压下,4℃时水的密度最大 b.水的沸点比硫化氢的沸点高 160℃
c.水的热稳定性比硫化氢强
(6)[FeF6]3-与 NH+4 形成的化合物可以作为锂离子电池的电极材料。
①化合物(NH4)3[FeF6]中的化学键类型有_______(填字母)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
② (NH4)3[FeF6]的晶胞形状为立方体,边长为 a nm,结构如下图所示:
图中“ ”代表的是_______(填“NH+4 ”或“[FeF6]3-”)。
已知(NH4)3[FeF6]的摩尔质量是M g·mol-1,阿伏加德罗常数为 NA,该晶体的密度为
_______ g·cm-3。(1nm =10-7cm)
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
16.合成 NH3是重要的研究课题,一种合成 NH3的流程示意如下。
相关数据如下:
物质 熔点/℃ 沸点/℃ 与 N2反应温度/℃ 分解温度/℃
Mg 649 1090 >300 Mg3N2:>800
(1)固氮:
① 固氮反应的化学方程式是 。
② 固氮的适宜温度范围是 。
a.500~600℃ b.700~800℃ c.900~1000℃
③ 人工固氮是高能耗的过程,结合N2分子结构解释原因:
④ 检测固氮作用:向固氮后的产物中加水, (填操作和现象),说明Mg 能起
到固氮作用。
(2)转氨:选用试剂 a完成转化。
Ⅰ.选用 H2O进行转化。发现从体系中分离出 NH3较困难。
Ⅱ.选用 HCl气体进行转化。发现能产生 NH3,且产物MgCl2能直接循环利用。但
NH3的收率较低,原因是 。
Ⅲ.选用 NH4Cl固体进行转化。合成氨的过程如下:
① 合成氨的总反应方程式是 。
② 经实验研究,证实了Mg3N2中的氮元素在“转氨”过程中能转变为氨。
实验: 将 (填化学式)两种物质混合,充分反应。检测结果:经探测仪检
测所得氨气中存在 15NH3。
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
17. 环丙基甲基酮是合成环丙氟哌酸类广谱抗菌药物和抗艾滋特效药依法韦仑的重要中间
体,在医药、化工及农林等领域均有广泛应用。
已知:
(1)实验室制取 A的化学方程式为_______。
(2)A→B发生了加成反应,B中含有羟基。B的结构简式为_______。
(3)D→E的化学方程式为_______。
(4)M是 F的同分异构体,写出符合下列条件的M的结构简式_______。
①能发生银镜反应
②核磁共振氢谱有 3 组峰,且峰面积之比为 1:2:2
(5)H分子中含有一个五元环,写出 G→H的化学方程式_______。
(6)I可以与 NaHCO3溶液反应。I的结构简式为_______。
(7)J→K的反应中常伴有其他环状副产物生成,依据 J→K的反应原理,该副产物的结构
简式为_______。
{#{QQABRSQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
18.卤素的单质及其化合物在生产、生活领域应用广泛。
ⅰ.市售食盐有无碘盐和加碘盐(含 KIO3和少量 KI)。检验食盐是否为加碘盐的定性方法:
① 取待检食盐溶于水,加入稀硫酸酸化,再加入过量的 KI 溶液,振荡。
② 为验证①中有 I2生成,向上述混合液中加入少量 CCl4充分振荡后,静置。
(1)若为加碘盐,则①中发生反应的离子方程式为________。
(2)②中的实验操作名称是________。
(3)实验过程中能证明食盐含 KIO3的现象是________。
ⅱ.碘摄入过多或者过少都会增加患甲状腺疾病的风险,目前所用食盐中碘含量测定方法:
①用饱和溴水将碘盐中少量的 I-氧化成 IO -3 。
②再加入甲酸发生反应:Br2+HCOOH = CO2↑ + 2HBr。
③在酸性条件下,加入过量 KI,使之与 IO -3 完全反应。
④以淀粉作指示剂,用 Na2S2O3标准溶液进行滴定,测定碘元素的含量。
I2+ 2Na2S2O3 =2NaI + Na2S4O6
(4) ①中反应的离子方程式为________。
(5) 取 a 克含碘食盐配制成 100mL 溶液,取 25mL 溶液用 bmol/LNa2S2O3标准溶液滴
定,消耗 Na2S2O3溶液 vmL,食盐中含碘元素的质量分数为
ⅲ. 氯是海水中含量丰富的元素,氯的单质及其化合物在生产、生活领域应用广泛:
(6)可以使用二氧化氯(ClO2)代替液氯消毒。工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)
和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素(-1 价)最终氧化成
SO 2-4 ,写出制备二氧化氯的离子方程式:________。
(7)用莫尔法可以测定溶液中的 Cl-的含量。莫尔法是一种沉淀滴定法,用标准 AgNO3
溶液滴定待测液,以 K2CrO4为指示剂,滴定终点的现象是溶液中出现砖红色沉淀
(Ag CrO )。已知平衡 Cr O 2- + H O 2CrO 2-2 4 2 7 2 4 + 2H+,该滴定过程需要控制 pH 范
围在 6.5~10.5,若 pH 小于 6.5 会使测定结果偏高。结合平衡移动原理解释偏高的
原因:________。
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
19.某小组同学探究 SO2与 FeCl3溶液的反应。
(1)实验 I:用如下装置(夹持、加热仪器略)制备 SO2,将 SO2通入 FeCl3溶液中。
FeCl3溶液
实验现象:A中产生白雾;C 中溶液由黄色变成红棕色,静置 5 min 后,溶液颜
色从红棕色变回黄色,检测到 Fe2+;静置 9 h后,溶液变为浅绿色。
① 浓 H2SO4与 Cu反应的化学方程式是______。
② 试剂 a是______。
(2)分析 C中溶液颜色变化的原因。
① 溶液颜色由黄色最终变为浅绿色的原因是______(写离子方程式)。
② 针对溶液颜色变为红棕色,提出了两种假设。
假设 1:主要与 SO2、H2SO3有关。 假设 2:主要与 SO32 、HSO3 有关。
实验 II证实假设 1不成立,假设 2成立。
实验 II:向 FeCl3溶液中加入 NaHSO3溶液,______(填现象),然后滴加______
(填试剂),溶液变为黄色。
(3)进一步探究 FeCl3与 SO32 、HSO3 显红棕色的原因。
查阅资料:Fe3+ + nSO32 + mH2O [Fe(SO3)n(H2O)m]3-2n(红棕色)
实验 III:向 FeCl3溶液中滴加 Na2SO3溶液,溶液由黄色变成红棕色,析出大量橙黄色沉
淀。甲同学认为橙黄色沉淀中可能含有 OH 、SO32 、SO42 ,设计如下检验方案。
① 乙同学认为酸性 KMnO4溶液褪色不能证明橙黄色沉淀中含有 SO32 ,理由是_____。
② 实验证实橙黄色沉淀中含有 SO32 、不含 SO42 ,试剂 b、c分别是______、______。
(4) 实验反思:实验 I静置 5 min 后溶液颜色由红棕色变回黄色可能的原因是______。
{#{QQABRSQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
草稿纸
{#{QQABRSQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
高三化学 2024.10
行政班 教学班 姓名 学号
试卷说明:试卷分值 100 ,考试时间 90 分钟.I卷为选择题,共 14个小题,共 42分。II卷为主观题,
包括第 15至第 19 题,共 58 分。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56 I 127
第一部分
一.选择题(共 14个小题,每题 3分,共 42分。每小题只有一个正确选项,请.选.择.正.确.答.
案.填.在.机.读.卡.相.应.的.题.号.处.)
1.中国传统文化中包括许多科技知识。下列古语中不.涉.及.化学变化的是
千淘万漉虽辛苦,吹 熬胆矾(CuSO4 5H2O) 凡石灰(CaCO3), 丹砂(HgS)烧之成水
尽狂沙始到金 铁釜,久之亦化为铜 经火焚炼为用 银,积变又成丹砂
2.下列各组离子在指定溶液中一定能大量共存的是
A.无色透明溶液中:Cu2+、Al3+、HCO-3、SO2-4
B.能使品红褪色的溶液中:MnO-、Mg2+4 、I
-
、Ca2+
C.遇酚酞变红的溶液中:Na+、K+、SO2- -4 、F
D.与 Al反应能生成氢气的溶液中:NH +、Fe3+4 、NO-3、SO2-4
3.NA为阿伏加德罗常数的值。下列说法正确的是
A.56 g Fe 与足量稀 HNO3反应转移的电子数目为 2NA
B 标准状况下,5.6 L H2O所含 O-H键的数目为 0.5 NA
C.28 g乙烯和丙烯的混合气体中含有的碳原子数为 2NA
D.0.1 mol·L 1 NH4Cl溶液中,NH4+、NH3·H2O数目之和为 0.1NA
4.下列关于同主族元素 C、Si及其化合物的性质比较和原因分析不.正.确.的是
选项 性质比较 原因分析
A 熔点:CO2<SiO2 摩尔质量:CO2<SiO2
B 电负性:Se>33As 原子半径:Se<As
C 酸性:H2CO3>H2SiO3 非金属性:C>Si
D 热稳定性:CH4>SiH4 键能:C-H>Si-H
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
5. 下列方程式能准确解释相应事实的是
A.金属钠在空气中加热生成淡黄色固体:4Na + O2 === 2Na2O
B.向AlCl3溶液中加入过量氨水,产生白色沉淀:Al3+ + 3OH- ===Al(OH)3↓
C.和面时在小苏打中加少量醋酸,增强效果:
CH3COOH+HCO-3====CH3COO-+H2O+CO2↑
D.向 NaHSO4溶液中加入足量 Ba(OH)2溶液,得到白色沉淀:
2H++SO2-+Ba2+4 +2OH ====BaSO4↓+2H2O
6.“律动世界”国际化学元素周期表主题年活动报告中,提到了一种具有净水作用的物质,
它由 Q、W、X、Y、Z 五种原子序数依次增大的元素组成。该五种元素的性质或结构信
息如下表:
元素 信息
Q 基态原子只有一种形状的轨道填有电子,并容易形成共价键
W 基态原子有 5 个原子轨道填充有电子,有 2 个未成对电子
X 最高价氧化物对应的水化物与 Y、Z 最高价氧化物对应的水化物都能反应
Y 在元素周期表中位于第 3 周期、第ⅥA 族
Z 焰色反应为紫色
下列说法正确的是
A.电负性:Q < W < Y B.Y 易溶于水
C.简单离子半径:X < W < Z < Y D.这种物质只含离子键
7.西汉末年华佗创制的用于外科手术的麻醉药“麻沸散”中含有东莨菪碱,其结构简式如
图。下列关于该物质的说法不.正.确.的是
A.含有 3种含氧官能团
B.N的杂化方式为 sp3
C.不能发生消去反应
D.具有碱性,能与强酸反应
8.下列实验中,锥形瓶内均能产生气体。试管内不.能.产生沉淀的是
A B C D
试剂 a 浓盐酸 浓 H2SO4 浓氨水 稀 H2SO4
试剂 b KMnO4 少量蔗糖 CaO CaCO3粉末
试剂 c AgNO3 AlCl3 MgCl2 冷、浓氨盐水
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
9.依地酸铁钠是一种强化补铁剂。某实验小组采用如下实验探究该补铁剂中铁元素的化合
价。(已知:依地酸根是常见的配体,邻二氮菲可与 Fe2+形成橙红色配合物)
下列说法正确的是
A. 依据现象②和③推测,依地酸铁钠中不含 Fe(III)
B. 依据现象②和⑤推测,依地酸铁钠中含 Fe(II)
C. 依据现象①、②和③推测,SCN-与 Fe3+形成配合物的稳定性强于依地酸铁钠
D. 依据现象①、④和⑤推测,与依地酸根相比,邻二氮菲与 Fe2+形成的配合物更稳定
10. 室温下,1体积的水能溶解约 40体积的 SO2。用试管收集 SO2后进行如下实验。对实验
现象的分析正确的是
A.试管内液面上升,证明 SO2与 H2O发生了反应
B.试管中剩余少量气体,是因为 SO2的溶解已达饱和
C.取出试管中溶液,立即加入紫色石蕊试液,溶液显红色,原因是:
SO2 + H2O H2SO3,H2SO3 H+ + HSO3 ,HSO3 H+ + SO32
D.取出试管中溶液,在空气中放置一段时间后 pH下降,是由于 SO2挥发
11.某种超分子聚合物网络生物电极的制备原料 CB 和 PDMA的结构如图。下列说法正确
的是
A.CB中核磁共振氢谱有两组峰 B.PDMA单体的化学式为 C10H20N2O2
C.CB与 PDMA均为高分子 D.CB与 PDMA都具有良好的耐酸碱性
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
12.常温下,将 4.0 g铁钉加入到 30 mL 4%的 CuSO4溶液中,一段时间后观察到铁钉表面
产生气泡,氧气含量和溶液 pH变化如下图所示。
下列说法不.正.确.的是
A.CuSO4溶液 pH<7的原因:Cu2+ + 2H2O Cu(OH)2 + 2H+
B.铁钉表面产生气泡的原因:Fe + 2H+===Fe2+ + H2↑
C.加入铁钉消耗 H+,Cu2+水解平衡正向移动,产生 Cu(OH)2沉淀
D.推测溶液 pH减小的原因:4Fe2+ + O2 + 10H2O ===4Fe(OH)3↓+ 8H+
13. 聚酰胺(PA)具有良好的力学性能,一种合成路线如下图所示。下列说法不.正.确.的是
A.Y中含有五元环 B.②是酯化反应
C.该合成路线中甲醇可循环使用 D.PA可发生水解反应重新生成 Z
14.为探究Na2SO3的性质,实验小组同学进行了如下实验:
下列说法一定正确的是
A.③和④中产生的气体成分完全相同
B.②和⑥中沉淀的主要成分不同
C.①→②和④→⑥均只发生了复分解反应
D.SO32-的还原性在酸性条件下增强
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
第二部分
15.水的性质与其结构密切相关,[FeF6]3-与金属离子或 NH+4 形成的化合物有广泛的用途。
(1)基态 Fe 原子的价层电子轨道表示式为_______
(2)钢铁表面成膜技术是钢铁防腐的重要方法。工业上利用某种转化液使钢铁表面形成致密
的K3[FeF6]膜以进行防腐,该转化液是含KF、HNO3、(NH4)2S2O8(或 H2O2)等物质的
溶液(pH ≈ 2)。 S2O82-的结构如下:
①比较 O原子和 S原子的第一电离能大小,从原子结构的角度说明理由:_______。
②下列说法正确的是_______(填字母)。
a.(NH4)2S2O8能将 Fe2+氧化为 Fe3+的可能原因是含有“-O-O-”结构
b.依据结构分析,(NH4)2S2O8中硫元素的化合价为+7价
c.S2O2-8中“S-O-O”在一条直线上
③ 转化液 pH过小时,不易得到 K3[FeF6],原因是_______。
(3)对于水分子中的共价键,依据原子轨道重叠的方式判断,属于 键;H2O 的
O-H 键是由 O的 轨道与 H 的 1S 轨道重叠形成的。
(4)水分子的 VSEPR 的模型名称为 ,H +3O 的电子式为 ;
判断 H O+3 和 H2O 的键角大小:H3O+ H2O(填“>”或“<”),解释原因:
(5)下列事实可用“水分子间存在氢键”解释的是 (填字母序号)。
a.常压下,4℃时水的密度最大 b.水的沸点比硫化氢的沸点高 160℃
c.水的热稳定性比硫化氢强
(6)[FeF6]3-与 NH+4 形成的化合物可以作为锂离子电池的电极材料。
①化合物(NH4)3[FeF6]中的化学键类型有_______(填字母)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
② (NH4)3[FeF6]的晶胞形状为立方体,边长为 a nm,结构如下图所示:
图中“ ”代表的是_______(填“NH+4 ”或“[FeF6]3-”)。
已知(NH4)3[FeF6]的摩尔质量是M g·mol-1,阿伏加德罗常数为 NA,该晶体的密度为
_______ g·cm-3。(1nm =10-7cm)
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
16.合成 NH3是重要的研究课题,一种合成 NH3的流程示意如下。
相关数据如下:
物质 熔点/℃ 沸点/℃ 与 N2反应温度/℃ 分解温度/℃
Mg 649 1090 >300 Mg3N2:>800
(1)固氮:
① 固氮反应的化学方程式是 。
② 固氮的适宜温度范围是 。
a.500~600℃ b.700~800℃ c.900~1000℃
③ 人工固氮是高能耗的过程,结合N2分子结构解释原因:
④ 检测固氮作用:向固氮后的产物中加水, (填操作和现象),说明Mg 能起
到固氮作用。
(2)转氨:选用试剂 a完成转化。
Ⅰ.选用 H2O进行转化。发现从体系中分离出 NH3较困难。
Ⅱ.选用 HCl气体进行转化。发现能产生 NH3,且产物MgCl2能直接循环利用。但
NH3的收率较低,原因是 。
Ⅲ.选用 NH4Cl固体进行转化。合成氨的过程如下:
① 合成氨的总反应方程式是 。
② 经实验研究,证实了Mg3N2中的氮元素在“转氨”过程中能转变为氨。
实验: 将 (填化学式)两种物质混合,充分反应。检测结果:经探测仪检
测所得氨气中存在 15NH3。
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
17. 环丙基甲基酮是合成环丙氟哌酸类广谱抗菌药物和抗艾滋特效药依法韦仑的重要中间
体,在医药、化工及农林等领域均有广泛应用。
已知:
(1)实验室制取 A的化学方程式为_______。
(2)A→B发生了加成反应,B中含有羟基。B的结构简式为_______。
(3)D→E的化学方程式为_______。
(4)M是 F的同分异构体,写出符合下列条件的M的结构简式_______。
①能发生银镜反应
②核磁共振氢谱有 3 组峰,且峰面积之比为 1:2:2
(5)H分子中含有一个五元环,写出 G→H的化学方程式_______。
(6)I可以与 NaHCO3溶液反应。I的结构简式为_______。
(7)J→K的反应中常伴有其他环状副产物生成,依据 J→K的反应原理,该副产物的结构
简式为_______。
{#{QQABRSQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
18.卤素的单质及其化合物在生产、生活领域应用广泛。
ⅰ.市售食盐有无碘盐和加碘盐(含 KIO3和少量 KI)。检验食盐是否为加碘盐的定性方法:
① 取待检食盐溶于水,加入稀硫酸酸化,再加入过量的 KI 溶液,振荡。
② 为验证①中有 I2生成,向上述混合液中加入少量 CCl4充分振荡后,静置。
(1)若为加碘盐,则①中发生反应的离子方程式为________。
(2)②中的实验操作名称是________。
(3)实验过程中能证明食盐含 KIO3的现象是________。
ⅱ.碘摄入过多或者过少都会增加患甲状腺疾病的风险,目前所用食盐中碘含量测定方法:
①用饱和溴水将碘盐中少量的 I-氧化成 IO -3 。
②再加入甲酸发生反应:Br2+HCOOH = CO2↑ + 2HBr。
③在酸性条件下,加入过量 KI,使之与 IO -3 完全反应。
④以淀粉作指示剂,用 Na2S2O3标准溶液进行滴定,测定碘元素的含量。
I2+ 2Na2S2O3 =2NaI + Na2S4O6
(4) ①中反应的离子方程式为________。
(5) 取 a 克含碘食盐配制成 100mL 溶液,取 25mL 溶液用 bmol/LNa2S2O3标准溶液滴
定,消耗 Na2S2O3溶液 vmL,食盐中含碘元素的质量分数为
ⅲ. 氯是海水中含量丰富的元素,氯的单质及其化合物在生产、生活领域应用广泛:
(6)可以使用二氧化氯(ClO2)代替液氯消毒。工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)
和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素(-1 价)最终氧化成
SO 2-4 ,写出制备二氧化氯的离子方程式:________。
(7)用莫尔法可以测定溶液中的 Cl-的含量。莫尔法是一种沉淀滴定法,用标准 AgNO3
溶液滴定待测液,以 K2CrO4为指示剂,滴定终点的现象是溶液中出现砖红色沉淀
(Ag CrO )。已知平衡 Cr O 2- + H O 2CrO 2-2 4 2 7 2 4 + 2H+,该滴定过程需要控制 pH 范
围在 6.5~10.5,若 pH 小于 6.5 会使测定结果偏高。结合平衡移动原理解释偏高的
原因:________。
{#{QQABSRQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
19.某小组同学探究 SO2与 FeCl3溶液的反应。
(1)实验 I:用如下装置(夹持、加热仪器略)制备 SO2,将 SO2通入 FeCl3溶液中。
FeCl3溶液
实验现象:A中产生白雾;C 中溶液由黄色变成红棕色,静置 5 min 后,溶液颜
色从红棕色变回黄色,检测到 Fe2+;静置 9 h后,溶液变为浅绿色。
① 浓 H2SO4与 Cu反应的化学方程式是______。
② 试剂 a是______。
(2)分析 C中溶液颜色变化的原因。
① 溶液颜色由黄色最终变为浅绿色的原因是______(写离子方程式)。
② 针对溶液颜色变为红棕色,提出了两种假设。
假设 1:主要与 SO2、H2SO3有关。 假设 2:主要与 SO32 、HSO3 有关。
实验 II证实假设 1不成立,假设 2成立。
实验 II:向 FeCl3溶液中加入 NaHSO3溶液,______(填现象),然后滴加______
(填试剂),溶液变为黄色。
(3)进一步探究 FeCl3与 SO32 、HSO3 显红棕色的原因。
查阅资料:Fe3+ + nSO32 + mH2O [Fe(SO3)n(H2O)m]3-2n(红棕色)
实验 III:向 FeCl3溶液中滴加 Na2SO3溶液,溶液由黄色变成红棕色,析出大量橙黄色沉
淀。甲同学认为橙黄色沉淀中可能含有 OH 、SO32 、SO42 ,设计如下检验方案。
① 乙同学认为酸性 KMnO4溶液褪色不能证明橙黄色沉淀中含有 SO32 ,理由是_____。
② 实验证实橙黄色沉淀中含有 SO32 、不含 SO42 ,试剂 b、c分别是______、______。
(4) 实验反思:实验 I静置 5 min 后溶液颜色由红棕色变回黄色可能的原因是______。
{#{QQABRSQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
草稿纸
{#{QQABRSQywAsgwggCiYogAIJSAACAAA4gKCQQ0wl8lCICwgmKQskIBCChALAUYgkgAGRxAADEuAoARAKACSJAFAFABBKCA=A}=#}}#}
同课章节目录
