水溶液中平衡图像的拓展与探析--2025年高考化学微专题(pdf含解析)
文档属性
| 名称 | 水溶液中平衡图像的拓展与探析--2025年高考化学微专题(pdf含解析) |

|
|
| 格式 | |||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 00:00:00 | ||
图片预览


文档简介
水溶液中平衡图像的拓展与探析-2025年
高考化学微专题
水溶液中平衡图像的拓展与探析
目录
01考情分析
02真题精研
03规律·方法·技巧
04经典变式练
05核心知识精炼
06基础测评
07能力提升
考情分析
水溶液中存在着弱电解质的电离平衡,盐的水解平衡,难溶电解质的溶解平衡,而有关这些平衡的图象分
析是近几年高考的热点和必考点,且不断探索创新点,这样不仅创新了考查形式,而且大大增加了试题的综合
性和难度。要想攻克此点,就需要学生在利用好数形结合思想的基础上,提高自己的迁移运用能力和科学思
维,达到考题万变不离其宗。
真题精研
1.(2024·湖南·.高考真题)常温下K(HCOOH)=1.8×104,向20mL0.10mol·L NaOH溶液中缓慢滴
入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如
图所示,下列说法错误的是
0.10
2
M
N
0
5101520
V(HCOOH)/mL
A.水的电离程度:MB.M点:2c(OH)=c(Na)+c(H)
C.当V(HCOOH)=10mL时,c(OH)=c(H+)+2c(HCOOH)+c(HCOO)
D.N点:c(Na)>c(HCOO)>c(OH)>c(H)>c(HCOOH)
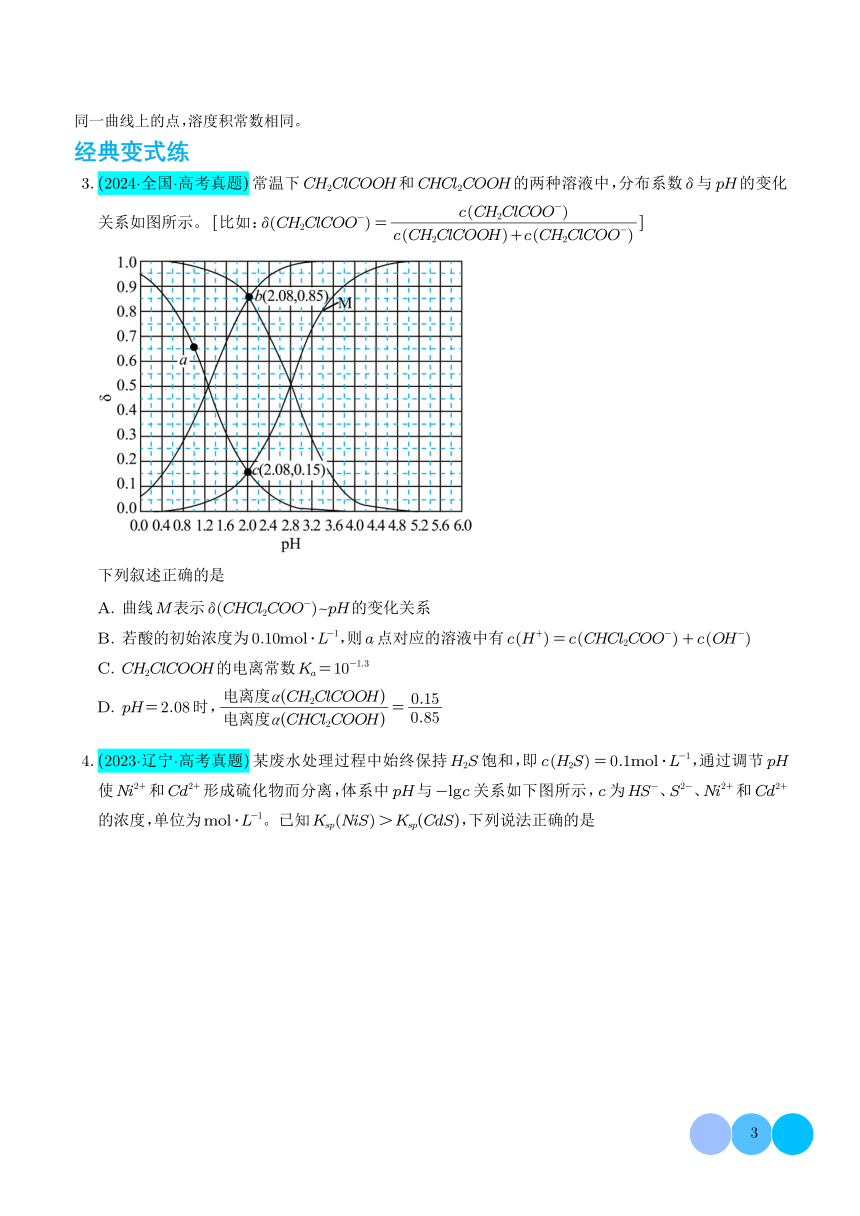
2.(2024·浙江·高考真题)室温下,H2S水溶液中各含硫微粒物质的量分数6随pH变化关系如下图[例如
6(H2S)=
c(H,S)+c(S)+cs).已知:K,(FeS)=6.3×10,Kp[F(OH]=4.9×107。
c(H2S)
1.0
0.5
70
13.0
0.0
4
10
12
14
pH
下列说法正确的是
A.溶解度:FeS大于Fe(OH)2
B.以酚酞为指示剂(变色的pH范围8.2-10.0),用NaOH标准溶液可滴定HS水溶液的浓度
C.忽略S2-的第二步水解,0.10mo/L的Na2S溶液中S2-水解率约为62%
D.0.010mol/L的FeCL2溶液中加入等体积0.20mol/L的Na2S溶液,反应初始生成的沉淀是FeS
规律·方法技巧
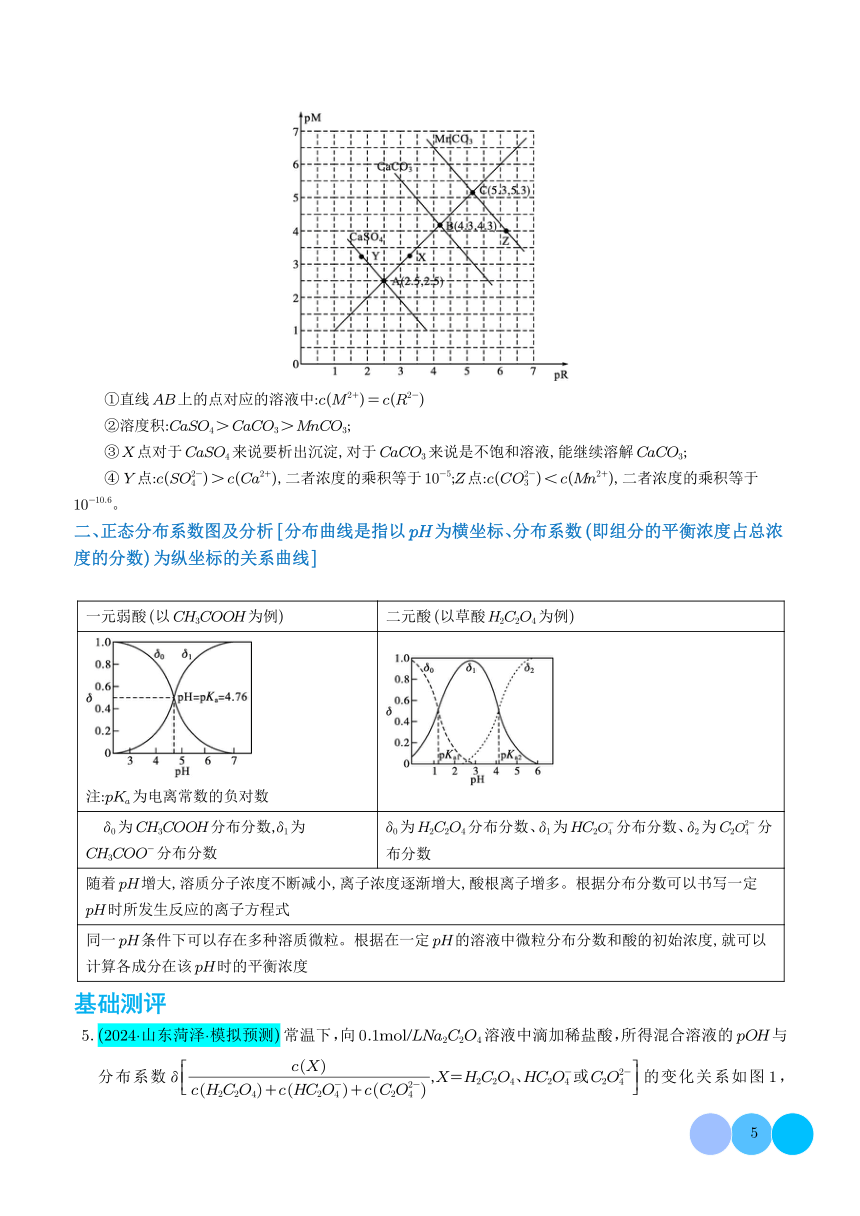
一、分布系数图像题应注意的三点
1.明标:要想理清溶液中粒子浓度关系,首先看各纵、横坐标表示的含义,尤其多维坐标图像更应注意。
2.理线:根据坐标内曲线的变化趋势,理清每曲线、每部分表示的含义,判断曲线所代表的粒子。
3.求点:要注意图像内的各种交点,通过交点建立不同粒子间的等量关系,由已知量代替未知量,简化求解过
程。
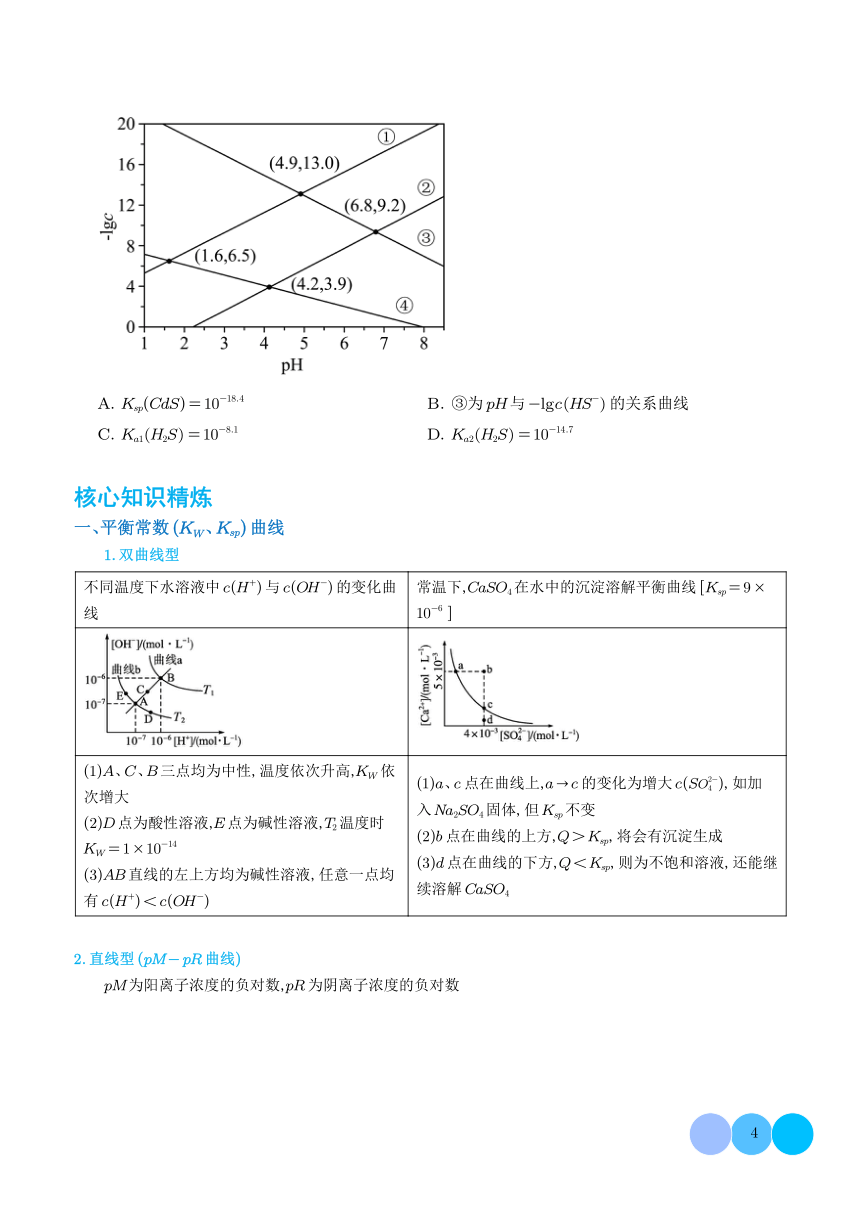
二、解沉淀溶解平衡图像题三步骤
第一步:明确图像中纵、横坐标的含义。
纵、横坐标通常是难溶物溶解后电离出的离子浓度。
第二步:理解图像中线上点、线外点的含义。
(1)曲线上任意一点都达到了沉淀溶解平衡状态,此时Q。=Ksp。在
温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲
线上变化,不会出现在曲线以外。
(2)曲线上方区域的点均为过饱和溶液,此时Q。>Ksp。
(3)曲线下方区域的点均为不饱和溶液,此时QQ>K。
Q=K。
K>9
c(CI)/(mol-L-)
第三步:抓住Ksp的特点,结合选项分析判断。
(1)溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大:
②原溶液饱和时,离子浓度都不变。
(2)溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在
2
高考化学微专题
水溶液中平衡图像的拓展与探析
目录
01考情分析
02真题精研
03规律·方法·技巧
04经典变式练
05核心知识精炼
06基础测评
07能力提升
考情分析
水溶液中存在着弱电解质的电离平衡,盐的水解平衡,难溶电解质的溶解平衡,而有关这些平衡的图象分
析是近几年高考的热点和必考点,且不断探索创新点,这样不仅创新了考查形式,而且大大增加了试题的综合
性和难度。要想攻克此点,就需要学生在利用好数形结合思想的基础上,提高自己的迁移运用能力和科学思
维,达到考题万变不离其宗。
真题精研
1.(2024·湖南·.高考真题)常温下K(HCOOH)=1.8×104,向20mL0.10mol·L NaOH溶液中缓慢滴
入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如
图所示,下列说法错误的是
0.10
2
M
N
0
5101520
V(HCOOH)/mL
A.水的电离程度:M
C.当V(HCOOH)=10mL时,c(OH)=c(H+)+2c(HCOOH)+c(HCOO)
D.N点:c(Na)>c(HCOO)>c(OH)>c(H)>c(HCOOH)
2.(2024·浙江·高考真题)室温下,H2S水溶液中各含硫微粒物质的量分数6随pH变化关系如下图[例如
6(H2S)=
c(H,S)+c(S)+cs).已知:K,(FeS)=6.3×10,Kp[F(OH]=4.9×107。
c(H2S)
1.0
0.5
70
13.0
0.0
4
10
12
14
pH
下列说法正确的是
A.溶解度:FeS大于Fe(OH)2
B.以酚酞为指示剂(变色的pH范围8.2-10.0),用NaOH标准溶液可滴定HS水溶液的浓度
C.忽略S2-的第二步水解,0.10mo/L的Na2S溶液中S2-水解率约为62%
D.0.010mol/L的FeCL2溶液中加入等体积0.20mol/L的Na2S溶液,反应初始生成的沉淀是FeS
规律·方法技巧
一、分布系数图像题应注意的三点
1.明标:要想理清溶液中粒子浓度关系,首先看各纵、横坐标表示的含义,尤其多维坐标图像更应注意。
2.理线:根据坐标内曲线的变化趋势,理清每曲线、每部分表示的含义,判断曲线所代表的粒子。
3.求点:要注意图像内的各种交点,通过交点建立不同粒子间的等量关系,由已知量代替未知量,简化求解过
程。
二、解沉淀溶解平衡图像题三步骤
第一步:明确图像中纵、横坐标的含义。
纵、横坐标通常是难溶物溶解后电离出的离子浓度。
第二步:理解图像中线上点、线外点的含义。
(1)曲线上任意一点都达到了沉淀溶解平衡状态,此时Q。=Ksp。在
温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲
线上变化,不会出现在曲线以外。
(2)曲线上方区域的点均为过饱和溶液,此时Q。>Ksp。
(3)曲线下方区域的点均为不饱和溶液,此时Q
Q=K。
K>9
c(CI)/(mol-L-)
第三步:抓住Ksp的特点,结合选项分析判断。
(1)溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大:
②原溶液饱和时,离子浓度都不变。
(2)溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在
2
同课章节目录
