北京北大附中2025届 10月阶段检测化学试题(PDF版,无答案)
文档属性
| 名称 | 北京北大附中2025届 10月阶段检测化学试题(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-13 21:44:02 | ||
图片预览



文档简介
2025届高三化学
北大附中2025届 10月阶段检测
化 学 2024.10
本试卷满分100分。 考试时长90分钟。考生务必将答案答在答题卡上, 在试卷上作答视
为无效。 考试结束,试卷和答题卡一并收回。
考号 : 姓名:
可能用到的相对原子质量 : H 1 C 12 N 14 O 16 S 3 2 Br 80
第一部分 选择题 (每题3分,共 42分)
在每题列出的4个选项中, 选出最符合题目要求的一项 。
1. 下列说法正确的是
A. 氯化钠能使蛋白质变性, 故不可用作食品防腐剂
B.豆浆能产生丁达尔效应是由于胶体中分散质微粒对光线的散射作用
C. SO 可用于丝织品漂白是由于其能氧化丝织品中的有色成分
D.用铁槽车运输浓硝酸利用了常温下铁和浓硝酸不能发生反应的性质
2. 下列反应不属子氧化还原反应的是
A. 向Ba(NO 溶液中通入 SO , 产生白色沉淀
B. 向FeSO 溶液中加入NaClO溶液,产生红褐色沉淀
C.向新制的Cu(OH) 中加入乙醛溶液,加热,产生砖红色沉淀
D. 向饱和氨盐水中通入CO , 产生白色沉淀
3.下列化学用语或图示表达正确的是
A. HCl分子中σ键的形成过程 :
B. 基态 z Cr原子的价层电子轨道表示式为
o l gl r 3à 4sc.t 的电子式为H ǒ. t
D. 聚-1,3-丁二烯的顺式结构:
4. 下列比较不能用元素周期律解释的是
A. 沸点: H O>H S B.电负性 : F> O
. C 还原性 : I> CI- D. 酸 性: HNO > H PO
5.NA为阿伏加德罗常数的值。 下列说法正确的是
A. 18gH O含有的中子数为 10N
B. 0.1 mol-L- HClO 溶液中含有的H 数为0.1NA
C. 1molC H 中含有σ键的数目为5NA
D. 标准状况下, 1.12LN 和足量H 于密闭容器充分反应, 生成NH 分子数为0.1N
高三年级 (化学) 第1页 (共 8页)
2025届高三化学
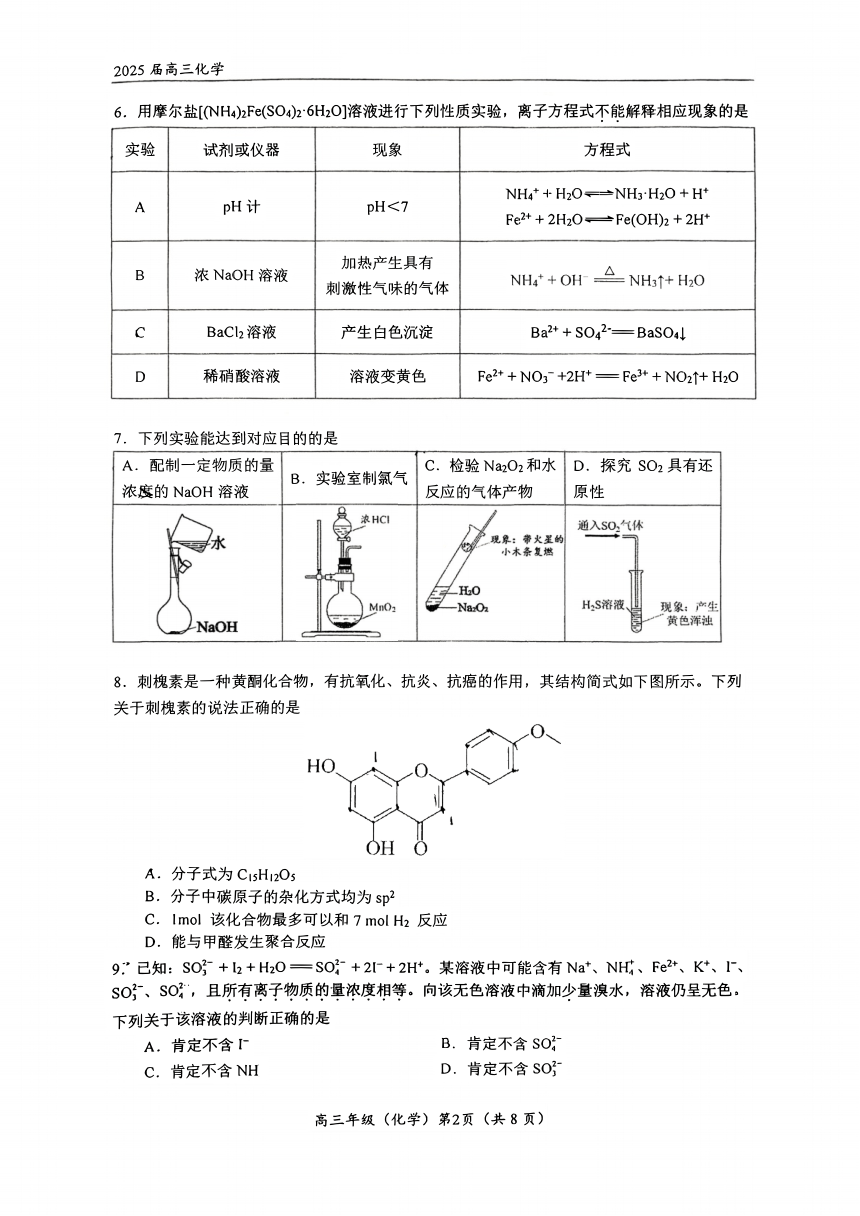
6. 用摩尔盐[(NH ) Fe(SO )·6H O]溶液进行下列性质实验, 离子方程式不能解释相应现象的是
实验 试剂或仪器 现象 方程式
A pH<7 NH +H O≈→NH ·H O H+pH计 e F + +
+
2H O→Fe(OH ) +2H+
加热产生具有
B 浓NaOH溶液 刺激性气味 的气体
c BaCl 溶 液 产生白色沉淀 Ba +SO —BaSO L
D 稀硝酸溶液 溶液变黄色 Fe ++NO ~+2H = Fe +NO ↑+H O
7. 下列实验能达到对应目的的是
A. 配制一定物质的量 C. 检验 Na O 和水 D. 探 究 SO 具有还
浓鹰的NaOH溶液 B.实验室制氯气 反应的气体产物 原性
8.刺槐素是一种黄酮化合物, 有抗氧化、 抗炎、 抗癌的作用, 其结构简式如下图所示。 下列
关于刺槐素的说法正确的是
A. 分 子式为 CisHi O
B.分子中碳原子的杂化方式均为sp
C. Imol该化合物最多可以和 7mol H 反 应
D. 能与甲醛发生聚合反应
9:”已知: SO3~+l +H O=SO;+21+2H'。 某溶液中可能含有Na 、 NHj、 Fe *、 K*、 I、
So 、 So , 且所有离子物质的量浓度相等。 向该无色溶液中滴加少量溴水,溶液仍呈无色。
下列关于该溶液的判断正确的是
A.肯 定不含T B.肯定不含SO;
c. 肯定不含NH D. 肯定不含 SO}-
高三 年级 (化 学) 第2页 (共 8 页)
2025 届高三化学
10. 溴及其化合物广泛应用于医药、 农药和阻燃剂等生产中。 一种利用空气吹出法从海水中提
取溴的工艺流程如下。
已知 : i.与Na CO 反 应时,Brz 转化 为 BrO 和Br 。
ii.HBrO 为强 酸 。下列说法不正确的是
A. 酸 化海水通入Cl 提取溴的反应: Clz+2Br= 2CI+Br
B. 脱氯过程Fe2*和Br-均具有脱氯作用
C. 用Na CO 溶液吸收足量Br 蒸气后,所得产物中的含碳粒子主要是HCO -
D.H SO 酸化后重新得到Br 的反应: 5Br+BrO +6H= 3Brz+3H O
11. 下列关于实验现象的解释或所得结论正确的是
选项 实验操作 现象 解释或结论
向某补铁剂(添加维生素C作抗
A 氧化剂) 中滴加酸性 KMnO 溶 酸性KMnO 溶
液 液紫色褪去
该补血口服液中一定含有Fe +
B 用蒸馏水溶解CuCl 固体,并继 溶液 由 绿色 逐
[CuCl ] -+4H O →[Cu(H O) + }
续加水稀释 渐变为蓝色 + 4Cr正向移 动, [CuCl ] -转
变为
[Cu(H O ) β+
C 向NaBr溶液中滴加过量氯水, 溶液 先 变 橙 色再加入淀粉-KI溶液 后变为蓝色 氧化性: Cl >Brz>l
D 将碳与浓硫酸加热反应产生的气体通入澄清石灰水中 产生白色沉淀 该气体中一定含有CO
12.·油画创作通常需要用到多种无机颜料。 研究发现, 在不同的空气湿度和光照条件下, 颜料
雌黄 (As S ) 褪色的主要原因是发生了以下两种化学反应:
资料 : 硫 代硫酸根(S O3)可看作是SO ”中的一个O原 子被 S原 子取代的产物 。
下列说法正确的是
A. S,O”的空间构型是平面三角形 , SO3的空间构型是正四面体形
B. 反应I和Ⅱ中,元素As和S都被氧化
C. 反应I和Ⅱ中, 参加反应n(O )/n(H O)的比值: 反应[小于反应Ⅱ
D. 反应 I和Ⅱ中, 氧 化 1 molAs S 转 移的电子数之比为3 : 7
高三年级 (化学) 第3页 (共 8 页)
2025届高三化学
13.元素X的某价态离子X 中所有电子正好充满K、 L、 M三个电子层,它与N -形成晶体的
· 晶胞结构如图所示。 下列说法不正确的是
A..X元素的原子序数是 19B 该晶体中阳离子与阴离子个数比为 3 : 1
C.·X 中n=1
D. 晶体中每个X“周围有2个等距离且最近的N - ○表示X", ○表示N
14.研究小组为探究Na S晶体在空气中变质后的产物,进行实验并记录现象如下:
① 取 Na S样品加水溶解,得到澄清溶液a。
② 取少量溶液a加入过量盐酸,有臭鸡蛋气味的气体放出 ,且 出现淡黄色浑浊。
③ 将②中浊液过滤, 向滤液中加入BaCl 溶液,产生白色沉淀。
资料: i. Na S溶液能溶解 S生成 Na Se, Na S 与酸反应生成 S和 H S (奥鸡蛋气味)
ii. BaS易溶于水
下列说法不正确的是
A ②中淡黄色浑浊可能是 S,2-与H+反应产生的
B….①和②说明该Na S样品中含有S
c.③中白色沉淀是BaSO
D. 该 Na S样品中可能含有Na SO
第二部分 非选择题 (共 58分 )
15. (10分) 寻找安全高效、 低成本的储氢材料对于实现氢能经济具有重要意义。 以 下是常见的
储氢材料。
1. 氰基配合物Cu [Co(CN)Jz·xH O
(1) Cu的基态原子价电子排布式为 。
(2) 墨态N原于占据的最高能级的电子云轮廓图的形状是 。
(3) CN-中C为正价,从原子结构的角度说明理由 。
(4) Co(II)化合物转化为Co(III)化合物:
①在空气中久置后, CoCl 溶液无明显变化; 配制成 [Co(NH )aβ*后, 放置在空气中即可被氧化
为[Co(NH )*,据此推测 (填 “Co ”或 “[Co(NH ) β+”) 还原性更强。
②己知: Co *+6NH ≤ →[Co(NH )a] * KCo +6NH→ Co NH c * K [ ( ) }
利用氧化还原反应规律,可作出推测: K K (填“>”“<”或“=”)。
高三年级 (化学 ) 第4页 (共 8页)
2025届高三化学
ll.金属氢化物
Mg FeH 是非常有潜力的储氢材料。 其晶胞形状为立方体, o H
边长为anm, 如右图所示 。 Mg
(5)M g FeH 晶胞中H 原子个数为 Fe
(6) 已知Mg FeH 的摩尔质量是Mg·mofF',阿伏加德罗
常数为N, 该晶体的密度为 gcm 。 (1nm=10 cm)
16.(13分 ) 碘单质 (紫黑色固体, 微溶于水, 具有挥发性) 及含碘化合物广泛用于医药、 染料
等方面。 回答下列问题:
(1) HI主要用于药物合成,通常用I 和 P反应生成Pl , Pl 再水解制备Hl 。
PI 的空间结构是_ _。 Fl 的P-1键是由磷的 轨道与碘的5p轨道重叠形成σ键。
(2) l 的一种制备方法如下图所示:
AgNO Fe粉 Cl
净化除氯后含碘海水一 富集 悬浊液一 转化 氧化 I
沉淀
①加入Fe粉进行转化反应的离子方程式为_ _, 生 成的沉淀与硝酸反应, 生成 _后可
循环使用。
②通入Cl 的过程中,若氧化产物只有一种,反应的化学方程式为_ ;若反应物用量比n(Cl2)
1n(Fel )= 1.5时 ,氧化产物为 。
(3) 以NalO 为原料制备 l 的方法是: 先向NalO 溶液中加入适量NaHSO3,恰好完全反应生
成碘化物; 再向混合溶液中加入 NalO 溶液,反应得到 I , 上述制备 I 的总反应的离子方程式
为 。
(4)KI溶液和 CuSO 溶液混合可生成Cul沉淀和l2, 若生成1moll ,消耗的KI至少为
mol。 I 在 KI溶液中可发生反应 I2+1 = l3 。实验室中使用过量的KI与 CuSO 溶液反应后,
过滤, 滤液经蒸馏可制得高纯碘。 反应中加入过量K1的原因是 _。
(5) l 与足量F 在一定条件下发生反应可生成卤素互化物IF , 写出其与H O发生的非氧化还
原反应的化学方程式
高三年级 (化学) 第5页 (共 8页)
2025届高三化学
17. (12分)
药物卡托普利的合成原料F、 工程材料聚碳酸酯 (简称PC) 的合成路线如下图所示:
已知 :
②酯与含羟基的化合物可发生如下酯交换反应:
CR、 R’、 R”代表烃基)
请回答:
(1) 已知C的核磁共振氢谱只有一种峰。
①丙烯→A的反应类型是
②A→B的反应试剂和条件是
③B→C的化学方程式是
(2) 9.4g的D与饱和溴水完全反应生成33.1g白色沉淀,D的结构简式是
(3) C与D反应生成双酚A的化学方程式是
(4) F有多种同分异构体, 满足下列条件的同分异构体的结构简式是 _。 (写出一
种即可)
①含有甲基 ②含有碳碳双键 ③能发生银镜反应 ④属于酯
(5) PC的结构简式是
高三年级 (化学) 第6页 (共 8页)
2025届高三化学
18. (12 分 ) 工 业用黄铜矿 (主要成分 CuFeS , 含 少量 锌、 铅 的硫化物) 冶 炼铜的一种方法如
下:
固体Q
IV Cu O VI Cu溶液B Na CO 溶液 固 休 H 单质
V
溶液 A N ⅢaOH 溶液C NaOH
黄 π 溶液 Cn OH铜 ( ) C 溶液盐酸 空 气 固 体 盐酸 NaCI
矿 CuCl 溶液 溶液D 溶液
固体 M
VⅡ盐 酸
VⅢ Cl
(1) I中发生下列反应 。
i.CuFeS +3Cu ++4Cl=4CuCl+ Fe ++2S
ii.CuCl+Cl= CuCl -
1 中盐酸的作用是 。
(2) Ⅱ中通入空气, 将 Fe *转化 FeOOH沉 淀。
①Fe *转化为 FeOOH 的离子方程式是
② 溶液A 中含金属元素的离子有: Zn +、 Pb *和 _。
(3) Ⅲ 中需控制NaOH 溶 液的用量, 其 原因是 。
(4) IV中加入Na CO 溶液的目的是 _。
(5) V中反应的离子方程式是 _。
高三 年级 (化 学 ) 第7页 (共 8 页)
2025届高三化学
19. (11 分 ) 某实验小组探究SO 与 K FeO 的反应, 实验如下.
资料: i. K FeO 为紫 色固体,微溶于KOH溶液; 具有强氧化性,在酸性或中性溶液中快速产
生O2, 在碱性溶液中较稳定 。
ii. Fe 可以与C O 2-形成[Fe(C O ) 。
装置 操作及现象
实验一: 向B中 通入SO ,产 生暗红褐色沉
淀X和溶液Y (略显红色) ; 继续通入SO
一段时间后 ,溶液呈红色,继而变为橙
色,最终沉淀消失,溶液几乎无色。
(1) A中严生SO 的化学方程式为
(2) 暗红褐色沉淀X可能含Fe *、 OH-、 SO -、 SO -,检验如下:
实验二: 向X中加入足量盐酸,沉淀溶解。 取少量溶液,滴加KSCN溶液后变红。 证明溶液中
存在 。 另取少量溶液滴加 BaCl 溶液,产生白色沉淀,但不能确认含有 SO ,原因是
。
实验三: 向X中加入H C O 溶液, 沉淀溶解。 继续滴加BaCl 溶液,产生白色沉淀,过滤后,向
沉淀中加入盐酸, 白色沉淀溶解。 确认X中不含SO - 。
实验三中用H C O 溶液溶解沉淀的目的是 _。
实验四: 向X中加入足量盐酸,沉淀溶解。 加入几滴碘水 (含淀粉) ,蓝色立即褪去。 静置,一
段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3) 查阅资料 :
a. Fe、 SO 、 H O (或OH-) 会形成配合物HOFeOSO 。
b. SO 和O 在金属离子的催化作用下产生具有强氧化性的过一硫酸 (H SO ) 。
①向溶液Y中滴加2滴 KSCN溶液,未见红色; 再加几滴6mol-L 盐酸,溶液变红 。
溶液Y中存在Fe(II), 但直接滴加KSCN溶液未见红色的原因是 _。
②取出部分实验一中的橙色溶液, 久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎
无色”的原因: 。
总结: SO 与K FeO 发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
高三年级 (化学) 第8页 (共 8页)
北大附中2025届 10月阶段检测
化 学 2024.10
本试卷满分100分。 考试时长90分钟。考生务必将答案答在答题卡上, 在试卷上作答视
为无效。 考试结束,试卷和答题卡一并收回。
考号 : 姓名:
可能用到的相对原子质量 : H 1 C 12 N 14 O 16 S 3 2 Br 80
第一部分 选择题 (每题3分,共 42分)
在每题列出的4个选项中, 选出最符合题目要求的一项 。
1. 下列说法正确的是
A. 氯化钠能使蛋白质变性, 故不可用作食品防腐剂
B.豆浆能产生丁达尔效应是由于胶体中分散质微粒对光线的散射作用
C. SO 可用于丝织品漂白是由于其能氧化丝织品中的有色成分
D.用铁槽车运输浓硝酸利用了常温下铁和浓硝酸不能发生反应的性质
2. 下列反应不属子氧化还原反应的是
A. 向Ba(NO 溶液中通入 SO , 产生白色沉淀
B. 向FeSO 溶液中加入NaClO溶液,产生红褐色沉淀
C.向新制的Cu(OH) 中加入乙醛溶液,加热,产生砖红色沉淀
D. 向饱和氨盐水中通入CO , 产生白色沉淀
3.下列化学用语或图示表达正确的是
A. HCl分子中σ键的形成过程 :
B. 基态 z Cr原子的价层电子轨道表示式为
o l gl r 3à 4sc.t 的电子式为H ǒ. t
D. 聚-1,3-丁二烯的顺式结构:
4. 下列比较不能用元素周期律解释的是
A. 沸点: H O>H S B.电负性 : F> O
. C 还原性 : I> CI- D. 酸 性: HNO > H PO
5.NA为阿伏加德罗常数的值。 下列说法正确的是
A. 18gH O含有的中子数为 10N
B. 0.1 mol-L- HClO 溶液中含有的H 数为0.1NA
C. 1molC H 中含有σ键的数目为5NA
D. 标准状况下, 1.12LN 和足量H 于密闭容器充分反应, 生成NH 分子数为0.1N
高三年级 (化学) 第1页 (共 8页)
2025届高三化学
6. 用摩尔盐[(NH ) Fe(SO )·6H O]溶液进行下列性质实验, 离子方程式不能解释相应现象的是
实验 试剂或仪器 现象 方程式
A pH<7 NH +H O≈→NH ·H O H+pH计 e F + +
+
2H O→Fe(OH ) +2H+
加热产生具有
B 浓NaOH溶液 刺激性气味 的气体
c BaCl 溶 液 产生白色沉淀 Ba +SO —BaSO L
D 稀硝酸溶液 溶液变黄色 Fe ++NO ~+2H = Fe +NO ↑+H O
7. 下列实验能达到对应目的的是
A. 配制一定物质的量 C. 检验 Na O 和水 D. 探 究 SO 具有还
浓鹰的NaOH溶液 B.实验室制氯气 反应的气体产物 原性
8.刺槐素是一种黄酮化合物, 有抗氧化、 抗炎、 抗癌的作用, 其结构简式如下图所示。 下列
关于刺槐素的说法正确的是
A. 分 子式为 CisHi O
B.分子中碳原子的杂化方式均为sp
C. Imol该化合物最多可以和 7mol H 反 应
D. 能与甲醛发生聚合反应
9:”已知: SO3~+l +H O=SO;+21+2H'。 某溶液中可能含有Na 、 NHj、 Fe *、 K*、 I、
So 、 So , 且所有离子物质的量浓度相等。 向该无色溶液中滴加少量溴水,溶液仍呈无色。
下列关于该溶液的判断正确的是
A.肯 定不含T B.肯定不含SO;
c. 肯定不含NH D. 肯定不含 SO}-
高三 年级 (化 学) 第2页 (共 8 页)
2025 届高三化学
10. 溴及其化合物广泛应用于医药、 农药和阻燃剂等生产中。 一种利用空气吹出法从海水中提
取溴的工艺流程如下。
已知 : i.与Na CO 反 应时,Brz 转化 为 BrO 和Br 。
ii.HBrO 为强 酸 。下列说法不正确的是
A. 酸 化海水通入Cl 提取溴的反应: Clz+2Br= 2CI+Br
B. 脱氯过程Fe2*和Br-均具有脱氯作用
C. 用Na CO 溶液吸收足量Br 蒸气后,所得产物中的含碳粒子主要是HCO -
D.H SO 酸化后重新得到Br 的反应: 5Br+BrO +6H= 3Brz+3H O
11. 下列关于实验现象的解释或所得结论正确的是
选项 实验操作 现象 解释或结论
向某补铁剂(添加维生素C作抗
A 氧化剂) 中滴加酸性 KMnO 溶 酸性KMnO 溶
液 液紫色褪去
该补血口服液中一定含有Fe +
B 用蒸馏水溶解CuCl 固体,并继 溶液 由 绿色 逐
[CuCl ] -+4H O →[Cu(H O) + }
续加水稀释 渐变为蓝色 + 4Cr正向移 动, [CuCl ] -转
变为
[Cu(H O ) β+
C 向NaBr溶液中滴加过量氯水, 溶液 先 变 橙 色再加入淀粉-KI溶液 后变为蓝色 氧化性: Cl >Brz>l
D 将碳与浓硫酸加热反应产生的气体通入澄清石灰水中 产生白色沉淀 该气体中一定含有CO
12.·油画创作通常需要用到多种无机颜料。 研究发现, 在不同的空气湿度和光照条件下, 颜料
雌黄 (As S ) 褪色的主要原因是发生了以下两种化学反应:
资料 : 硫 代硫酸根(S O3)可看作是SO ”中的一个O原 子被 S原 子取代的产物 。
下列说法正确的是
A. S,O”的空间构型是平面三角形 , SO3的空间构型是正四面体形
B. 反应I和Ⅱ中,元素As和S都被氧化
C. 反应I和Ⅱ中, 参加反应n(O )/n(H O)的比值: 反应[小于反应Ⅱ
D. 反应 I和Ⅱ中, 氧 化 1 molAs S 转 移的电子数之比为3 : 7
高三年级 (化学) 第3页 (共 8 页)
2025届高三化学
13.元素X的某价态离子X 中所有电子正好充满K、 L、 M三个电子层,它与N -形成晶体的
· 晶胞结构如图所示。 下列说法不正确的是
A..X元素的原子序数是 19B 该晶体中阳离子与阴离子个数比为 3 : 1
C.·X 中n=1
D. 晶体中每个X“周围有2个等距离且最近的N - ○表示X", ○表示N
14.研究小组为探究Na S晶体在空气中变质后的产物,进行实验并记录现象如下:
① 取 Na S样品加水溶解,得到澄清溶液a。
② 取少量溶液a加入过量盐酸,有臭鸡蛋气味的气体放出 ,且 出现淡黄色浑浊。
③ 将②中浊液过滤, 向滤液中加入BaCl 溶液,产生白色沉淀。
资料: i. Na S溶液能溶解 S生成 Na Se, Na S 与酸反应生成 S和 H S (奥鸡蛋气味)
ii. BaS易溶于水
下列说法不正确的是
A ②中淡黄色浑浊可能是 S,2-与H+反应产生的
B….①和②说明该Na S样品中含有S
c.③中白色沉淀是BaSO
D. 该 Na S样品中可能含有Na SO
第二部分 非选择题 (共 58分 )
15. (10分) 寻找安全高效、 低成本的储氢材料对于实现氢能经济具有重要意义。 以 下是常见的
储氢材料。
1. 氰基配合物Cu [Co(CN)Jz·xH O
(1) Cu的基态原子价电子排布式为 。
(2) 墨态N原于占据的最高能级的电子云轮廓图的形状是 。
(3) CN-中C为正价,从原子结构的角度说明理由 。
(4) Co(II)化合物转化为Co(III)化合物:
①在空气中久置后, CoCl 溶液无明显变化; 配制成 [Co(NH )aβ*后, 放置在空气中即可被氧化
为[Co(NH )*,据此推测 (填 “Co ”或 “[Co(NH ) β+”) 还原性更强。
②己知: Co *+6NH ≤ →[Co(NH )a] * KCo +6NH→ Co NH c * K [ ( ) }
利用氧化还原反应规律,可作出推测: K K (填“>”“<”或“=”)。
高三年级 (化学 ) 第4页 (共 8页)
2025届高三化学
ll.金属氢化物
Mg FeH 是非常有潜力的储氢材料。 其晶胞形状为立方体, o H
边长为anm, 如右图所示 。 Mg
(5)M g FeH 晶胞中H 原子个数为 Fe
(6) 已知Mg FeH 的摩尔质量是Mg·mofF',阿伏加德罗
常数为N, 该晶体的密度为 gcm 。 (1nm=10 cm)
16.(13分 ) 碘单质 (紫黑色固体, 微溶于水, 具有挥发性) 及含碘化合物广泛用于医药、 染料
等方面。 回答下列问题:
(1) HI主要用于药物合成,通常用I 和 P反应生成Pl , Pl 再水解制备Hl 。
PI 的空间结构是_ _。 Fl 的P-1键是由磷的 轨道与碘的5p轨道重叠形成σ键。
(2) l 的一种制备方法如下图所示:
AgNO Fe粉 Cl
净化除氯后含碘海水一 富集 悬浊液一 转化 氧化 I
沉淀
①加入Fe粉进行转化反应的离子方程式为_ _, 生 成的沉淀与硝酸反应, 生成 _后可
循环使用。
②通入Cl 的过程中,若氧化产物只有一种,反应的化学方程式为_ ;若反应物用量比n(Cl2)
1n(Fel )= 1.5时 ,氧化产物为 。
(3) 以NalO 为原料制备 l 的方法是: 先向NalO 溶液中加入适量NaHSO3,恰好完全反应生
成碘化物; 再向混合溶液中加入 NalO 溶液,反应得到 I , 上述制备 I 的总反应的离子方程式
为 。
(4)KI溶液和 CuSO 溶液混合可生成Cul沉淀和l2, 若生成1moll ,消耗的KI至少为
mol。 I 在 KI溶液中可发生反应 I2+1 = l3 。实验室中使用过量的KI与 CuSO 溶液反应后,
过滤, 滤液经蒸馏可制得高纯碘。 反应中加入过量K1的原因是 _。
(5) l 与足量F 在一定条件下发生反应可生成卤素互化物IF , 写出其与H O发生的非氧化还
原反应的化学方程式
高三年级 (化学) 第5页 (共 8页)
2025届高三化学
17. (12分)
药物卡托普利的合成原料F、 工程材料聚碳酸酯 (简称PC) 的合成路线如下图所示:
已知 :
②酯与含羟基的化合物可发生如下酯交换反应:
CR、 R’、 R”代表烃基)
请回答:
(1) 已知C的核磁共振氢谱只有一种峰。
①丙烯→A的反应类型是
②A→B的反应试剂和条件是
③B→C的化学方程式是
(2) 9.4g的D与饱和溴水完全反应生成33.1g白色沉淀,D的结构简式是
(3) C与D反应生成双酚A的化学方程式是
(4) F有多种同分异构体, 满足下列条件的同分异构体的结构简式是 _。 (写出一
种即可)
①含有甲基 ②含有碳碳双键 ③能发生银镜反应 ④属于酯
(5) PC的结构简式是
高三年级 (化学) 第6页 (共 8页)
2025届高三化学
18. (12 分 ) 工 业用黄铜矿 (主要成分 CuFeS , 含 少量 锌、 铅 的硫化物) 冶 炼铜的一种方法如
下:
固体Q
IV Cu O VI Cu溶液B Na CO 溶液 固 休 H 单质
V
溶液 A N ⅢaOH 溶液C NaOH
黄 π 溶液 Cn OH铜 ( ) C 溶液盐酸 空 气 固 体 盐酸 NaCI
矿 CuCl 溶液 溶液D 溶液
固体 M
VⅡ盐 酸
VⅢ Cl
(1) I中发生下列反应 。
i.CuFeS +3Cu ++4Cl=4CuCl+ Fe ++2S
ii.CuCl+Cl= CuCl -
1 中盐酸的作用是 。
(2) Ⅱ中通入空气, 将 Fe *转化 FeOOH沉 淀。
①Fe *转化为 FeOOH 的离子方程式是
② 溶液A 中含金属元素的离子有: Zn +、 Pb *和 _。
(3) Ⅲ 中需控制NaOH 溶 液的用量, 其 原因是 。
(4) IV中加入Na CO 溶液的目的是 _。
(5) V中反应的离子方程式是 _。
高三 年级 (化 学 ) 第7页 (共 8 页)
2025届高三化学
19. (11 分 ) 某实验小组探究SO 与 K FeO 的反应, 实验如下.
资料: i. K FeO 为紫 色固体,微溶于KOH溶液; 具有强氧化性,在酸性或中性溶液中快速产
生O2, 在碱性溶液中较稳定 。
ii. Fe 可以与C O 2-形成[Fe(C O ) 。
装置 操作及现象
实验一: 向B中 通入SO ,产 生暗红褐色沉
淀X和溶液Y (略显红色) ; 继续通入SO
一段时间后 ,溶液呈红色,继而变为橙
色,最终沉淀消失,溶液几乎无色。
(1) A中严生SO 的化学方程式为
(2) 暗红褐色沉淀X可能含Fe *、 OH-、 SO -、 SO -,检验如下:
实验二: 向X中加入足量盐酸,沉淀溶解。 取少量溶液,滴加KSCN溶液后变红。 证明溶液中
存在 。 另取少量溶液滴加 BaCl 溶液,产生白色沉淀,但不能确认含有 SO ,原因是
。
实验三: 向X中加入H C O 溶液, 沉淀溶解。 继续滴加BaCl 溶液,产生白色沉淀,过滤后,向
沉淀中加入盐酸, 白色沉淀溶解。 确认X中不含SO - 。
实验三中用H C O 溶液溶解沉淀的目的是 _。
实验四: 向X中加入足量盐酸,沉淀溶解。 加入几滴碘水 (含淀粉) ,蓝色立即褪去。 静置,一
段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3) 查阅资料 :
a. Fe、 SO 、 H O (或OH-) 会形成配合物HOFeOSO 。
b. SO 和O 在金属离子的催化作用下产生具有强氧化性的过一硫酸 (H SO ) 。
①向溶液Y中滴加2滴 KSCN溶液,未见红色; 再加几滴6mol-L 盐酸,溶液变红 。
溶液Y中存在Fe(II), 但直接滴加KSCN溶液未见红色的原因是 _。
②取出部分实验一中的橙色溶液, 久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎
无色”的原因: 。
总结: SO 与K FeO 发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
高三年级 (化学) 第8页 (共 8页)
同课章节目录
