北京市第九中学2024-2025学年高三上学期10月月考 化学试题(PDF版,无答案)
文档属性
| 名称 | 北京市第九中学2024-2025学年高三上学期10月月考 化学试题(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-14 07:18:09 | ||
图片预览



文档简介
北京九中 2024-2025 学年第一学期 10 月统练
高三化学 2024.10
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mn 55 Fe 56
一、单选题(每题 3分,共 60 分)。
1. 下列化学用语或图示表达不.正.确.的是
A.二氧化碳的电子式: B. 乙烯的结构式:
C. 用电子云轮廓图示意 p-pπ键的形成:
D. 用电子式表示Cl2的形成:
2. 下列科学研究领域中,不.属.于.化学研究范畴的是
A.国家游泳馆水立方采用的覆盖膜为先进的 EFET膜,具有防火、抗老化等功能
B.两个氢原子核聚变成一个氦核,释放出巨大能量,用于发电
C.利用分子组装技术组装分子机器
D.研究物质性质,用于合成杀死新型冠状病毒的物质
3. 氯化铁是一种重要的盐,下列说法不.正.确.的是
A.氯化铁属于弱电解质 B.氯化铁溶液可腐蚀覆铜板
C.氯化铁可由铁与氯气反应制得 D.氯化铁溶液可制备氢氧化铁胶体
4. 中国化学会遴选了 118名青年化学家作为“元素代言人”组成“中国青年化学家元素
周期表”。 元素 Po(钋)与 S同主族,由暨南大学陈填烽代言,其原子序数为 84。
下列说法正确的是
A.Po位于元素周期表的第 4周期 B.原子半径:Po<S
C.210Po的中子数为 126 D.PoO2只有还原性
5. NaN3是汽车安全气囊系统中普遍使用的物质之一。当汽车受到猛烈碰撞时,瞬间引
发反应:2NaN3 == 2Na + 3N2↑,同时释放大量的热。NaN3为离子化合物,下列说
法正确的是
A.生成 3 mol N2时,转移 2 mol电子 B.1个 N3-中含有 21个电子
C.NaN3中只含离子键 D.N2的电子式为 N N
{#{QQABABQQEoxggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBNAMOAsAQAKACiAJFAFBKCA=}}#}}
6. 下列离子方程式书写不.正.确.的是
A.少量金属 Na 加入水中:2Na + 2H2O ═ 2Na+ + 2OH- + H2↑
B.用浓 NaOH溶液反萃取法提取碘:3I2 + 6OH- ═ 5I- + IO-3 + 3H2O
C.向次氯酸钙溶液中通入足量CO 2+ -2:Ca +2ClO +CO2+H2O ═ CaCO3↓+2HClO
D.小苏打溶液中滴加少量澄清石灰水:Ca2++2OH-+2HCO-3═ CaCO ↓+CO2-3 3 +2H2O
7. 下列物质的应用中,主要利用的反应不.属.于.氧化还原反应的是
A.用铝和氧化铁的混合物焊接铁轨 B.用氮气实现工业合成氨
C.实验室用 NaOH溶液吸收 SO2尾气 D.湿润淀粉碘化钾试纸检验 Cl2
8. 用 NA代表阿伏加德罗常数的值,下列说法正确的是
A.pH=2 +的盐酸中的 H 总数为 0.01 NA
B.7.8 g Na2O2中的离子总数为 0.4 NA
C.标准状况下,5.6 L H2O所含 O-H键的数目为 0.5 NA
D.2.3 g Na和足量氧气反应转移电子数一定为 0.1 NA
9. 下列叙述对应的离子方程式正确的是
A.向饱和 NaOH溶液通入过量CO2析出白色晶体:OH- + CO2 = HCO-3
B.白色沉淀 CuCl溶于NH4Cl-NH3 H2O溶液得到深蓝色溶液:
4Cu++ 4NH+4 + O2 + 12NH = 4 Cu NH 2+3 3 4 + 2H2O
C.向NaHSO3溶液中滴入酸化的 Ba NO3 2溶液产生白色沉淀:
2HSO- + Ba2+3 = H2O + SO2↑ + BaSO3
D.向KMnO4溶液中滴入H2O2溶液产生黑色沉淀和气泡:
2MnO-4 + 3H2O -2 = 2MnO2↓ + 3O2↑ + 2OH + 2H2O
10. 已知 Cl、Se、Br在元素周期表中的位置如下图所示。下列说法不.正.确.的是
A. 原子半径:Se > Br >Cl
B. 还原性:Br- > Se2- >Cl-
C. 酸性:HClO4>HBrO4>H2SeO4
D. 气态氢化物的稳定性:HCl>HBr>H2Se
{#{QQABABQQoExggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBANMOsAAQAKACiAJFAFBKCA=}}#}}
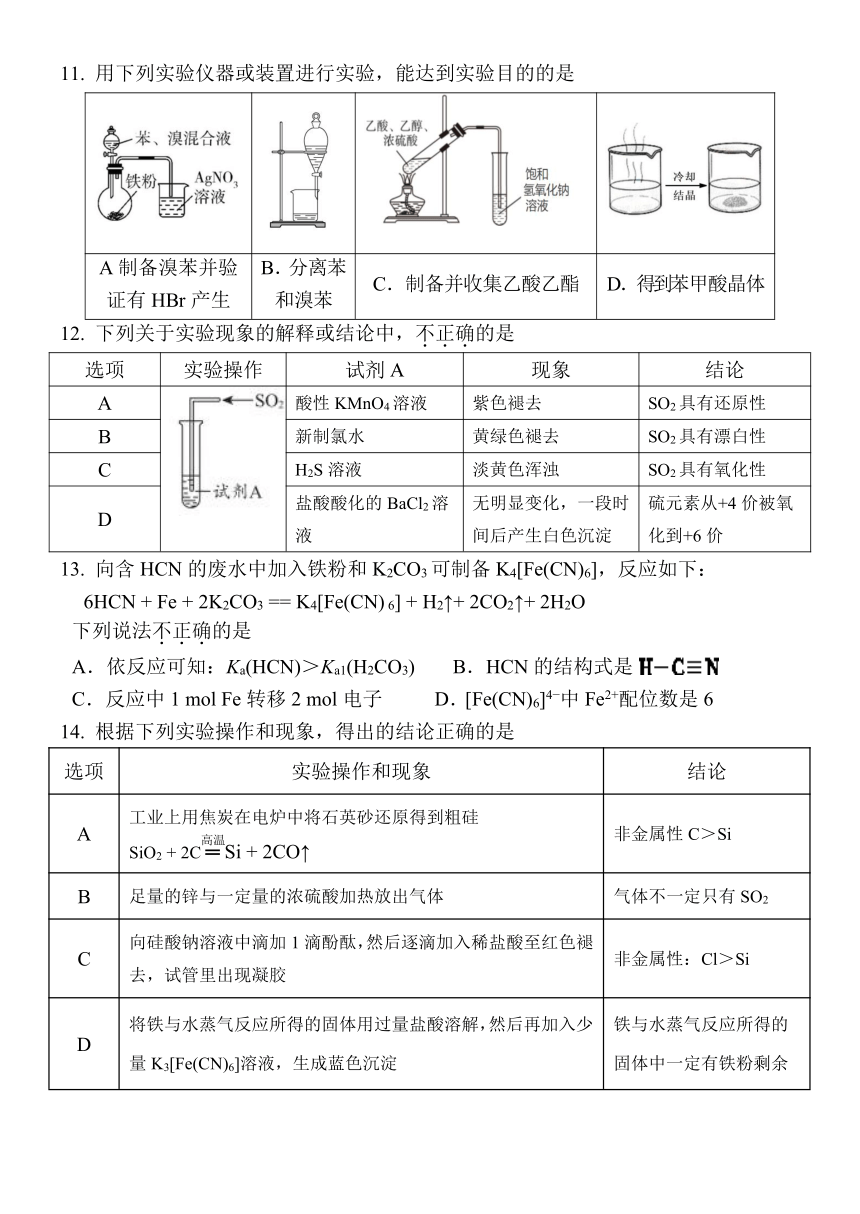
11. 用下列实验仪器或装置进行实验,能达到实验目的的是
A制备溴苯并验 B.分离苯
C.制备并收集乙酸乙酯 D.得到苯甲酸晶体
证有 HBr产生 和溴苯
12. 下列关于实验现象的解释或结论中,不.正.确.的是
选项 实验操作 试剂 A 现象 结论
A 酸性 KMnO4溶液 紫色褪去 SO2具有还原性
B 新制氯水 黄绿色褪去 SO2具有漂白性
C H2S溶液 淡黄色浑浊 SO2具有氧化性
盐酸酸化的 BaCl2溶 无明显变化,一段时 硫元素从+4价被氧
D
液 间后产生白色沉淀 化到+6价
13. 向含 HCN的废水中加入铁粉和 K2CO3可制备 K4[Fe(CN)6],反应如下:
6HCN + Fe + 2K2CO3 == K4[Fe(CN) 6] + H2↑+ 2CO2↑+ 2H2O
下列说法不.正.确.的是
A.依反应可知:Ka(HCN)>Ka1(H2CO3) B.HCN的结构式是
C.反应中 1 mol Fe转移 2 mol电子 D.[Fe(CN)6]4 中 Fe2+配位数是 6
14. 根据下列实验操作和现象,得出的结论正确的是
选项 实验操作和现象 结论
工业上用焦炭在电炉中将石英砂还原得到粗硅
A 高温 非金属性 C>Si
SiO2 + 2C ═ Si + 2CO↑
B 足量的锌与一定量的浓硫酸加热放出气体 气体不一定只有 SO2
向硅酸钠溶液中滴加 1滴酚酞,然后逐滴加入稀盐酸至红色褪
C 非金属性:Cl>Si
去,试管里出现凝胶
将铁与水蒸气反应所得的固体用过量盐酸溶解,然后再加入少 铁与水蒸气反应所得的
D
量 K3[Fe(CN)6]溶液,生成蓝色沉淀 固体中一定有铁粉剩余
{#{QQABABQQEoxggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBANMOsAAQAKACiAJFAFBKCA=}}#}}
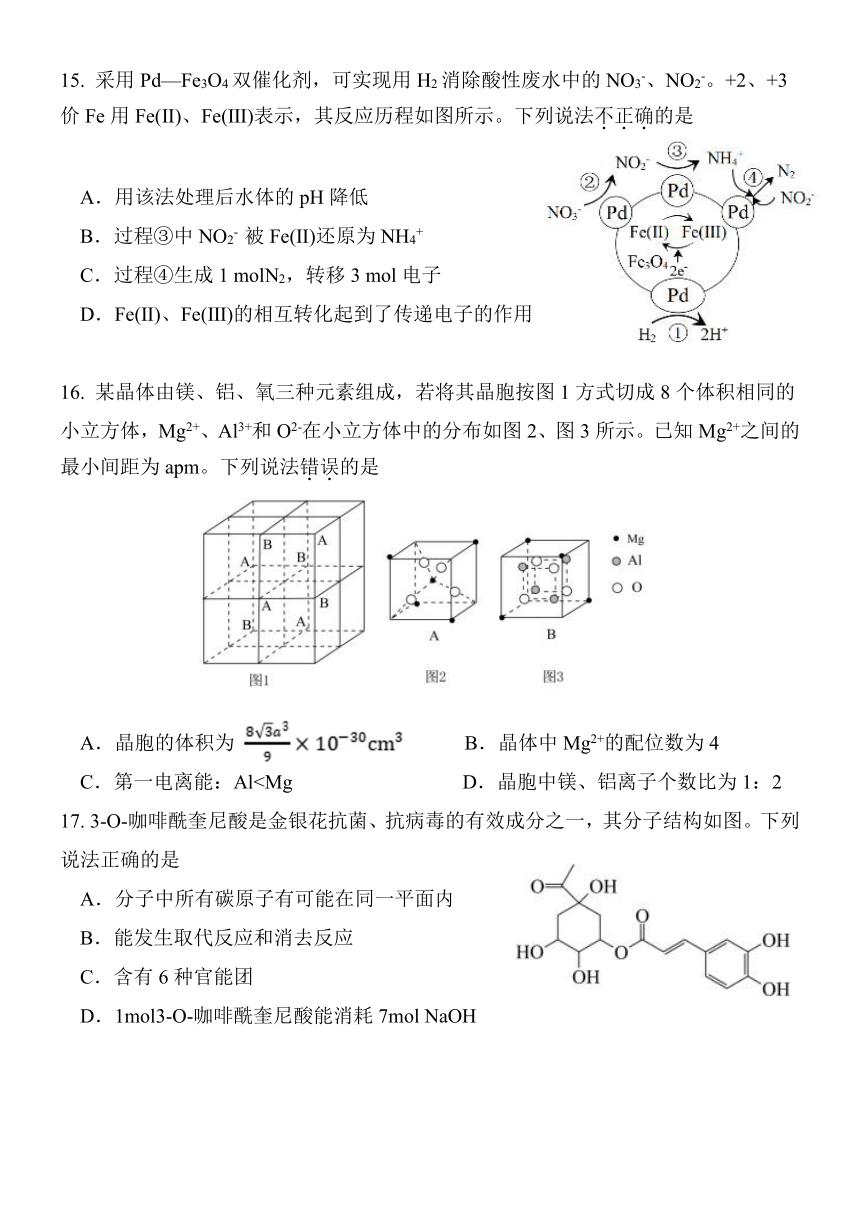
15. 采用 Pd—Fe3O4双催化剂,可实现用 H2消除酸性废水中的 NO3-、NO2-。+2、+3
价 Fe用 Fe(Ⅱ)、Fe(Ⅲ)表示,其反应历程如图所示。下列说法不.正.确.的是
A.用该法处理后水体的 pH降低
B.过程③中 NO2- 被 Fe(Ⅱ)还原为 NH4+
C.过程④生成 1 molN2,转移 3 mol电子
D.Fe(Ⅱ)、Fe(Ⅲ)的相互转化起到了传递电子的作用
16. 某晶体由镁、铝、氧三种元素组成,若将其晶胞按图 1方式切成 8个体积相同的
小立方体,Mg2+、Al3+和 O2-在小立方体中的分布如图 2、图 3所示。已知Mg2+之间的
最小间距为 apm。下列说法错.误.的是
A.晶胞的体积为 B.晶体中Mg2+的配位数为 4
C.第一电离能:Al17. 3-O-咖啡酰奎尼酸是金银花抗菌、抗病毒的有效成分之一,其分子结构如图。下列
说法正确的是
A.分子中所有碳原子有可能在同一平面内
B.能发生取代反应和消去反应
C.含有 6种官能团
D.1mol3-O-咖啡酰奎尼酸能消耗 7mol NaOH
{#{QQABABQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBNAMOsAAQAKACiAJFAFBKCA=}}#}}
18. 高分子M广泛用于纺织、涂料等产品,合成路线如下:
已知:
下列说法不.正.确.的是
A.化合物 A不存在顺反异构体 B.化合物 A含有两种官能团
C.N能与溴水反应 D.M、N均可水解得到
19. 酞菁钴近年来被广泛应用于光电材料、非线性光学材料、催化剂等方面。酞菁钴
的熔点约为 163℃,其结构如图所示(部分化学键未画明)。下列说法错.误.的是
A.酞菁钴中 Co的化合价为+4价
B.酞菁钴中碳原子只有 sp2杂化这一种方式
C.与钴离子通过配位键结合的是 2号和 4号 N原子
D.酞菁钴是分子晶体
20. 某物质的转化关系如图所示,下列有关说法正确的是
A.化合物 A的结构可能有 3种
B.化合物 A中一定含有的官能团是醛基、羧基和碳碳双键
C.F的结构简式可表示为
D.由 A生成 E发生氧化反应
{#{QQABBAQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBANMOsAAQAKACiAJFAFBKCA=}}#}}
二、填空题(共 4题,共 40分)
21. 乌药内酯具有抗炎、镇痛作用。乌药内酯的中间体 X合成路线如下图所示(部分
反应条件或试剂略去)。
(1)B的官能团名称是________。
(2)B→D的化学方程式是___________________________________。
(3)已知 2D→E+A,E的结构简式是___________________________。
(4)下列关于有机物 I的说法不正确的是________。(填序号)。
a.可以发生取代反应、加成反应、氧化反应
b.存在酚类同分异构体
c.可以用酸性 KMnO4溶液检验其中的碳碳双键
d.核磁共振氢谱中有 6种信号峰,有手性碳原子
(5)I→J的化学方程式是____________________________________。
(6)已知:
①
②
G与 L可以在碱性条件下经过如下图所示的多步反应得到 X。
中间产物 1、中间产物 3的结构简式是______________、_________________。
{#{QQABABQQoExggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBANMOAsAQAKACiAJFAFBKCA=}}#}}
22. 磷及其化合物在工业生产中起着重要的作用。
(1)基态磷原子价电子的轨道表示式是__________________________。
(2)磷元素有白磷、黑磷等常见的单质。
①白磷(P4)是分子晶体,易溶于 CS2,难溶于水,可能原因是
___________________________________________________________。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,
如右图。下列有关黑磷晶体的说法正确的是______(填序号)。
a.层与层之间的作用力是共价键
b.分子中磷原子杂化方式为 sp2 杂化
c.是混合型晶体
(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干
扰,常在 Fe3+溶液中加入 H3PO4 形成无色的[Fe(PO4)2]3-。
由此推测与 Fe3+形成的配离子更稳定的配体是 ,
其空间构型是 。
(4)第ⅢA 族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
物质 磷化铝(AlP ) 磷化镓(GaP ) 磷化铟( InP )
熔点/℃ 2000 1465 1070
从结构角度说明表中三种物质熔点差异的原因
。
(5)过硼酸钠Na 2 B2 O2 OH 2 4 被用于洗衣粉中作增白剂,其阴离子结构如图所示
,该物质可用于增白的原因是 。
{#{QQABBAQQEoxggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBNAMOAsAQAKACiAJFAFBKCA=}}#}}
23. 铁和硒(Se)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。
回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 Se原子的核外电子排布式为[Ar] ;
②该新药分子中有 种不同化学环境的 C原子;
③比较键角:气态 SeO3分子 SeO32-离子(填“>”、“<”或“=”),原因
是 。
(2) 富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中σ键与π键的数目比为 ;
②富马酸亚铁中各元素的电负性由大到小的顺序为 ;
③富马酸亚铁中 C的杂化方式为 。
(3)铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低
矫顽力,有望获得较高的微波磁导率,具有极大的市场潜力,其四子格结构如图所
示,已知该晶胞的边长为 a pm,阿伏加德罗常数为 NA。
1 该化合物的化学式为 _____________;
2 计算晶体密度为__________________ g·cm-3
{#{QQABBAQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBNAMOsAAQAKACiAJFAFBKCA=}}#}}
24. 软锰矿浆(主要成分MnO2)可吸收烟气中的 SO2,同时可制备MnCO3,工艺流
程如下:
资料:①吸收 SO2后的软锰矿浆中含有 Fe2+、Fe3+、Al3+、Zn2+等阳离子;
②金属离子沉淀的 pH如下表
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Zn2+
开始沉淀的 pH 8.1 6.3 1.5 3.4 6.2
沉淀完全的 pH 10.1 8.3 2.8 4.7 8.2
(1)脱硫的产物是MnSO4,软锰矿中MnO2所起的作用是 。
(2)过程 1向浆液中通入 O2主要发生反应的离子方程式为 。
(3)滤渣 1的成分是________,过程 2中发生反应的离子方程式为 。
(4)物质 A是 NH4HCO3溶液(pH约为 7.8),制备MnCO3时一般控制溶液的 pH范
围为 5-7,写出反应的离子方程式 。
(5)取 m g碳酸锰样品,加适量硫酸加热溶解后,用 c mol·L-1的 KMnO4溶液滴定,
至滴定终点时,消耗 KMnO4溶液的体积为 V mL。
(已知:反应产物为MnO2,杂质不参与反应)
样品中MnCO3质量分数的计算式为________(用质量分数表示)。
{#{QQABABQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBNAMOsAAQAKACiAJFAFBKCA=}}#}}
草稿区
{#{QQABBAQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBNAMOsAAQAKACiAJFAFBKCA=}}#}}
高三化学 2024.10
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mn 55 Fe 56
一、单选题(每题 3分,共 60 分)。
1. 下列化学用语或图示表达不.正.确.的是
A.二氧化碳的电子式: B. 乙烯的结构式:
C. 用电子云轮廓图示意 p-pπ键的形成:
D. 用电子式表示Cl2的形成:
2. 下列科学研究领域中,不.属.于.化学研究范畴的是
A.国家游泳馆水立方采用的覆盖膜为先进的 EFET膜,具有防火、抗老化等功能
B.两个氢原子核聚变成一个氦核,释放出巨大能量,用于发电
C.利用分子组装技术组装分子机器
D.研究物质性质,用于合成杀死新型冠状病毒的物质
3. 氯化铁是一种重要的盐,下列说法不.正.确.的是
A.氯化铁属于弱电解质 B.氯化铁溶液可腐蚀覆铜板
C.氯化铁可由铁与氯气反应制得 D.氯化铁溶液可制备氢氧化铁胶体
4. 中国化学会遴选了 118名青年化学家作为“元素代言人”组成“中国青年化学家元素
周期表”。 元素 Po(钋)与 S同主族,由暨南大学陈填烽代言,其原子序数为 84。
下列说法正确的是
A.Po位于元素周期表的第 4周期 B.原子半径:Po<S
C.210Po的中子数为 126 D.PoO2只有还原性
5. NaN3是汽车安全气囊系统中普遍使用的物质之一。当汽车受到猛烈碰撞时,瞬间引
发反应:2NaN3 == 2Na + 3N2↑,同时释放大量的热。NaN3为离子化合物,下列说
法正确的是
A.生成 3 mol N2时,转移 2 mol电子 B.1个 N3-中含有 21个电子
C.NaN3中只含离子键 D.N2的电子式为 N N
{#{QQABABQQEoxggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBNAMOAsAQAKACiAJFAFBKCA=}}#}}
6. 下列离子方程式书写不.正.确.的是
A.少量金属 Na 加入水中:2Na + 2H2O ═ 2Na+ + 2OH- + H2↑
B.用浓 NaOH溶液反萃取法提取碘:3I2 + 6OH- ═ 5I- + IO-3 + 3H2O
C.向次氯酸钙溶液中通入足量CO 2+ -2:Ca +2ClO +CO2+H2O ═ CaCO3↓+2HClO
D.小苏打溶液中滴加少量澄清石灰水:Ca2++2OH-+2HCO-3═ CaCO ↓+CO2-3 3 +2H2O
7. 下列物质的应用中,主要利用的反应不.属.于.氧化还原反应的是
A.用铝和氧化铁的混合物焊接铁轨 B.用氮气实现工业合成氨
C.实验室用 NaOH溶液吸收 SO2尾气 D.湿润淀粉碘化钾试纸检验 Cl2
8. 用 NA代表阿伏加德罗常数的值,下列说法正确的是
A.pH=2 +的盐酸中的 H 总数为 0.01 NA
B.7.8 g Na2O2中的离子总数为 0.4 NA
C.标准状况下,5.6 L H2O所含 O-H键的数目为 0.5 NA
D.2.3 g Na和足量氧气反应转移电子数一定为 0.1 NA
9. 下列叙述对应的离子方程式正确的是
A.向饱和 NaOH溶液通入过量CO2析出白色晶体:OH- + CO2 = HCO-3
B.白色沉淀 CuCl溶于NH4Cl-NH3 H2O溶液得到深蓝色溶液:
4Cu++ 4NH+4 + O2 + 12NH = 4 Cu NH 2+3 3 4 + 2H2O
C.向NaHSO3溶液中滴入酸化的 Ba NO3 2溶液产生白色沉淀:
2HSO- + Ba2+3 = H2O + SO2↑ + BaSO3
D.向KMnO4溶液中滴入H2O2溶液产生黑色沉淀和气泡:
2MnO-4 + 3H2O -2 = 2MnO2↓ + 3O2↑ + 2OH + 2H2O
10. 已知 Cl、Se、Br在元素周期表中的位置如下图所示。下列说法不.正.确.的是
A. 原子半径:Se > Br >Cl
B. 还原性:Br- > Se2- >Cl-
C. 酸性:HClO4>HBrO4>H2SeO4
D. 气态氢化物的稳定性:HCl>HBr>H2Se
{#{QQABABQQoExggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBANMOsAAQAKACiAJFAFBKCA=}}#}}
11. 用下列实验仪器或装置进行实验,能达到实验目的的是
A制备溴苯并验 B.分离苯
C.制备并收集乙酸乙酯 D.得到苯甲酸晶体
证有 HBr产生 和溴苯
12. 下列关于实验现象的解释或结论中,不.正.确.的是
选项 实验操作 试剂 A 现象 结论
A 酸性 KMnO4溶液 紫色褪去 SO2具有还原性
B 新制氯水 黄绿色褪去 SO2具有漂白性
C H2S溶液 淡黄色浑浊 SO2具有氧化性
盐酸酸化的 BaCl2溶 无明显变化,一段时 硫元素从+4价被氧
D
液 间后产生白色沉淀 化到+6价
13. 向含 HCN的废水中加入铁粉和 K2CO3可制备 K4[Fe(CN)6],反应如下:
6HCN + Fe + 2K2CO3 == K4[Fe(CN) 6] + H2↑+ 2CO2↑+ 2H2O
下列说法不.正.确.的是
A.依反应可知:Ka(HCN)>Ka1(H2CO3) B.HCN的结构式是
C.反应中 1 mol Fe转移 2 mol电子 D.[Fe(CN)6]4 中 Fe2+配位数是 6
14. 根据下列实验操作和现象,得出的结论正确的是
选项 实验操作和现象 结论
工业上用焦炭在电炉中将石英砂还原得到粗硅
A 高温 非金属性 C>Si
SiO2 + 2C ═ Si + 2CO↑
B 足量的锌与一定量的浓硫酸加热放出气体 气体不一定只有 SO2
向硅酸钠溶液中滴加 1滴酚酞,然后逐滴加入稀盐酸至红色褪
C 非金属性:Cl>Si
去,试管里出现凝胶
将铁与水蒸气反应所得的固体用过量盐酸溶解,然后再加入少 铁与水蒸气反应所得的
D
量 K3[Fe(CN)6]溶液,生成蓝色沉淀 固体中一定有铁粉剩余
{#{QQABABQQEoxggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBANMOsAAQAKACiAJFAFBKCA=}}#}}
15. 采用 Pd—Fe3O4双催化剂,可实现用 H2消除酸性废水中的 NO3-、NO2-。+2、+3
价 Fe用 Fe(Ⅱ)、Fe(Ⅲ)表示,其反应历程如图所示。下列说法不.正.确.的是
A.用该法处理后水体的 pH降低
B.过程③中 NO2- 被 Fe(Ⅱ)还原为 NH4+
C.过程④生成 1 molN2,转移 3 mol电子
D.Fe(Ⅱ)、Fe(Ⅲ)的相互转化起到了传递电子的作用
16. 某晶体由镁、铝、氧三种元素组成,若将其晶胞按图 1方式切成 8个体积相同的
小立方体,Mg2+、Al3+和 O2-在小立方体中的分布如图 2、图 3所示。已知Mg2+之间的
最小间距为 apm。下列说法错.误.的是
A.晶胞的体积为 B.晶体中Mg2+的配位数为 4
C.第一电离能:Al
说法正确的是
A.分子中所有碳原子有可能在同一平面内
B.能发生取代反应和消去反应
C.含有 6种官能团
D.1mol3-O-咖啡酰奎尼酸能消耗 7mol NaOH
{#{QQABABQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBNAMOsAAQAKACiAJFAFBKCA=}}#}}
18. 高分子M广泛用于纺织、涂料等产品,合成路线如下:
已知:
下列说法不.正.确.的是
A.化合物 A不存在顺反异构体 B.化合物 A含有两种官能团
C.N能与溴水反应 D.M、N均可水解得到
19. 酞菁钴近年来被广泛应用于光电材料、非线性光学材料、催化剂等方面。酞菁钴
的熔点约为 163℃,其结构如图所示(部分化学键未画明)。下列说法错.误.的是
A.酞菁钴中 Co的化合价为+4价
B.酞菁钴中碳原子只有 sp2杂化这一种方式
C.与钴离子通过配位键结合的是 2号和 4号 N原子
D.酞菁钴是分子晶体
20. 某物质的转化关系如图所示,下列有关说法正确的是
A.化合物 A的结构可能有 3种
B.化合物 A中一定含有的官能团是醛基、羧基和碳碳双键
C.F的结构简式可表示为
D.由 A生成 E发生氧化反应
{#{QQABBAQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBANMOsAAQAKACiAJFAFBKCA=}}#}}
二、填空题(共 4题,共 40分)
21. 乌药内酯具有抗炎、镇痛作用。乌药内酯的中间体 X合成路线如下图所示(部分
反应条件或试剂略去)。
(1)B的官能团名称是________。
(2)B→D的化学方程式是___________________________________。
(3)已知 2D→E+A,E的结构简式是___________________________。
(4)下列关于有机物 I的说法不正确的是________。(填序号)。
a.可以发生取代反应、加成反应、氧化反应
b.存在酚类同分异构体
c.可以用酸性 KMnO4溶液检验其中的碳碳双键
d.核磁共振氢谱中有 6种信号峰,有手性碳原子
(5)I→J的化学方程式是____________________________________。
(6)已知:
①
②
G与 L可以在碱性条件下经过如下图所示的多步反应得到 X。
中间产物 1、中间产物 3的结构简式是______________、_________________。
{#{QQABABQQoExggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBANMOAsAQAKACiAJFAFBKCA=}}#}}
22. 磷及其化合物在工业生产中起着重要的作用。
(1)基态磷原子价电子的轨道表示式是__________________________。
(2)磷元素有白磷、黑磷等常见的单质。
①白磷(P4)是分子晶体,易溶于 CS2,难溶于水,可能原因是
___________________________________________________________。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,
如右图。下列有关黑磷晶体的说法正确的是______(填序号)。
a.层与层之间的作用力是共价键
b.分子中磷原子杂化方式为 sp2 杂化
c.是混合型晶体
(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干
扰,常在 Fe3+溶液中加入 H3PO4 形成无色的[Fe(PO4)2]3-。
由此推测与 Fe3+形成的配离子更稳定的配体是 ,
其空间构型是 。
(4)第ⅢA 族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
物质 磷化铝(AlP ) 磷化镓(GaP ) 磷化铟( InP )
熔点/℃ 2000 1465 1070
从结构角度说明表中三种物质熔点差异的原因
。
(5)过硼酸钠Na 2 B2 O2 OH 2 4 被用于洗衣粉中作增白剂,其阴离子结构如图所示
,该物质可用于增白的原因是 。
{#{QQABBAQQEoxggoiAQAgopASAACQg5CKQw00kaqCUECq QkJAMChALCcQgMgGhQBCBNAMOAsAQAKACiAJFAFBKCA=}}#}}
23. 铁和硒(Se)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。
回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 Se原子的核外电子排布式为[Ar] ;
②该新药分子中有 种不同化学环境的 C原子;
③比较键角:气态 SeO3分子 SeO32-离子(填“>”、“<”或“=”),原因
是 。
(2) 富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中σ键与π键的数目比为 ;
②富马酸亚铁中各元素的电负性由大到小的顺序为 ;
③富马酸亚铁中 C的杂化方式为 。
(3)铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低
矫顽力,有望获得较高的微波磁导率,具有极大的市场潜力,其四子格结构如图所
示,已知该晶胞的边长为 a pm,阿伏加德罗常数为 NA。
1 该化合物的化学式为 _____________;
2 计算晶体密度为__________________ g·cm-3
{#{QQABBAQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBNAMOsAAQAKACiAJFAFBKCA=}}#}}
24. 软锰矿浆(主要成分MnO2)可吸收烟气中的 SO2,同时可制备MnCO3,工艺流
程如下:
资料:①吸收 SO2后的软锰矿浆中含有 Fe2+、Fe3+、Al3+、Zn2+等阳离子;
②金属离子沉淀的 pH如下表
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Zn2+
开始沉淀的 pH 8.1 6.3 1.5 3.4 6.2
沉淀完全的 pH 10.1 8.3 2.8 4.7 8.2
(1)脱硫的产物是MnSO4,软锰矿中MnO2所起的作用是 。
(2)过程 1向浆液中通入 O2主要发生反应的离子方程式为 。
(3)滤渣 1的成分是________,过程 2中发生反应的离子方程式为 。
(4)物质 A是 NH4HCO3溶液(pH约为 7.8),制备MnCO3时一般控制溶液的 pH范
围为 5-7,写出反应的离子方程式 。
(5)取 m g碳酸锰样品,加适量硫酸加热溶解后,用 c mol·L-1的 KMnO4溶液滴定,
至滴定终点时,消耗 KMnO4溶液的体积为 V mL。
(已知:反应产物为MnO2,杂质不参与反应)
样品中MnCO3质量分数的计算式为________(用质量分数表示)。
{#{QQABABQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBNAMOsAAQAKACiAJFAFBKCA=}}#}}
草稿区
{#{QQABBAQQEoxggoiAQAgopASAACQg5CKQw00kaqCUEqCQkJAMChALCcQgMgGhQBCBNAMOsAAQAKACiAJFAFBKCA=}}#}}
同课章节目录
