3.2.3 离子反应 课件(共27张PPT)—高中化学苏教版(2019)必修一
文档属性
| 名称 | 3.2.3 离子反应 课件(共27张PPT)—高中化学苏教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 20.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-14 15:41:18 | ||
图片预览








文档简介
(共25张PPT)
专题3 从海水中获得的化学物质
第二单元 金属钠及钠的化合物
第三课时 离子反应
课前导入
三国时,诸葛亮为了擒拿南王孟获,率军南征至云南西洱河,遇四口毒泉,其中一口为哑泉。时逢天气好生炎热,人马饮用了哑泉水后,全都中毒,将士们都说不出话来。后来幸得一智者指点,复饮安乐泉水,随即吐出恶涎,便能言语。
课前导入
经研究发现,哑泉水是一种含铜盐的泉水,即硫酸铜(胆矾)的水溶液,称为胆水。这里的安乐泉为碱性水,即氢氧化钙的水溶液。二者相互混合后能使铜盐生成不溶于水的沉淀物。从而达到了解毒的效果。
涉及的离子反应方程式为:
上述反应为离子反应,那么,这种类型的反应发生时需要满足什么条件呢?
Cu2+ + 2OH- = Cu(OH)2↓
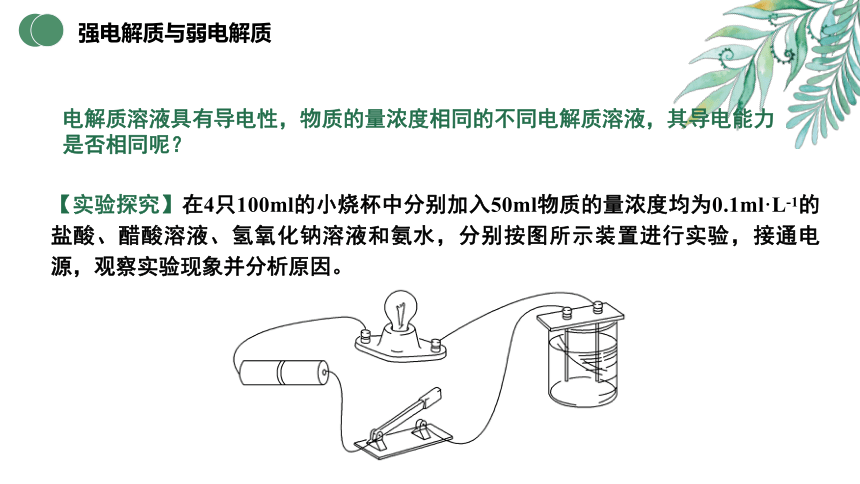
强电解质与弱电解质
电解质溶液具有导电性,物质的量浓度相同的不同电解质溶液,其导电能力是否相同呢?
【实验探究】在4只100ml的小烧杯中分别加入50ml物质的量浓度均为0.1ml·L-1的盐酸、醋酸溶液、氢氧化钠溶液和氨水,分别按图所示装置进行实验,接通电源,观察实验现象并分析原因。
强电解质与弱电解质
强电解质与弱电解质
样品 盐酸 醋酸 氢氧化钠 氨水
现象
结论 【实验现象及结论】
当物质的浓度相等时,醋酸溶液和氨水的导电能力明显弱于盐酸和氢氧化钠溶液的导电能力。
灯泡很亮,有电流产生
灯泡不太亮,有微弱电流产生
灯泡不太亮,有微弱电流产生
灯泡很亮,有电流产生
强电解质与弱电解质
上述实验产生的现象是因为HCl、NaOH在水溶液中能完全电离,而CH3COOH、NH3·H2O在水溶液中只发生部分电离。当电解质不完全电离时,书写电离方程式要用“ ”代替“==”。
强酸(如H2SO4、HCl、HNO3等)、强碱(如NaOH、KOH等)和绝大多数盐在水溶液中能完全电离,这样的电解质称为强电解质。弱酸(H2CO3、CH3COOH、HClO等)、弱碱(如NH3·H2O等)在水溶液中不能完全电离,这样的电解质称为弱电解质。
离子反应
Na2CO3、Ca(OH)2和CaCl2的电离方程式 ______________________________、________________________________
、_____________________________________
混合前三种溶液中的离子 Na2CO3溶液:___________________、Ca(OH)2溶液:___________________、
CaCl2溶液:_______________
混合后数目减少的离子
混合后数目不变的离子
反应实质
CaCl2===Ca2++2Cl-
CO32-、Na+
Na+、Cl-、OH-
Na2CO3===CO32-+2Na+
OH-、Ca2+
CO32-、 Ca2+
CO32-、Ca2+结合成CaCO3白色沉淀
Ca(OH)2===2OH-+Ca2+
Ca2+、Cl-
离子反应
实验中产生了白色沉淀,说明Ca2+ 和CO32- 发生反应,生成了CaCO3沉淀。这种离子间的反应,叫做离子反应。
定义:
电解质在溶液中的反应实质上是_____之间的反应,这样的反应属于离子反应。
离子
离子符号
Ba2++SO42-===BaSO4↓
离子方程式:
用实际参加反应的_________来表示反应的式子。
如:Na2SO4溶液和BaCl2溶液反应的离子方程式可表示为______________________。
相互交换离子
实质:
①从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中_____________的反应。②离子反应使溶液中某些离子的浓度_____。
减小
指反应、生成或二者皆有
离子方程式
离子方程式
用实际参加反应的离子符合表示离子反应的式子叫做离子方程式。如盐酸与氢氧化钠反应:
H++OH-= H2O
离子方程式不仅可以表示某个具体的化学反应,还可以表示某一类型的离子反应。如硫酸与氯化钡、硫酸钠与硝酸钡的离子方程式均为:
Ba2++SO42-== BaSO4↓
定义
意义
(1)写:化学方程式(必须根据实验事实):________________________________。
离子方程式
2HCl+Na2CO3===2NaCl+H2O+CO2↑
(2)拆:把易溶于水、易电离的物质拆成离子的形式:
_______________________________________________。
离子方程式的书写步骤
以碳酸钠和盐酸在溶液中反应为例
(3)删:删去方程式两边不参加反应的离子,并将方程式化为最简:
______________________。
(4)查:检查方程式两边各元素的原子个数和电荷总数是否相等以及反应条件、沉淀符号、气体符号等。
2H++2Cl-+2Na++CO32-===2Na++2Cl-+H2O+CO2↑
2H++CO32-===H2O+CO2↑
离子方程式
写出下列反应的化学方程式和离子方程式:
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠
盐酸与氢氧化钾
硫酸与氢氧化钠
HCl+NaOH===NaCl+H2O
H++OH-===H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
H2SO4+2NaOH===Na2SO4+2H2O
H++OH-===H2O
离子方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应
离子方程式
思考交流:电解质溶液之间发生反应时有哪些不同情况?并完成下表内容。
举例 向硫酸铜溶液中滴加氢氧化钠溶液 向氢氧化钠溶液(含酚酞)中滴加酚酞 向碳酸钠溶液中滴加稀盐酸
现象
离子反应
分析
有蓝色沉淀生成
红色褪去
有无色无味气体产生
Cu2++ 2OH-= Cu(OH)2↓
H++OH-= H2O
2H++CO32-=H2O+CO2↑
生成沉淀使铜离子和氢氧根离子浓度减小
生成水,使氢离子和氢氧根离子浓度减小
生成气体,使氢离子和碳酸根离子浓度减小
离子方程式
离子反应发生的条件
离子共存
离子共存即溶液中的离子之间不能发生反应。判断溶液中的离子能否大量共存,事实上是看离子之间能否发生反应,若能发生反应,则不能大量共存;若不能发生反应,则能大量共存。
溶液中离子共存的判断原理
能发生复分解反应的离子不能大量共存
生成难溶物或微溶物
生成气体或挥发性物质
生成难电离的物质(弱酸、弱碱、水)
离子共存
一看要求
(1)“无色透明”溶液不存在有色离子
例如:Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫红色)
例如: H+与CO32-、HCO3-、OH-等
例如: OH-与H+、Fe3+、Fe2+、Mg2+、Cu2+等
“三看”突破溶液中离子能否大量共存问题
是“能大量共存”还是“不能大量共存”;是“一定大量共存”还是“可能大量共存”
二看条件
(2)酸性溶液不能大量存在与H+反应的离子
(3)碱性溶液不能大量存在与OH-反应的离子
离子共存
“三看”突破溶液中离子能否大量共存问题
例如: H+与CO32- 、HCO3-等不能大量共存
三看反应
(1)能否生成难溶物或微溶物
例如:Mg2+与OH-,Ca2+与CO32-、SO42-都不能大量共存
(2)能否生成水
例如:在酸性溶液中OH-不能大量共存,在碱性溶液中H+不能大量共存
(3)能否生成挥发性物质
离子的检验与推断
依据
离子推断要坚持“四项基本原则”
离子反应所表现出的某“唯一性”的特征性质及现象。
(1)肯定性原则:
据现象推断存在或肯定不存在的离子。
(2)互斥性原则:
如溶液中含有Ba2+,则不存在大量的CO32-、SO42-。
(3)进出性原则:
要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则) :
阳离子和阴离子同时存在于溶液中且正负电荷总量相等。
离子的检验与推断
离子 试剂 现象 注意
沉淀法 Cl- AgNO3溶液和稀HNO3 AgCl(白色)
SO42- 稀盐酸和BaCl2溶液 白色沉淀 先用稀盐酸酸化
Fe3+ NaOH溶液 红褐色沉淀
根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体。
气体法 NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝 要加热
CO32- 稀盐酸和石灰水 石灰水变浑浊 SO32-、HCO3-有干扰
随堂训练
1.下列反应属于离子反应的是( )
A.H2O和CO2气体的反应
B.NH3溶于水的反应
C.硝酸与Ca(OH)2溶液的反应
D.H2在O2中燃烧
C
随堂训练
2.(双选)下列符合离子方程式Ba2++SO42-==BaSO4↓的化学反应是(均指溶液间)( )
A. H2SO4和Ba(OH)2混合 B.H2SO4与BaCl2混合 C.Ba(OH)2与Na2SO4混合 D.Ba(OH)2与NaHSO4混合
BC
随堂训练
3.下列反应的离子方程式书写正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B.稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+===BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
D
随堂训练
4.海盐经溶解、过滤后仍含有Ca2+、Mg2+、SO42-等可溶性杂质,为了得到纯净的NaCl,可向滤液中依次加入过量的下列溶液,其中不合理的是( )
A.BaCl2→NaOH→Na2CO3→过滤→稀盐酸→蒸发结晶
B.Ba(OH)2→Na2CO3→过滤→稀盐酸→蒸发结晶
C.Na2CO3→NaOH→BaCl2→过滤→稀盐酸→蒸发结晶
D.BaCl2→Na2CO3→NaOH→过滤→稀盐酸→蒸发结晶
C
随堂训练
5.下列离子方程式中,只能表示一个化学反应的是( )
①CO32-+2H+===CO2↑+H2O
②Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
③Ag++Cl-===AgCl↓
④Fe+Cu2+===Fe2++Cu
⑤Cl2+H2O===H++Cl-+HClO
A.①③ B.②④ C.②⑤ D.只有⑤
D
谢谢观看
专题3 从海水中获得的化学物质
第二单元 金属钠及钠的化合物
第三课时 离子反应
课前导入
三国时,诸葛亮为了擒拿南王孟获,率军南征至云南西洱河,遇四口毒泉,其中一口为哑泉。时逢天气好生炎热,人马饮用了哑泉水后,全都中毒,将士们都说不出话来。后来幸得一智者指点,复饮安乐泉水,随即吐出恶涎,便能言语。
课前导入
经研究发现,哑泉水是一种含铜盐的泉水,即硫酸铜(胆矾)的水溶液,称为胆水。这里的安乐泉为碱性水,即氢氧化钙的水溶液。二者相互混合后能使铜盐生成不溶于水的沉淀物。从而达到了解毒的效果。
涉及的离子反应方程式为:
上述反应为离子反应,那么,这种类型的反应发生时需要满足什么条件呢?
Cu2+ + 2OH- = Cu(OH)2↓
强电解质与弱电解质
电解质溶液具有导电性,物质的量浓度相同的不同电解质溶液,其导电能力是否相同呢?
【实验探究】在4只100ml的小烧杯中分别加入50ml物质的量浓度均为0.1ml·L-1的盐酸、醋酸溶液、氢氧化钠溶液和氨水,分别按图所示装置进行实验,接通电源,观察实验现象并分析原因。
强电解质与弱电解质
强电解质与弱电解质
样品 盐酸 醋酸 氢氧化钠 氨水
现象
结论 【实验现象及结论】
当物质的浓度相等时,醋酸溶液和氨水的导电能力明显弱于盐酸和氢氧化钠溶液的导电能力。
灯泡很亮,有电流产生
灯泡不太亮,有微弱电流产生
灯泡不太亮,有微弱电流产生
灯泡很亮,有电流产生
强电解质与弱电解质
上述实验产生的现象是因为HCl、NaOH在水溶液中能完全电离,而CH3COOH、NH3·H2O在水溶液中只发生部分电离。当电解质不完全电离时,书写电离方程式要用“ ”代替“==”。
强酸(如H2SO4、HCl、HNO3等)、强碱(如NaOH、KOH等)和绝大多数盐在水溶液中能完全电离,这样的电解质称为强电解质。弱酸(H2CO3、CH3COOH、HClO等)、弱碱(如NH3·H2O等)在水溶液中不能完全电离,这样的电解质称为弱电解质。
离子反应
Na2CO3、Ca(OH)2和CaCl2的电离方程式 ______________________________、________________________________
、_____________________________________
混合前三种溶液中的离子 Na2CO3溶液:___________________、Ca(OH)2溶液:___________________、
CaCl2溶液:_______________
混合后数目减少的离子
混合后数目不变的离子
反应实质
CaCl2===Ca2++2Cl-
CO32-、Na+
Na+、Cl-、OH-
Na2CO3===CO32-+2Na+
OH-、Ca2+
CO32-、 Ca2+
CO32-、Ca2+结合成CaCO3白色沉淀
Ca(OH)2===2OH-+Ca2+
Ca2+、Cl-
离子反应
实验中产生了白色沉淀,说明Ca2+ 和CO32- 发生反应,生成了CaCO3沉淀。这种离子间的反应,叫做离子反应。
定义:
电解质在溶液中的反应实质上是_____之间的反应,这样的反应属于离子反应。
离子
离子符号
Ba2++SO42-===BaSO4↓
离子方程式:
用实际参加反应的_________来表示反应的式子。
如:Na2SO4溶液和BaCl2溶液反应的离子方程式可表示为______________________。
相互交换离子
实质:
①从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中_____________的反应。②离子反应使溶液中某些离子的浓度_____。
减小
指反应、生成或二者皆有
离子方程式
离子方程式
用实际参加反应的离子符合表示离子反应的式子叫做离子方程式。如盐酸与氢氧化钠反应:
H++OH-= H2O
离子方程式不仅可以表示某个具体的化学反应,还可以表示某一类型的离子反应。如硫酸与氯化钡、硫酸钠与硝酸钡的离子方程式均为:
Ba2++SO42-== BaSO4↓
定义
意义
(1)写:化学方程式(必须根据实验事实):________________________________。
离子方程式
2HCl+Na2CO3===2NaCl+H2O+CO2↑
(2)拆:把易溶于水、易电离的物质拆成离子的形式:
_______________________________________________。
离子方程式的书写步骤
以碳酸钠和盐酸在溶液中反应为例
(3)删:删去方程式两边不参加反应的离子,并将方程式化为最简:
______________________。
(4)查:检查方程式两边各元素的原子个数和电荷总数是否相等以及反应条件、沉淀符号、气体符号等。
2H++2Cl-+2Na++CO32-===2Na++2Cl-+H2O+CO2↑
2H++CO32-===H2O+CO2↑
离子方程式
写出下列反应的化学方程式和离子方程式:
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠
盐酸与氢氧化钾
硫酸与氢氧化钠
HCl+NaOH===NaCl+H2O
H++OH-===H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
H2SO4+2NaOH===Na2SO4+2H2O
H++OH-===H2O
离子方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应
离子方程式
思考交流:电解质溶液之间发生反应时有哪些不同情况?并完成下表内容。
举例 向硫酸铜溶液中滴加氢氧化钠溶液 向氢氧化钠溶液(含酚酞)中滴加酚酞 向碳酸钠溶液中滴加稀盐酸
现象
离子反应
分析
有蓝色沉淀生成
红色褪去
有无色无味气体产生
Cu2++ 2OH-= Cu(OH)2↓
H++OH-= H2O
2H++CO32-=H2O+CO2↑
生成沉淀使铜离子和氢氧根离子浓度减小
生成水,使氢离子和氢氧根离子浓度减小
生成气体,使氢离子和碳酸根离子浓度减小
离子方程式
离子反应发生的条件
离子共存
离子共存即溶液中的离子之间不能发生反应。判断溶液中的离子能否大量共存,事实上是看离子之间能否发生反应,若能发生反应,则不能大量共存;若不能发生反应,则能大量共存。
溶液中离子共存的判断原理
能发生复分解反应的离子不能大量共存
生成难溶物或微溶物
生成气体或挥发性物质
生成难电离的物质(弱酸、弱碱、水)
离子共存
一看要求
(1)“无色透明”溶液不存在有色离子
例如:Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫红色)
例如: H+与CO32-、HCO3-、OH-等
例如: OH-与H+、Fe3+、Fe2+、Mg2+、Cu2+等
“三看”突破溶液中离子能否大量共存问题
是“能大量共存”还是“不能大量共存”;是“一定大量共存”还是“可能大量共存”
二看条件
(2)酸性溶液不能大量存在与H+反应的离子
(3)碱性溶液不能大量存在与OH-反应的离子
离子共存
“三看”突破溶液中离子能否大量共存问题
例如: H+与CO32- 、HCO3-等不能大量共存
三看反应
(1)能否生成难溶物或微溶物
例如:Mg2+与OH-,Ca2+与CO32-、SO42-都不能大量共存
(2)能否生成水
例如:在酸性溶液中OH-不能大量共存,在碱性溶液中H+不能大量共存
(3)能否生成挥发性物质
离子的检验与推断
依据
离子推断要坚持“四项基本原则”
离子反应所表现出的某“唯一性”的特征性质及现象。
(1)肯定性原则:
据现象推断存在或肯定不存在的离子。
(2)互斥性原则:
如溶液中含有Ba2+,则不存在大量的CO32-、SO42-。
(3)进出性原则:
要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则) :
阳离子和阴离子同时存在于溶液中且正负电荷总量相等。
离子的检验与推断
离子 试剂 现象 注意
沉淀法 Cl- AgNO3溶液和稀HNO3 AgCl(白色)
SO42- 稀盐酸和BaCl2溶液 白色沉淀 先用稀盐酸酸化
Fe3+ NaOH溶液 红褐色沉淀
根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体。
气体法 NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝 要加热
CO32- 稀盐酸和石灰水 石灰水变浑浊 SO32-、HCO3-有干扰
随堂训练
1.下列反应属于离子反应的是( )
A.H2O和CO2气体的反应
B.NH3溶于水的反应
C.硝酸与Ca(OH)2溶液的反应
D.H2在O2中燃烧
C
随堂训练
2.(双选)下列符合离子方程式Ba2++SO42-==BaSO4↓的化学反应是(均指溶液间)( )
A. H2SO4和Ba(OH)2混合 B.H2SO4与BaCl2混合 C.Ba(OH)2与Na2SO4混合 D.Ba(OH)2与NaHSO4混合
BC
随堂训练
3.下列反应的离子方程式书写正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B.稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+===BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
D
随堂训练
4.海盐经溶解、过滤后仍含有Ca2+、Mg2+、SO42-等可溶性杂质,为了得到纯净的NaCl,可向滤液中依次加入过量的下列溶液,其中不合理的是( )
A.BaCl2→NaOH→Na2CO3→过滤→稀盐酸→蒸发结晶
B.Ba(OH)2→Na2CO3→过滤→稀盐酸→蒸发结晶
C.Na2CO3→NaOH→BaCl2→过滤→稀盐酸→蒸发结晶
D.BaCl2→Na2CO3→NaOH→过滤→稀盐酸→蒸发结晶
C
随堂训练
5.下列离子方程式中,只能表示一个化学反应的是( )
①CO32-+2H+===CO2↑+H2O
②Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
③Ag++Cl-===AgCl↓
④Fe+Cu2+===Fe2++Cu
⑤Cl2+H2O===H++Cl-+HClO
A.①③ B.②④ C.②⑤ D.只有⑤
D
谢谢观看
