4.2. 硫及其化合物的相互转化 课件(共24张PPT)—高中化学苏教版(2019)必修一
文档属性
| 名称 | 4.2. 硫及其化合物的相互转化 课件(共24张PPT)—高中化学苏教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-14 15:42:58 | ||
图片预览








文档简介
(共23张PPT)
专题4 硫与环境保护
第二单元 硫及其化合物的相互转化
新课导入
2022年1月14日,汤加洪阿哈阿帕伊岛北部的海底火山发生剧烈喷发,其火山灰柱直径约5千米、高2万米。火山所喷出的硫化物,主要转变为硫酸盐气溶胶遍布于大气中,同时阻挡来自太阳的热量辐射,导致全球降温,农作物大幅度减产,饥荒、疫情等夺走无数人的性命。
怎样检测是否有硫酸盐存在呢?怎样才能减缓硫化物的危害呢?
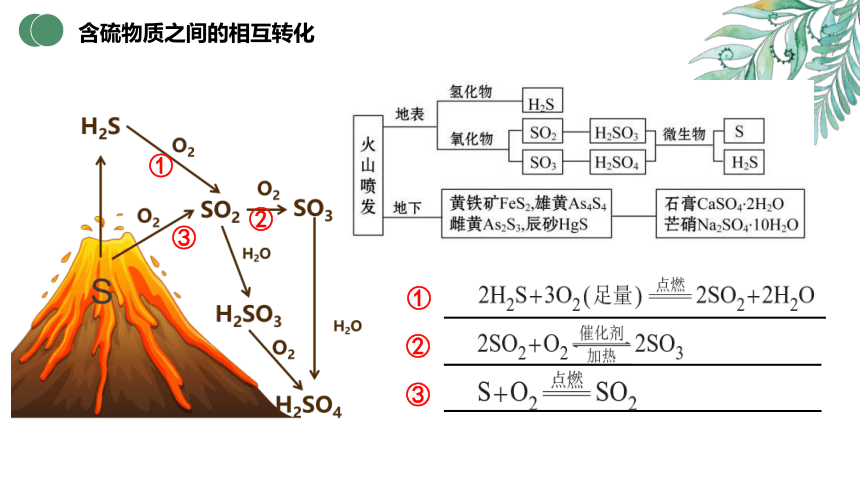
含硫物质之间的相互转化
小杨老师 15521324728
①
②
③
①
②
③
含硫物质之间的相互转化
写出下列含硫物质发生转化的化学方程式,如果是在水溶液中进行的反应,请写出离子方程式。
(1)在一定条件下,硫单质能与许多金属单质化合。汞与硫黄在常温下化合生成硫化汞(HgS),因此,实验室常将硫黄撒在汞的表面,以除去不慎洒落的汞。
S + Hg === HgS
含硫物质之间的相互转化
(2)工业上或实验室用亚硫酸钠与浓硫酸反应制备二氧化硫。
(3) 长期暴露在空气中的亚硫酸钠会被空气中的氧气氧化成硫酸钠。
(4)实验室常用过量的氢氧化钠溶液吸收二氧化硫尾气。
Na2SO3+H2SO4(较浓) === Na2SO4+ SO2↑ + H2O
2Na2SO3 + O2=== 2Na2SO4
2NaOH + SO2 === Na2SO3 + H2O
含硫物质之间的相互转化
不同价态含硫物质的转化
含硫物质之间的相互转化
1.不同价态含硫物质的转化必须要加入氧化剂或者还原剂吗?
不一定需要。如S可以和NaOH溶液反应,歧化为Na2S和Na2SO3。
2.转化前后的价态有什么规律?
当硫元素的化合价升高或降低时,一般升高或降低到相邻的价态。
2.相邻价态含硫物质可以反应吗?可以发生氧化还原反应吗?
相邻价态的含硫物质可以反应,如Na2SO3和H2SO4,但相邻价态含硫物质不可以发生氧化还原反应。
氧化还原反应方程式的配平
氧化还原反应中都有哪些守恒?如何配平陌生的氧化还原反应方程式?
1.得失电子守恒,氧化剂得电子总数等于还原剂失电子总数等于转移电子总数。(本质)
2.化合价升降守恒,化合价降低总数和化合价升高总数相等。(特征)
3.质量守恒,反应前后原子的种类和数目不变。
4.电荷守恒,对于离子反应,方程式两端阴、阳离子所带电荷总数相等
氧化还原反应方程式的配平
一、氧化还原反应方程式的配平依据:得失电子数相等。
二、氧化还原反应的配平步骤:(以C与浓硫酸反应为例)
0
+6
+4
+4
(1)标变价:写出反应物、生成物的化学式,并标明化合价发生变化的元素化合价。
C+H2SO4(浓)——CO2+SO2+H2O
氧化还原反应方程式的配平
(2)列变化:标出电子转移方向和数目。
(3)求总数:得失电子数目相等。
氧化还原反应方程式的配平
(4)配平系数:根据质量守恒配平其他物质的计量数,添加气体、沉淀符号,注明条件,将单线改为双线。
(5)查守恒:检查质量、电荷、得失电子是否守恒。
氧化还原反应方程式的配平
题型一 正向配平法
(1) KMnO4+ FeSO4+ H2SO4 K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
(2) Na2SO3+ KIO3+ H2SO4 Na2SO4+ K2SO4+ I2+ H2O
方法技巧:全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
氧化还原反应方程式的配平
题型二 逆向配平法
(1) S+ KOH K2S+ K2SO3+ H2O
(2) Fe+ HNO3(浓) Fe(NO3)3+ NO2↑+ H2O
方法技巧:自变从右边配:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
氧化还原反应方程式的配平
题型三 氧化还原型离子方程式的配平
(1) Fe3++ SO2+ H2O Fe2++ SO42- + H+
(2) C2O42-+ MnO4-+ H+ CO2↑+ Mn2++ H2O
方法技巧:首先根据得失电子守恒配平氧化剂、还原剂、氧化产物、还原产物的化学计量数,在此基础上根据电荷守恒,配平两边离子所带电荷数,最后根据质量守恒配平其余物质的化学计量数。
氧化还原反应方程式的配平
题型四 缺项配平类
(1) MnO4-+ H2O2+ Mn2++ O2↑+ H2O
(2) ClO-+ Fe(OH)3+ Cl-+ FeO42-+ H2O
缺项配平类[一般缺的为酸(H+)、碱(OH-)、水]
(1)先将得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般
加H+,生成物一边加水;若反应物这边缺负电荷,一般加OH-,生成物一边加
水,然后进行两边电荷数配平。
(2)当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
氧化还原反应方程式的配平
题型五 “零价”配平法
(1) FeS2+ O2 = Fe2O3+ SO2
(2) Fe3C+ HNO3 = Fe(NO3)3+ NO2 + CO2 + H2O
方法技巧:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降值相等,最后用观察法配平其他物质的化学计量数。
氧化还原反应方程式的配平
题型六 信息型氧化还原反应方程式的书写及配平
(1)某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,写出并配平该化学方式。
(2)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,写出该反应的离子方程式为 。
K2Cr2O7+14HCl 3Cl2↑+2KCl+2CrCl3+7H2O
Cr2 +3HS +5H+ = 2Cr3++3S +4H2O
氧化还原反应方程式的配平
题型六 信息型氧化还原反应方程式的书写及配平
信息型氧化还原反应方程式的书写步骤
(1)一判:据题给信息,联想所学知识,判断主要的反应物、生成物。若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
(2)二平:据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
(3)三补:根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
书写陌生情景氧化还原反应方程式的方法模型
根据信息,结合氧化还原反应认识模型,书写氧化还原反应中的四要素。
化合价升降守恒配平
电荷守恒配平(酸性用H+,碱性用OH-)
元素守恒配平
随堂训练
1.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
D
随堂训练
2.硫元素的价类二维图如图所示。下列说法错误的是
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的pH减小
C.盐g与盐f之间也可能发生反应
D.铜与e的浓溶液共热产生的气体通入BaCl2溶液中,无明显现象
D
随堂训练
3.如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
D
随堂训练
4.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可个表述为:
KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+ ( )
(1)请完成该化学方程式并配平(未知物化学式填入括号内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1NACl2,则转移的电子的物质的量为_________mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
H2O
2
2
4
1
2
2
②
0.2
2.63
谢谢观看
专题4 硫与环境保护
第二单元 硫及其化合物的相互转化
新课导入
2022年1月14日,汤加洪阿哈阿帕伊岛北部的海底火山发生剧烈喷发,其火山灰柱直径约5千米、高2万米。火山所喷出的硫化物,主要转变为硫酸盐气溶胶遍布于大气中,同时阻挡来自太阳的热量辐射,导致全球降温,农作物大幅度减产,饥荒、疫情等夺走无数人的性命。
怎样检测是否有硫酸盐存在呢?怎样才能减缓硫化物的危害呢?
含硫物质之间的相互转化
小杨老师 15521324728
①
②
③
①
②
③
含硫物质之间的相互转化
写出下列含硫物质发生转化的化学方程式,如果是在水溶液中进行的反应,请写出离子方程式。
(1)在一定条件下,硫单质能与许多金属单质化合。汞与硫黄在常温下化合生成硫化汞(HgS),因此,实验室常将硫黄撒在汞的表面,以除去不慎洒落的汞。
S + Hg === HgS
含硫物质之间的相互转化
(2)工业上或实验室用亚硫酸钠与浓硫酸反应制备二氧化硫。
(3) 长期暴露在空气中的亚硫酸钠会被空气中的氧气氧化成硫酸钠。
(4)实验室常用过量的氢氧化钠溶液吸收二氧化硫尾气。
Na2SO3+H2SO4(较浓) === Na2SO4+ SO2↑ + H2O
2Na2SO3 + O2=== 2Na2SO4
2NaOH + SO2 === Na2SO3 + H2O
含硫物质之间的相互转化
不同价态含硫物质的转化
含硫物质之间的相互转化
1.不同价态含硫物质的转化必须要加入氧化剂或者还原剂吗?
不一定需要。如S可以和NaOH溶液反应,歧化为Na2S和Na2SO3。
2.转化前后的价态有什么规律?
当硫元素的化合价升高或降低时,一般升高或降低到相邻的价态。
2.相邻价态含硫物质可以反应吗?可以发生氧化还原反应吗?
相邻价态的含硫物质可以反应,如Na2SO3和H2SO4,但相邻价态含硫物质不可以发生氧化还原反应。
氧化还原反应方程式的配平
氧化还原反应中都有哪些守恒?如何配平陌生的氧化还原反应方程式?
1.得失电子守恒,氧化剂得电子总数等于还原剂失电子总数等于转移电子总数。(本质)
2.化合价升降守恒,化合价降低总数和化合价升高总数相等。(特征)
3.质量守恒,反应前后原子的种类和数目不变。
4.电荷守恒,对于离子反应,方程式两端阴、阳离子所带电荷总数相等
氧化还原反应方程式的配平
一、氧化还原反应方程式的配平依据:得失电子数相等。
二、氧化还原反应的配平步骤:(以C与浓硫酸反应为例)
0
+6
+4
+4
(1)标变价:写出反应物、生成物的化学式,并标明化合价发生变化的元素化合价。
C+H2SO4(浓)——CO2+SO2+H2O
氧化还原反应方程式的配平
(2)列变化:标出电子转移方向和数目。
(3)求总数:得失电子数目相等。
氧化还原反应方程式的配平
(4)配平系数:根据质量守恒配平其他物质的计量数,添加气体、沉淀符号,注明条件,将单线改为双线。
(5)查守恒:检查质量、电荷、得失电子是否守恒。
氧化还原反应方程式的配平
题型一 正向配平法
(1) KMnO4+ FeSO4+ H2SO4 K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
(2) Na2SO3+ KIO3+ H2SO4 Na2SO4+ K2SO4+ I2+ H2O
方法技巧:全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
氧化还原反应方程式的配平
题型二 逆向配平法
(1) S+ KOH K2S+ K2SO3+ H2O
(2) Fe+ HNO3(浓) Fe(NO3)3+ NO2↑+ H2O
方法技巧:自变从右边配:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
氧化还原反应方程式的配平
题型三 氧化还原型离子方程式的配平
(1) Fe3++ SO2+ H2O Fe2++ SO42- + H+
(2) C2O42-+ MnO4-+ H+ CO2↑+ Mn2++ H2O
方法技巧:首先根据得失电子守恒配平氧化剂、还原剂、氧化产物、还原产物的化学计量数,在此基础上根据电荷守恒,配平两边离子所带电荷数,最后根据质量守恒配平其余物质的化学计量数。
氧化还原反应方程式的配平
题型四 缺项配平类
(1) MnO4-+ H2O2+ Mn2++ O2↑+ H2O
(2) ClO-+ Fe(OH)3+ Cl-+ FeO42-+ H2O
缺项配平类[一般缺的为酸(H+)、碱(OH-)、水]
(1)先将得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般
加H+,生成物一边加水;若反应物这边缺负电荷,一般加OH-,生成物一边加
水,然后进行两边电荷数配平。
(2)当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
氧化还原反应方程式的配平
题型五 “零价”配平法
(1) FeS2+ O2 = Fe2O3+ SO2
(2) Fe3C+ HNO3 = Fe(NO3)3+ NO2 + CO2 + H2O
方法技巧:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降值相等,最后用观察法配平其他物质的化学计量数。
氧化还原反应方程式的配平
题型六 信息型氧化还原反应方程式的书写及配平
(1)某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,写出并配平该化学方式。
(2)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,写出该反应的离子方程式为 。
K2Cr2O7+14HCl 3Cl2↑+2KCl+2CrCl3+7H2O
Cr2 +3HS +5H+ = 2Cr3++3S +4H2O
氧化还原反应方程式的配平
题型六 信息型氧化还原反应方程式的书写及配平
信息型氧化还原反应方程式的书写步骤
(1)一判:据题给信息,联想所学知识,判断主要的反应物、生成物。若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
(2)二平:据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
(3)三补:根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
书写陌生情景氧化还原反应方程式的方法模型
根据信息,结合氧化还原反应认识模型,书写氧化还原反应中的四要素。
化合价升降守恒配平
电荷守恒配平(酸性用H+,碱性用OH-)
元素守恒配平
随堂训练
1.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
D
随堂训练
2.硫元素的价类二维图如图所示。下列说法错误的是
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的pH减小
C.盐g与盐f之间也可能发生反应
D.铜与e的浓溶液共热产生的气体通入BaCl2溶液中,无明显现象
D
随堂训练
3.如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
D
随堂训练
4.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可个表述为:
KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+ ( )
(1)请完成该化学方程式并配平(未知物化学式填入括号内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1NACl2,则转移的电子的物质的量为_________mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
H2O
2
2
4
1
2
2
②
0.2
2.63
谢谢观看
