5.1.1元素周期律和元素周期表 课件(共34页)—高中化学苏教版(2019)必修第一册
文档属性
| 名称 | 5.1.1元素周期律和元素周期表 课件(共34页)—高中化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-14 15:54:00 | ||
图片预览






文档简介
(共32张PPT)
专题5 微观结构与物质的多样性
第一单元元素周期律和元素周期表
5.1.1元素周期律
课前导入
同学们,在化学的历史长河中,有一位伟大的科学家门捷列夫。据说,他在研究元素的过程中遇到了巨大的困难,很多规律都难以捉摸。有一天晚上,他疲惫地入睡了,在梦中他看到了一张神奇的表格,所有的元素都整齐有序地排列在上面,它们的性质随着排列呈现出一种奇妙的规律。当他醒来后,立刻将梦中的表格记录下来,经过不断地完善,就有了我们现在非常重要的元素周期表。今天,就让我们一起走进元素周期律的奇妙世界,去探索元素之间隐藏的秘密。
原子序数
随着人们对原子内部结构的深入认识,化学家尝试将元素的宏观性质与原子的微观结构之间建立联系,研究元素的性质与核电荷数之间的关系。为了方便研究,化学家按照核电荷数由小到大的顺序给元素依次编号,这种编号叫作原子序数(atomic number)。元素的原子序数在数值上等于该元素原子的核电荷数。
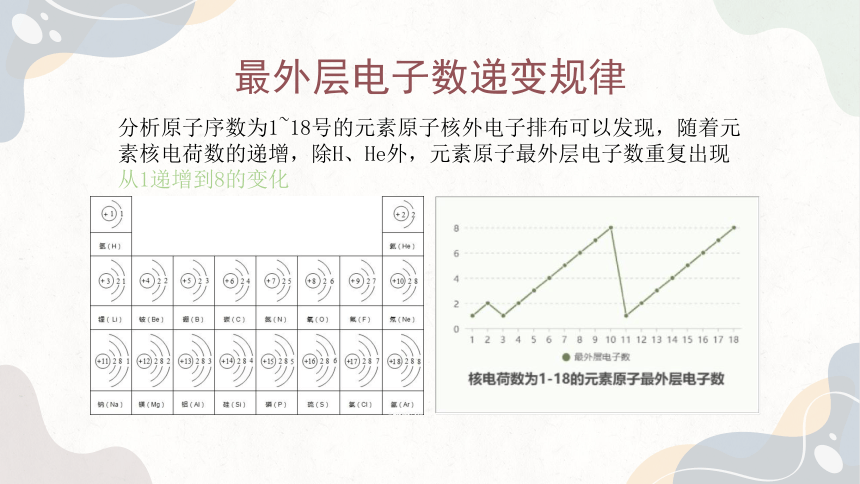
最外层电子数递变规律
分析原子序数为1~18号的元素原子核外电子排布可以发现,随着元素核电荷数的递增,除H、He外,元素原子最外层电子数重复出现从1递增到8的变化
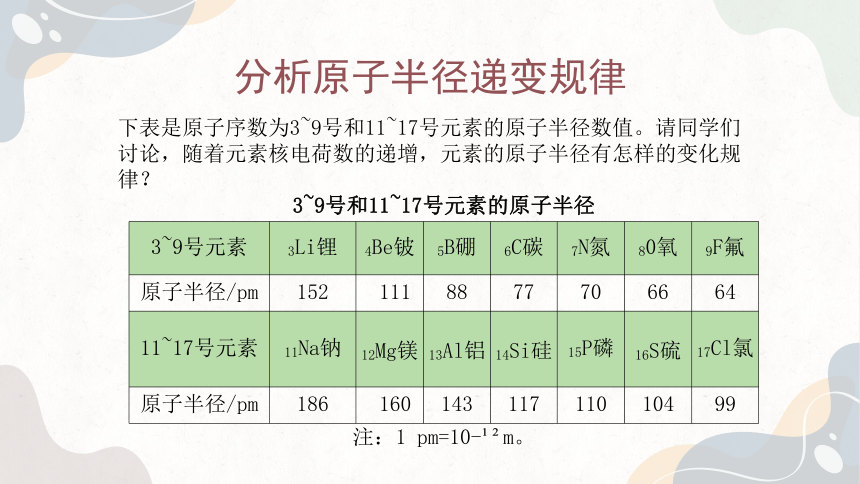
分析原子半径递变规律
下表是原子序数为3~9号和11~17号元素的原子半径数值。请同学们讨论,随着元素核电荷数的递增,元素的原子半径有怎样的变化规律?
3~9号和11~17号元素的原子半径 3~9号元素 3Li锂 4Be铍 5B硼 6C碳 7N氮 80氧 9F氟
原子半径/pm 152 111 88 77 70 66 64
11~17号元素 11Na钠
12Mg镁
13Al铝
14Si硅 15P磷
16S硫 17Cl氯
原子半径/pm 186 160 143 117 110 104 99
注:1 pm=10- m。 分析原子半径递变规律
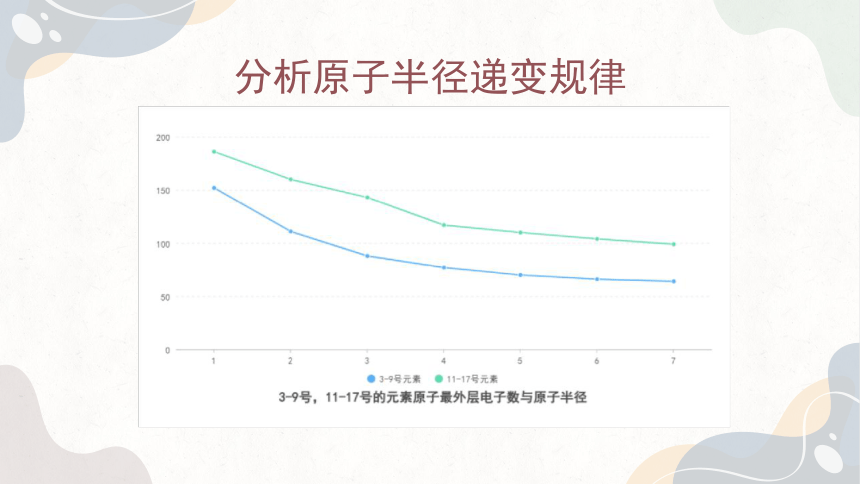
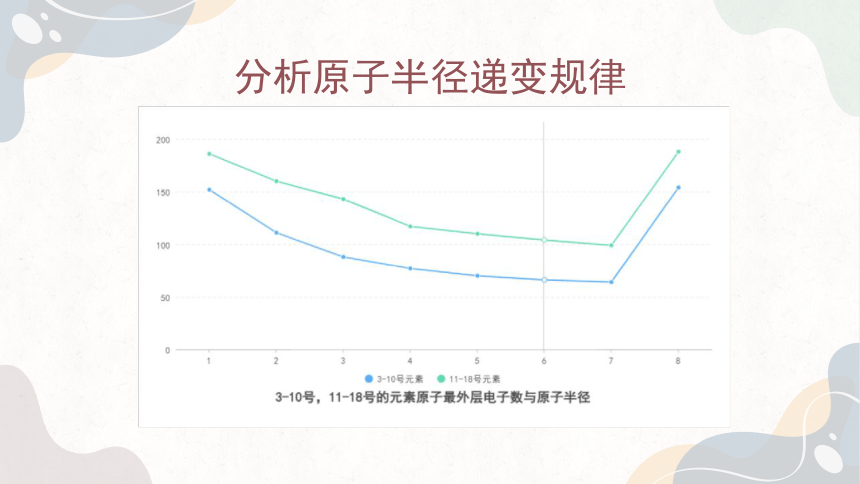
1. 以元素原子核外最外层电子数为横坐标,原子半径为纵坐标,在下面的坐标系中表示出3~9号元素、11~17号元素原子的最外层电子数和原子半径所对应的点,并把这两组点分别用光滑的曲线连接起来。
分析原子半径递变规律
分析原子半径递变规律
分析原子半径递变规律
通过上述分析我们可以发现,随着核电荷数的递增,元素的原子半径呈现周期性变化,原子序数为3~9号和11~17号元素的原子半径分别依次递减。
由此可知,在元素周期表内,从上到下原子半径依次递增从左到右原子半径依次递减(稀有气体除外)
分析原子半径递变规律
【思考】3-9号元素和11-17号元素的原子半径为什么会逐渐减小?
在同一周期中,从左到右原子序数递增,核电荷数也随之增加。核电荷数增多,原子核带的正电荷增多,对核外电子的吸引力就增强。电子被更紧密地吸引在原子核周围,使得电子云向原子核收缩,从而导致原子半径减小。
同一周期的元素电子层数是相同的。电子层数没有增加这一因素来增大原子半径,而只有核电荷数增加使原子核对电子吸引增强这一因素起主导作用,所以原子半径从左到右逐渐减小。
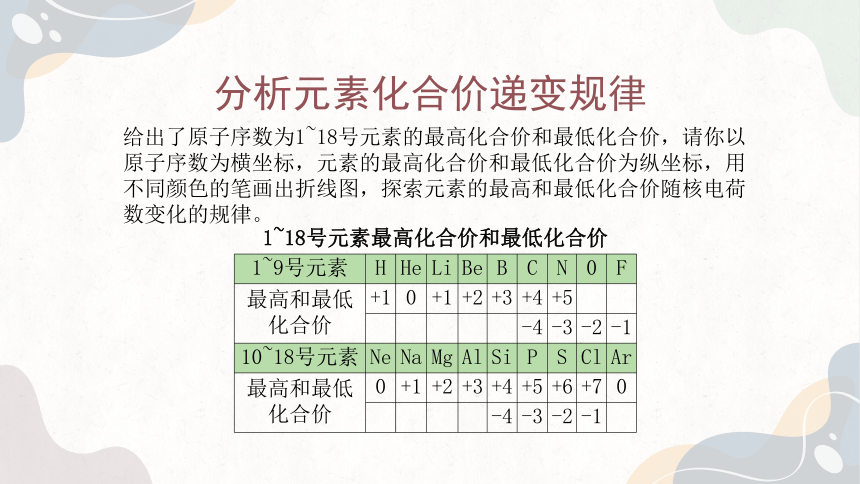
分析元素化合价递变规律
给出了原子序数为1~18号元素的最高化合价和最低化合价,请你以原子序数为横坐标,元素的最高化合价和最低化合价为纵坐标,用不同颜色的笔画出折线图,探索元素的最高和最低化合价随核电荷数变化的规律。
1~18号元素最高化合价和最低化合价 1~9号元素 H He Li Be B C N 0 F
最高和最低
化合价 +1 0 +1 +2 +3 +4 +5
-4 -3 -2 -1
10~18号元素 Ne Na Mg Al Si P S Cl Ar
最高和最低
化合价 0 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -1
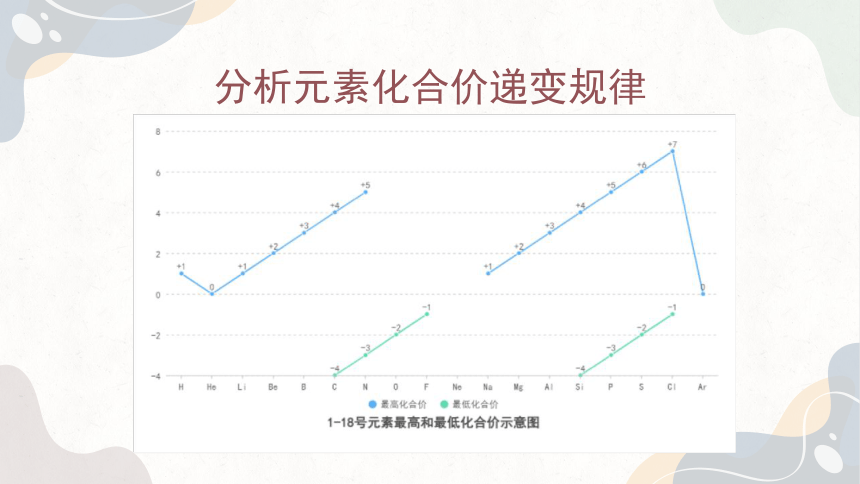
分析元素化合价递变规律
分析元素化合价递变规律
同一周期:
最高正化合价:从左至右,最高正化合价呈递增趋势(从 + 1 价递增到 +7 价,第一周期除外),但第二周期的 O、F 元素比较特殊,O 无最高正价,F 无正价(OF 等特殊物质除外)。这是因为同一周期从左到右原子序数递增,核电荷数增多,原子核对最外层电子的吸引力增强,使电子更倾向于失去,从而导致正化合价升高。
最低负化合价:从左至右,最低负化合价也呈递增趋势(从 -4 价递增到 -1 价,第一周期除外)。金属元素一般无负化合价,所以负化合价的递变是从 ⅣA 族开始的。这是由于随着原子序数增加,原子得电子能力逐渐增强,更容易获得电子形成负化合价,且负化合价的数值逐渐增大。
分析元素化合价递变规律
同一主族:
最高正化合价:从上至下,最高正化合价基本相同,均等于该元素所在的族序数(O、F 除外)。这是因为主族元素的最外层电子数相同,其失去电子形成最高正化合价的能力相似。
特殊情况:对于某些元素,在不同化合物中可能呈现多种化合价,例如氮元素,有 -3、+2、+3、+4、+5 等多种化合价;铁元素有 +2、+3 等化合价。
分析元素化合价递变规律
元素的最高化合价和最低化合价的数值与原子最外层电子数有哪些关系?
元素最高价的绝对值与最低价的绝对值的和为 8(仅限除 O、F 的非金属元素)。即对于除 O、F 外的非金属元素,其最高正化合价与最低负化合价之间存在这样的数量关系
判断元素的金属性与非金属性强弱
人们在长期的研究中发现,元素单质和化合物的某些性
质有助于判断元素的金属性、非金属性强弱。通常情况下,元
素原子失电子能力越强,元素的金属性越强,它的单质越容易
从水或酸中置换出氢,该元素最高价氧化物的水化物的碱性越
强;元素原子得电子能力越强,元素的非金属性越强,它的单
质越容易与氢气反应形成气态氢化物,气态氢化物的热稳定性
越强,该元素最高价氧化物的水化物的酸性越强。
钠、镁、铝性质的递变
进行下列实验,探究钠、镁、铝元素的金属性强弱,把实验现象记录在表中。
【实验1】切取绿豆大小的一小块金属钠,用滤纸吸干其表面的煤油。在一只250 mL烧杯中加入少量的水,在水中滴加两滴酚酞溶液,将金属钠投入烧杯中,观察并记录实验现象。
【实验2】在两支试管中,分别放入已用砂纸打磨除去氧化膜的一小段镁条和一小块铝片,向试管中加入适量的水,再向水中滴加两滴酚酞溶液,观察实验现象。然后加热试管,观察并记录实验现象。
【实验3】在两支试管中,分别放入已用砂纸打磨除去氧化膜的一小段镁条和一小块铝片,再向试管中各加入2 mL 2 mol·L-1盐酸,观察并记录实验现象。
实验 Na Mg Al
与水的反应 与冷水的反应 与冷水剧烈反应,溶液呈红色 Na+H2O=NaOH+H2↑ 与冷水反应不明显, 无明显现象
与热水的反应 —— 加热反应较剧烈,溶液呈浅红色 Mg+2H2O=Mg(OH)2+H2↑ 无明显现象
与盐酸的反应 —— 剧烈反应,产生气泡快 Mg+2HCl=MgCl2+H2↑ 产生气泡较快
2Al+6HCl=2AlCl3+3H2↑
钠、镁、铝金属性强弱的顺序是钠>镁>铝
元素金属性递变规律
从上述实验可以得出,钠、镁、铝三种金属单质与水或酸反应的剧烈程度逐渐减弱,说明钠、镁、铝元素的金属性依次减弱。这是因为当元素原子的核外电子层数相同时,随着核电荷数的递增,原子半径逐渐减小(稀有气体元素除外),原子失电子能力逐渐减弱,所以金属性逐渐减弱。
元素非金属性递变规律
阅读并分析下表,根据硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性,探究硅、磷、硫、氯元素的非金属性强弱。
硅、磷、硫、氯的气态氢化物 元素 14Si 15P 16S 17Cl
单质与氢气
的反应条件 高温下反应 磷蒸气与氢气能反应 加热时反应 光照或点燃时发生爆炸而化合
气态氢化物
的化学式 SiH PH H2S HCl
气态氢化物
的热稳定性 不稳定 不稳定 受热分解 稳定
元素非金属性递变规律
从表可以看出,按硅、磷、硫、氯元素的顺序,它们的单质与氢气反应的条件逐渐变得容易,而反应得到的气态氢化物的热稳定性逐渐增强,可见这四种元素的非金属性依次增强。这是因为当元素原子的核外电子层数相同时,随着核电荷数的递增,原子半径逐渐减小(稀有气体元素除外),原子得电子能力逐渐增强,所以非金属性逐渐增强。
最高价氧化物的水化物的酸性和碱性强弱
阅读并分析下表,根据11~17号元素最高价氧化物的水化物的酸碱性强弱,探究元素的金属性和非金属性的强弱变化规律。
11~17号元素最高价氧化物的水化物 元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl
化学式 NaOH Mg(OH)2 Al(OH)3 H4SiO4 H3PO4 H2SO4 HClO
酸碱性强弱 强碱 中强碱 弱酸 中强酸 强酸 酸性更强
最高价氧化物的水化物的酸性和碱性强弱
1.从上表分析可知,11~17号元素最高价氧化物的水化物的
酸碱性强弱的变化规律是__________________________________
;11~17号元素的金属性和非金属性强弱的变化规律是__________________________________________。
2. 根据11~17号元素最高价氧化物的水化物的酸碱性强弱的变化规律,预测Al(OH)3可能具有的性质是_________________。
碱性逐渐减弱,酸性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
既有酸性又有碱性
探究Al(OH)3的性质
在两支洁净的试管中分别加入2~3 mL 2 mol·L-1氯化铝溶液,逐滴加入6 mol·L-1氨水,生成白色胶状物质,继续滴加氨水直到不再产生沉淀为止,即制得Al(OH)3沉淀。然后向一支试管中滴加6.0 mol·L-1
盐酸,向另一支试管中滴加 6.0 mol·L-1NaOH溶液。边滴加边振荡,记录你观察到的现象:
探究Al(OH)3的性质
可以观察到两支试管中的白色沉淀均逐渐溶解。
实验表明,Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,它是两性氢氧化物。
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
元素周期律
更多的研究表明,随着元素核电荷数的递增,元素的原子半径(稀有气体元素除外)、元素的主要化合价(最高化合价和最低化价)、元素的金属性和非金属性均呈现周期性变化。
元素的性质随着元素核电荷数的递增呈周期性变化的规律叫作元素周期律(periodic law of the elements)。
元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果,揭示了元素之间的内在关系。
1.下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg
B.铁投人CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Fe>Na
C.酸性H2CO3C
D.F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl
B
课堂练习
2.下列根据事实得出的元素金属性或非金属性相对强弱的推论错误的是( )
选项 事实 推论
A 与冷水反应,Na比Mg剧烈 金属性:Na>Mg
B Ca(OH)2的碱性强于Mg(OH)2 金属性:Ca>Mg
C SO2与NaHCO3溶液反应生成CO2性 非金属:S>C
D 一定条件下,等物质的量的Br2(g)、I2(g)、H2(g)在同一容器中反应,最终生成的HBr的量多于HI的 非金属性:Br>I
C
课堂练习
感谢您的观看
专题5 微观结构与物质的多样性
第一单元元素周期律和元素周期表
5.1.1元素周期律
课前导入
同学们,在化学的历史长河中,有一位伟大的科学家门捷列夫。据说,他在研究元素的过程中遇到了巨大的困难,很多规律都难以捉摸。有一天晚上,他疲惫地入睡了,在梦中他看到了一张神奇的表格,所有的元素都整齐有序地排列在上面,它们的性质随着排列呈现出一种奇妙的规律。当他醒来后,立刻将梦中的表格记录下来,经过不断地完善,就有了我们现在非常重要的元素周期表。今天,就让我们一起走进元素周期律的奇妙世界,去探索元素之间隐藏的秘密。
原子序数
随着人们对原子内部结构的深入认识,化学家尝试将元素的宏观性质与原子的微观结构之间建立联系,研究元素的性质与核电荷数之间的关系。为了方便研究,化学家按照核电荷数由小到大的顺序给元素依次编号,这种编号叫作原子序数(atomic number)。元素的原子序数在数值上等于该元素原子的核电荷数。
最外层电子数递变规律
分析原子序数为1~18号的元素原子核外电子排布可以发现,随着元素核电荷数的递增,除H、He外,元素原子最外层电子数重复出现从1递增到8的变化
分析原子半径递变规律
下表是原子序数为3~9号和11~17号元素的原子半径数值。请同学们讨论,随着元素核电荷数的递增,元素的原子半径有怎样的变化规律?
3~9号和11~17号元素的原子半径 3~9号元素 3Li锂 4Be铍 5B硼 6C碳 7N氮 80氧 9F氟
原子半径/pm 152 111 88 77 70 66 64
11~17号元素 11Na钠
12Mg镁
13Al铝
14Si硅 15P磷
16S硫 17Cl氯
原子半径/pm 186 160 143 117 110 104 99
注:1 pm=10- m。 分析原子半径递变规律
1. 以元素原子核外最外层电子数为横坐标,原子半径为纵坐标,在下面的坐标系中表示出3~9号元素、11~17号元素原子的最外层电子数和原子半径所对应的点,并把这两组点分别用光滑的曲线连接起来。
分析原子半径递变规律
分析原子半径递变规律
分析原子半径递变规律
通过上述分析我们可以发现,随着核电荷数的递增,元素的原子半径呈现周期性变化,原子序数为3~9号和11~17号元素的原子半径分别依次递减。
由此可知,在元素周期表内,从上到下原子半径依次递增从左到右原子半径依次递减(稀有气体除外)
分析原子半径递变规律
【思考】3-9号元素和11-17号元素的原子半径为什么会逐渐减小?
在同一周期中,从左到右原子序数递增,核电荷数也随之增加。核电荷数增多,原子核带的正电荷增多,对核外电子的吸引力就增强。电子被更紧密地吸引在原子核周围,使得电子云向原子核收缩,从而导致原子半径减小。
同一周期的元素电子层数是相同的。电子层数没有增加这一因素来增大原子半径,而只有核电荷数增加使原子核对电子吸引增强这一因素起主导作用,所以原子半径从左到右逐渐减小。
分析元素化合价递变规律
给出了原子序数为1~18号元素的最高化合价和最低化合价,请你以原子序数为横坐标,元素的最高化合价和最低化合价为纵坐标,用不同颜色的笔画出折线图,探索元素的最高和最低化合价随核电荷数变化的规律。
1~18号元素最高化合价和最低化合价 1~9号元素 H He Li Be B C N 0 F
最高和最低
化合价 +1 0 +1 +2 +3 +4 +5
-4 -3 -2 -1
10~18号元素 Ne Na Mg Al Si P S Cl Ar
最高和最低
化合价 0 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -1
分析元素化合价递变规律
分析元素化合价递变规律
同一周期:
最高正化合价:从左至右,最高正化合价呈递增趋势(从 + 1 价递增到 +7 价,第一周期除外),但第二周期的 O、F 元素比较特殊,O 无最高正价,F 无正价(OF 等特殊物质除外)。这是因为同一周期从左到右原子序数递增,核电荷数增多,原子核对最外层电子的吸引力增强,使电子更倾向于失去,从而导致正化合价升高。
最低负化合价:从左至右,最低负化合价也呈递增趋势(从 -4 价递增到 -1 价,第一周期除外)。金属元素一般无负化合价,所以负化合价的递变是从 ⅣA 族开始的。这是由于随着原子序数增加,原子得电子能力逐渐增强,更容易获得电子形成负化合价,且负化合价的数值逐渐增大。
分析元素化合价递变规律
同一主族:
最高正化合价:从上至下,最高正化合价基本相同,均等于该元素所在的族序数(O、F 除外)。这是因为主族元素的最外层电子数相同,其失去电子形成最高正化合价的能力相似。
特殊情况:对于某些元素,在不同化合物中可能呈现多种化合价,例如氮元素,有 -3、+2、+3、+4、+5 等多种化合价;铁元素有 +2、+3 等化合价。
分析元素化合价递变规律
元素的最高化合价和最低化合价的数值与原子最外层电子数有哪些关系?
元素最高价的绝对值与最低价的绝对值的和为 8(仅限除 O、F 的非金属元素)。即对于除 O、F 外的非金属元素,其最高正化合价与最低负化合价之间存在这样的数量关系
判断元素的金属性与非金属性强弱
人们在长期的研究中发现,元素单质和化合物的某些性
质有助于判断元素的金属性、非金属性强弱。通常情况下,元
素原子失电子能力越强,元素的金属性越强,它的单质越容易
从水或酸中置换出氢,该元素最高价氧化物的水化物的碱性越
强;元素原子得电子能力越强,元素的非金属性越强,它的单
质越容易与氢气反应形成气态氢化物,气态氢化物的热稳定性
越强,该元素最高价氧化物的水化物的酸性越强。
钠、镁、铝性质的递变
进行下列实验,探究钠、镁、铝元素的金属性强弱,把实验现象记录在表中。
【实验1】切取绿豆大小的一小块金属钠,用滤纸吸干其表面的煤油。在一只250 mL烧杯中加入少量的水,在水中滴加两滴酚酞溶液,将金属钠投入烧杯中,观察并记录实验现象。
【实验2】在两支试管中,分别放入已用砂纸打磨除去氧化膜的一小段镁条和一小块铝片,向试管中加入适量的水,再向水中滴加两滴酚酞溶液,观察实验现象。然后加热试管,观察并记录实验现象。
【实验3】在两支试管中,分别放入已用砂纸打磨除去氧化膜的一小段镁条和一小块铝片,再向试管中各加入2 mL 2 mol·L-1盐酸,观察并记录实验现象。
实验 Na Mg Al
与水的反应 与冷水的反应 与冷水剧烈反应,溶液呈红色 Na+H2O=NaOH+H2↑ 与冷水反应不明显, 无明显现象
与热水的反应 —— 加热反应较剧烈,溶液呈浅红色 Mg+2H2O=Mg(OH)2+H2↑ 无明显现象
与盐酸的反应 —— 剧烈反应,产生气泡快 Mg+2HCl=MgCl2+H2↑ 产生气泡较快
2Al+6HCl=2AlCl3+3H2↑
钠、镁、铝金属性强弱的顺序是钠>镁>铝
元素金属性递变规律
从上述实验可以得出,钠、镁、铝三种金属单质与水或酸反应的剧烈程度逐渐减弱,说明钠、镁、铝元素的金属性依次减弱。这是因为当元素原子的核外电子层数相同时,随着核电荷数的递增,原子半径逐渐减小(稀有气体元素除外),原子失电子能力逐渐减弱,所以金属性逐渐减弱。
元素非金属性递变规律
阅读并分析下表,根据硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性,探究硅、磷、硫、氯元素的非金属性强弱。
硅、磷、硫、氯的气态氢化物 元素 14Si 15P 16S 17Cl
单质与氢气
的反应条件 高温下反应 磷蒸气与氢气能反应 加热时反应 光照或点燃时发生爆炸而化合
气态氢化物
的化学式 SiH PH H2S HCl
气态氢化物
的热稳定性 不稳定 不稳定 受热分解 稳定
元素非金属性递变规律
从表可以看出,按硅、磷、硫、氯元素的顺序,它们的单质与氢气反应的条件逐渐变得容易,而反应得到的气态氢化物的热稳定性逐渐增强,可见这四种元素的非金属性依次增强。这是因为当元素原子的核外电子层数相同时,随着核电荷数的递增,原子半径逐渐减小(稀有气体元素除外),原子得电子能力逐渐增强,所以非金属性逐渐增强。
最高价氧化物的水化物的酸性和碱性强弱
阅读并分析下表,根据11~17号元素最高价氧化物的水化物的酸碱性强弱,探究元素的金属性和非金属性的强弱变化规律。
11~17号元素最高价氧化物的水化物 元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl
化学式 NaOH Mg(OH)2 Al(OH)3 H4SiO4 H3PO4 H2SO4 HClO
酸碱性强弱 强碱 中强碱 弱酸 中强酸 强酸 酸性更强
最高价氧化物的水化物的酸性和碱性强弱
1.从上表分析可知,11~17号元素最高价氧化物的水化物的
酸碱性强弱的变化规律是__________________________________
;11~17号元素的金属性和非金属性强弱的变化规律是__________________________________________。
2. 根据11~17号元素最高价氧化物的水化物的酸碱性强弱的变化规律,预测Al(OH)3可能具有的性质是_________________。
碱性逐渐减弱,酸性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
既有酸性又有碱性
探究Al(OH)3的性质
在两支洁净的试管中分别加入2~3 mL 2 mol·L-1氯化铝溶液,逐滴加入6 mol·L-1氨水,生成白色胶状物质,继续滴加氨水直到不再产生沉淀为止,即制得Al(OH)3沉淀。然后向一支试管中滴加6.0 mol·L-1
盐酸,向另一支试管中滴加 6.0 mol·L-1NaOH溶液。边滴加边振荡,记录你观察到的现象:
探究Al(OH)3的性质
可以观察到两支试管中的白色沉淀均逐渐溶解。
实验表明,Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,它是两性氢氧化物。
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
元素周期律
更多的研究表明,随着元素核电荷数的递增,元素的原子半径(稀有气体元素除外)、元素的主要化合价(最高化合价和最低化价)、元素的金属性和非金属性均呈现周期性变化。
元素的性质随着元素核电荷数的递增呈周期性变化的规律叫作元素周期律(periodic law of the elements)。
元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果,揭示了元素之间的内在关系。
1.下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg
B.铁投人CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Fe>Na
C.酸性H2CO3
D.F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl
B
课堂练习
2.下列根据事实得出的元素金属性或非金属性相对强弱的推论错误的是( )
选项 事实 推论
A 与冷水反应,Na比Mg剧烈 金属性:Na>Mg
B Ca(OH)2的碱性强于Mg(OH)2 金属性:Ca>Mg
C SO2与NaHCO3溶液反应生成CO2性 非金属:S>C
D 一定条件下,等物质的量的Br2(g)、I2(g)、H2(g)在同一容器中反应,最终生成的HBr的量多于HI的 非金属性:Br>I
C
课堂练习
感谢您的观看
