4.1.1 二氧化硫的性质和应用 课件(共25张PPT)—高中化学苏教版(2019)必修一
文档属性
| 名称 | 4.1.1 二氧化硫的性质和应用 课件(共25张PPT)—高中化学苏教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 67.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-14 15:58:08 | ||
图片预览








文档简介
(共23张PPT)
专题4 硫与环境保护
第一单元 含硫化合物的性质
第一课时 二氧化硫的性质与应用
硫的存在与性质
硫元素是一种重要的非金属元素,广泛存于自然界中,是植物生长不可缺少的元素。硫在自然界中既有游离态(单质),又有化合态(化合物)。
游离态硫存在于火山喷口附近或地壳的岩层中。
单质硫
硫化汞
黄色或淡蓝色的固体、质脆,易研磨成粉末。难溶于水,微溶于酒精,易溶于CS2。
二氧化硫的性质
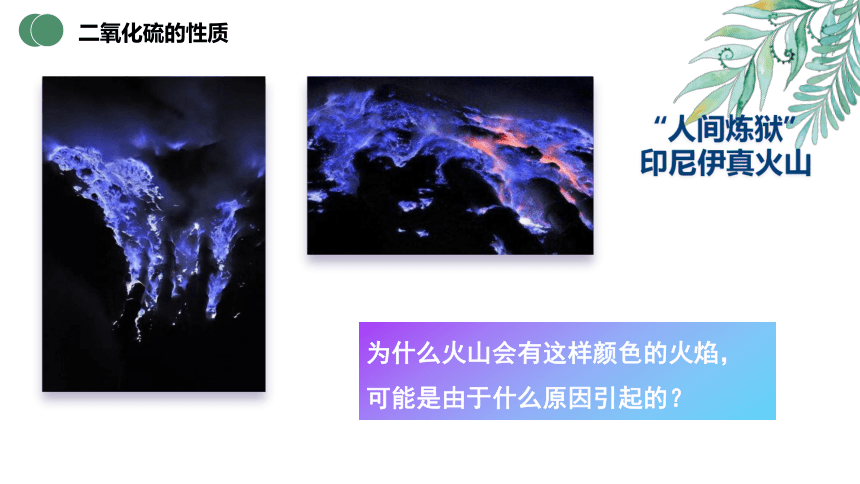
“人间炼狱”
印尼伊真火山
为什么火山会有这样颜色的火焰,可能是由于什么原因引起的?
二氧化硫的性质
硫单质在氧气中剧烈燃烧,发出明亮的蓝紫色火焰,产物是二氧化硫,化学方程式:
单质硫既有氧化性又有还原性。
点燃
S+O2 SO2
二氧化硫的性质
4000多年前,古埃及人就用硫燃烧后产生的气体来处理布匹;公元前9世纪,古希腊人和古罗马人用这种气体来消毒和漂白。
二氧化硫还具有哪些性质?在生产、生活中又扮演着怎样的角色呢?
二氧化硫的性质
颜色、状态 密度
溶解度
无色、有刺激性气味的有毒气体
比空气大
易溶于水,通常情况下,1体积的水可以溶解约40体积的二氧化硫
二氧化硫的物理性质
二氧化硫的性质
【实验探究】
如图所示,把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度。
二氧化硫溶于水
二氧化硫是一种酸性氧化物,溶于水时可与水反应生成亚硫酸(H2SO3),亚硫酸不稳定,同时又容易分解,生成二氧化硫与水。
二氧化硫的性质
现象:
pH试纸变红
结论:
SO2的水溶液显酸性
二氧化硫的性质
【实验探究】向盛有氯化钡溶液的试管中滴加SO2水溶液,再滴加0.5mL 3%的过氧化氢(具有强氧化性)溶液,振荡,猜测实验现象。
实验序号 实验现象 结论
实验2
滴入BaCl2溶液无明显现象,加入H2O2后产生白色沉淀,加盐酸沉淀不溶解
SO2具有还原性,在水溶液中易被H2O2氧化生成硫酸,SO2+H2O2==H2SO4,H2SO4与BaCl2溶液反应生成硫酸钡沉淀
H2SO4+BaCl2=BaSO4↓+2HCl
二氧化硫的性质
【实验探究】
用试管取2 mL二氧化硫溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液的变化。
二氧化硫的性质
实验 现 象 结 论
向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化
加热试管,观察溶液的变化
品红溶液褪色
SO2有漂白性
无色溶液又恢复原来的红色
SO2的漂白性是暂时的,不稳定,容易变回原来的颜色
通入SO2
加热
二氧化硫的性质
漂白原理:SO2能与某些有色物质化合成不稳定的无色物质,漂白性是暂时的。
它可以用来漂白纸浆、毛、丝、草编制品等。
讨论:SO2可以使石蕊试液褪色吗?
二氧化硫的应用
漂白性比较:
物质 HClO、O3、 Na2O2、H2O2 SO2 活性炭
原理 与有色物质化合 生成不稳定无色 物质(非氧化还原) 将有色物质的分
子吸附在其表面
(物理变化)
效果
范围 适用于几乎所有的有机色质 适用于品红、纸浆、草编等,不能漂白酸碱指示剂 可吸附某些有色物质的分子
强氧化性(氧化还原反应)
永久性
暂时性
暂时性
二氧化硫的性质
SO2+H2O2=H2SO4
SO2+Cl2+2H2O=H2SO4+2HCl
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
总结
二氧化硫的应用
?
二氧化硫的应用
①SO2 具有较强的还原性,起到抗氧化的作用。
②改善葡萄酒风味,添加酸度
③ SO2 可以杀菌和抑制微生物的活动。
SO2有毒,若残留量超标,会对人体健康有害。要严格按照国家标准规定合理使用。
二氧化硫的应用
SO2可用来漂白纸浆及草帽等编织物
随堂训练
1.下列说法正确的是( )
A.硫与金属或非金属反应均作氧化剂
B.试管内壁的硫可用热的烧碱溶液洗涤
C.过量的硫与铁反应生成Fe2S3,表现了硫单质的氧化性
D.硫只以化合态形式存在于自然界
B
随堂训练
2.硫在自然界中的循环过程如下图所示,下列说法不正确的是( )
A.石油和煤等化石燃料中含有硫元素
B.大气中的二氧化硫只来源于火山喷发产生的气体
C.地壳中的硫元素常以硫化物和硫酸盐的形式存在
D.动植物遗体被微生物分解后,可产生SO42-和SO2
B
随堂训练
3.下列有关SO2的说法错误的是
A.SO2能与NaOH溶液反应,说明SO2是酸性氧化物
B.SO2通入溴水,溴水褪色,说明SO2有还原性
C.SO2通入H2S溶液中有浅黄色沉淀生成,说明SO2有氧化性
D.SO2气体能使酸性高锰酸钾溶液褪色,说明SO2有漂白性
D
随堂训练
4.用下图所示实验装置进行SO2性质的探究实验。
随堂训练
(1)装置A中发生反应的离子方程式为_____________________,G装置的作用____________________________。
(2)简述检查该装置气密性的方法
__________________________________________________。
(3)能够证明SO2具有还原性、氧化性的实验装置依次为________和________(用字母表示),观察到的现象依次是___________、_________________。
(4)若要证明酸性:H2CO3>H2SiO3,则应观察到的实验现象有________________________。
+H+===SO2↑+H2O
吸收尾气,防止空气中的CO2进入F
G中加水至没过导管口,微热A中圆底烧瓶,若G中有气泡产生,停止加热,冷却后导管末端形成一段水柱,说明气密性良好
C
B
C中溴水褪色
B中出现淡黄色沉淀
E中品红不褪色,F中出现浑浊
谢谢观看
专题4 硫与环境保护
第一单元 含硫化合物的性质
第一课时 二氧化硫的性质与应用
硫的存在与性质
硫元素是一种重要的非金属元素,广泛存于自然界中,是植物生长不可缺少的元素。硫在自然界中既有游离态(单质),又有化合态(化合物)。
游离态硫存在于火山喷口附近或地壳的岩层中。
单质硫
硫化汞
黄色或淡蓝色的固体、质脆,易研磨成粉末。难溶于水,微溶于酒精,易溶于CS2。
二氧化硫的性质
“人间炼狱”
印尼伊真火山
为什么火山会有这样颜色的火焰,可能是由于什么原因引起的?
二氧化硫的性质
硫单质在氧气中剧烈燃烧,发出明亮的蓝紫色火焰,产物是二氧化硫,化学方程式:
单质硫既有氧化性又有还原性。
点燃
S+O2 SO2
二氧化硫的性质
4000多年前,古埃及人就用硫燃烧后产生的气体来处理布匹;公元前9世纪,古希腊人和古罗马人用这种气体来消毒和漂白。
二氧化硫还具有哪些性质?在生产、生活中又扮演着怎样的角色呢?
二氧化硫的性质
颜色、状态 密度
溶解度
无色、有刺激性气味的有毒气体
比空气大
易溶于水,通常情况下,1体积的水可以溶解约40体积的二氧化硫
二氧化硫的物理性质
二氧化硫的性质
【实验探究】
如图所示,把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度。
二氧化硫溶于水
二氧化硫是一种酸性氧化物,溶于水时可与水反应生成亚硫酸(H2SO3),亚硫酸不稳定,同时又容易分解,生成二氧化硫与水。
二氧化硫的性质
现象:
pH试纸变红
结论:
SO2的水溶液显酸性
二氧化硫的性质
【实验探究】向盛有氯化钡溶液的试管中滴加SO2水溶液,再滴加0.5mL 3%的过氧化氢(具有强氧化性)溶液,振荡,猜测实验现象。
实验序号 实验现象 结论
实验2
滴入BaCl2溶液无明显现象,加入H2O2后产生白色沉淀,加盐酸沉淀不溶解
SO2具有还原性,在水溶液中易被H2O2氧化生成硫酸,SO2+H2O2==H2SO4,H2SO4与BaCl2溶液反应生成硫酸钡沉淀
H2SO4+BaCl2=BaSO4↓+2HCl
二氧化硫的性质
【实验探究】
用试管取2 mL二氧化硫溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,再观察溶液的变化。
二氧化硫的性质
实验 现 象 结 论
向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化
加热试管,观察溶液的变化
品红溶液褪色
SO2有漂白性
无色溶液又恢复原来的红色
SO2的漂白性是暂时的,不稳定,容易变回原来的颜色
通入SO2
加热
二氧化硫的性质
漂白原理:SO2能与某些有色物质化合成不稳定的无色物质,漂白性是暂时的。
它可以用来漂白纸浆、毛、丝、草编制品等。
讨论:SO2可以使石蕊试液褪色吗?
二氧化硫的应用
漂白性比较:
物质 HClO、O3、 Na2O2、H2O2 SO2 活性炭
原理 与有色物质化合 生成不稳定无色 物质(非氧化还原) 将有色物质的分
子吸附在其表面
(物理变化)
效果
范围 适用于几乎所有的有机色质 适用于品红、纸浆、草编等,不能漂白酸碱指示剂 可吸附某些有色物质的分子
强氧化性(氧化还原反应)
永久性
暂时性
暂时性
二氧化硫的性质
SO2+H2O2=H2SO4
SO2+Cl2+2H2O=H2SO4+2HCl
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
总结
二氧化硫的应用
?
二氧化硫的应用
①SO2 具有较强的还原性,起到抗氧化的作用。
②改善葡萄酒风味,添加酸度
③ SO2 可以杀菌和抑制微生物的活动。
SO2有毒,若残留量超标,会对人体健康有害。要严格按照国家标准规定合理使用。
二氧化硫的应用
SO2可用来漂白纸浆及草帽等编织物
随堂训练
1.下列说法正确的是( )
A.硫与金属或非金属反应均作氧化剂
B.试管内壁的硫可用热的烧碱溶液洗涤
C.过量的硫与铁反应生成Fe2S3,表现了硫单质的氧化性
D.硫只以化合态形式存在于自然界
B
随堂训练
2.硫在自然界中的循环过程如下图所示,下列说法不正确的是( )
A.石油和煤等化石燃料中含有硫元素
B.大气中的二氧化硫只来源于火山喷发产生的气体
C.地壳中的硫元素常以硫化物和硫酸盐的形式存在
D.动植物遗体被微生物分解后,可产生SO42-和SO2
B
随堂训练
3.下列有关SO2的说法错误的是
A.SO2能与NaOH溶液反应,说明SO2是酸性氧化物
B.SO2通入溴水,溴水褪色,说明SO2有还原性
C.SO2通入H2S溶液中有浅黄色沉淀生成,说明SO2有氧化性
D.SO2气体能使酸性高锰酸钾溶液褪色,说明SO2有漂白性
D
随堂训练
4.用下图所示实验装置进行SO2性质的探究实验。
随堂训练
(1)装置A中发生反应的离子方程式为_____________________,G装置的作用____________________________。
(2)简述检查该装置气密性的方法
__________________________________________________。
(3)能够证明SO2具有还原性、氧化性的实验装置依次为________和________(用字母表示),观察到的现象依次是___________、_________________。
(4)若要证明酸性:H2CO3>H2SiO3,则应观察到的实验现象有________________________。
+H+===SO2↑+H2O
吸收尾气,防止空气中的CO2进入F
G中加水至没过导管口,微热A中圆底烧瓶,若G中有气泡产生,停止加热,冷却后导管末端形成一段水柱,说明气密性良好
C
B
C中溴水褪色
B中出现淡黄色沉淀
E中品红不褪色,F中出现浑浊
谢谢观看
