人教版高二化学选修四第二章第一节《化学反应速率》教学课件(共26张PPT)
文档属性
| 名称 | 人教版高二化学选修四第二章第一节《化学反应速率》教学课件(共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 276.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-24 00:00:00 | ||
图片预览







文档简介
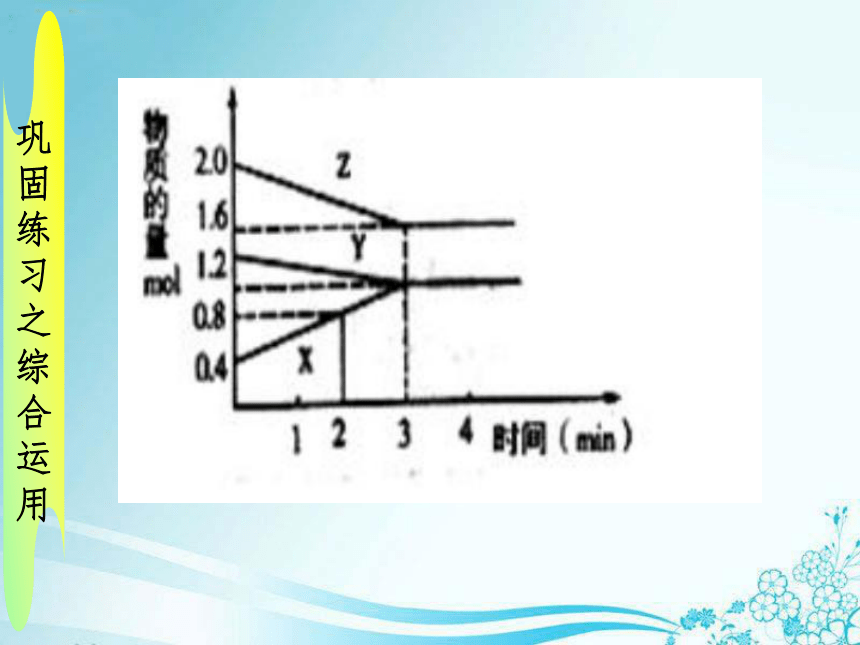
课件26张PPT。化学反应速率巩固练习之概念理解下列有关化学反应速率的说法正确的是( )A、化学反应速率通常用单位时间内任一反应物或生成物的浓度变化来表示B、化学反应速率通常指的是平均速率,不是即时速率C、用不同物质来表示同一反应在相同条件下的反应速率时,各数值与方程式中各物质的化学计量数成正比D、用不同物质来表示同一反应在相同条件下的反应速率时,各数值不一定相同,表示的意义也不同巩固练习之速率计算反应A+3B==2C+2D在四种不同情况下的反应速率
① v(A)=0.015mol/(L·s)
② v(B)=0.09mol/(L·s)
③ v(C)=0.04mol/(L·s)
④ v(D)=1.2mol/(L·s)
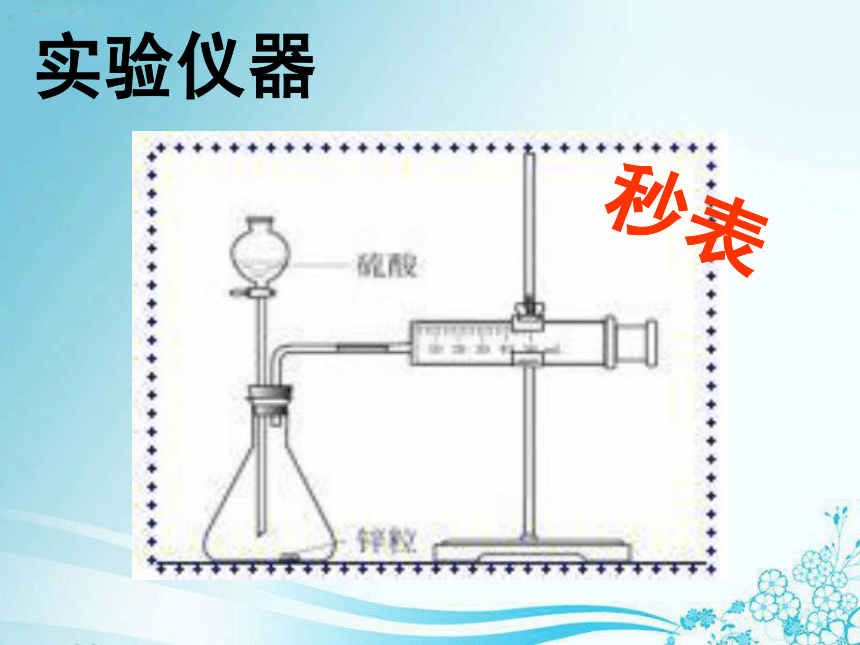
由快到慢的顺序为 。巩固练习之速率计算在2L的密闭容器中,分别通入1molN2,4molH2,经10s后,测得生成NH3的浓度为0.25mol/L,试计算v(H2)巩固练习之综合运用化学反应速率的测定实验目的探究不同浓度的硫酸溶液对化学反应速率的影响实验原理通过收集相同体积氢气所用的时间来测定该反应速率(通过在相同时间内所收集的氢气体积来测定该反应速率)实验药品Zn粒、1mol/L硫酸、4mol/L硫酸实验仪器秒表实验步骤1、按图连好装置,检查装置的气密性2、加入药品,记录产生10ml氢气所用
的时间,重复操作2-3次,取平均值3、将1mol/L硫酸换成4mol/L,重
复第2步操作2-3次,取平均值4、数据处理气密性检查1、创建一个封闭环境2、通过改变压强或改变温度的方
法使得封闭的气体体积发生变化3、通过观察是否出现稳定
的水柱或导管末端出现气泡(4、撤去热源后,是否回流一段稳定的水柱)影响化学反应速率的因素反应物分子间的碰撞能够发生化学反应的碰撞不能够发生化学反应的碰撞有效碰撞无效碰撞能量较高的分子合适的碰撞取向活化分子 具有较高能量,能够发生有效碰撞的分子称为活化分子注意:能够发生有效碰撞的分子一定是活化分子,但由于活化分子的碰撞方向和力度不同,所以,不是所有的活化分子的碰撞都是有效碰撞。
有效碰撞是发生化学反应的充要条件活化能 活化分子比普通分子所多出的那部分能量称为活化能活化能与化学反应速率的关系活化能降低普通分子变成活化分子活化分子百分数增大有效碰撞次数增多反应速率增大浓度、压强对化学反应速率的影响改变压强对化学反应速率的影响的几种情况 对于有气体参加的反应,改变压强,对化学反应速率产生的影响的根本原因是浓度的改变。所以,讨论压强对反应速率的影响时,应区分引起压强改变的原因。恒温时:体积缩小压强增大浓度增大反应速率加快体积增大压强减小浓度减小反应速率减慢恒温恒容时:充入气体反应物总压强增大浓度增大反应速率加快充入无关气体总压强增大分压不变,反应物浓度不变反应速率不变恒温恒压时:充入气体反应物压强不变浓度不变反应速率不变充入无关气体体积增大反应物浓度减小反应速率减慢温度对化学反应速率的影响升高温度活化分子百分数增多增大单位体积内有效碰撞次数化学反应速率加快增大单位体积内活化分子数 温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。 对于可逆反应,升高温度,正、逆反应速率都增大;降低温度,正、逆反应速率都减小。
只不过增大或减小的程度不同催化剂对化学反应速率的影响降低活化能活化分子数增多有效碰撞几率增大反应速率加快总结硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4===Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )(2014·广东执信中学高二期中考)下列有关化学反应速率的说法中,正确的是( )
A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率
C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,为了加快反应速率,实际生活中使用了增大压强或升高温度的方法
把镁条投入盛有盐酸敞口容器中,产生氢气变化如图所示。则OA段反应速率增加的原因是________________________________________________________________________;
AB段反应速率减小的原因是________________________________________________________________________。
进行如下实验,在A瓶中放入10 g黄豆粒大小的碳酸钙,在B瓶放入5 g粉末状碳酸钙,分别加入50 mL 1 mol/L盐酸,下图中横轴代表时间,纵轴代表瓶中碳酸钙减少的质量,其中能正确表示实验结果的是( )
① v(A)=0.015mol/(L·s)
② v(B)=0.09mol/(L·s)
③ v(C)=0.04mol/(L·s)
④ v(D)=1.2mol/(L·s)
由快到慢的顺序为 。巩固练习之速率计算在2L的密闭容器中,分别通入1molN2,4molH2,经10s后,测得生成NH3的浓度为0.25mol/L,试计算v(H2)巩固练习之综合运用化学反应速率的测定实验目的探究不同浓度的硫酸溶液对化学反应速率的影响实验原理通过收集相同体积氢气所用的时间来测定该反应速率(通过在相同时间内所收集的氢气体积来测定该反应速率)实验药品Zn粒、1mol/L硫酸、4mol/L硫酸实验仪器秒表实验步骤1、按图连好装置,检查装置的气密性2、加入药品,记录产生10ml氢气所用
的时间,重复操作2-3次,取平均值3、将1mol/L硫酸换成4mol/L,重
复第2步操作2-3次,取平均值4、数据处理气密性检查1、创建一个封闭环境2、通过改变压强或改变温度的方
法使得封闭的气体体积发生变化3、通过观察是否出现稳定
的水柱或导管末端出现气泡(4、撤去热源后,是否回流一段稳定的水柱)影响化学反应速率的因素反应物分子间的碰撞能够发生化学反应的碰撞不能够发生化学反应的碰撞有效碰撞无效碰撞能量较高的分子合适的碰撞取向活化分子 具有较高能量,能够发生有效碰撞的分子称为活化分子注意:能够发生有效碰撞的分子一定是活化分子,但由于活化分子的碰撞方向和力度不同,所以,不是所有的活化分子的碰撞都是有效碰撞。
有效碰撞是发生化学反应的充要条件活化能 活化分子比普通分子所多出的那部分能量称为活化能活化能与化学反应速率的关系活化能降低普通分子变成活化分子活化分子百分数增大有效碰撞次数增多反应速率增大浓度、压强对化学反应速率的影响改变压强对化学反应速率的影响的几种情况 对于有气体参加的反应,改变压强,对化学反应速率产生的影响的根本原因是浓度的改变。所以,讨论压强对反应速率的影响时,应区分引起压强改变的原因。恒温时:体积缩小压强增大浓度增大反应速率加快体积增大压强减小浓度减小反应速率减慢恒温恒容时:充入气体反应物总压强增大浓度增大反应速率加快充入无关气体总压强增大分压不变,反应物浓度不变反应速率不变恒温恒压时:充入气体反应物压强不变浓度不变反应速率不变充入无关气体体积增大反应物浓度减小反应速率减慢温度对化学反应速率的影响升高温度活化分子百分数增多增大单位体积内有效碰撞次数化学反应速率加快增大单位体积内活化分子数 温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。 对于可逆反应,升高温度,正、逆反应速率都增大;降低温度,正、逆反应速率都减小。
只不过增大或减小的程度不同催化剂对化学反应速率的影响降低活化能活化分子数增多有效碰撞几率增大反应速率加快总结硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4===Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )(2014·广东执信中学高二期中考)下列有关化学反应速率的说法中,正确的是( )
A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率
C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,为了加快反应速率,实际生活中使用了增大压强或升高温度的方法
把镁条投入盛有盐酸敞口容器中,产生氢气变化如图所示。则OA段反应速率增加的原因是________________________________________________________________________;
AB段反应速率减小的原因是________________________________________________________________________。
进行如下实验,在A瓶中放入10 g黄豆粒大小的碳酸钙,在B瓶放入5 g粉末状碳酸钙,分别加入50 mL 1 mol/L盐酸,下图中横轴代表时间,纵轴代表瓶中碳酸钙减少的质量,其中能正确表示实验结果的是( )
