人教版高二化学选修四第一章第一节《化学反应与能量的变化》教学课件(共19张PPT)
文档属性
| 名称 | 人教版高二化学选修四第一章第一节《化学反应与能量的变化》教学课件(共19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 81.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-24 16:55:22 | ||
图片预览





文档简介
课件19张PPT。化学反应与能量的变化1、化学反应过程中为什么会伴随着能量的变化?2、化学反应过程中能量上的变化有哪些形式?3、化学反应中有哪些典型的放热反应和吸热反应?化学反应中存在能量变化的主要原因是:
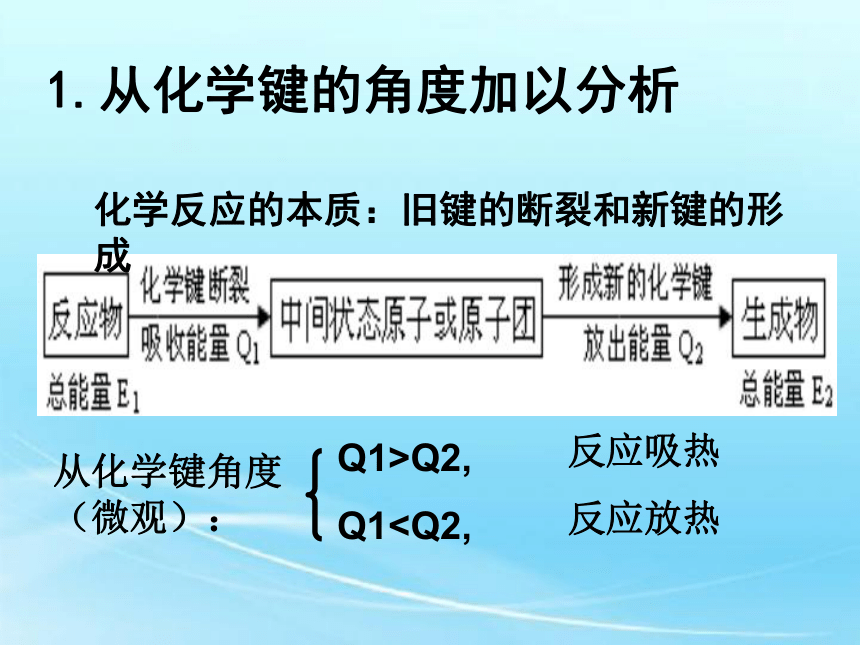
1.从化学键的角度加以分析
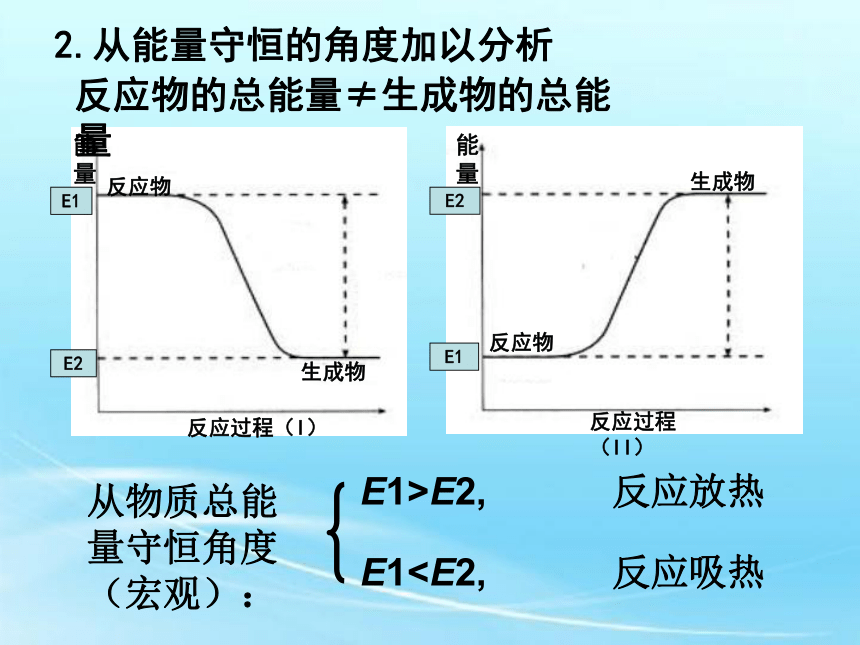
2.从能量守恒的角度加以分析从化学键角度(微观):1.从化学键的角度加以分析化学反应的本质:旧键的断裂和新键的形成Q1>Q2,反应吸热Q1 恒压反应热:恒压条件下进行反应的反应热
恒容反应热:恒容条件下进行反应的反应热焓 变定义:恒压条件下进行反应的反应热符号:单位:ΔHkJ/mol或kJ·mol-1ΔH=H生成物 - H反应物ΔH的正负号与初中所学的Q有何区别?为什么?参照系不同造成的结果!
体
系环境石墨、金刚石哪个更稳定? 1. 判断物质的稳定性2.判断反应热的大小(计算)例 1:1mol C与 1mol H2O(g) 反应生成 lmol CO(g) 和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H = kJ/mol。例 2:拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1mol N2生成NH3的反应热为 ,
则1mol H2生成NH3的反应热为 。 相当于 1/3 mol N2+131.5-92.0 kJ/mol-30.67 kJ/mol任何一个化学反应都包括物质的变化和能量的变化。
那么,有什么表达式能把这两种变化都表示出来?只表示物质变化【例1】 在200℃、101kPa时,1 mol H2与碘蒸气作用生成HI的反应,科学文献上表示为:二、热化学方程式: 能表示参加反应物质的量和反应热的
关系的化学方程式。1、定义:H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol200℃
101kPa 热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
普通化学方程式只包含物质变化一个部分。物质变化能量变化书写热化学方程式的注意事项热化学方程式表示的意义1、反应物和生成物的种类、聚集状态
2、反应中各物质的物质的量比和质量比
3、反应中放出或吸收的热量。⑴ 一般应注明反应的温度、压强;(250C ,101kPa时不注明)⑵ 一定标明各物质的状态(s、l、g、aq) ;(5) ΔH只放右边(数值及单位);
放热: ΔH < 0; 吸热: ΔH > 0; (3) 系数仅仅表示物质的量,不表示分子或原子个数;故系数可以是整数、分数、小数; (4)ΔH的值与系数相匹配。系数加倍,ΔH值也加倍。正逆反应的ΔH绝对值相等,符号相反。请完成课本第六页第三题注意事项:物质的聚集状态、ΔH的正负号、
单位、各物质系数(即物质的量)1、热化学方程式的书写2、热化学方程式的正误判断3、ΔH的大小比较
在同温、同压下,比较下列反应放出热量ΔH1 、 ΔH2的大小 2H2(g)+O2(g)=2H2O(g) ;
2H2(g)+O2(g)=2H2O(l);Q2>Q1ΔH1 = -Q1ΔH 2= -Q2(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、ad>0 C、2a=b< 0 D、2c=d>0 在同温同压下,下列各组热化学方程式中 Q2>Ql的是( )
A、2H2(g)+02(g) =2H20(g); △H1=-Q1
2H2(g)+02(g)=2H20(1); △H2=-Q2
B、S(g)+O2(g)=S02(g); △H1=-Q1
S(s)+02(g)=S02(g); △H2=-Q2
C、C(s)+1/2O2 (g)=CO(g); △H1=-Q1
C(s)+02(g)=C02(g); △H2=-Q2
D、H2(g)+Cl2(g)=2HCl(g); △H1=-Q1
1/2H2(g)+ 1/2Cl2(g)= HCl(g); △H2=-Q2
恒容反应热:恒容条件下进行反应的反应热焓 变定义:恒压条件下进行反应的反应热符号:单位:ΔHkJ/mol或kJ·mol-1ΔH=H生成物 - H反应物ΔH的正负号与初中所学的Q有何区别?为什么?参照系不同造成的结果!
体
系环境石墨、金刚石哪个更稳定? 1. 判断物质的稳定性2.判断反应热的大小(计算)例 1:1mol C与 1mol H2O(g) 反应生成 lmol CO(g) 和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H = kJ/mol。例 2:拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1mol N2生成NH3的反应热为 ,
则1mol H2生成NH3的反应热为 。 相当于 1/3 mol N2+131.5-92.0 kJ/mol-30.67 kJ/mol任何一个化学反应都包括物质的变化和能量的变化。
那么,有什么表达式能把这两种变化都表示出来?只表示物质变化【例1】 在200℃、101kPa时,1 mol H2与碘蒸气作用生成HI的反应,科学文献上表示为:二、热化学方程式: 能表示参加反应物质的量和反应热的
关系的化学方程式。1、定义:H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol200℃
101kPa 热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
普通化学方程式只包含物质变化一个部分。物质变化能量变化书写热化学方程式的注意事项热化学方程式表示的意义1、反应物和生成物的种类、聚集状态
2、反应中各物质的物质的量比和质量比
3、反应中放出或吸收的热量。⑴ 一般应注明反应的温度、压强;(250C ,101kPa时不注明)⑵ 一定标明各物质的状态(s、l、g、aq) ;(5) ΔH只放右边(数值及单位);
放热: ΔH < 0; 吸热: ΔH > 0; (3) 系数仅仅表示物质的量,不表示分子或原子个数;故系数可以是整数、分数、小数; (4)ΔH的值与系数相匹配。系数加倍,ΔH值也加倍。正逆反应的ΔH绝对值相等,符号相反。请完成课本第六页第三题注意事项:物质的聚集状态、ΔH的正负号、
单位、各物质系数(即物质的量)1、热化学方程式的书写2、热化学方程式的正误判断3、ΔH的大小比较
在同温、同压下,比较下列反应放出热量ΔH1 、 ΔH2的大小 2H2(g)+O2(g)=2H2O(g) ;
2H2(g)+O2(g)=2H2O(l);Q2>Q1ΔH1 = -Q1ΔH 2= -Q2(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、a
A、2H2(g)+02(g) =2H20(g); △H1=-Q1
2H2(g)+02(g)=2H20(1); △H2=-Q2
B、S(g)+O2(g)=S02(g); △H1=-Q1
S(s)+02(g)=S02(g); △H2=-Q2
C、C(s)+1/2O2 (g)=CO(g); △H1=-Q1
C(s)+02(g)=C02(g); △H2=-Q2
D、H2(g)+Cl2(g)=2HCl(g); △H1=-Q1
1/2H2(g)+ 1/2Cl2(g)= HCl(g); △H2=-Q2
