2024-2025学年度北京市海淀区高三10月考化学试卷(PDF版,无答案)
文档属性
| 名称 | 2024-2025学年度北京市海淀区高三10月考化学试卷(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 818.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-16 16:35:22 | ||
图片预览


文档简介
2024~2025 学年阶段练习一
高三化学 2024.10.5
本试卷共 8 页,100 分。考试时长 90 分钟。考生务必将答案答在答题纸上,在试卷上作答无效。
考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:H 1 O 16 Mn 55 Fe 56 S 32 Cl 35.5 Sn 119
第一部分
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.用 NA表示阿伏加德罗常数的值。下列说法正确的是
A.4g 21 H2 含有的原子数为 NA
B.1 L 0.1 mol/L FeCl3溶液含有的 Fe3+个数为 0.1NA
C.0.1 mol Na 与 10 mL 0.5 mol/L 盐酸充分反应,转移电子数为 0.1 NA
D. 标准状况下,11.2 L O2和 N2的混合气体含有的分子数为 NA
2.下列化学用语或图示表达正确的是
A.NaCl 的电子式为 B.NH3的 VSEPR 模型为
C.2pz电子云图为
D.基态 24Cr 原子的价层电子轨道表示式为
3.完成下述实验,装置或试剂正确的是
A.由 MgCl2 溶液制得 C.验证 NH3极易溶于 D.除去 CO2中混有的少
B.验证有 SO2
MgCl2 水且溶液呈碱性 量 HCl
BaCl2 溶液
4.下列物质的应用中,利用了氧化还原反应的是
A.用石灰乳脱除烟气中的 SO2 B.用明矾[KAl(SO4)2 12H2O]处理污水
C.用盐酸去除铁锈(主要成分 Fe2O3 xH2O) D.用 84 消毒液(有效成分 NaClO)杀灭细菌
5.已知 33As、35Br 位于同一周期,下列关系正确的是
A.原子半径:As > Cl > P B.还原性:As3- > S2- > Cl-
C.热稳定性:HCl > AsH3 > HBr D.第一电离能:As < Se < Br
1 / 8
6.下列说法不.正.确.的是
A.用碳酸钠溶液处理锅炉水垢:CaSO4(s)+CO 2 3 CaCO3(s)+SO
2
4
B .湿润的淀粉碘化钾试纸遇氯气变蓝:3Cl2+I-+3H2O=6Cl-+IO +3 +6H
高温
C.铝粉和氧化铁组成的铝热剂用于焊接钢轨:2Al+Fe2O3 Al2O3+2Fe
D.淡黄色的过氧化钠敞口放置变成白色:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑
7.下列关于自然界中氮循环(如下图)的说法不.正.确.的是
A.工业合成氨属于人工固氮 B.氮元素均被氧化
C.含氮无机物和含氮有机物可相互转化 D.碳、氢、氧三种元素也参与了氮循环
8.最新报道:科学家首次用 X 射线激光技术观察到 CO 与 O 在催化剂表面形成化学键的过程。反应过程
的示意图如右图:
下列说法中正确的是
A.CO 和 O 生成 CO2 是吸热反应
B.在该过程中,CO 断键形成 C 和 O
C.状态Ⅰ →状态Ⅲ表示 CO 与 O2 反应的过程
D.CO 和 O 生成了具有极性共价键的 CO2
9.用右图所示装置进行下列实验,实验结果与预测的现象不.一.致.的是
①中的物质 ②中的物质 预测①中现象
A 淀粉 KI 溶液 浓硝酸 无明显现象
B 酚酞溶液 浓盐酸 无明显现象
C AlCl3 溶液 浓氨水 有白色沉淀
D 湿润红纸条 饱和氯水 红纸条褪色
2 / 8
10.某MOFs多孔材料孔径大小和形状恰好将 N2O4 “固定”,能高选择性吸附 NO2 。废气中的NO2 被吸附
后,经处理能全部转化为HNO3。原理示意图如下。下列说法不.正.确.的是
已知: △H<0
A.温度升高时不利于NO2 吸附
B.多孔材料“固定” N2O4 ,
促进 平衡正向移动
C.转化为HNO3的反应是 2N2O4 +O2 +2H2O=4HNO3
D.每获得0.4molHNO3 时,转移电子的数目为6.02 1022
11.在两份相同的 Ba(OH)2 溶液中,分别滴入物质的量浓度相等的 H2SO4、NaHSO4 溶液,其导电能力随
滴入溶液体积变化的曲线如右图所示。
下列分析不.正.确.的是
A.①代表滴加 H2 SO4 溶液的变化曲线
B.b 点,溶液中大量存在的离子是 Na+、OH–
C.c 点,两溶液中含有相同量的 OH–
D.a、d 两点对应的溶液均显中性
12.可采用Deacon催化氧化法将工业副产物HCl 制成Cl2,实现氯资源的再利用。反应的热化学方程式:
CuO
4HCl(g)+O2 (g) 2Cl2 (g)+2H2 O(g) ΔH=-114.4kJ mol
-1
。下图所示为该法的一种催化机理。
下列说法不.正.确.的是
A.反应制得1mol Cl2,须投入 2molCuO
B.Y 为反应物 HCl,W 为生成物 H2O
C.升高反应温度,HCl 被 O2氧化制 Cl2的反应平衡常数减小
D.图中转化涉及的反应中有两个属于氧化还原反应
13.研究小组在探究卤素离子与硝酸银的反应时,进行了以下实验。
编号 操作 所用试剂 现象
1 ①KCl 溶液 ②稀硝酸酸化的 AgNO3 溶液 产生白色沉淀
2 ①KCl 溶液 ②浓硝酸酸化的 AgNO3 溶液 产生白色沉淀
3 ①KI 溶液 ②稀硝酸酸化的 AgNO3 溶液 产生黄色沉淀
4 ①KI 溶液 ②浓硝酸酸化的 AgNO3 溶液 产生褐色的浊液
3 / 8
下列说法不.正.确.的是
A.实验 1 和 2 说明,硝酸浓度不影响 Cl-的检验
B.实验 1 和 3 说明,卤素离子的检验可使用稀硝酸酸化的 AgNO3溶液
C.对比实验 2 和 4,说明异常现象的产生与卤离子种类有关
D.由上述实验推测,Br-的检验不能使用浓硝酸酸化的 AgNO3溶液
14.不同条件下,当 KMnO4与 KI 按照反应①②的化学计量比恰好反应,结果如下。
KI KMnO4
反应序号 起始酸碱性 还原产物 氧化产物
物质的量/mol 物质的量/mol
① 酸性 0.001 n Mn2+ I2
② 中性 0.001 10n MnO —2 IOx
已知:MnO-4的氧化性随酸性减弱而减弱。
下列说法正确的是
A n Mn2+.反应①, :n I2 =1:5 B.对比反应①和②, I- 的还原性随酸性减弱而减弱
C.对比反应①和②,x=3 D.随反应进行,体系 pH 变化:①增大,②不变
第二部分
本部分共5题,共58分。
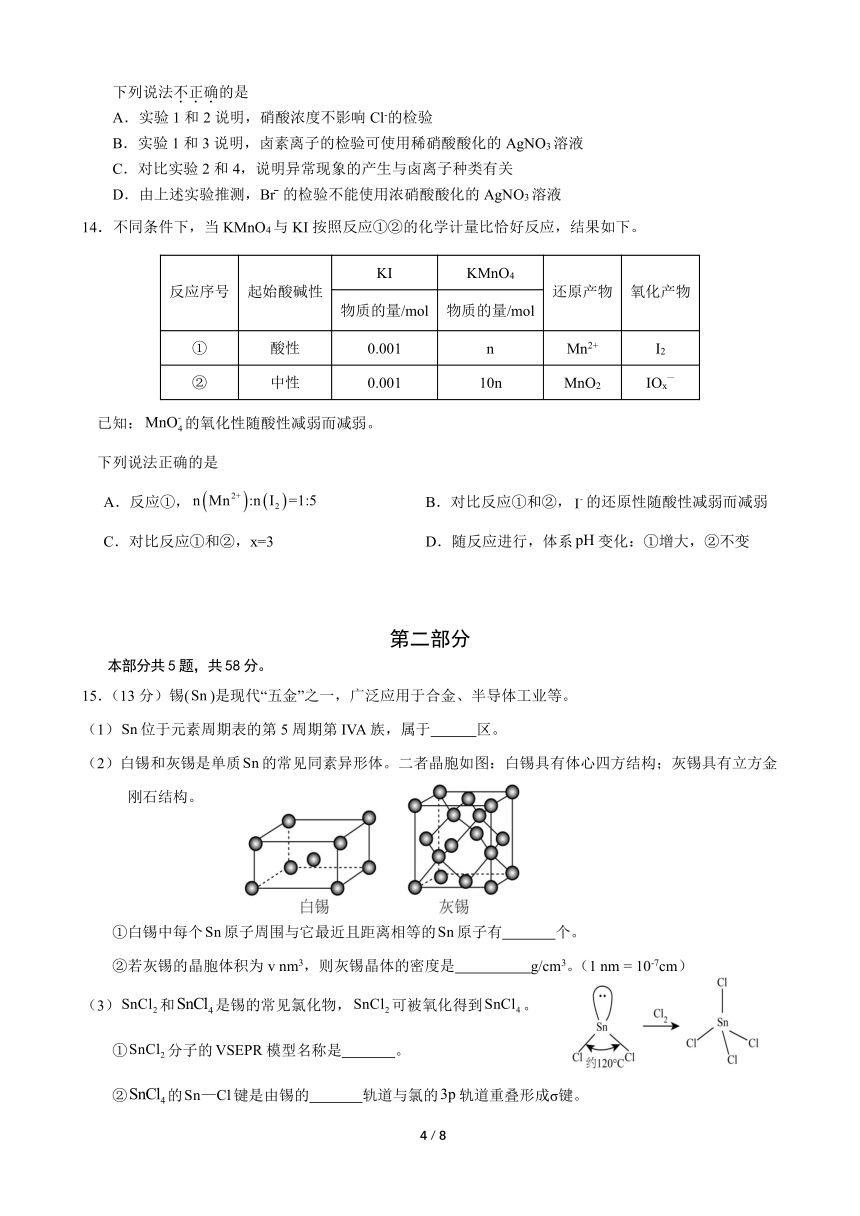
15.(13 分)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第 5 周期第 IVA 族,属于 区。
(2)白锡和灰锡是单质Sn 的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金
刚石结构。
①白锡中每个Sn原子周围与它最近且距离相等的Sn 原子有 个。
②若灰锡的晶胞体积为 v nm3,则灰锡晶体的密度是 g/cm3。(1 nm = 10-7cm)
(3)SnCl2 和SnCl4是锡的常见氯化物,SnCl2 可被氧化得到SnCl4 。
①SnCl2 分子的VSEPR 模型名称是 。
②SnCl4的Sn—Cl键是由锡的 轨道与氯的3p 轨道重叠形成σ键。
4 / 8
③SnCl2 分子中,Cl-Sn-Cl 键角小于 120°的原因是 。
(4)C、Si 是与 Sn 同主族的两种元素
①二者电负性 C Si,从原子结构角度解释原因
②金刚石的熔点高于晶体硅,说明原因
16.(11 分)HNO3是一种重要的工业原料。可采用不同的氮源制备HNO3。
(1)方法一:早期以硝石(含 NaNO3 )为氮源制备HNO3,反应的化学方程式
H2SO4(浓)+NaNO3 NaHSO4 +HNO3 。该反应利用了浓硫酸的性质是酸性和 。
(2)方法二:以 NH3为氮源催化氧化制备HNO3,反应原理分三步进行。
①第 I 步反应的化学方程式为 。
②针对第Ⅱ步反应进行研究:在容积可变的密闭容器中,充入 2nmolNO和 n mol O2 进行反应。在不同
压强下( p1 、 p2 ),反应达到平衡时,测得NO 转化率随温度的变化如图所示。从平衡角度解释 y 点
的容器容积小于 x 点的容器容积的原因 。
(3)人工固氮是高能耗的过程,结合N2分子结构解释原因 。
(4)NOx 是汽车尾气中的主要污染物之一。
①NOx 能形成酸雨,写出 NO2 转化为 HNO3 的化学方程式 。
②汽车发动机工作时会引发 N2 和 O2 反应,其能量变化示意图如下:
写出该反应的热化学方程式: 。
③在汽车尾气系统中装置催化转化器,可有效降低 NOX 的排放。当尾气中空气不足时,NOX在催化
转化器中被还原成 N2排出。写出 NO 被 CO 还原的化学方程式:
5 / 8
17 10 ( CuFeS SiO.( 分)利用黄铜矿 主要成分为 2 ,含有 2 等杂质)生产纯铜,流程示意图如下。
(1)矿石在焙烧前需粉碎,其作用是 。
(2) NH4 SO4 的作用是利用其分解产生的SO3使矿石中的铜元素转化为CuSO4 。 NH2 4 SO2 4 发生热分
解的化学方程式是 。
(3)矿石和过量(NH4)2SO4按一定比例混合,取相同质量,在不同温度下焙烧相同时间,测得:“吸收”过
程氨吸收率和“浸铜”过程铜浸出率变化如图;400℃和500℃时,固体 B 中所含铜、铁的主要物质如表。
温度/℃ B 中所含铜、铁的主要物质
400 Fe2O3、CuSO4、CuFeS2
500 Fe2 SO4 、CuSO3 4、CuO
①温度低于 425℃,随焙烧温度升高,铜浸出率显著增大的原因是 。
②温度高于 425℃,根据焙烧时可能发生的反应,解释铜浸出率随焙烧温度升高而降低的原因是 。
(4)用离子方程式表示置换过程中加入 Fe 的目的 。
(5)粗铜经酸浸处理,再进行电解精炼;电解时用酸化的CuSO +4溶液做电解液,并维持一定的 c H 和
c Cu 2+ 。粗铜若未经酸浸处理,消耗相同电量时,会降低得到纯铜的量,原因是 。
6 / 8
18.(12 分)资料显示,I2可以将 Cu 氧化为 Cu2+。某小组同学设计实验探究 Cu 被 I2 氧化的产物及铜元素
的价态。已知:I2 易溶于 KI 溶液,发生反应 I2 + I- I -3 (红棕色);I2和 I -3 氧化性几乎相同。
(1)将等体积的 KI 溶液加入到 m mol 铜粉和 n mol I2(n > m)的固体混合物中,振荡。实验记录如下:
c(KI) 实验现象
极少量 I2 溶解,溶液为淡红色;充分反应后,红色的铜粉转
实验 I 0.01 mol L-1
化为白色沉淀,溶液仍为淡红色。
部分 I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化
实验 II 0.1 mol L-1
为白色沉淀,溶液仍为红棕色。
I2 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完
实验 III 4 mol L-1
全溶解,溶液为深红棕色。
① 初始阶段,Cu 被氧化的反应速率:实验 I 实验 II(填“>”、“<”或“=”)。
② 实验 III 所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),
进行以下实验探究:
步骤 a.取实验 III 的深红棕色溶液,加入 CCl4,多次萃取、分液。
步骤 b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
i.步骤 a 的目的是 。
ii.查阅资料,2Cu2+ + 4I- === 2CuI↓ + I2,[Cu(NH3)2]+(无色)容易被空气氧化。用离子方程式
解释步骤 b 的溶液中发生的变化: 。
③ 结合实验 III,推测实验 I 和 II 中的白色沉淀可能是 CuI,实验 I 中铜被氧化的化学方程式
是 。分别取实验 I 和 II 充分反应后的固体,洗涤后得到白色沉淀,加入浓 KI 溶液,
(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 。
(2)上述实验结果,I2仅将 Cu 氧化为+1 价。在隔绝空气的条件下进行电化学实验,证实了 I2能将 Cu
氧化为 Cu2+。运用氧化还原反应规律,分析实验 I-III 中 Cu 被 I2氧化只得到+1 价的原因: 。
19.(12 分)某小组探究 Fe2S3 的制备。配制 0.1 mol·L-1 的 FeCl3 溶液和 0.1 mol·L-1 的 Na2S 溶液备用。
【查阅资料】i. FeS,Fe2S3 均为黑色固体,难溶于水。
ii. Fe3+ + 6F [FeF6]3- , [FeF6]3- 为无色离子。
iii. 硫单质微溶于乙醇,难溶于水。
7 / 8
【设计并实施实验】
编号 实验一 实验二
操作
迅速产生黑色沉淀 a,振荡后黑色沉淀溶解,并产生
现象 产生棕黑色沉淀
有臭鸡蛋气味的气体,最终得到棕黄色浊液 X
(1)实验一中,根据复分解反应规律推测,生成黑色沉淀 a 的离子方程式为___________。
(2)进一步检验浊液 X 的组成,过程如下。
① 通过对浊液 X 组成的检验,推测实验一的黑色沉淀 a 溶解过程中有氧化还原反应发生,实验证据
是_________。
② 经检测,黑色固体 b 中含有 FeS。甲同学认为,FeS 是由红褐色清液中的 Fe2+,与加入的 S2-反应产
生的。乙同学认为该推测不严谨,理由是_________。
(3)实验二制得了 Fe2S3,但其中含少量 Fe(OH)3。
①生成 Fe(OH)3的离子方程式为___________。
②从化学反应速率角度推测实验二的棕黑色沉淀中不含 S 的原因:__________。
实验三 小组同学进行如下图所示的改进实验。经检验,黑色沉淀 c 为纯净的 Fe2S3。
(4)实验三中,由无色清液生成 Fe2S3 的离子方程式为___________。
【反思与评价】
(5)对比三个实验,实验三能成功制备 Fe2S3的原因是___________。
8 / 8
高三化学 2024.10.5
本试卷共 8 页,100 分。考试时长 90 分钟。考生务必将答案答在答题纸上,在试卷上作答无效。
考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:H 1 O 16 Mn 55 Fe 56 S 32 Cl 35.5 Sn 119
第一部分
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.用 NA表示阿伏加德罗常数的值。下列说法正确的是
A.4g 21 H2 含有的原子数为 NA
B.1 L 0.1 mol/L FeCl3溶液含有的 Fe3+个数为 0.1NA
C.0.1 mol Na 与 10 mL 0.5 mol/L 盐酸充分反应,转移电子数为 0.1 NA
D. 标准状况下,11.2 L O2和 N2的混合气体含有的分子数为 NA
2.下列化学用语或图示表达正确的是
A.NaCl 的电子式为 B.NH3的 VSEPR 模型为
C.2pz电子云图为
D.基态 24Cr 原子的价层电子轨道表示式为
3.完成下述实验,装置或试剂正确的是
A.由 MgCl2 溶液制得 C.验证 NH3极易溶于 D.除去 CO2中混有的少
B.验证有 SO2
MgCl2 水且溶液呈碱性 量 HCl
BaCl2 溶液
4.下列物质的应用中,利用了氧化还原反应的是
A.用石灰乳脱除烟气中的 SO2 B.用明矾[KAl(SO4)2 12H2O]处理污水
C.用盐酸去除铁锈(主要成分 Fe2O3 xH2O) D.用 84 消毒液(有效成分 NaClO)杀灭细菌
5.已知 33As、35Br 位于同一周期,下列关系正确的是
A.原子半径:As > Cl > P B.还原性:As3- > S2- > Cl-
C.热稳定性:HCl > AsH3 > HBr D.第一电离能:As < Se < Br
1 / 8
6.下列说法不.正.确.的是
A.用碳酸钠溶液处理锅炉水垢:CaSO4(s)+CO 2 3 CaCO3(s)+SO
2
4
B .湿润的淀粉碘化钾试纸遇氯气变蓝:3Cl2+I-+3H2O=6Cl-+IO +3 +6H
高温
C.铝粉和氧化铁组成的铝热剂用于焊接钢轨:2Al+Fe2O3 Al2O3+2Fe
D.淡黄色的过氧化钠敞口放置变成白色:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑
7.下列关于自然界中氮循环(如下图)的说法不.正.确.的是
A.工业合成氨属于人工固氮 B.氮元素均被氧化
C.含氮无机物和含氮有机物可相互转化 D.碳、氢、氧三种元素也参与了氮循环
8.最新报道:科学家首次用 X 射线激光技术观察到 CO 与 O 在催化剂表面形成化学键的过程。反应过程
的示意图如右图:
下列说法中正确的是
A.CO 和 O 生成 CO2 是吸热反应
B.在该过程中,CO 断键形成 C 和 O
C.状态Ⅰ →状态Ⅲ表示 CO 与 O2 反应的过程
D.CO 和 O 生成了具有极性共价键的 CO2
9.用右图所示装置进行下列实验,实验结果与预测的现象不.一.致.的是
①中的物质 ②中的物质 预测①中现象
A 淀粉 KI 溶液 浓硝酸 无明显现象
B 酚酞溶液 浓盐酸 无明显现象
C AlCl3 溶液 浓氨水 有白色沉淀
D 湿润红纸条 饱和氯水 红纸条褪色
2 / 8
10.某MOFs多孔材料孔径大小和形状恰好将 N2O4 “固定”,能高选择性吸附 NO2 。废气中的NO2 被吸附
后,经处理能全部转化为HNO3。原理示意图如下。下列说法不.正.确.的是
已知: △H<0
A.温度升高时不利于NO2 吸附
B.多孔材料“固定” N2O4 ,
促进 平衡正向移动
C.转化为HNO3的反应是 2N2O4 +O2 +2H2O=4HNO3
D.每获得0.4molHNO3 时,转移电子的数目为6.02 1022
11.在两份相同的 Ba(OH)2 溶液中,分别滴入物质的量浓度相等的 H2SO4、NaHSO4 溶液,其导电能力随
滴入溶液体积变化的曲线如右图所示。
下列分析不.正.确.的是
A.①代表滴加 H2 SO4 溶液的变化曲线
B.b 点,溶液中大量存在的离子是 Na+、OH–
C.c 点,两溶液中含有相同量的 OH–
D.a、d 两点对应的溶液均显中性
12.可采用Deacon催化氧化法将工业副产物HCl 制成Cl2,实现氯资源的再利用。反应的热化学方程式:
CuO
4HCl(g)+O2 (g) 2Cl2 (g)+2H2 O(g) ΔH=-114.4kJ mol
-1
。下图所示为该法的一种催化机理。
下列说法不.正.确.的是
A.反应制得1mol Cl2,须投入 2molCuO
B.Y 为反应物 HCl,W 为生成物 H2O
C.升高反应温度,HCl 被 O2氧化制 Cl2的反应平衡常数减小
D.图中转化涉及的反应中有两个属于氧化还原反应
13.研究小组在探究卤素离子与硝酸银的反应时,进行了以下实验。
编号 操作 所用试剂 现象
1 ①KCl 溶液 ②稀硝酸酸化的 AgNO3 溶液 产生白色沉淀
2 ①KCl 溶液 ②浓硝酸酸化的 AgNO3 溶液 产生白色沉淀
3 ①KI 溶液 ②稀硝酸酸化的 AgNO3 溶液 产生黄色沉淀
4 ①KI 溶液 ②浓硝酸酸化的 AgNO3 溶液 产生褐色的浊液
3 / 8
下列说法不.正.确.的是
A.实验 1 和 2 说明,硝酸浓度不影响 Cl-的检验
B.实验 1 和 3 说明,卤素离子的检验可使用稀硝酸酸化的 AgNO3溶液
C.对比实验 2 和 4,说明异常现象的产生与卤离子种类有关
D.由上述实验推测,Br-的检验不能使用浓硝酸酸化的 AgNO3溶液
14.不同条件下,当 KMnO4与 KI 按照反应①②的化学计量比恰好反应,结果如下。
KI KMnO4
反应序号 起始酸碱性 还原产物 氧化产物
物质的量/mol 物质的量/mol
① 酸性 0.001 n Mn2+ I2
② 中性 0.001 10n MnO —2 IOx
已知:MnO-4的氧化性随酸性减弱而减弱。
下列说法正确的是
A n Mn2+.反应①, :n I2 =1:5 B.对比反应①和②, I- 的还原性随酸性减弱而减弱
C.对比反应①和②,x=3 D.随反应进行,体系 pH 变化:①增大,②不变
第二部分
本部分共5题,共58分。
15.(13 分)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第 5 周期第 IVA 族,属于 区。
(2)白锡和灰锡是单质Sn 的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金
刚石结构。
①白锡中每个Sn原子周围与它最近且距离相等的Sn 原子有 个。
②若灰锡的晶胞体积为 v nm3,则灰锡晶体的密度是 g/cm3。(1 nm = 10-7cm)
(3)SnCl2 和SnCl4是锡的常见氯化物,SnCl2 可被氧化得到SnCl4 。
①SnCl2 分子的VSEPR 模型名称是 。
②SnCl4的Sn—Cl键是由锡的 轨道与氯的3p 轨道重叠形成σ键。
4 / 8
③SnCl2 分子中,Cl-Sn-Cl 键角小于 120°的原因是 。
(4)C、Si 是与 Sn 同主族的两种元素
①二者电负性 C Si,从原子结构角度解释原因
②金刚石的熔点高于晶体硅,说明原因
16.(11 分)HNO3是一种重要的工业原料。可采用不同的氮源制备HNO3。
(1)方法一:早期以硝石(含 NaNO3 )为氮源制备HNO3,反应的化学方程式
H2SO4(浓)+NaNO3 NaHSO4 +HNO3 。该反应利用了浓硫酸的性质是酸性和 。
(2)方法二:以 NH3为氮源催化氧化制备HNO3,反应原理分三步进行。
①第 I 步反应的化学方程式为 。
②针对第Ⅱ步反应进行研究:在容积可变的密闭容器中,充入 2nmolNO和 n mol O2 进行反应。在不同
压强下( p1 、 p2 ),反应达到平衡时,测得NO 转化率随温度的变化如图所示。从平衡角度解释 y 点
的容器容积小于 x 点的容器容积的原因 。
(3)人工固氮是高能耗的过程,结合N2分子结构解释原因 。
(4)NOx 是汽车尾气中的主要污染物之一。
①NOx 能形成酸雨,写出 NO2 转化为 HNO3 的化学方程式 。
②汽车发动机工作时会引发 N2 和 O2 反应,其能量变化示意图如下:
写出该反应的热化学方程式: 。
③在汽车尾气系统中装置催化转化器,可有效降低 NOX 的排放。当尾气中空气不足时,NOX在催化
转化器中被还原成 N2排出。写出 NO 被 CO 还原的化学方程式:
5 / 8
17 10 ( CuFeS SiO.( 分)利用黄铜矿 主要成分为 2 ,含有 2 等杂质)生产纯铜,流程示意图如下。
(1)矿石在焙烧前需粉碎,其作用是 。
(2) NH4 SO4 的作用是利用其分解产生的SO3使矿石中的铜元素转化为CuSO4 。 NH2 4 SO2 4 发生热分
解的化学方程式是 。
(3)矿石和过量(NH4)2SO4按一定比例混合,取相同质量,在不同温度下焙烧相同时间,测得:“吸收”过
程氨吸收率和“浸铜”过程铜浸出率变化如图;400℃和500℃时,固体 B 中所含铜、铁的主要物质如表。
温度/℃ B 中所含铜、铁的主要物质
400 Fe2O3、CuSO4、CuFeS2
500 Fe2 SO4 、CuSO3 4、CuO
①温度低于 425℃,随焙烧温度升高,铜浸出率显著增大的原因是 。
②温度高于 425℃,根据焙烧时可能发生的反应,解释铜浸出率随焙烧温度升高而降低的原因是 。
(4)用离子方程式表示置换过程中加入 Fe 的目的 。
(5)粗铜经酸浸处理,再进行电解精炼;电解时用酸化的CuSO +4溶液做电解液,并维持一定的 c H 和
c Cu 2+ 。粗铜若未经酸浸处理,消耗相同电量时,会降低得到纯铜的量,原因是 。
6 / 8
18.(12 分)资料显示,I2可以将 Cu 氧化为 Cu2+。某小组同学设计实验探究 Cu 被 I2 氧化的产物及铜元素
的价态。已知:I2 易溶于 KI 溶液,发生反应 I2 + I- I -3 (红棕色);I2和 I -3 氧化性几乎相同。
(1)将等体积的 KI 溶液加入到 m mol 铜粉和 n mol I2(n > m)的固体混合物中,振荡。实验记录如下:
c(KI) 实验现象
极少量 I2 溶解,溶液为淡红色;充分反应后,红色的铜粉转
实验 I 0.01 mol L-1
化为白色沉淀,溶液仍为淡红色。
部分 I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化
实验 II 0.1 mol L-1
为白色沉淀,溶液仍为红棕色。
I2 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完
实验 III 4 mol L-1
全溶解,溶液为深红棕色。
① 初始阶段,Cu 被氧化的反应速率:实验 I 实验 II(填“>”、“<”或“=”)。
② 实验 III 所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),
进行以下实验探究:
步骤 a.取实验 III 的深红棕色溶液,加入 CCl4,多次萃取、分液。
步骤 b.取分液后的无色水溶液,滴入浓氨水,溶液颜色变浅蓝色,并逐渐变深。
i.步骤 a 的目的是 。
ii.查阅资料,2Cu2+ + 4I- === 2CuI↓ + I2,[Cu(NH3)2]+(无色)容易被空气氧化。用离子方程式
解释步骤 b 的溶液中发生的变化: 。
③ 结合实验 III,推测实验 I 和 II 中的白色沉淀可能是 CuI,实验 I 中铜被氧化的化学方程式
是 。分别取实验 I 和 II 充分反应后的固体,洗涤后得到白色沉淀,加入浓 KI 溶液,
(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 。
(2)上述实验结果,I2仅将 Cu 氧化为+1 价。在隔绝空气的条件下进行电化学实验,证实了 I2能将 Cu
氧化为 Cu2+。运用氧化还原反应规律,分析实验 I-III 中 Cu 被 I2氧化只得到+1 价的原因: 。
19.(12 分)某小组探究 Fe2S3 的制备。配制 0.1 mol·L-1 的 FeCl3 溶液和 0.1 mol·L-1 的 Na2S 溶液备用。
【查阅资料】i. FeS,Fe2S3 均为黑色固体,难溶于水。
ii. Fe3+ + 6F [FeF6]3- , [FeF6]3- 为无色离子。
iii. 硫单质微溶于乙醇,难溶于水。
7 / 8
【设计并实施实验】
编号 实验一 实验二
操作
迅速产生黑色沉淀 a,振荡后黑色沉淀溶解,并产生
现象 产生棕黑色沉淀
有臭鸡蛋气味的气体,最终得到棕黄色浊液 X
(1)实验一中,根据复分解反应规律推测,生成黑色沉淀 a 的离子方程式为___________。
(2)进一步检验浊液 X 的组成,过程如下。
① 通过对浊液 X 组成的检验,推测实验一的黑色沉淀 a 溶解过程中有氧化还原反应发生,实验证据
是_________。
② 经检测,黑色固体 b 中含有 FeS。甲同学认为,FeS 是由红褐色清液中的 Fe2+,与加入的 S2-反应产
生的。乙同学认为该推测不严谨,理由是_________。
(3)实验二制得了 Fe2S3,但其中含少量 Fe(OH)3。
①生成 Fe(OH)3的离子方程式为___________。
②从化学反应速率角度推测实验二的棕黑色沉淀中不含 S 的原因:__________。
实验三 小组同学进行如下图所示的改进实验。经检验,黑色沉淀 c 为纯净的 Fe2S3。
(4)实验三中,由无色清液生成 Fe2S3 的离子方程式为___________。
【反思与评价】
(5)对比三个实验,实验三能成功制备 Fe2S3的原因是___________。
8 / 8
同课章节目录
