4.1 化学式 课件(共69张PPT)
图片预览










文档简介
(共69张PPT)
第四单元
化学式与化学方程式
4.1化学式
标签上“H2O”这这个符号有什么含义
H表示氢元素、(表示氧元素,数字“2”表示什么呢
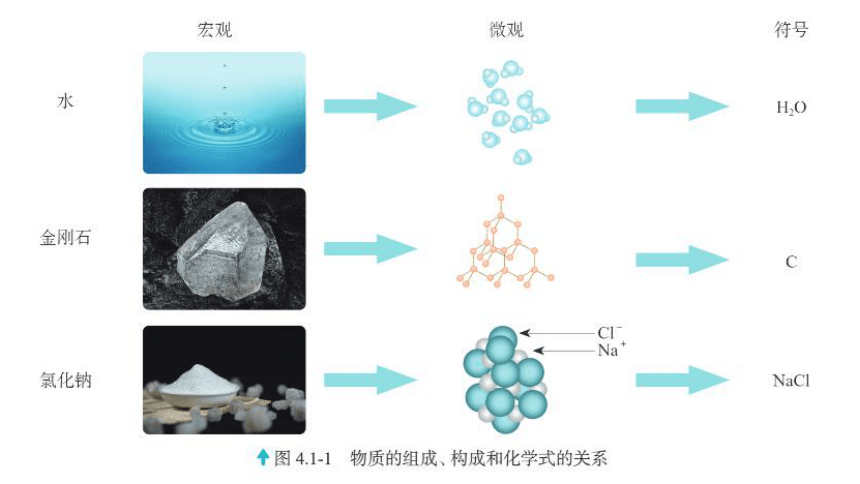
怎样表示物质的组成与构成
讨论与交流 >>>
你能从上述化学式表示物质组成与构成的方法中,总结出化学式的含义吗
化学式可以从宏观和微观的视角表示物质的组成与构成。
如图 4.1-2 中“H2O”从宏观、微观的视角可以表示各种含义。
表示水这种物质
宏观
表示水由氢元素和氧元素组成。
表示1个水分子
宏观
表示1个水分子由2个氢原子和1个氧原子构成。
怎样书写单质的化学式
例如:氧气(O2)、氯气(Cl2)、
氮气(N2)、臭氧(O3)。
怎样书写化合物的化学式
要写出化合物的化学式,除了要知道化合物含有哪些元素外,还要知道元素的化合价。
1.元素的化合价
在由不同元素组成的化合物中,各元素的原子个数比都有确定的数值(如图4.1-3)。
例如:不同元素组成的化合物:
HCl H2O NH3
分子中的原子的个数比:
1:1 2 :1 1:3
不同元素间形成化合物时,它们的原子个数比是不同的,显示了这些元素的某种特性,即元素的化合价。
可以看出,不同元素组成化合物时,它们的原子个数比是不同的,显示了这些元素的某种特性,即元素的化合价。
化学上用化合价来确定化合物中原子或离子之间相互结合的数目。
应当明确的是:
(1)化合价有正价和负价,
金属与非金属形成化合物时,
金属元素显正价 非金属元素显负价。
(2)氢元素通常显+1价,
氧元素通常显-2价,
许多非金属元素与氧元素形成化合物时,则显正价。
(3)部分元素可显不同的化合价
化合价与离子符号的区别与联系
化合价 离子符号
区别 正、负号与数值的位置 标在元素符号或原子团正上方 标在元素符号或原子团右上角
正、负号与数值书写的顺序 正、负号在前数值在后 数值在前正、负号在后
数值是1时 1不能省略 1省略不写
实例 Mg Cl SO4
Mg Cl SO4
联系 同种元素的化合价与离子的电荷,通常数值相等,正负相同,位置不同,写法相反
它们既可分开计算每种元素的化合价,也可合并计算总的化合价。
表4-1列出了部分常见元素或原子团的化合价。
例1 按下表所列的步骤,明确书写水的化学式的方法,进而练习书写氧化铝的化学式。
步骤 写出水的化学式 练习:请写出氧化铝的化学式
1.写出组成化合物的元素符号,一般来说,正价元素居左负价元素居右、
2.标出有关元素的化合价。
3.根据化合物中各种元素化合价代数和等于零的原则确定各元素的原子数目
4.写出化学式。
因为2×(+1)+1× (-2)=0,所以氢的原子数为2,氧的原子数为1
H2O
例2 已知氧化铁的化学式为Fe2O3,其中氧元素为-2价,求氧化铁中铁元素的化合价。
解:根据化合物中各元素的正负化合价代数和为0的原则,设铁的化合价为x,列式:
答:在氧化铁(Fe2O3)中,
铁元素的化合价为+3。
请你求出五氧化二磷(P2O5)中磷元素的化合价:______________
还可以根据化合物中各元素的正负化合价代数和为0的原则,求出多于两种元素组成的化合物中某元素的化合价。
+3
请你再求出 H2SO4 中硫元素的化合价:
______
解:设硫元素的化合价为x
列式: 2×(+1)+x+4×(-2)=0
x=+6
+6
怎样读化合物的化学式
若非金属元素原子为一个,数字“1”不读。
含有原子团的化合物,要读出原子团的名称,如
Ca(OH)2(氢氧化钙) Na2SO4(硫酸钠 )
NH4C1(氯化铵) (NH4)4CO3 ( 碳酸铵 )
金属元素和氢氧根组成的物质,从右往左读作氢氧化某
含有原子团的化合物,要读出原子团的名称,如
Ca(OH)2(氢氧化钙) Na2SO4(硫酸钠 )
NH4C1(氯化铵) (NH4)4CO3 ( 碳酸铵 )
含有酸根的从右往左读作“某酸某”如果阳离子是氢离子,就读作“某酸”
含有原子团的化合物,要读出原子团的名称,如
Ca(OH)2(氢氧化钙) Na2SO4(硫酸钠 )
NH4C1(氯化铵) (NH4)4CO3 ( 碳酸铵 )
NH4+命名时看成一种金属元素。
怎样根据化学式进行计算
例3
水(H2O)的相对分子质量=1×2+16=18
请练习:
碳酸氢铵(NH2HCO3)的相对分子质量
=_________________________
14+1x5+12+16x3=79
例4
计算H2O中氢元素和氧元素的质量比。
解:在 H2O中,氢和氧的原子个数比为2:1,则
氢元素的质量:氧元素的质=(1x2):16=1:8
请练习:H2SO4中各元素的质量比为:
____________________________________
____________________________________
____________________________________
3.计算化合物中某一元素的质量分数
根据化学式,可通过相对分子质量和某一元素的相对原子质量及原子个数,计算化合物中该元素的质量分数,即该元素的质量与组成化合物的各元素质量总和之比。
例5 计算水H2O中氢元素和氧元素的质量比。
解:水中氧元素的质量分数
=×100%
=×100%
=88.9%
答:水中氧元素的质量分数为88.9%
由此可见,化合物中某元素的质量分数就是该元素占有的相对质量与化合物的相对分子质量之比,
计算公式为:
=×100%
化学式可以从宏观和微观的视角表示物质的组成与构成,
也可以从定性和定量的视角表示物质所含元素的种类和质量关系。
1.下列物质的化学式正确的是( )
A.氦气:He2
B.氧化铁:FeO
C.氧化铝:Al2O3
D.碳酸钠:NaCO3
C
2.次氯酸是常见的消毒剂,含有氢、氯、氧三种元素,其中氯元素的化合价为+1价,则次氯酸的化学式为( )。A.HCl
B.HCIO
C. HCIO3
D.HCIO4
B
3.常用药材金银花的有效成分之一绿原酸(化学式为C16H18O9)具有抗菌、抗病毒等作用。下列关于绿原酸的说法正确的是( )。
A.碳、氧元素的质量比为16:9
B.相对分子质量为 258g
C.由3种元素组成 D.由 43 个原子构成
C
4.吸烟危害健康。吸烟时会吸入多种有害气体,其中有一种是氧化物,它所含的氧元素与另一种元素的质量比为4:3,这种气体是( )
A.CO B.NO C.CO3 D.SO2
A
5.根据下列微观粒子图示,写出相应的化学符号。
( ) ( ) ( ) ( ) ( )
H
O
C
2O
O3
2O2
H2O
CO2
6.青少年多饮用牛奶可以保证钙元素的足量摄入,帮助骨骼良好发育。
牛奶中的钙元素主要以磷酸钙[Ca3 (PO4)2]的形式存在。某品牌纯牛奶的标签如图所示.
请回答下列问题
(1)磷酸钙中磷元素的化合价为____________
(2)磷酸钙的相对分子质量为____________
(3)磷酸钙中钙元素的质量分数为____________
+5
310
38.7%
(4)该牛奶中的钙元素约60%来自磷酸钙,请根据标签计算100mL该牛奶中的磷酸钙质量。(结果保留到0.01g)
解:设100 m该牛奶中的磷酸钙质量为x,则其中钙元素的质量
= x××100%=100×60%
x=155mg≈0.16g
答:100mm该牛奶中磷酸钙质量约为0.16g
(5)中国营养学会推荐11~17岁青少年每日应摄入不低于1000 mg的钙,如果全部由这种牛奶提供,每人每天需要喝多少毫升
如果全部由这种牛奶提供,每人每天需要喝1000毫升
(6)根据(5)的计算结果,你觉得这样摄入钙的方式合理吗 请调查了解生活中其他富含钙元素的食物,并就如何合理摄入足量的钙提出自己的建议。
不合理,均衡膳食,多吃豆制品、鱼虾、紫菜等富含钙质的食物。
7.表示一种常见物质,它由钠离子和碳酸氢根离子构成, 化学式“NaHCO3”请读出这个化学式,再找找看哪些生活物品中含有它.
碳酸氢钠
第四单元
化学式与化学方程式
4.1化学式
标签上“H2O”这这个符号有什么含义
H表示氢元素、(表示氧元素,数字“2”表示什么呢
怎样表示物质的组成与构成
讨论与交流 >>>
你能从上述化学式表示物质组成与构成的方法中,总结出化学式的含义吗
化学式可以从宏观和微观的视角表示物质的组成与构成。
如图 4.1-2 中“H2O”从宏观、微观的视角可以表示各种含义。
表示水这种物质
宏观
表示水由氢元素和氧元素组成。
表示1个水分子
宏观
表示1个水分子由2个氢原子和1个氧原子构成。
怎样书写单质的化学式
例如:氧气(O2)、氯气(Cl2)、
氮气(N2)、臭氧(O3)。
怎样书写化合物的化学式
要写出化合物的化学式,除了要知道化合物含有哪些元素外,还要知道元素的化合价。
1.元素的化合价
在由不同元素组成的化合物中,各元素的原子个数比都有确定的数值(如图4.1-3)。
例如:不同元素组成的化合物:
HCl H2O NH3
分子中的原子的个数比:
1:1 2 :1 1:3
不同元素间形成化合物时,它们的原子个数比是不同的,显示了这些元素的某种特性,即元素的化合价。
可以看出,不同元素组成化合物时,它们的原子个数比是不同的,显示了这些元素的某种特性,即元素的化合价。
化学上用化合价来确定化合物中原子或离子之间相互结合的数目。
应当明确的是:
(1)化合价有正价和负价,
金属与非金属形成化合物时,
金属元素显正价 非金属元素显负价。
(2)氢元素通常显+1价,
氧元素通常显-2价,
许多非金属元素与氧元素形成化合物时,则显正价。
(3)部分元素可显不同的化合价
化合价与离子符号的区别与联系
化合价 离子符号
区别 正、负号与数值的位置 标在元素符号或原子团正上方 标在元素符号或原子团右上角
正、负号与数值书写的顺序 正、负号在前数值在后 数值在前正、负号在后
数值是1时 1不能省略 1省略不写
实例 Mg Cl SO4
Mg Cl SO4
联系 同种元素的化合价与离子的电荷,通常数值相等,正负相同,位置不同,写法相反
它们既可分开计算每种元素的化合价,也可合并计算总的化合价。
表4-1列出了部分常见元素或原子团的化合价。
例1 按下表所列的步骤,明确书写水的化学式的方法,进而练习书写氧化铝的化学式。
步骤 写出水的化学式 练习:请写出氧化铝的化学式
1.写出组成化合物的元素符号,一般来说,正价元素居左负价元素居右、
2.标出有关元素的化合价。
3.根据化合物中各种元素化合价代数和等于零的原则确定各元素的原子数目
4.写出化学式。
因为2×(+1)+1× (-2)=0,所以氢的原子数为2,氧的原子数为1
H2O
例2 已知氧化铁的化学式为Fe2O3,其中氧元素为-2价,求氧化铁中铁元素的化合价。
解:根据化合物中各元素的正负化合价代数和为0的原则,设铁的化合价为x,列式:
答:在氧化铁(Fe2O3)中,
铁元素的化合价为+3。
请你求出五氧化二磷(P2O5)中磷元素的化合价:______________
还可以根据化合物中各元素的正负化合价代数和为0的原则,求出多于两种元素组成的化合物中某元素的化合价。
+3
请你再求出 H2SO4 中硫元素的化合价:
______
解:设硫元素的化合价为x
列式: 2×(+1)+x+4×(-2)=0
x=+6
+6
怎样读化合物的化学式
若非金属元素原子为一个,数字“1”不读。
含有原子团的化合物,要读出原子团的名称,如
Ca(OH)2(氢氧化钙) Na2SO4(硫酸钠 )
NH4C1(氯化铵) (NH4)4CO3 ( 碳酸铵 )
金属元素和氢氧根组成的物质,从右往左读作氢氧化某
含有原子团的化合物,要读出原子团的名称,如
Ca(OH)2(氢氧化钙) Na2SO4(硫酸钠 )
NH4C1(氯化铵) (NH4)4CO3 ( 碳酸铵 )
含有酸根的从右往左读作“某酸某”如果阳离子是氢离子,就读作“某酸”
含有原子团的化合物,要读出原子团的名称,如
Ca(OH)2(氢氧化钙) Na2SO4(硫酸钠 )
NH4C1(氯化铵) (NH4)4CO3 ( 碳酸铵 )
NH4+命名时看成一种金属元素。
怎样根据化学式进行计算
例3
水(H2O)的相对分子质量=1×2+16=18
请练习:
碳酸氢铵(NH2HCO3)的相对分子质量
=_________________________
14+1x5+12+16x3=79
例4
计算H2O中氢元素和氧元素的质量比。
解:在 H2O中,氢和氧的原子个数比为2:1,则
氢元素的质量:氧元素的质=(1x2):16=1:8
请练习:H2SO4中各元素的质量比为:
____________________________________
____________________________________
____________________________________
3.计算化合物中某一元素的质量分数
根据化学式,可通过相对分子质量和某一元素的相对原子质量及原子个数,计算化合物中该元素的质量分数,即该元素的质量与组成化合物的各元素质量总和之比。
例5 计算水H2O中氢元素和氧元素的质量比。
解:水中氧元素的质量分数
=×100%
=×100%
=88.9%
答:水中氧元素的质量分数为88.9%
由此可见,化合物中某元素的质量分数就是该元素占有的相对质量与化合物的相对分子质量之比,
计算公式为:
=×100%
化学式可以从宏观和微观的视角表示物质的组成与构成,
也可以从定性和定量的视角表示物质所含元素的种类和质量关系。
1.下列物质的化学式正确的是( )
A.氦气:He2
B.氧化铁:FeO
C.氧化铝:Al2O3
D.碳酸钠:NaCO3
C
2.次氯酸是常见的消毒剂,含有氢、氯、氧三种元素,其中氯元素的化合价为+1价,则次氯酸的化学式为( )。A.HCl
B.HCIO
C. HCIO3
D.HCIO4
B
3.常用药材金银花的有效成分之一绿原酸(化学式为C16H18O9)具有抗菌、抗病毒等作用。下列关于绿原酸的说法正确的是( )。
A.碳、氧元素的质量比为16:9
B.相对分子质量为 258g
C.由3种元素组成 D.由 43 个原子构成
C
4.吸烟危害健康。吸烟时会吸入多种有害气体,其中有一种是氧化物,它所含的氧元素与另一种元素的质量比为4:3,这种气体是( )
A.CO B.NO C.CO3 D.SO2
A
5.根据下列微观粒子图示,写出相应的化学符号。
( ) ( ) ( ) ( ) ( )
H
O
C
2O
O3
2O2
H2O
CO2
6.青少年多饮用牛奶可以保证钙元素的足量摄入,帮助骨骼良好发育。
牛奶中的钙元素主要以磷酸钙[Ca3 (PO4)2]的形式存在。某品牌纯牛奶的标签如图所示.
请回答下列问题
(1)磷酸钙中磷元素的化合价为____________
(2)磷酸钙的相对分子质量为____________
(3)磷酸钙中钙元素的质量分数为____________
+5
310
38.7%
(4)该牛奶中的钙元素约60%来自磷酸钙,请根据标签计算100mL该牛奶中的磷酸钙质量。(结果保留到0.01g)
解:设100 m该牛奶中的磷酸钙质量为x,则其中钙元素的质量
= x××100%=100×60%
x=155mg≈0.16g
答:100mm该牛奶中磷酸钙质量约为0.16g
(5)中国营养学会推荐11~17岁青少年每日应摄入不低于1000 mg的钙,如果全部由这种牛奶提供,每人每天需要喝多少毫升
如果全部由这种牛奶提供,每人每天需要喝1000毫升
(6)根据(5)的计算结果,你觉得这样摄入钙的方式合理吗 请调查了解生活中其他富含钙元素的食物,并就如何合理摄入足量的钙提出自己的建议。
不合理,均衡膳食,多吃豆制品、鱼虾、紫菜等富含钙质的食物。
7.表示一种常见物质,它由钠离子和碳酸氢根离子构成, 化学式“NaHCO3”请读出这个化学式,再找找看哪些生活物品中含有它.
碳酸氢钠
同课章节目录
