4.3 化学方程式 课件(共78张PPT)
文档属性
| 名称 | 4.3 化学方程式 课件(共78张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-16 22:17:18 | ||
图片预览









文档简介
(共78张PPT)
第四单元
化学式与化学方程式
4.3 化学方程式
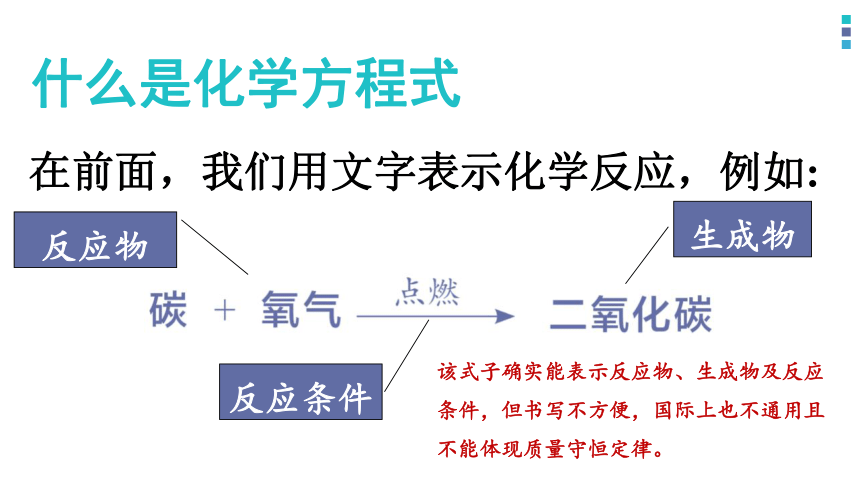
什么是化学方程式
在前面,我们用文字表示化学反应,例如:
反应物
反应条件
生成物
该式子确实能表示反应物、生成物及反应条件,但书写不方便,国际上也不通用且不能体现质量守恒定律。
这种式子只能表示哪些物质发生反应,生成了什么物质。
但不能表示反应过程的质量关系,而且不简明,不利于国际交流。
因此化学家们采用国际通用的化学式来表示化学反应。
例如,上述反应可表示为:
1.定义 :
用__________化学式,表示化学反应的式子,叫作化学方程式又叫 ______________反应方程式,简称________
反应方程式
化学式
反应式
其中,参加反应的物质,叫作________
化学反应后产生的物质,叫作________
反应物
生成物
化学方程式有什么意义呢
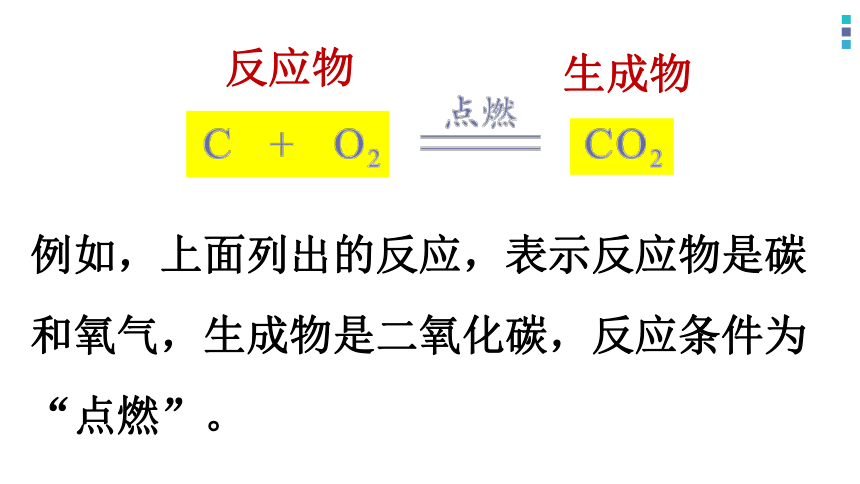
首先,从定性视角认识,化学方程式表明了反应物、生成物和反应条件。
例如,上面列出的反应,表示反应物是碳和氧气,生成物是二氧化碳,反应条件为“点燃”。
反应物
生成物
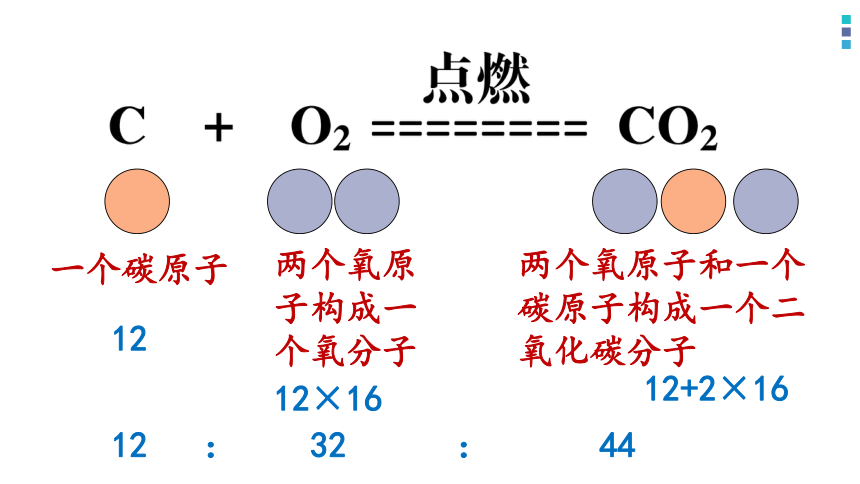
其次,从定量视角认识,微观上化学方程式表示了反应中构成各物质的微观粒子间的数量关系,宏观上表示质量关系。
仍以上述反应为例:
一个碳原子
两个氧原子构成一个氧分子
两个氧原子和一个碳原子构成一个二氧化碳分子
12
12×16
12+2×16
12 : 32 : 44
很明显,
每12份质量的碳与32份质量的氧气恰好完全反应
生成44份质量的二氧化碳
这符合质量守恒定律
从定性的角度认识,表明了______\______
____________
从定量的角度认识
表示各物质的______________
表示各物质的______________
讨论与交流 >>>
①根据电解水的化学方程式:
说出该反应式可以表示哪些含义。
②你认为书写化学方程式的依据是什么
链接
《化学》第二单元 2.4[实验 2-5 ]水的组成及变化的探究
什么是化学方程式
书写化学方程式要遵循两个原则:
一是以科学实验的事实为根据,写出反应物和生成物的化学式,以及反应条件;
二是以质量守恒定律为根据,等号两边各种原子的种类和数目必须相同。
现在,请你进行化学方程式的书写练习。
步骤 示例 请练习
1.根据实验事实,在左、右两边分别写反应物和尘成物的化学式。
步骤 示例 请练习
2.根据质量守恒定律进行配平,即在有关化学式前配上适当的化学计量数,使反应前后各元素的原子个数相等。
3.标明反应条件和生成物状态
要保证所写的化学方程式遵循质量守恒定律,关键在于掌握正确的配平方法。
图 4.3-1为你介绍常见的最小公倍数法。
另外,在第三个步骤中,如果反应物中没有气体,而生成物有气体,则后者用“↑”号标明。溶液中的反应,如果反应物中没有难溶物质,而在生成物中有沉淀,则后者用“↓”号标明。
例如:
固
固
固
气
液
液
固
液
化学方程式是用化学式表示化学反应的式子,可以表示反应中的质量关系、比例关系。
书写时要根据事实并注意配平,适当标明反应条件和生成物状态。
表 4-2 化学方程式所用符号
1.写出 KClO3在 MnO2催化下加热分解成 KCl和O2的化学方程式:
2.在化学方程式 2XY2+Y2======2Z中,代号乙的化学式是( )
A.XY B.XY2 C. X2Y D.XY3
D
什么是化学方程式
既然化学方程式不仅能表明反应物的质量总和与生成物质量总和相等的规律,而且还能表示各反应物与生成物之问的质量关系。
你便可以根据化学方程式进行一系列的化学计算,从质量关系与比例关系的角度探究化学变化。
例如,计算投入一定质量的原料(反应物),可以生产多少产品(生成物),或反过来计算要生产一定质量的产品,应投放多少原料等。
值得注意的是
按化学方程式的反应物或生成物进行计算时都必须是纯净物的质量。
1.根据反应物的质量求生成物的质量
例1 在实验室中,将含有13.6g过氧化氢的溶液与少量二氧化锰混合求过氧化氢完全分解生成的氧气质量是多少。
解题步骤 书写格式
设未知量 解:设生成氧气的质量为x。
确定根据,即写出化学方程式
找相关量,即列出与计算相关的量
列比例式
求未知量
回答问题
2.根据生成物的质量求反应物的质量
例2 用加热氯酸钾与少量二氧化锰混合物的方法,制得气9.6g,求被分解的氯酸钾的质量是多少。
解题步骤 练习解答
设未知量
确定根据,即写出化学方程式
找相关量,即列出与计算相关的量
列比例式
求未知量
回答问题
3.反应物(或生成物)之间质量互求
例3 工业上高温煅烧石灰石(按CaCO3纯净物计算),可制得生石灰(按CaO纯净物计算),同时会产生大量的二氧化碳。试计算每制得100t氧化钙的同时会产生二氧化碳多少吨。
解题步骤 练习解答
设未知量
确定根据,即写出化学方程式
找相关量,即列出与计算相关的量
列比例式
求未知量
回答问题
1.下列关于化学方程式 4Al +3O3 ==== 2Al3O3的叙述中,正确的是( )。
A.读作铝加氧气等于氧化铝
B.表示氧化铝分解生成铝和氧气
C.表示4个铝和3个氧气在点燃的条件下生成2个氧化铝
D.表示每108份质量的铝恰好与96份质量的氧气完全反应,生成204份质量的氧化铝.
点燃
C
2.下列化学方程式书写正确的是( )
C
3.长征二号F遥十四运载火箭使用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)点燃作推进剂,有关反应的化学方程式为C2H8N2 + N2O4 ======= 2CO2 +3X + 4H2O,
X的化学式是_________________.
点燃
N2
4.配平下列化学方程式。
(1)P+O2 ——P2O5
(2) P2O5 + H2O —— H3PO4
(3)C+ CO2 ——CO
(4)CH3OH +O2 —— CO2 + H2O
点燃
高温
5.写出下列反应的化学方程式,计算反应中各物质的质量比
(1)氢气在氧气中燃烧,生成水。
(2)氧化汞受热分解生成汞和氧气,
(3)氢氧化钠溶液和硫酸铜溶液反应,生成氢氧化铜沉淀和硫酸钠溶液
6.2021年9月,我国科学家首次实现了二氧化碳到淀粉的人工合成。其过程为:
在催化剂的作用下,将二氧化碳和氢气转化为甲醇(CH3OH)和水再经过复杂的反应将甲醇转化为淀粉。
若制取1.6kg甲醇,需要多少千克二氧化碳
7.大量植树造林是缓解气候变暖的有效方法,若一棵树一天能吸收12kg的二氧化碳,那么一棵树一年(按365天计算)可吸收多少吨含质量分数为80% 的煤完全燃烧生成的二氧化碳
8.学校实验室要购买高锰酸钾完成氧气的制取与性质实验。有300名学生参加该实验,每组2人且需制取4瓶氧气(集气瓶容积为500mL)。请你帮助实验员完成下列购买高锰酸钾的预算单,并写出计算过程。(氧气的密度为1.43 g·L-1)
药品名称
高锰酸钾
认识化学反应的角度
定性
定量
物质 A+物质 B → 5物质 C +物质 D
反应物的总质量_______生成物的总质量
宏观
一、基础性练习
1.臭氧是由氧元素组成的一种单质,每个分子中含有3个原子,下列化学式能表示3个臭氧分子的是( )。
A. O3 B.3O3 C. O3+ D. 3O
B
2.下列各组含氯物质中,氯元素化合价相同的一组是( )
A.Cl3 HCl
B.NaCl HClO
C.ClO2 NaClO2
D.KClO2 Ca(ClO3)2
D
3.前面学习了几种用化学原理制氧气的方法,这些方法用化学方程式表示如下,正确的是( )
C
4.2021年12月9日,“天宫课堂”第一课上,太空教师王亚平做了一个有趣的实验:把泡腾片放进水球中,产生了许多欢乐的小气泡。如图是有关“泡腾片”成分的相关信息,
则实验中产生的气体不可能是( )
A.N3
B. CO2
C. O2
D.CH4
A
5.化学研究小组为探究口罩中熔喷布的元素组成,将4.2g该熔喷布在氧气中完全燃烧,生成5.4g水和13.2g二氧化碳,由此推知熔喷布( )
一定含碳、氢、氧元素
B.一定含碳、氢元素,不含氧元素
C.一定含碳、氢元素,可能含氧元素 D.无法确定
B
6.根据前面所学内容,写出下列反应的化学方程式
(1)为延长白炽灯的使用寿命,灯泡内常放入极少量的红磷
(2)燃放含硫黄的烟花爆竹时,会产生一种刺激性的气味
(3)点燃木炭为烧烤做准备:
(4)照明弹发出强光是因为镁粉被点燃,在空气中燃烧
(5)某金属在氧气中燃烧,现象为剧烈燃烧,火星四射
(6)液体加固体在常温下制氧气
(7)用某白色固体制氧气
(8)用某紫黑色固体制氧气
7.某有机物燃烧的化学方程式是
则x=_______ y=________
2
2
8.某实验室需用氧气做实验,现将 26.5g氯酸钾与3.5g二氧化锰的混合物加热一定时间后,冷却称量剩余固体为20.4g,请回答
(1)制得氧气质量为______ g。
9.6
(2)剩余固体中存在哪些物质 各为多少
2KClO3====2KCl + 3O2↑
149 96
x 9.6g
MnO2
△
x==14.9g
因为14.9g+3.5g=18.4g<20.4g
所以剩余固体中还存在氯酸钾
质量为20.4g-18.4g=2g
答:剩余固体中存在14.9g氯化钾、2g氯酸钾、3.5g二氧化锰。
二、拓展性练习
9.2022年4月16日,神舟十三号载人飞船成功返回地面,圆满完成任务氧气、水、食物等是维持航天员在空间站生存的必需物质。为提高物质的利用率,目前空间站通过以下途径实现物质循环利用。
(1)由图可知,目前空间站通过物质循环获得水的途径共有_______条。其同中氢燃料电池提供水的反应的化学方程式为_______________________同时将______能转化为______能,为飞船提供能量。
(2)空间站获得氧气的原理是___________________________________ (用化学方程式表示)。
4
2H2 +O2 ==== 2H2O
化学
电
2H2O ==== 2H2↑+ O2 ↑
通电
(3)“萨巴蒂尔反应器”可以将核心舱内水电解产生的氢气和航天员呼出的二氧化碳,在一定条件下转化为甲烷和水,如图中反应所示。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约为1.1kg,若这些二氧化碳全部与氢气反应,则可生成多少千克水
解:设可生成水的质量为x。
CO2 + H2 ====== CH4+ 2H2 O
44 36
1.1kg x
一定条件
=0.9kg
答:可生成0.9kg水。
10.某同学把1.8g不纯的过氧化钙样品(杂质不与水反应)加入盛有足量水的烧杯中,发生了反应:
2CaO2 +2H2O======2Ca(OH)2+O2↑完全反应后,生成了0.224L氧气(密度为1.43g·L-1)。
请计算:
(1)生成氧气的质量(精确到0.01g)
解:生成氧气的质量为0.224L×1.43g·L-1=0.32g。
(2)该样品中过氧化钙的质量分数。
解:设参加反应的过氧化钙质量为x
2CaO2+2H2O======2Ca(OH)2+O2↑
144 32
x 0.32g
x==1.44g
则该样品中过氧化钙的质量分数=×100%=80%
11.19世纪末,人们已经知道将食盐水电解可制得氢氧化钠、氯气和氢气,这种方法可制得很纯的氢氧化钠,反应的化学方程式为
2NaCl+2H2O======2NaOH+Cl2↑+H2↑
所得的 H2和Cl2可以用于制造用点燃途广泛的
HCl:Cl2+H2======2HCl.
通电
请回答下列问题。
(1)从理论上计算,1170kg食盐(按NaCl的纯物质计算)能生产氢氧化钠、氯气和氢气各多少千克
解:设能生产氢氧化钠、氯气和氢气的质量分别为x,y,z
2NaCl+2H2O=======2NaOH+Cl2↑+H2↑
117 80 71 2
1170kg x y z
解:能生产800kg氢氧化钠、710kg氯气和20kg氢气
通电
x=800kg y=710kg
z=20kg
(2)利用(1)中所得的氯气和氢气能否制得 730 kg氯化氢 不用化学方程式也能直接准确地算出来,为什么
解:能,因为(1)中生成氯气710kg、氢气20kg,二者恰好完全反应,根据质量守恒定律可得,生成的氯化氢的质量为710kg+20kg=730kg.
三、实践性练习
12.利用生活中的物品组装反应装置,利用小苏打和白醋的反应证明质量守恒定律,并将你的实验过程录制成视频与同学分享。
第四单元
化学式与化学方程式
4.3 化学方程式
什么是化学方程式
在前面,我们用文字表示化学反应,例如:
反应物
反应条件
生成物
该式子确实能表示反应物、生成物及反应条件,但书写不方便,国际上也不通用且不能体现质量守恒定律。
这种式子只能表示哪些物质发生反应,生成了什么物质。
但不能表示反应过程的质量关系,而且不简明,不利于国际交流。
因此化学家们采用国际通用的化学式来表示化学反应。
例如,上述反应可表示为:
1.定义 :
用__________化学式,表示化学反应的式子,叫作化学方程式又叫 ______________反应方程式,简称________
反应方程式
化学式
反应式
其中,参加反应的物质,叫作________
化学反应后产生的物质,叫作________
反应物
生成物
化学方程式有什么意义呢
首先,从定性视角认识,化学方程式表明了反应物、生成物和反应条件。
例如,上面列出的反应,表示反应物是碳和氧气,生成物是二氧化碳,反应条件为“点燃”。
反应物
生成物
其次,从定量视角认识,微观上化学方程式表示了反应中构成各物质的微观粒子间的数量关系,宏观上表示质量关系。
仍以上述反应为例:
一个碳原子
两个氧原子构成一个氧分子
两个氧原子和一个碳原子构成一个二氧化碳分子
12
12×16
12+2×16
12 : 32 : 44
很明显,
每12份质量的碳与32份质量的氧气恰好完全反应
生成44份质量的二氧化碳
这符合质量守恒定律
从定性的角度认识,表明了______\______
____________
从定量的角度认识
表示各物质的______________
表示各物质的______________
讨论与交流 >>>
①根据电解水的化学方程式:
说出该反应式可以表示哪些含义。
②你认为书写化学方程式的依据是什么
链接
《化学》第二单元 2.4[实验 2-5 ]水的组成及变化的探究
什么是化学方程式
书写化学方程式要遵循两个原则:
一是以科学实验的事实为根据,写出反应物和生成物的化学式,以及反应条件;
二是以质量守恒定律为根据,等号两边各种原子的种类和数目必须相同。
现在,请你进行化学方程式的书写练习。
步骤 示例 请练习
1.根据实验事实,在左、右两边分别写反应物和尘成物的化学式。
步骤 示例 请练习
2.根据质量守恒定律进行配平,即在有关化学式前配上适当的化学计量数,使反应前后各元素的原子个数相等。
3.标明反应条件和生成物状态
要保证所写的化学方程式遵循质量守恒定律,关键在于掌握正确的配平方法。
图 4.3-1为你介绍常见的最小公倍数法。
另外,在第三个步骤中,如果反应物中没有气体,而生成物有气体,则后者用“↑”号标明。溶液中的反应,如果反应物中没有难溶物质,而在生成物中有沉淀,则后者用“↓”号标明。
例如:
固
固
固
气
液
液
固
液
化学方程式是用化学式表示化学反应的式子,可以表示反应中的质量关系、比例关系。
书写时要根据事实并注意配平,适当标明反应条件和生成物状态。
表 4-2 化学方程式所用符号
1.写出 KClO3在 MnO2催化下加热分解成 KCl和O2的化学方程式:
2.在化学方程式 2XY2+Y2======2Z中,代号乙的化学式是( )
A.XY B.XY2 C. X2Y D.XY3
D
什么是化学方程式
既然化学方程式不仅能表明反应物的质量总和与生成物质量总和相等的规律,而且还能表示各反应物与生成物之问的质量关系。
你便可以根据化学方程式进行一系列的化学计算,从质量关系与比例关系的角度探究化学变化。
例如,计算投入一定质量的原料(反应物),可以生产多少产品(生成物),或反过来计算要生产一定质量的产品,应投放多少原料等。
值得注意的是
按化学方程式的反应物或生成物进行计算时都必须是纯净物的质量。
1.根据反应物的质量求生成物的质量
例1 在实验室中,将含有13.6g过氧化氢的溶液与少量二氧化锰混合求过氧化氢完全分解生成的氧气质量是多少。
解题步骤 书写格式
设未知量 解:设生成氧气的质量为x。
确定根据,即写出化学方程式
找相关量,即列出与计算相关的量
列比例式
求未知量
回答问题
2.根据生成物的质量求反应物的质量
例2 用加热氯酸钾与少量二氧化锰混合物的方法,制得气9.6g,求被分解的氯酸钾的质量是多少。
解题步骤 练习解答
设未知量
确定根据,即写出化学方程式
找相关量,即列出与计算相关的量
列比例式
求未知量
回答问题
3.反应物(或生成物)之间质量互求
例3 工业上高温煅烧石灰石(按CaCO3纯净物计算),可制得生石灰(按CaO纯净物计算),同时会产生大量的二氧化碳。试计算每制得100t氧化钙的同时会产生二氧化碳多少吨。
解题步骤 练习解答
设未知量
确定根据,即写出化学方程式
找相关量,即列出与计算相关的量
列比例式
求未知量
回答问题
1.下列关于化学方程式 4Al +3O3 ==== 2Al3O3的叙述中,正确的是( )。
A.读作铝加氧气等于氧化铝
B.表示氧化铝分解生成铝和氧气
C.表示4个铝和3个氧气在点燃的条件下生成2个氧化铝
D.表示每108份质量的铝恰好与96份质量的氧气完全反应,生成204份质量的氧化铝.
点燃
C
2.下列化学方程式书写正确的是( )
C
3.长征二号F遥十四运载火箭使用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)点燃作推进剂,有关反应的化学方程式为C2H8N2 + N2O4 ======= 2CO2 +3X + 4H2O,
X的化学式是_________________.
点燃
N2
4.配平下列化学方程式。
(1)P+O2 ——P2O5
(2) P2O5 + H2O —— H3PO4
(3)C+ CO2 ——CO
(4)CH3OH +O2 —— CO2 + H2O
点燃
高温
5.写出下列反应的化学方程式,计算反应中各物质的质量比
(1)氢气在氧气中燃烧,生成水。
(2)氧化汞受热分解生成汞和氧气,
(3)氢氧化钠溶液和硫酸铜溶液反应,生成氢氧化铜沉淀和硫酸钠溶液
6.2021年9月,我国科学家首次实现了二氧化碳到淀粉的人工合成。其过程为:
在催化剂的作用下,将二氧化碳和氢气转化为甲醇(CH3OH)和水再经过复杂的反应将甲醇转化为淀粉。
若制取1.6kg甲醇,需要多少千克二氧化碳
7.大量植树造林是缓解气候变暖的有效方法,若一棵树一天能吸收12kg的二氧化碳,那么一棵树一年(按365天计算)可吸收多少吨含质量分数为80% 的煤完全燃烧生成的二氧化碳
8.学校实验室要购买高锰酸钾完成氧气的制取与性质实验。有300名学生参加该实验,每组2人且需制取4瓶氧气(集气瓶容积为500mL)。请你帮助实验员完成下列购买高锰酸钾的预算单,并写出计算过程。(氧气的密度为1.43 g·L-1)
药品名称
高锰酸钾
认识化学反应的角度
定性
定量
物质 A+物质 B → 5物质 C +物质 D
反应物的总质量_______生成物的总质量
宏观
一、基础性练习
1.臭氧是由氧元素组成的一种单质,每个分子中含有3个原子,下列化学式能表示3个臭氧分子的是( )。
A. O3 B.3O3 C. O3+ D. 3O
B
2.下列各组含氯物质中,氯元素化合价相同的一组是( )
A.Cl3 HCl
B.NaCl HClO
C.ClO2 NaClO2
D.KClO2 Ca(ClO3)2
D
3.前面学习了几种用化学原理制氧气的方法,这些方法用化学方程式表示如下,正确的是( )
C
4.2021年12月9日,“天宫课堂”第一课上,太空教师王亚平做了一个有趣的实验:把泡腾片放进水球中,产生了许多欢乐的小气泡。如图是有关“泡腾片”成分的相关信息,
则实验中产生的气体不可能是( )
A.N3
B. CO2
C. O2
D.CH4
A
5.化学研究小组为探究口罩中熔喷布的元素组成,将4.2g该熔喷布在氧气中完全燃烧,生成5.4g水和13.2g二氧化碳,由此推知熔喷布( )
一定含碳、氢、氧元素
B.一定含碳、氢元素,不含氧元素
C.一定含碳、氢元素,可能含氧元素 D.无法确定
B
6.根据前面所学内容,写出下列反应的化学方程式
(1)为延长白炽灯的使用寿命,灯泡内常放入极少量的红磷
(2)燃放含硫黄的烟花爆竹时,会产生一种刺激性的气味
(3)点燃木炭为烧烤做准备:
(4)照明弹发出强光是因为镁粉被点燃,在空气中燃烧
(5)某金属在氧气中燃烧,现象为剧烈燃烧,火星四射
(6)液体加固体在常温下制氧气
(7)用某白色固体制氧气
(8)用某紫黑色固体制氧气
7.某有机物燃烧的化学方程式是
则x=_______ y=________
2
2
8.某实验室需用氧气做实验,现将 26.5g氯酸钾与3.5g二氧化锰的混合物加热一定时间后,冷却称量剩余固体为20.4g,请回答
(1)制得氧气质量为______ g。
9.6
(2)剩余固体中存在哪些物质 各为多少
2KClO3====2KCl + 3O2↑
149 96
x 9.6g
MnO2
△
x==14.9g
因为14.9g+3.5g=18.4g<20.4g
所以剩余固体中还存在氯酸钾
质量为20.4g-18.4g=2g
答:剩余固体中存在14.9g氯化钾、2g氯酸钾、3.5g二氧化锰。
二、拓展性练习
9.2022年4月16日,神舟十三号载人飞船成功返回地面,圆满完成任务氧气、水、食物等是维持航天员在空间站生存的必需物质。为提高物质的利用率,目前空间站通过以下途径实现物质循环利用。
(1)由图可知,目前空间站通过物质循环获得水的途径共有_______条。其同中氢燃料电池提供水的反应的化学方程式为_______________________同时将______能转化为______能,为飞船提供能量。
(2)空间站获得氧气的原理是___________________________________ (用化学方程式表示)。
4
2H2 +O2 ==== 2H2O
化学
电
2H2O ==== 2H2↑+ O2 ↑
通电
(3)“萨巴蒂尔反应器”可以将核心舱内水电解产生的氢气和航天员呼出的二氧化碳,在一定条件下转化为甲烷和水,如图中反应所示。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约为1.1kg,若这些二氧化碳全部与氢气反应,则可生成多少千克水
解:设可生成水的质量为x。
CO2 + H2 ====== CH4+ 2H2 O
44 36
1.1kg x
一定条件
=0.9kg
答:可生成0.9kg水。
10.某同学把1.8g不纯的过氧化钙样品(杂质不与水反应)加入盛有足量水的烧杯中,发生了反应:
2CaO2 +2H2O======2Ca(OH)2+O2↑完全反应后,生成了0.224L氧气(密度为1.43g·L-1)。
请计算:
(1)生成氧气的质量(精确到0.01g)
解:生成氧气的质量为0.224L×1.43g·L-1=0.32g。
(2)该样品中过氧化钙的质量分数。
解:设参加反应的过氧化钙质量为x
2CaO2+2H2O======2Ca(OH)2+O2↑
144 32
x 0.32g
x==1.44g
则该样品中过氧化钙的质量分数=×100%=80%
11.19世纪末,人们已经知道将食盐水电解可制得氢氧化钠、氯气和氢气,这种方法可制得很纯的氢氧化钠,反应的化学方程式为
2NaCl+2H2O======2NaOH+Cl2↑+H2↑
所得的 H2和Cl2可以用于制造用点燃途广泛的
HCl:Cl2+H2======2HCl.
通电
请回答下列问题。
(1)从理论上计算,1170kg食盐(按NaCl的纯物质计算)能生产氢氧化钠、氯气和氢气各多少千克
解:设能生产氢氧化钠、氯气和氢气的质量分别为x,y,z
2NaCl+2H2O=======2NaOH+Cl2↑+H2↑
117 80 71 2
1170kg x y z
解:能生产800kg氢氧化钠、710kg氯气和20kg氢气
通电
x=800kg y=710kg
z=20kg
(2)利用(1)中所得的氯气和氢气能否制得 730 kg氯化氢 不用化学方程式也能直接准确地算出来,为什么
解:能,因为(1)中生成氯气710kg、氢气20kg,二者恰好完全反应,根据质量守恒定律可得,生成的氯化氢的质量为710kg+20kg=730kg.
三、实践性练习
12.利用生活中的物品组装反应装置,利用小苏打和白醋的反应证明质量守恒定律,并将你的实验过程录制成视频与同学分享。
同课章节目录
