高考化学化学反应速率与化学平衡专题复习真题分类汇编2020-2024
文档属性
| 名称 | 高考化学化学反应速率与化学平衡专题复习真题分类汇编2020-2024 |  | |
| 格式 | docx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-18 08:48:53 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
专题14 化学反应速率与化学平衡
考向 五年考情(2020-2024) 命题趋势
考点一 化学反应速率 2024·甘肃卷;2024·江苏卷;2024·安徽卷;2023·山东卷;2021·湖南卷 分析近5年高考化学选择题,对于化学反应速率和化学平衡内容的考查不算太多,这是因为在主观题中,化学反应速率和化学平衡才是考查的重头戏,不过随着新高考单科卷的实行,有关化学反应速率和化学平衡试题的考查在选择题中开始有所增加,考查的核心知识还是有关化学反应速率的比较、计算和影响因素的判断,化学平衡常数、转化率、物质的浓度的计算,以及平衡移动原理的分析等,常结合坐标图像或表格进行考查。
考点二 化学平衡及其移动 2024·浙江6月卷;2023·北京卷;2022·天津卷;2022·重庆卷;2022·江苏卷;2022·浙江卷;2022·北京卷;2022·辽宁卷;2021·浙江卷;2020·江苏卷
考点三 化学反应速率、平衡图像分析 2024·山东卷;2024·河北卷;2024·黑吉辽卷;2024·江苏卷;2024·湖南卷;2023·广东卷;2023·江苏卷;2023·湖南卷;2023·辽宁卷;2023·河北卷;2023·重庆卷;2022·湖南卷;2022·广东卷;2022·广东卷;2022·北京卷;2022·江苏卷;2021·广东卷等
考点一 化学反应速率
1.(2024·甘肃卷)下列措施能降低化学反应速率的是
A.催化氧化氨制备硝酸时加入铂 B.中和滴定时,边滴边摇锥形瓶
C.锌粉和盐酸反应时加水稀释 D.石墨合成金刚石时增大压强
2.(2024·江苏卷)催化剂能改变化学反应速率而不改变反应的焓变,常见倠化剂有金属及其氧化物、酸和碱等。倠化反应广泛存在,如豆科植物固氮、石墨制金刚石、和制(二甲醚)、倠化氧化等。催化剂有选择性,如与反应用Ag催化生成(环氧乙烷)、用催化生成。催化作用能消除污染和影响环境,如汽车尾气处理、废水中电倠化生成、氯自由基催化分解形成臭氧空洞。我国在石油催化领域领先世界,高效、经济、绿色是未来催化剂研究的发展方向。下列说法正确的是
A.豆科植物固氮过程中,固氮酶能提高该反应的活化能
B.与反应中,Ag催化能提高生成的选择性
C.制反应中,能加快化学反应速率
D.与反应中,能减小该反应的焓变
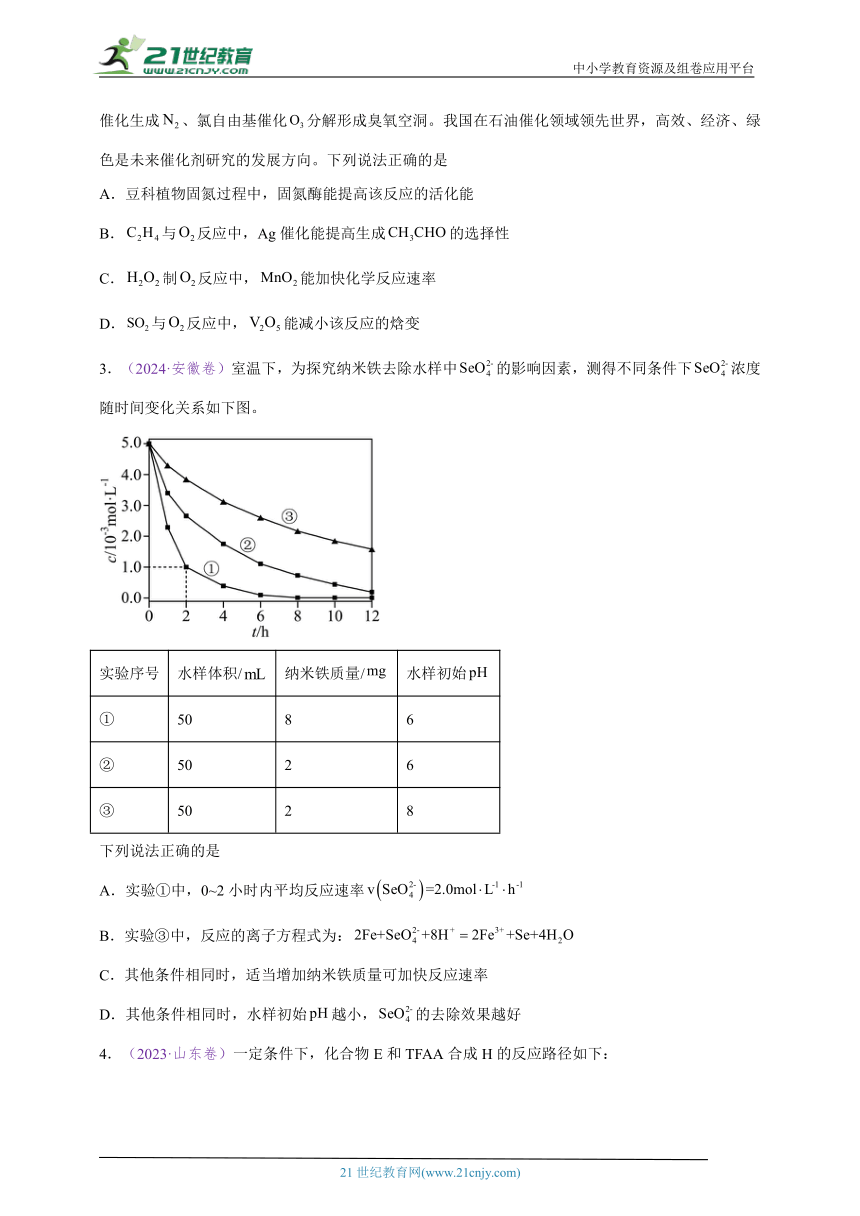
3.(2024·安徽卷)室温下,为探究纳米铁去除水样中的影响因素,测得不同条件下浓度随时间变化关系如下图。
实验序号 水样体积/ 纳米铁质量/ 水样初始
① 50 8 6
② 50 2 6
③ 50 2 8
下列说法正确的是
A.实验①中,0~2小时内平均反应速率
B.实验③中,反应的离子方程式为:
C.其他条件相同时,适当增加纳米铁质量可加快反应速率
D.其他条件相同时,水样初始越小,的去除效果越好
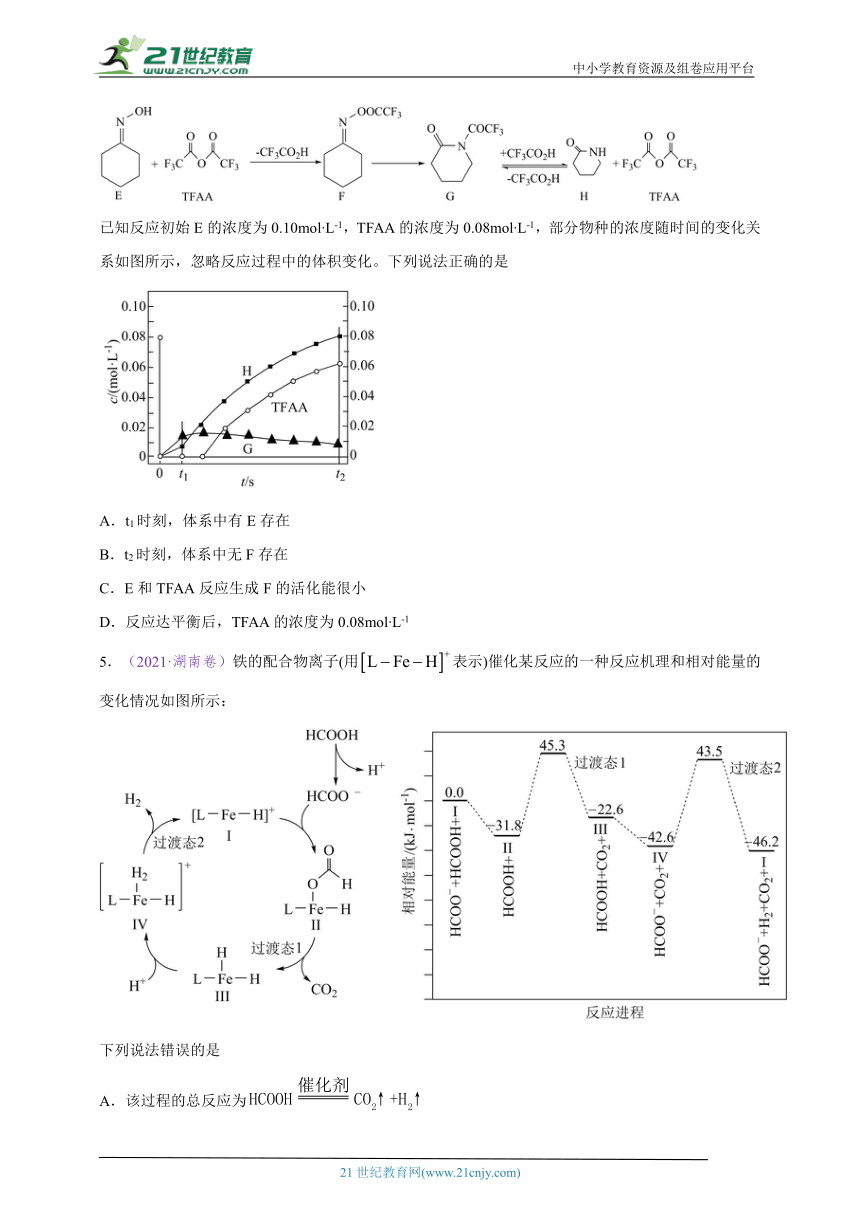
4.(2023·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10mol L-1,TFAA的浓度为0.08mol L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是
A.t1时刻,体系中有E存在
B.t2时刻,体系中无F存在
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08mol L-1
5.(2021·湖南卷)铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是
A.该过程的总反应为
B.浓度过大或者过小,均导致反应速率降低
C.该催化循环中元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
考点二 化学平衡及其移动
6.(2024·浙江6月卷)二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
I.
II.
向容积为的密闭容器中投入和,不同温度下,测得时(反应均未平衡)的相关数据见下表,下列说法不正确的是
温度() 400 500 600
乙烷转化率() 2.2 9.0 17.8
乙烯选择性() 92.6 80.0 61.8
注:乙烯选择性
A.反应活化能:
B.时,反应I的平均速率为:
C.其他条件不变,平衡后及时移除,可提高乙烯的产率
D.其他条件不变,增大投料比投料,平衡后可提高乙烷转化率
7.(2023·北京卷)下列事实能用平衡移动原理解释的是
A.溶液中加入少量固体,促进分解
B.密闭烧瓶内的和的混合气体,受热后颜色加深
C.铁钢放入浓中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀反应过程中,加入少量固体,促进的产生
8.(2022·天津卷)向恒温恒容密闭容器中通入2mol 和1mol ,反应达到平衡后,再通入一定量,达到新平衡时,下列有关判断错误的是
A.的平衡浓度增大 B.反应平衡常数增大
C.正向反应速率增大 D.的转化总量增大
9.(2022·重庆卷)两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) p1=3.6×104Pa
反应2:2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) p2=4×103Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是
A.反应2的平衡常数为4×106Pa2 B.通入NH3,再次平衡后,总压强增大
C.平衡后总压强为4.36×105Pa D.缩小体积,再次平衡后总压强不变
10.(2022·江苏卷)用尿素水解生成的催化还原,是柴油机车辆尾气净化的主要方法。反应为,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中消耗,转移电子的数目为
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
11.(2022·浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
A.实验①,,
B.实验②,时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
12.(2022·北京卷)某多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
已知:
下列说法不正确的是
A.温度升高时不利于吸附
B.多孔材料“固定”,促进平衡正向移动
C.转化为的反应是
D.每获得时,转移电子的数目为
13.(2022·辽宁卷)某温度下,在恒容密闭容器中发生反应,有关数据如下:
时间段/ 产物Z的平均生成速率/
0~2 0.20
0~4 0.15
0~6 0.10
下列说法错误的是
A.时,Z的浓度大于
B.时,加入,此时
C.时,Y的体积分数约为33.3%
D.时,X的物质的量为
14.(2021·浙江卷)一定温度下:在的四氯化碳溶液()中发生分解反应:。在不同时刻测量放出的体积,换算成浓度如下表:
0 600 1200 1710 2220 2820 x
1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是
A.,生成的平均速率为
B.反应时,放出的体积为(标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
15.(2020·浙江卷)一定条件下: 。在测定的相对分子质量时,下列条件中,测定结果误差最小的是( )
A. 温度、压强 B. 温度、压强
C. 温度、压强 D. 温度、压强
16.(2020·浙江卷)溶液与溶液发生反应:,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C. 加入固体,平衡逆向移动
D. 该反应的平衡常数
17.(2020·江苏卷)反应可用于纯硅的制备。下列有关该反应的说法正确的是
A. 该反应 、
B. 该反应的平衡常数
C. 高温下反应每生成1 mol Si需消耗
D 用E表示键能,该反应
考点三 化学反应速率、平衡图像分析
18.(2024·山东卷)逆水气变换反应:。一定压力下,按,物质的量之比投料,,温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为,,温度时反应速率常数k分别为。下列说法错误的是
A.
B.温度下达平衡时反应速率的比值:
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.温度下,改变初始投料比例,可使平衡时各组分摩尔分数与温度时相同
19.(2024·河北卷)在水溶液中,可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与形成配离子达平衡时,与的关系如图。
下列说法正确的是
A.的X、Y转化为配离子时,两溶液中的平衡浓度:
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时
C.由Y和Z分别制备等物质的量的配离子时,消耗的物质的量:
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
20.(2024·黑吉辽卷)异山梨醇是一种由生物质制备的高附加值化学品,时其制备过程及相关物质浓度随时间变化如图所示,后异山梨醇浓度不再变化。下列说法错误的是
A.时,反应②正、逆反应速率相等
B.该温度下的平衡常数:①>②
C.平均速率(异山梨醇)
D.反应②加入催化剂不改变其平衡转化率
21.(2024·江苏卷)二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
①
②
、下,将一定比例、混合气匀速通过装有催化剂的绝热反应管。装置及L1、L2、L3…位点处(相邻位点距离相同)的气体温度、CO和的体积分数如图所示。下列说法正确的是
A.L4处与L5处反应①的平衡常数K相等
B.反应②的焓变
C.L6处的的体积分数大于L5处
D.混合气从起始到通过L1处,CO的生成速率小于的生成速率
22.(2024·湖南卷)恒压下,向某密闭容器中充入一定量的和,发生如下反应:
主反应:
副反应:
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数随投料比x(物质的量之比)的变化关系如图所示,下列说法正确的是
A.投料比x代表
B.曲线c代表乙酸的分布分数
C.,
D.L、M、N三点的平衡常数:
23.(2023·广东卷)催化剂Ⅰ和Ⅱ均能催化反应。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是
A.使用Ⅰ和Ⅱ,反应历程都分4步进行 B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡 D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
24.(2023·海南卷)工业上苯乙烯的生产主要采用乙苯脱氢工艺:。某条件下无催化剂存在时,该反应的正、逆反应速率v随时间t的变化关系如图所示。下列说法正确的是
A.曲线①表示的是逆反应的关系
B.时刻体系处于平衡状态
C.反应进行到时,(为浓度商)
D.催化剂存在时,、都增大
25.(2023·江苏卷)二氧化碳加氢制甲烷过程中的主要反应为
在密闭容器中,、时,平衡转化率、在催化剂作用下反应相同时间所测得的实际转化率随温度的变化如题图所示。的选择性可表示为。下列说法正确的是
A.反应的焓变
B.的平衡选择性随着温度的升高而增加
C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃
D.450℃时,提高的值或增大压强,均能使平衡转化率达到X点的值
26.(2023·湖南卷)向一恒容密闭容器中加入和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A.
B.反应速率:
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
27.(2023·辽宁卷)一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是
A.(Ⅲ)不能氧化
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,(Ⅱ)和(Ⅶ)不能大量共存
D.总反应为:
28.(2023·河北卷)在恒温恒容密闭容器中充入一定量,发生如下反应:
反应②和③的速率方程分别为和,其中分别为反应②和③的速率常数,反应③的活化能大于反应②。测得的浓度随时间的变化如下表。
0 1 2 3 4 5
0.160 0.113 0.080 0.056 0.040 0.028
下列说法正确的是
A.内,X的平均反应速率为
B.若增大容器容积,平衡时Y的产率增大
C.若,平衡时
D.若升高温度,平衡时减小
29.(2023·重庆卷)逆水煤气变换体系中存在以下两个反应:
反应Ⅰ:
反应Ⅱ:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法正确的是
A.反应Ⅰ的,反应Ⅱ的
B.点反应Ⅰ的平衡常数
C.点的压强是的3倍
D.若按投料,则曲线之间交点位置不变
30.(2023·浙江卷)一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
31.(2022·湖南卷)向体积均为1L的两恒容容器中分别充入和发生反应:,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. B.气体的总物质的量:
C.a点平衡常数: D.反应速率:
32.(2022·广东卷)恒容密闭容器中,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是
A.该反应的
B.a为随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入,H2的平衡转化率增大
33.(2022·广东卷)在相同条件下研究催化剂I、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,内,
34.(2022·北京卷)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
下列说法不正确的是
A.反应①为CaO+CO2=CaCO3;反应②为CaCO3+CH4CaO+2CO+2H2
B.t1~t3,n(H2)比n(CO)多,且生成H2速率不变,可能有副反应CH4C+2H2
C.t2时刻,副反应生成H2的速率大于反应②生成H2速率
D.t3之后,生成CO的速率为0,是因为反应②不再发生
35.(2022·江苏卷)乙醇-水催化重整可获得。其主要反应为,,在、时,若仅考虑上述反应,平衡时和CO的选择性及的产率随温度的变化如图所示。
CO的选择性,下列说法正确的是
A.图中曲线①表示平衡时产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大可提高乙醇平衡转化率
D.一定温度下,加入或选用高效催化剂,均能提高平衡时产率
36.(2021·广东卷)反应经历两步:①;②。反应体系中、、的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为随t的变化曲线
B.时,
C.时,的消耗速率大于生成速率
D.后,
37.(2021·河北卷)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是
A.0~30min时间段内,Y的平均反应速率为6.67×10-8mol L-1 min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
38.(2021·湖南卷)已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态I,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B.时改变的条件:向容器中加入C
C.平衡时A的体积分数:
D.平衡常数K:
39.(2020·江苏卷)CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A. 升高温度、增大压强均有利于提高CH4的平衡转化率
B. 曲线B表示CH4的平衡转化率随温度的变化
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
专题14 化学反应速率与化学平衡
考向 五年考情(2020-2024) 命题趋势
考点一 化学反应速率 2024·甘肃卷;2024·江苏卷;2024·安徽卷;2023·山东卷;2021·湖南卷 分析近5年高考化学选择题,对于化学反应速率和化学平衡内容的考查不算太多,这是因为在主观题中,化学反应速率和化学平衡才是考查的重头戏,不过随着新高考单科卷的实行,有关化学反应速率和化学平衡试题的考查在选择题中开始有所增加,考查的核心知识还是有关化学反应速率的比较、计算和影响因素的判断,化学平衡常数、转化率、物质的浓度的计算,以及平衡移动原理的分析等,常结合坐标图像或表格进行考查。
考点二 化学平衡及其移动 2024·浙江6月卷;2023·北京卷;2022·天津卷;2022·重庆卷;2022·江苏卷;2022·浙江卷;2022·北京卷;2022·辽宁卷;2021·浙江卷;2020·江苏卷
考点三 化学反应速率、平衡图像分析 2024·山东卷;2024·河北卷;2024·黑吉辽卷;2024·江苏卷;2024·湖南卷;2023·广东卷;2023·江苏卷;2023·湖南卷;2023·辽宁卷;2023·河北卷;2023·重庆卷;2022·湖南卷;2022·广东卷;2022·广东卷;2022·北京卷;2022·江苏卷;2021·广东卷等
考点一 化学反应速率
1.(2024·甘肃卷)下列措施能降低化学反应速率的是
A.催化氧化氨制备硝酸时加入铂 B.中和滴定时,边滴边摇锥形瓶
C.锌粉和盐酸反应时加水稀释 D.石墨合成金刚石时增大压强
【答案】C
【解析】A.催化剂可以改变化学反应速率,一般来说,催化剂可以用来加快化学反应速率,故催化氧化氨制备硝酸时加入铂可以加快化学反应速率,A项不符合题意;
B.中和滴定时,边滴边摇锥形瓶,可以让反应物快速接触,可以加快化学反应速率,B项不符合题意;
C.锌粉和盐酸反应时加水稀释会降低盐酸的浓度,会降低化学反应速率,C项符合题意;
D.石墨合成金刚石,该反应中没有气体参与,增大压强不会改变化学反应速率,D项不符合题意;
故选C。
2.(2024·江苏卷)催化剂能改变化学反应速率而不改变反应的焓变,常见倠化剂有金属及其氧化物、酸和碱等。倠化反应广泛存在,如豆科植物固氮、石墨制金刚石、和制(二甲醚)、倠化氧化等。催化剂有选择性,如与反应用Ag催化生成(环氧乙烷)、用催化生成。催化作用能消除污染和影响环境,如汽车尾气处理、废水中电倠化生成、氯自由基催化分解形成臭氧空洞。我国在石油催化领域领先世界,高效、经济、绿色是未来催化剂研究的发展方向。下列说法正确的是
A.豆科植物固氮过程中,固氮酶能提高该反应的活化能
B.与反应中,Ag催化能提高生成的选择性
C.制反应中,能加快化学反应速率
D.与反应中,能减小该反应的焓变
【答案】C
【解析】固氮酶是豆科植物固氮过程的催化剂,能降低该反应的活化能,A错误;
B.根据题意,催化剂有选择性,如C2H4与O2反应用Ag催化生成(环氧乙烷)、用CuCl2/PdCl2催化生成CH3CHO,则判断Ag催化不能提高生成CH3CHO的选择性,B错误;
C. MnO2是H2O2制O2反应的催化剂,能加快化学反应速率,C正确;
D. V2O5是SO2与O2反应的催化剂,能加快反应速率,但不能改变该反应的焓变,D错误;
故选C。
3.(2024·安徽卷)室温下,为探究纳米铁去除水样中的影响因素,测得不同条件下浓度随时间变化关系如下图。
实验序号 水样体积/ 纳米铁质量/ 水样初始
① 50 8 6
② 50 2 6
③ 50 2 8
下列说法正确的是
A.实验①中,0~2小时内平均反应速率
B.实验③中,反应的离子方程式为:
C.其他条件相同时,适当增加纳米铁质量可加快反应速率
D.其他条件相同时,水样初始越小,的去除效果越好
【答案】C
【解析】A. 实验①中,0~2小时内平均反应速率,A不正确;
B. 实验③中水样初始=8,溶液显弱碱性,发生反应的离子方程式中不能用配电荷守恒,B不正确;
C. 综合分析实验①和②可知,在相同时间内,实验①中浓度的变化量大,因此,其他条件相同时,适当增加纳米铁质量可加快反应速率,C正确;
D. 综合分析实验③和②可知,在相同时间内,实验②中浓度的变化量大,因此,其他条件相同时,适当减小初始,的去除效果越好,但是当初始太小时,浓度太大,纳米铁与反应速率加快,会导致与反应的纳米铁减少,因此,当初始越小时的去除效果不一定越好,D不正确;
综上所述,本题选C。
4.(2023·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10mol L-1,TFAA的浓度为0.08mol L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是
A.t1时刻,体系中有E存在
B.t2时刻,体系中无F存在
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08mol L-1
【答案】AC
【分析】一定条件下,化合物E和TFAA合成H的反应路径中,共发生三个反应:
①E+TFAAF ②FG ③GH+TFAA
t1之后的某时刻,H为0.02 mol L-1,此时TFAA的浓度仍为0,则表明0.10mol L-1E、起始时的0.08mol L-1TFAA、G分解生成的0.02 mol L-1 TFAA全部参加反应,生成0.10mol L-1F;在t2时刻,H为0.08mol L-1,TFAA为0.06mol L-1,G为0.01 mol L-1,则F为0.01 mol L-1。
【解析】A.t1时刻,H的浓度小于0.02 mol L-1,此时反应③生成F的浓度小于0.02 mol L-1,参加反应①的H的浓度小于0.1 mol L-1,则参加反应E的浓度小于0.1 mol L-1,所以体系中有E存在,A正确;
B.由分析可知,t2时刻,H为0.08mol L-1,TFAA为0.06mol L-1,G为0.01 mol L-1,则F为0.01 mol L-1,所以体系中有F存在,B不正确;
C.t1之后的某时刻,H为0.02 mol L-1,此时TFAA的浓度仍为0,表明此时E和TFAA完全反应生成F,所以E和TFAA生成F的反应速率快,反应的活化能很小,C正确;
D.在t2时刻,H为0.08mol L-1,TFAA为0.06mol L-1,G为0.01 mol L-1,F为0.01 mol L-1,只有F、G全部转化为H和TFAA时,TFAA的浓度才能为0.08mol L-1,而GH+TFAA为可逆反应,所以反应达平衡后,TFAA的浓度一定小于0.08mol L-1,D不正确;
故选AC。
5.(2021·湖南卷)铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是
A.该过程的总反应为
B.浓度过大或者过小,均导致反应速率降低
C.该催化循环中元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
【答案】D
【解析】
A.由反应机理可知,HCOOH电离出氢离子后,HCOO-与催化剂结合,放出二氧化碳,然后又结合氢离子转化为氢气,所以化学方程式为HCOOHCO2↑+H2↑,故A正确;
B.若氢离子浓度过低,则反应Ⅲ→Ⅳ的反应物浓度降低,反应速率减慢,若氢离子浓度过高,则会抑制加酸的电离,使甲酸根浓度降低,反应Ⅰ→Ⅱ速率减慢,所以氢离子浓度过高或过低,均导致反应速率减慢,故B正确;
C.由反应机理可知,Fe在反应过程中,化学键数目发生变化,则化合价也发生变化,故C正确;
D.由反应进程可知,反应Ⅳ→Ⅰ能垒最大,反应速率最慢,对该过程的总反应起决定作用,故D错误;
故选D。
考点二 化学平衡及其移动
6.(2024·浙江6月卷)二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
I.
II.
向容积为的密闭容器中投入和,不同温度下,测得时(反应均未平衡)的相关数据见下表,下列说法不正确的是
温度() 400 500 600
乙烷转化率() 2.2 9.0 17.8
乙烯选择性() 92.6 80.0 61.8
注:乙烯选择性
A.反应活化能:
B.时,反应I的平均速率为:
C.其他条件不变,平衡后及时移除,可提高乙烯的产率
D.其他条件不变,增大投料比投料,平衡后可提高乙烷转化率
【答案】D
【解析】由表可知,相同温度下,乙烷在发生转化时,反应Ⅰ更易发生,则反应活化能:Ⅰ<Ⅱ,A正确;由表可知,500℃时,乙烷的转化率为9.0%,可得转化的乙烷的总物质的量为2mol×9.0%=0.18mol,而此温度下乙烯的选择性为80%,则转化为乙烯的乙烷的物质的量为0.18mol×80%=0.144mol,根据方程式可得,生成乙烯的物质的量为0.144mol,则反应I的平均速率为:,B正确;其他条件不变,平衡后及时移除,反应Ⅰ正向进行,可提高乙烯的产率,C正确;其他条件不变,增大投料比投料,平衡后CO2转化率提高,C2H6转化率降低,D错误。
7.(2023·北京卷)下列事实能用平衡移动原理解释的是
A.溶液中加入少量固体,促进分解
B.密闭烧瓶内的和的混合气体,受热后颜色加深
C.铁钢放入浓中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀反应过程中,加入少量固体,促进的产生
【答案】B
【解析】A.MnO2会催化 H2O2分解,与平衡移动无关,A项错误;
B.NO2转化为N2O4 的反应是放热反应,升温平衡逆向移动, NO2浓度增大,混合气体颜色加深,B项正确;
C.铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C项错误;
D.加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D项错误;
故选B。
8.(2022·天津卷)向恒温恒容密闭容器中通入2mol 和1mol ,反应达到平衡后,再通入一定量,达到新平衡时,下列有关判断错误的是
A.的平衡浓度增大 B.反应平衡常数增大
C.正向反应速率增大 D.的转化总量增大
【答案】B
【解析】A.平衡后,再通入一定量,平衡正向移动,的平衡浓度增大,A正确;
B.平衡常数是与温度有关的常数,温度不变,平衡常数不变,B错误;
C.通入一定量,反应物浓度增大,正向反应速率增大,C正确;
D.通入一定量,促进二氧化硫的转化,的转化总量增大,D正确;
故选B。
9.(2022·重庆卷)两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) p1=3.6×104Pa
反应2:2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) p2=4×103Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是
A.反应2的平衡常数为4×106Pa2 B.通入NH3,再次平衡后,总压强增大
C.平衡后总压强为4.36×105Pa D.缩小体积,再次平衡后总压强不变
【答案】B
【解析】A.反应2的平衡常数为,A正确;
B.刚性密闭容器,温度不变平衡常数不变,再次达平衡后,容器内各气体分压不变,总压强不变,B错误;
C., ,,,所以总压强为:,C正确;
D.达平衡后,缩小体积,平衡逆向移动,温度不变,平衡常数不变,再次平衡后总压强不变,D正确;
故选B。
10.(2022·江苏卷)用尿素水解生成的催化还原,是柴油机车辆尾气净化的主要方法。反应为,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中消耗,转移电子的数目为
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
【答案】B
【解析】A.由方程式可知,该反应是一个气体分子数增大的反应,即熵增的反应,反应△S>0,故A错误;
B.由方程式可知,反应平衡常数,故B正确;
C.由方程式可知,反应每消耗4mol氨气,反应转移12mol电子,则反应中消耗1mol氨气转移电子的数目为3mol×4××6.02×1023=3×6.02×1023,故C错误;
D.实际应用中,加入尿素的量越多,尿素水解生成的氨气过量,柴油机车辆排放的氨气对空气污染程度增大,故D错误;
故选B。
11.(2022·浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
A.实验①,,
B.实验②,时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
【答案】C
【解析】A.实验①中,0~20min,氨气浓度变化量为2.4010-3mol/L-2.0010-3mol/L=4.0010-4mol/L,v(NH3)==2.0010-5mol/(L·min),反应速率之比等于化学计量数之比,v(N2)=v(NH3)=1.0010-5mol/(L·min),A正确;
B.催化剂表面积大小只影响反应速率,不影响平衡,实验③中氨气初始浓度与实验①中一样,实验③达到平衡时氨气浓度为4.0010-4mol/L,则实验①达平衡时氨气浓度也为4.0010-4mol/L,而恒温恒容条件下,实验②相对于实验①为减小压强,平衡正向移动,因此实验②60min时处于平衡状态,x<0.4,即x≠0.4,B正确;
C.实验①、实验②中0~20min、20min~40min氨气浓度变化量都是4.0010-4mol/L,实验②中60min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨气初始浓度是实验②中氨气初始浓度的两倍,实验①60min时反应未达到平衡状态,相同条件下,增加氨气浓度,反应速率并没有增大,C错误;
D.对比实验①和实验③,氨气浓度相同,实验③中催化剂表面积是实验①中催化剂表面积的2倍,实验③先达到平衡状态,实验③的反应速率大,说明相同条件下,增加催化剂的表面积,反应速率增大,D正确;
答案选C。
12.(2022·北京卷)某多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
已知:
下列说法不正确的是
A.温度升高时不利于吸附
B.多孔材料“固定”,促进平衡正向移动
C.转化为的反应是
D.每获得时,转移电子的数目为
【答案】D
【分析】废气经过MOFs材料之后,NO2转化成N2O4被吸附,进而与氧气和水反应生成硝酸,从该过程中我们知道,NO2转化为N2O4的程度,决定了整个废气处理的效率。
【解析】A.从可以看出,这个是一个放热反应,升高温度之后,平衡逆向移动,导致生成的N2O4减少,不利于NO2的吸附,A正确;
B.多孔材料“固定”,从而促进平衡正向移动,B正确;
C.N2O4和氧气、水反应生成硝酸,其方程式为,C正确;
D.在方程式中,转移的电子数为4e-,则每获得,转移的电子数为0.4mol,即个数为,D错误;
故选D。
13.(2022·辽宁卷)某温度下,在恒容密闭容器中发生反应,有关数据如下:
时间段/ 产物Z的平均生成速率/
0~2 0.20
0~4 0.15
0~6 0.10
下列说法错误的是
A.时,Z的浓度大于
B.时,加入,此时
C.时,Y的体积分数约为33.3%
D.时,X的物质的量为
【答案】B
【解析】A.反应开始一段时间,随着时间的延长,反应物浓度逐渐减小,产物Z的平均生成速率逐渐减小,则内Z的平均生成速率大于内的,故时,Z的浓度大于,A正确;
B.时生成的Z的物质的量为,时生成的Z的物质的量为,故反应在时已达到平衡,设达到平衡时生了,列三段式:
根据,得,则Y的平衡浓度为,Z的平衡浓度为,平衡常数,时Y的浓度为,Z的浓度为,加入后Z的浓度变为,,反应正向进行,故,B错误;
C.反应生成的Y与Z的物质的量之比恒等于1∶2,反应体系中只有Y和Z为气体,相同条件下,体积之比等于物质的量之比,,故Y的体积分数始终约为33.3%,C正确;
D.由B项分析可知时反应处于平衡状态,此时生成Z为,则X的转化量为,初始X的物质的量为,剩余X的物质的量为,D正确;
故答案选B。
14.(2021·浙江卷)一定温度下:在的四氯化碳溶液()中发生分解反应:。在不同时刻测量放出的体积,换算成浓度如下表:
0 600 1200 1710 2220 2820 x
1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是
A.,生成的平均速率为
B.反应时,放出的体积为(标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
【答案】D
【解析】
A.,的变化量为(0.96-0.66)==0.3,在此时间段内的变化量为其2倍,即0.6,因此,生成的平均速率为,A说法不正确;
B.由表中数据可知,反应时,的变化量为(1.40-0.35)==1.05,其物质的量的变化量为1.050.1L=0.105mol,的变化量是其,即0.0525mol,因此,放出的在标准状况下的体积为0.0525mol 22.4L/mol=,B说法不正确;
C.反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,,C说法不正确;
D.分析表中数据可知,该反应经过1110s(600-1710,1710-2820)后的浓度会变为原来的,因此,的浓度由0.24变为0.12时,可以推测上表中的x为(2820+1110)=3930,D说法正确。
综上所述,本题选D。
15.(2020·浙江卷)一定条件下: 。在测定的相对分子质量时,下列条件中,测定结果误差最小的是( )
A. 温度、压强 B. 温度、压强
C. 温度、压强 D. 温度、压强
【答案】D
【解析】测定二氧化氮的相对分子质量,要使测定结果误差最小,应该使混合气体中NO2的含量越多越好,为了实现该目的,应该改变条件使平衡尽可以地逆向移动。该反应是一个反应前后气体分子数减小的放热反应,可以通过减小压强、升高温度使平衡逆向移动,则选项中,温度高的为130℃,压强低的为50kPa,结合二者选D。答案为D。
16.(2020·浙江卷)溶液与溶液发生反应:,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C. 加入固体,平衡逆向移动
D. 该反应的平衡常数
【答案】D
【解析】加入苯振荡,苯将I2萃取到苯层,水溶液中c(I2)减小,平衡正向移动,A正确;将5mL0.1mol/LKI溶液与1mL0.1mol/LFeCl3溶液混合,参与反应的Fe3+与I-物质的量之比为1:1,反应后I-一定过量,经苯2次萃取分离后,在水溶液中加入KSCN溶液呈血红色,说明水溶液中仍含有Fe3+,即Fe3+没有完全消耗,表明该化学反应存在限度,B正确;加入FeSO4固体溶于水电离出Fe2+,c(Fe2+)增大,平衡逆向移动,C正确;该反应的平衡常数K=,D错误;答案选D。
17.(2020·江苏卷)反应可用于纯硅的制备。下列有关该反应的说法正确的是
A. 该反应 、
B. 该反应的平衡常数
C. 高温下反应每生成1 mol Si需消耗
D 用E表示键能,该反应
【答案】B
【解析】SiCl4、H2、HCl为气体,且反应前气体系数之和小于反应后气体系数之和,因此该反应为熵增,即△S>0,故A错误;根据化学平衡常数的定义,该反应的平衡常数K=,故B正确;
高温不是标准状况下,因此不能直接用22.4L·mol-1计算,故C错误;△H=反应物键能总和-生成物键能总和,即△H=4E(Si-Cl)+2E(H-H)-4E(H-Cl) -2E(Si-Si),故D错误;答案为B。
考点三 化学反应速率、平衡图像分析
18.(2024·山东卷)逆水气变换反应:。一定压力下,按,物质的量之比投料,,温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为,,温度时反应速率常数k分别为。下列说法错误的是
A.
B.温度下达平衡时反应速率的比值:
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.温度下,改变初始投料比例,可使平衡时各组分摩尔分数与温度时相同
【答案】CD
【分析】由图可知,T1比T2反应速率速率快,则T1>T2;T1温度下达到平衡时反应物的摩尔分数低于T2温度下平衡时;由于起始CO2与H2的物质的量之比为1∶1,则达到平衡时CO2和H2的摩尔分数相等。
【解析】A.根据分析,T1比T2反应速率速率快,反应速率常数与温度有关,结合反应速率方程知k1>k2,A项正确;
B.反应的速率方程为v=kc0.5(H2)c(CO2),则,T1温度下达到平衡时反应物的摩尔分数低于T2温度下平衡时,则,B项正确;
C.温度不变,仅改变体系初始压力,虽然平衡不移动,但反应物的浓度改变,反应速率改变,反应达到平衡的时间改变,反应物摩尔分数随时间的变化曲线变化,C项错误;
D.T2温度下,改变初始投料比,相当于改变某一反应物的浓度,达到平衡时H2和CO2的摩尔分数不可能相等,故不能使平衡时各组分摩尔分数与T1温度时相同,D项错误;
答案选CD。
19.(2024·河北卷)在水溶液中,可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与形成配离子达平衡时,与的关系如图。
下列说法正确的是
A.的X、Y转化为配离子时,两溶液中的平衡浓度:
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时
C.由Y和Z分别制备等物质的量的配离子时,消耗的物质的量:
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
【答案】B
【解析】A.的X、Y转化为配离子时,溶液中,则,根据图像可知,纵坐标约为时,溶液中,则溶液中的平衡浓度:,A错误;
B.Q点时,即,加入少量可溶性Y盐后,会消耗形成Y配离子,使得溶液中减小(沿横坐标轴向右移动),与曲线在Q点相交后,随着继续增大,X对应曲线位于Z对应曲线上方,即,则,B正确;
C.设金属离子形成配离子的离子方程式为金属离子配离子,则平衡常数,,即,故X、Y、Z三种金属离子形成配离子时结合的越多,对应曲线斜率越大,由题图知,曲线斜率:,则由Y、Z制备等物质的量的配离子时,消耗的物质的量:,C错误;
D.由P点状态移动到形成Y配离子的反应的平衡状态时,不变,增大,即增大、c(Y配离子)减小,则P点状态Y配离子的解离速率>生成速率,D错误;
本题选B。
20.(2024·黑吉辽卷)异山梨醇是一种由生物质制备的高附加值化学品,时其制备过程及相关物质浓度随时间变化如图所示,后异山梨醇浓度不再变化。下列说法错误的是
A.时,反应②正、逆反应速率相等
B.该温度下的平衡常数:①>②
C.平均速率(异山梨醇)
D.反应②加入催化剂不改变其平衡转化率
【答案】A
【解析】A.由图可知,3小时后异山梨醇浓度继续增大,后异山梨醇浓度才不再变化,所以时,反应②未达到平衡状态,即正、逆反应速率不相等,故A错误;
B.图像显示该温度下,后所有物质浓度都不再变化,且此时山梨醇转化完全,即反应充分,而1,4-失水山梨醇仍有剩余,即反应②正向进行程度小于反应①、反应限度小于反应①,所以该温度下的平衡常数:①>②,故B正确;
C.由图可知,在内异山梨醇的浓度变化量为0.042mol/kg,所以平均速率(异山梨醇)=,故C正确;
D.催化剂只能改变化学反应速率,不能改变物质平衡转化率,所以反应②加入催化剂不改变其平衡转化率,故D正确;
故答案为:A。
21.(2024·江苏卷)二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
①
②
、下,将一定比例、混合气匀速通过装有催化剂的绝热反应管。装置及L1、L2、L3…位点处(相邻位点距离相同)的气体温度、CO和的体积分数如图所示。下列说法正确的是
A.L4处与L5处反应①的平衡常数K相等
B.反应②的焓变
C.L6处的的体积分数大于L5处
D.混合气从起始到通过L1处,CO的生成速率小于的生成速率
【答案】C
【解析】L4处与L5处的温度不同,故反应①的平衡常数K不相等,A错误;由图像可知,L1-L3温度在升高,该装置为绝热装置,反应①为吸热反应,所以反应②为放热反应,ΔH2<0,B错误;从L5到L6,甲醇的体积分数逐渐增加,说明反应②在向右进行,反应②消耗 CO,而 CO 体积分数没有明显变化,说明反应①也在向右进行,反应①为气体分子数不变的反应,其向右进行时,n(H2O) 增大,反应②为气体分子数减小的反应,且没有H2O的消耗与生成,故 n总减小而n(H O)增加,即H2O的体积分数会增大,故L6处的 H2O的体积分数大于L5处,C正确;L1处CO 的体积分数大于 CH3OH,说明生成的 CO 的物质的量大于CH3OH,两者反应时间相同,说明CO的生成速率大于 CH3OH的生成速率,D错误。
22.(2024·湖南卷)恒压下,向某密闭容器中充入一定量的和,发生如下反应:
主反应:
副反应:
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数随投料比x(物质的量之比)的变化关系如图所示,下列说法正确的是
A.投料比x代表
B.曲线c代表乙酸的分布分数
C.,
D.L、M、N三点的平衡常数:
【答案】D
【解析】题干明确指出,图中曲线表示的是测得两种含碳产物的分布分数即分别为、,若投料比x代表,x越大,可看作是CH3OH的量增多,则对于主、副反应可知生成的CH3COOCH3越多,CH3COOCH3分布分数越高,则曲线a或曲线b表示CH3COOCH3分布分数,曲线c或曲线d表示CH3COOH分布分数,据此分析可知AB均正确,可知如此假设错误,则可知投料比x代表,曲线a或曲线b表示,曲线c或曲线d表示。根据分析可知,投料比x代表,A错误;曲线c表示CH3COOCH3分布分数,B错误;曲线a或曲线b表示,当同一投料比时,观察图像可知T2时大于T1时,而可知,温度越高则越大,说明温度升高主反应的平衡正向移动,;曲线c或曲线d表示,当同一投料比时,观察可知T1时大于T2时,而可知,温度越高则越小,说明温度升高副反应的平衡逆向移动,,C错误;L、M、N三点对应副反应,且,升高温度平衡逆向移动,,D正确。
23.(2023·广东卷)催化剂Ⅰ和Ⅱ均能催化反应。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是
A.使用Ⅰ和Ⅱ,反应历程都分4步进行 B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡 D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
【答案】C
【解析】A.由图可知两种催化剂均出现四个波峰,所以使用Ⅰ和Ⅱ,反应历程都分4步进行,A正确;
B.由图可知该反应是放热反应,所以达平衡时,升高温度平衡向左移动,R的浓度增大,B正确;
C.由图可知Ⅰ的最高活化能小于Ⅱ的最高活化能,所以使用Ⅰ时反应速率更快,反应体系更快达到平衡,C错误;
D.由图可知在前两个历程中使用Ⅰ活化能较低反应速率较快,后两个历程中使用Ⅰ活化能较高反应速率较慢,所以使用Ⅰ时,反应过程中M所能达到的最高浓度更大,D正确;
故选C。
24.(2023·海南卷)工业上苯乙烯的生产主要采用乙苯脱氢工艺:。某条件下无催化剂存在时,该反应的正、逆反应速率v随时间t的变化关系如图所示。下列说法正确的是
A.曲线①表示的是逆反应的关系
B.时刻体系处于平衡状态
C.反应进行到时,(为浓度商)
D.催化剂存在时,、都增大
【答案】BD
【解析】A.反应为乙苯制备苯乙烯的过程,开始反应物浓度最大,生成物浓度为0,所以曲线①表示的是正反应的关系,曲线表示的是逆反应的关系,故A错误;
B.t2时,正逆反应速率相等,体系处于平衡状态,故B正确;
C.反应进行到时,反应正向进行,故Q<K,故C错误;
D.催化剂能降低反应的活化能,使反应的、都增大,故D正确;
故选BD。
25.(2023·江苏卷)二氧化碳加氢制甲烷过程中的主要反应为
在密闭容器中,、时,平衡转化率、在催化剂作用下反应相同时间所测得的实际转化率随温度的变化如题图所示。的选择性可表示为。下列说法正确的是
A.反应的焓变
B.的平衡选择性随着温度的升高而增加
C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃
D.450℃时,提高的值或增大压强,均能使平衡转化率达到X点的值
【答案】D
【解析】A.由盖斯定律可知反应的焓变,A错误;
B.为放热反应,升高温度平衡逆向移动,的含量降低,故的平衡选择性随着温度的升高而降低,B错误;
C.由图可知温度范围约为350~400℃时二氧化碳实际转化率最高,为最佳温度范围,C错误;
D.450℃时,提高的值可提高二氧化碳的平衡转化率,增大压强反应I平衡正向移动,可提高二氧化碳的平衡转化率,均能使平衡转化率达到X点的值,D正确。
故选D。
26.(2023·湖南卷)向一恒容密闭容器中加入和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A.
B.反应速率:
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
【答案】B
【解析】A.一定条件下,增大水的浓度,能提高CH4的转化率,即x值越小,CH4的转化率越大,则,故A正确;
B.b点和c点温度相同,CH4的起始物质的量都为1mol,b点x值小于c点,则b点加水多,反应物浓度大,则反应速率:,故B错误;
C.由图像可知,x一定时,温度升高CH4的平衡转化率增大,说明正反应为吸热反应,温度升高平衡正向移动,K增大;温度相同,K不变,则点a、b、c对应的平衡常数:,故C正确;
D.该反应为气体分子数增大的反应,反应进行时压强发生改变,所以温度一定时,当容器内压强不变时,反应达到平衡状态,故D正确;
答案选B。
27.(2023·辽宁卷)一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是
A.(Ⅲ)不能氧化
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,(Ⅱ)和(Ⅶ)不能大量共存
D.总反应为:
【答案】C
【分析】开始一段时间(大约13min前)随着时间的推移Mn(Ⅶ)浓度减小直至为0,Mn(Ⅲ)浓度增大直至达到最大值,结合图像,此时间段主要生成Mn(Ⅲ),同时先生成少量Mn(Ⅳ)后Mn(Ⅳ)被消耗;后来(大约13min后)随着时间的推移Mn(Ⅲ)浓度减少,Mn(Ⅱ)的浓度增大;据此作答。
【解析】A.由图像可知,随着时间的推移Mn(Ⅲ)的浓度先增大后减小,说明开始反应生成Mn(Ⅲ),后Mn(Ⅲ)被消耗生成Mn(Ⅱ),Mn(Ⅲ)能氧化H2C2O4,A项错误;
B.随着反应物浓度的减小,到大约13min时开始生成Mn(Ⅱ),Mn(Ⅱ)对反应起催化作用,13min后反应速率会增大,B项错误;
C.由图像可知,Mn(Ⅶ)的浓度为0后才开始生成Mn(Ⅱ),该条件下Mn(Ⅱ)和Mn(Ⅶ)不能大量共存,C项正确;
D.H2C2O4为弱酸,在离子方程式中应以化学式保留,总反应为2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,D项错误;
答案选C。
28.(2023·河北卷)在恒温恒容密闭容器中充入一定量,发生如下反应:
反应②和③的速率方程分别为和,其中分别为反应②和③的速率常数,反应③的活化能大于反应②。测得的浓度随时间的变化如下表。
0 1 2 3 4 5
0.160 0.113 0.080 0.056 0.040 0.028
下列说法正确的是
A.内,X的平均反应速率为
B.若增大容器容积,平衡时Y的产率增大
C.若,平衡时
D.若升高温度,平衡时减小
【答案】D
【解析】A.由表知内 c(W)=0.16-0.08=0.08mol/L,生成 c(X)=2 c(W)=0.16mol/L,但一部分X转化为Z,造成 c(X)<0.16mol/L,则v(X)<,故A错误;
B.过程①是完全反应,过程②是可逆反应,若增大容器容积相当于减小压强,对反应平衡向气体体积增大的方向移动,即逆向移动,X的浓度增大,平衡时Y的产率减小,故B错误;
C.由速率之比等于系数比,平衡时2v逆(X)=v正(Z),即,2=,若,平衡时,故C错误;
D.反应③的活化能大于反应②, H=正反应活化能-逆反应活化能<0,则,该反应是放热反应,升高温度,平衡逆向移动,则平衡时减小,故D正确;
故选D。
29.(2023·重庆卷)逆水煤气变换体系中存在以下两个反应:
反应Ⅰ:
反应Ⅱ:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法正确的是
A.反应Ⅰ的,反应Ⅱ的
B.点反应Ⅰ的平衡常数
C.点的压强是的3倍
D.若按投料,则曲线之间交点位置不变
【答案】C
【解析】A.随着温度的升高,甲烷含量减小、一氧化碳含量增大,则说明随着温度升高,反应Ⅱ逆向移动、反应Ⅰ正向移动,则反应Ⅱ为放热反应焓变小于零、反应Ⅰ为吸热反应焓变大于零,A错误;
B.点没有甲烷产物,且二氧化碳、一氧化碳含量相等,投料,则此时反应Ⅰ平衡时二氧化碳、氢气、一氧化碳、水的物质的量相等,反应Ⅰ的平衡常数,B错误;
C.点一氧化碳、甲烷物质的量相等,结合反应方程式的系数可知,生成水的总的物质的量为甲烷的3倍,结合阿伏加德罗定律可知,的压强是的3倍,C正确;
D.反应Ⅰ为气体分子数不变的反应、反应Ⅱ为气体分子数减小的反应;若按投料,相当于增加氢气的投料,会使得甲烷含量增大,导致甲烷、一氧化碳曲线之间交点位置发生改变,D错误;
故选C。
30.(2023·浙江卷)一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
【答案】C
【解析】A.反应I、Ⅲ为放热反应,相同物质的量的反应物,反应I放出的热量小于反应Ⅱ放出的热量,反应放出的热量越多,其焓变越小,因此反应焓变:反应I>反应Ⅱ,故A正确;
B.短时间里反应I得到的产物比反应Ⅱ得到的产物多,说明反应I的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应I<反应Ⅱ,故B正确;
C.增加浓度,平衡正向移动,但平衡时产物Ⅱ和产物I的比例可能降低,故C错误;
D.根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,故D正确。
综上所述,答案为C。
31.(2022·湖南卷)向体积均为1L的两恒容容器中分别充入和发生反应:,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. B.气体的总物质的量:
C.a点平衡常数: D.反应速率:
【答案】B
【解析】A.甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程PV=nRT可知,刚开始压强增大的原因是因为容器温度升高,则说明上述反应过程放热,即<0,故A错误;
B.根据A项分析可知,上述密闭溶液中的反应为放热反应,图中a点和c点的压强相等,因甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,则说明甲容器中气体的总物质的量此时相比乙容器在减小即气体总物质的量:na<nc,故B正确;
C.a点为平衡点,此时容器的总压为p,假设在恒温恒容条件下进行,则气体的压强之比等于气体的物质的量(物质的量浓度)之比,所以可设Y转化的物质的量浓度为xmol L 1,则列出三段式如下:,则有,计算得到x=0.75,那么化学平衡常数K=,又甲容器为绝热条件,等效为恒温条件下升温,平衡逆向移动,则平衡常数减小即平衡常数K<12,故C错误;
D.根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即Va正>Vb正,故D错误。
综上所述,答案为B。
32.(2022·广东卷)恒容密闭容器中,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是
A.该反应的
B.a为随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入,H2的平衡转化率增大
【答案】C
【解析】A.从图示可以看出,平衡时升高温度,氢气的物质的量减少,则平衡正向移动,说明该反应的正反应是吸热反应,即ΔH>0,故A错误;
B.从图示可以看出,在恒容密闭容器中,随着温度升高氢气的平衡时的物质的量减少,则平衡随着温度升高正向移动,水蒸气的物质的量增加,而a曲线表示的是物质的量不随温度变化而变化,故B错误;
C.容器体积固定,向容器中充入惰性气体,没有改变各物质的浓度,平衡不移动,故C正确;
D.BaSO4是固体,向平衡体系中加入BaSO4,不能改变其浓度,因此平衡不移动,氢气的转化率不变,故D错误;
故选C。
33.(2022·广东卷)在相同条件下研究催化剂I、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,内,
【答案】D
【解析】A.由图可知,无催化剂时,随反应进行,生成物浓度也在增加,说明反应也在进行,故A错误;
B.由图可知,催化剂I比催化剂II催化效果好,说明催化剂I使反应活化能更低,反应更快,故B错误;
C.由图可知,使用催化剂II时,在0~2min 内Y的浓度变化了2.0mol/L,而a曲线表示的X的浓度变化了2.0mol/L,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂II时X浓度随时间t的变化,故C错误;
D.使用催化剂I时,在0~2min 内,Y的浓度变化了4.0mol/L,则(Y) ===2.0,(X) =(Y) =2.0=1.0,故D正确;
答案选D。
34.(2022·北京卷)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
下列说法不正确的是
A.反应①为CaO+CO2=CaCO3;反应②为CaCO3+CH4CaO+2CO+2H2
B.t1~t3,n(H2)比n(CO)多,且生成H2速率不变,可能有副反应CH4C+2H2
C.t2时刻,副反应生成H2的速率大于反应②生成H2速率
D.t3之后,生成CO的速率为0,是因为反应②不再发生
【答案】C
【解析】A.由题干图1所示信息可知,反应①为CaO+CO2=CaCO3,结合氧化还原反应配平可得反应②为,A正确;
B.由题干图2信息可知,t1~t3,n(H2)比n(CO)多,且生成H2速率不变,且反应过程中始终未检测到CO2,在催化剂上有积碳,故可能有副反应,反应②和副反应中CH4和H2的系数比均为1:2,B正确;
C.由题干反应②方程式可知,H2和CO的反应速率相等,而t2时刻信息可知,H2的反应速率未变,仍然为2mmol/min,而CO变为1~2mmol/min之间,故能够说明副反应生成H2的速率小于反应②生成H2速率,C错误;
D.由题干图2信息可知,t3之后,CO的速率为0,CH4的速率逐渐增大,最终恢复到1,说明生成CO的速率为0,是因为反应②不再发生,而后副反应逐渐停止反应,D正确;
答案选C。
35.(2022·江苏卷)乙醇-水催化重整可获得。其主要反应为,,在、时,若仅考虑上述反应,平衡时和CO的选择性及的产率随温度的变化如图所示。
CO的选择性,下列说法正确的是
A.图中曲线①表示平衡时产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大可提高乙醇平衡转化率
D.一定温度下,加入或选用高效催化剂,均能提高平衡时产率
【答案】B
【分析】根据已知反应①,反应②,且反应①的热效应更大,温度升高的时候对反应①影响更大一些,根据选择性的含义,升温时CO选择性增大,同时CO2的选择性减小,所以图中③代表CO的选择性,①代表CO2的选择性,②代表H2的产率,以此解题。
【解析】A.由分析可知②代表H2的产率,故A错误;
B.由分析可知升高温度,平衡时CO的选择性增大,故B正确;
C.一定温度下,增大,可以认为开始时水蒸气物质的量不变,增大乙醇物质的量,乙醇的平衡转化率降低,故C错误;
D.加入或者选用高效催化剂,不会影响平衡时产率,故D错误;
故选B。
36.(2021·广东卷)反应经历两步:①;②。反应体系中、、的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为随t的变化曲线
B.时,
C.时,的消耗速率大于生成速率
D.后,
【答案】D
【分析】
由题中信息可知,反应经历两步:①;②。因此,图中呈不断减小趋势的a线为X的浓度随时间的变化曲线,呈不断增加趋势的线为Z的浓度随时间的变化曲线,先增加后减小的线为Y的浓度随时间的变化曲线。
【解析】
A.X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,由图可知,为随的变化曲线,A正确;
B.由图可知,分别代表3种不同物质的曲线相交于时刻,因此,时,B正确;
C.由图中信息可知,时刻以后,Y的浓度仍在不断减小,说明时刻反应两步仍在向正反应方向发生,而且反应①生成Y的速率小于反应②消耗Y的速率,即时的消耗速率大于生成速率,C正确;
D.由图可知,时刻反应①完成,X完全转化为Y,若无反应②发生,则,由于反应②的发生,时刻Y浓度的变化量为,变化量之比等于化学计量数之比,所以Z的浓度的变化量为,这种关系在后仍成立, 因此,D不正确。
综上所述,本题选D。
37.(2021·河北卷)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是
A.0~30min时间段内,Y的平均反应速率为6.67×10-8mol L-1 min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
【答案】A
【解析】
A.由图中数据可知,时,M、Z的浓度分别为0.300和0.125 ,则M的变化量为0.5-0.300 =0.200 ,其中转化为Y的变化量为0.200-0.125 =0.075 。因此,时间段内,Y的平均反应速率为 ,A说法不正确;
B.由题中信息可知,反应①和反应②的速率之比为,Y和Z分别为反应①和反应②的产物,且两者与M的化学计量数相同(化学计量数均为1),因此反应开始后,体系中Y和Z的浓度之比等于 ,由于k1、k2为速率常数,故该比值保持不变,B说法正确;
C.结合A、B的分析可知因此反应开始后,在相同的时间内体系中Y和Z的浓度之比等于=,因此,如果反应能进行到底,反应结束时有 的M转化为Z,即的M转化为Z,C说法正确;
D.由以上分析可知,在相同的时间内生成Z较多、生成Y较少,因此,反应①的化学反应速率较小,在同一体系中,活化能较小的化学反应速率较快,故反应①的活化能比反应②的活化能大,D说法正确。
综上所述,相关说法不正确的只有A,故本题选A。
38.(2021·湖南卷)已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态I,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B.时改变的条件:向容器中加入C
C.平衡时A的体积分数:
D.平衡常数K:
【答案】BC
【分析】
根据图像可知,向恒温恒容密闭容器中充入1molA和3molB发生反应,反应时间从开始到t1阶段,正反应速率不断减小,t1-t2时间段,正反应速率不变,反应达到平衡状态,t2-t3时间段,改变条件使正反应速率逐渐增大,平衡向逆反应方向移动,t3以后反应达到新的平衡状态,据此结合图像分析解答。
【解析】
A.容器内发生的反应为A(g)+2B(g)3C(g),该反应是气体分子数不变的可逆反应,所以在恒温恒容条件下,气体的压强始终保持不变,则容器内压强不变,不能说明反应达到平衡状态,A错误;
B.根据图像变化曲线可知,t2t3过程中,t2时,瞬间不变,平衡过程中不断增大,则说明反应向逆反应方向移动,且不是“突变”图像,属于“渐变”过程,所以排除温度与催化剂等影响因素,改变的条件为:向容器中加入C,B正确;
C.最初加入体系中的A和B的物质的量的比值为1:3,当向体系中加入C时,平衡逆向移动,最终A和B各自物质的量增加的比例为1:2,因此平衡时A的体积分数(II)>(I),C正确;
D.平衡常数K与温度有关,因该反应在恒温条件下进行,所以K保持不变,D错误。
故选BC。
39.(2020·江苏卷)CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A. 升高温度、增大压强均有利于提高CH4的平衡转化率
B. 曲线B表示CH4的平衡转化率随温度的变化
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
【答案】BD
【解析】甲烷和二氧化碳反应是吸热反应,升高温度,平衡向吸热反应即正向移动,甲烷转化率增大,甲烷和二氧化碳反应是体积增大的反应,增大压强,平衡逆向移动,甲烷转化率减小,故A错误;根据两个反应得到总反应为CH4(g)+2CO2(g)===H2(g)+3CO(g) +H2O (g),加入的CH4与CO2物质的量相等,CO2消耗量大于CH4,因此CO2的转化率大于CH4,因此曲线B表示CH4的平衡转化率随温度变化,故B正确;使用高效催化剂,只能提高反应速率,但不能改变平衡转化率,故C错误;800K时甲烷的转化率为X点,可以通过改变二氧化碳的量来提高甲烷的转化率达到Y点的值,故D正确。综上所述,答案为BD。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
专题14 化学反应速率与化学平衡
考向 五年考情(2020-2024) 命题趋势
考点一 化学反应速率 2024·甘肃卷;2024·江苏卷;2024·安徽卷;2023·山东卷;2021·湖南卷 分析近5年高考化学选择题,对于化学反应速率和化学平衡内容的考查不算太多,这是因为在主观题中,化学反应速率和化学平衡才是考查的重头戏,不过随着新高考单科卷的实行,有关化学反应速率和化学平衡试题的考查在选择题中开始有所增加,考查的核心知识还是有关化学反应速率的比较、计算和影响因素的判断,化学平衡常数、转化率、物质的浓度的计算,以及平衡移动原理的分析等,常结合坐标图像或表格进行考查。
考点二 化学平衡及其移动 2024·浙江6月卷;2023·北京卷;2022·天津卷;2022·重庆卷;2022·江苏卷;2022·浙江卷;2022·北京卷;2022·辽宁卷;2021·浙江卷;2020·江苏卷
考点三 化学反应速率、平衡图像分析 2024·山东卷;2024·河北卷;2024·黑吉辽卷;2024·江苏卷;2024·湖南卷;2023·广东卷;2023·江苏卷;2023·湖南卷;2023·辽宁卷;2023·河北卷;2023·重庆卷;2022·湖南卷;2022·广东卷;2022·广东卷;2022·北京卷;2022·江苏卷;2021·广东卷等
考点一 化学反应速率
1.(2024·甘肃卷)下列措施能降低化学反应速率的是
A.催化氧化氨制备硝酸时加入铂 B.中和滴定时,边滴边摇锥形瓶
C.锌粉和盐酸反应时加水稀释 D.石墨合成金刚石时增大压强
2.(2024·江苏卷)催化剂能改变化学反应速率而不改变反应的焓变,常见倠化剂有金属及其氧化物、酸和碱等。倠化反应广泛存在,如豆科植物固氮、石墨制金刚石、和制(二甲醚)、倠化氧化等。催化剂有选择性,如与反应用Ag催化生成(环氧乙烷)、用催化生成。催化作用能消除污染和影响环境,如汽车尾气处理、废水中电倠化生成、氯自由基催化分解形成臭氧空洞。我国在石油催化领域领先世界,高效、经济、绿色是未来催化剂研究的发展方向。下列说法正确的是
A.豆科植物固氮过程中,固氮酶能提高该反应的活化能
B.与反应中,Ag催化能提高生成的选择性
C.制反应中,能加快化学反应速率
D.与反应中,能减小该反应的焓变
3.(2024·安徽卷)室温下,为探究纳米铁去除水样中的影响因素,测得不同条件下浓度随时间变化关系如下图。
实验序号 水样体积/ 纳米铁质量/ 水样初始
① 50 8 6
② 50 2 6
③ 50 2 8
下列说法正确的是
A.实验①中,0~2小时内平均反应速率
B.实验③中,反应的离子方程式为:
C.其他条件相同时,适当增加纳米铁质量可加快反应速率
D.其他条件相同时,水样初始越小,的去除效果越好
4.(2023·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10mol L-1,TFAA的浓度为0.08mol L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是
A.t1时刻,体系中有E存在
B.t2时刻,体系中无F存在
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08mol L-1
5.(2021·湖南卷)铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是
A.该过程的总反应为
B.浓度过大或者过小,均导致反应速率降低
C.该催化循环中元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
考点二 化学平衡及其移动
6.(2024·浙江6月卷)二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
I.
II.
向容积为的密闭容器中投入和,不同温度下,测得时(反应均未平衡)的相关数据见下表,下列说法不正确的是
温度() 400 500 600
乙烷转化率() 2.2 9.0 17.8
乙烯选择性() 92.6 80.0 61.8
注:乙烯选择性
A.反应活化能:
B.时,反应I的平均速率为:
C.其他条件不变,平衡后及时移除,可提高乙烯的产率
D.其他条件不变,增大投料比投料,平衡后可提高乙烷转化率
7.(2023·北京卷)下列事实能用平衡移动原理解释的是
A.溶液中加入少量固体,促进分解
B.密闭烧瓶内的和的混合气体,受热后颜色加深
C.铁钢放入浓中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀反应过程中,加入少量固体,促进的产生
8.(2022·天津卷)向恒温恒容密闭容器中通入2mol 和1mol ,反应达到平衡后,再通入一定量,达到新平衡时,下列有关判断错误的是
A.的平衡浓度增大 B.反应平衡常数增大
C.正向反应速率增大 D.的转化总量增大
9.(2022·重庆卷)两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) p1=3.6×104Pa
反应2:2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) p2=4×103Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是
A.反应2的平衡常数为4×106Pa2 B.通入NH3,再次平衡后,总压强增大
C.平衡后总压强为4.36×105Pa D.缩小体积,再次平衡后总压强不变
10.(2022·江苏卷)用尿素水解生成的催化还原,是柴油机车辆尾气净化的主要方法。反应为,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中消耗,转移电子的数目为
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
11.(2022·浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
A.实验①,,
B.实验②,时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
12.(2022·北京卷)某多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
已知:
下列说法不正确的是
A.温度升高时不利于吸附
B.多孔材料“固定”,促进平衡正向移动
C.转化为的反应是
D.每获得时,转移电子的数目为
13.(2022·辽宁卷)某温度下,在恒容密闭容器中发生反应,有关数据如下:
时间段/ 产物Z的平均生成速率/
0~2 0.20
0~4 0.15
0~6 0.10
下列说法错误的是
A.时,Z的浓度大于
B.时,加入,此时
C.时,Y的体积分数约为33.3%
D.时,X的物质的量为
14.(2021·浙江卷)一定温度下:在的四氯化碳溶液()中发生分解反应:。在不同时刻测量放出的体积,换算成浓度如下表:
0 600 1200 1710 2220 2820 x
1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是
A.,生成的平均速率为
B.反应时,放出的体积为(标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
15.(2020·浙江卷)一定条件下: 。在测定的相对分子质量时,下列条件中,测定结果误差最小的是( )
A. 温度、压强 B. 温度、压强
C. 温度、压强 D. 温度、压强
16.(2020·浙江卷)溶液与溶液发生反应:,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C. 加入固体,平衡逆向移动
D. 该反应的平衡常数
17.(2020·江苏卷)反应可用于纯硅的制备。下列有关该反应的说法正确的是
A. 该反应 、
B. 该反应的平衡常数
C. 高温下反应每生成1 mol Si需消耗
D 用E表示键能,该反应
考点三 化学反应速率、平衡图像分析
18.(2024·山东卷)逆水气变换反应:。一定压力下,按,物质的量之比投料,,温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为,,温度时反应速率常数k分别为。下列说法错误的是
A.
B.温度下达平衡时反应速率的比值:
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.温度下,改变初始投料比例,可使平衡时各组分摩尔分数与温度时相同
19.(2024·河北卷)在水溶液中,可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与形成配离子达平衡时,与的关系如图。
下列说法正确的是
A.的X、Y转化为配离子时,两溶液中的平衡浓度:
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时
C.由Y和Z分别制备等物质的量的配离子时,消耗的物质的量:
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
20.(2024·黑吉辽卷)异山梨醇是一种由生物质制备的高附加值化学品,时其制备过程及相关物质浓度随时间变化如图所示,后异山梨醇浓度不再变化。下列说法错误的是
A.时,反应②正、逆反应速率相等
B.该温度下的平衡常数:①>②
C.平均速率(异山梨醇)
D.反应②加入催化剂不改变其平衡转化率
21.(2024·江苏卷)二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
①
②
、下,将一定比例、混合气匀速通过装有催化剂的绝热反应管。装置及L1、L2、L3…位点处(相邻位点距离相同)的气体温度、CO和的体积分数如图所示。下列说法正确的是
A.L4处与L5处反应①的平衡常数K相等
B.反应②的焓变
C.L6处的的体积分数大于L5处
D.混合气从起始到通过L1处,CO的生成速率小于的生成速率
22.(2024·湖南卷)恒压下,向某密闭容器中充入一定量的和,发生如下反应:
主反应:
副反应:
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数随投料比x(物质的量之比)的变化关系如图所示,下列说法正确的是
A.投料比x代表
B.曲线c代表乙酸的分布分数
C.,
D.L、M、N三点的平衡常数:
23.(2023·广东卷)催化剂Ⅰ和Ⅱ均能催化反应。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是
A.使用Ⅰ和Ⅱ,反应历程都分4步进行 B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡 D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
24.(2023·海南卷)工业上苯乙烯的生产主要采用乙苯脱氢工艺:。某条件下无催化剂存在时,该反应的正、逆反应速率v随时间t的变化关系如图所示。下列说法正确的是
A.曲线①表示的是逆反应的关系
B.时刻体系处于平衡状态
C.反应进行到时,(为浓度商)
D.催化剂存在时,、都增大
25.(2023·江苏卷)二氧化碳加氢制甲烷过程中的主要反应为
在密闭容器中,、时,平衡转化率、在催化剂作用下反应相同时间所测得的实际转化率随温度的变化如题图所示。的选择性可表示为。下列说法正确的是
A.反应的焓变
B.的平衡选择性随着温度的升高而增加
C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃
D.450℃时,提高的值或增大压强,均能使平衡转化率达到X点的值
26.(2023·湖南卷)向一恒容密闭容器中加入和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A.
B.反应速率:
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
27.(2023·辽宁卷)一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是
A.(Ⅲ)不能氧化
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,(Ⅱ)和(Ⅶ)不能大量共存
D.总反应为:
28.(2023·河北卷)在恒温恒容密闭容器中充入一定量,发生如下反应:
反应②和③的速率方程分别为和,其中分别为反应②和③的速率常数,反应③的活化能大于反应②。测得的浓度随时间的变化如下表。
0 1 2 3 4 5
0.160 0.113 0.080 0.056 0.040 0.028
下列说法正确的是
A.内,X的平均反应速率为
B.若增大容器容积,平衡时Y的产率增大
C.若,平衡时
D.若升高温度,平衡时减小
29.(2023·重庆卷)逆水煤气变换体系中存在以下两个反应:
反应Ⅰ:
反应Ⅱ:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法正确的是
A.反应Ⅰ的,反应Ⅱ的
B.点反应Ⅰ的平衡常数
C.点的压强是的3倍
D.若按投料,则曲线之间交点位置不变
30.(2023·浙江卷)一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
31.(2022·湖南卷)向体积均为1L的两恒容容器中分别充入和发生反应:,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. B.气体的总物质的量:
C.a点平衡常数: D.反应速率:
32.(2022·广东卷)恒容密闭容器中,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是
A.该反应的
B.a为随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入,H2的平衡转化率增大
33.(2022·广东卷)在相同条件下研究催化剂I、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,内,
34.(2022·北京卷)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
下列说法不正确的是
A.反应①为CaO+CO2=CaCO3;反应②为CaCO3+CH4CaO+2CO+2H2
B.t1~t3,n(H2)比n(CO)多,且生成H2速率不变,可能有副反应CH4C+2H2
C.t2时刻,副反应生成H2的速率大于反应②生成H2速率
D.t3之后,生成CO的速率为0,是因为反应②不再发生
35.(2022·江苏卷)乙醇-水催化重整可获得。其主要反应为,,在、时,若仅考虑上述反应,平衡时和CO的选择性及的产率随温度的变化如图所示。
CO的选择性,下列说法正确的是
A.图中曲线①表示平衡时产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大可提高乙醇平衡转化率
D.一定温度下,加入或选用高效催化剂,均能提高平衡时产率
36.(2021·广东卷)反应经历两步:①;②。反应体系中、、的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为随t的变化曲线
B.时,
C.时,的消耗速率大于生成速率
D.后,
37.(2021·河北卷)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是
A.0~30min时间段内,Y的平均反应速率为6.67×10-8mol L-1 min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
38.(2021·湖南卷)已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态I,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B.时改变的条件:向容器中加入C
C.平衡时A的体积分数:
D.平衡常数K:
39.(2020·江苏卷)CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A. 升高温度、增大压强均有利于提高CH4的平衡转化率
B. 曲线B表示CH4的平衡转化率随温度的变化
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
专题14 化学反应速率与化学平衡
考向 五年考情(2020-2024) 命题趋势
考点一 化学反应速率 2024·甘肃卷;2024·江苏卷;2024·安徽卷;2023·山东卷;2021·湖南卷 分析近5年高考化学选择题,对于化学反应速率和化学平衡内容的考查不算太多,这是因为在主观题中,化学反应速率和化学平衡才是考查的重头戏,不过随着新高考单科卷的实行,有关化学反应速率和化学平衡试题的考查在选择题中开始有所增加,考查的核心知识还是有关化学反应速率的比较、计算和影响因素的判断,化学平衡常数、转化率、物质的浓度的计算,以及平衡移动原理的分析等,常结合坐标图像或表格进行考查。
考点二 化学平衡及其移动 2024·浙江6月卷;2023·北京卷;2022·天津卷;2022·重庆卷;2022·江苏卷;2022·浙江卷;2022·北京卷;2022·辽宁卷;2021·浙江卷;2020·江苏卷
考点三 化学反应速率、平衡图像分析 2024·山东卷;2024·河北卷;2024·黑吉辽卷;2024·江苏卷;2024·湖南卷;2023·广东卷;2023·江苏卷;2023·湖南卷;2023·辽宁卷;2023·河北卷;2023·重庆卷;2022·湖南卷;2022·广东卷;2022·广东卷;2022·北京卷;2022·江苏卷;2021·广东卷等
考点一 化学反应速率
1.(2024·甘肃卷)下列措施能降低化学反应速率的是
A.催化氧化氨制备硝酸时加入铂 B.中和滴定时,边滴边摇锥形瓶
C.锌粉和盐酸反应时加水稀释 D.石墨合成金刚石时增大压强
【答案】C
【解析】A.催化剂可以改变化学反应速率,一般来说,催化剂可以用来加快化学反应速率,故催化氧化氨制备硝酸时加入铂可以加快化学反应速率,A项不符合题意;
B.中和滴定时,边滴边摇锥形瓶,可以让反应物快速接触,可以加快化学反应速率,B项不符合题意;
C.锌粉和盐酸反应时加水稀释会降低盐酸的浓度,会降低化学反应速率,C项符合题意;
D.石墨合成金刚石,该反应中没有气体参与,增大压强不会改变化学反应速率,D项不符合题意;
故选C。
2.(2024·江苏卷)催化剂能改变化学反应速率而不改变反应的焓变,常见倠化剂有金属及其氧化物、酸和碱等。倠化反应广泛存在,如豆科植物固氮、石墨制金刚石、和制(二甲醚)、倠化氧化等。催化剂有选择性,如与反应用Ag催化生成(环氧乙烷)、用催化生成。催化作用能消除污染和影响环境,如汽车尾气处理、废水中电倠化生成、氯自由基催化分解形成臭氧空洞。我国在石油催化领域领先世界,高效、经济、绿色是未来催化剂研究的发展方向。下列说法正确的是
A.豆科植物固氮过程中,固氮酶能提高该反应的活化能
B.与反应中,Ag催化能提高生成的选择性
C.制反应中,能加快化学反应速率
D.与反应中,能减小该反应的焓变
【答案】C
【解析】固氮酶是豆科植物固氮过程的催化剂,能降低该反应的活化能,A错误;
B.根据题意,催化剂有选择性,如C2H4与O2反应用Ag催化生成(环氧乙烷)、用CuCl2/PdCl2催化生成CH3CHO,则判断Ag催化不能提高生成CH3CHO的选择性,B错误;
C. MnO2是H2O2制O2反应的催化剂,能加快化学反应速率,C正确;
D. V2O5是SO2与O2反应的催化剂,能加快反应速率,但不能改变该反应的焓变,D错误;
故选C。
3.(2024·安徽卷)室温下,为探究纳米铁去除水样中的影响因素,测得不同条件下浓度随时间变化关系如下图。
实验序号 水样体积/ 纳米铁质量/ 水样初始
① 50 8 6
② 50 2 6
③ 50 2 8
下列说法正确的是
A.实验①中,0~2小时内平均反应速率
B.实验③中,反应的离子方程式为:
C.其他条件相同时,适当增加纳米铁质量可加快反应速率
D.其他条件相同时,水样初始越小,的去除效果越好
【答案】C
【解析】A. 实验①中,0~2小时内平均反应速率,A不正确;
B. 实验③中水样初始=8,溶液显弱碱性,发生反应的离子方程式中不能用配电荷守恒,B不正确;
C. 综合分析实验①和②可知,在相同时间内,实验①中浓度的变化量大,因此,其他条件相同时,适当增加纳米铁质量可加快反应速率,C正确;
D. 综合分析实验③和②可知,在相同时间内,实验②中浓度的变化量大,因此,其他条件相同时,适当减小初始,的去除效果越好,但是当初始太小时,浓度太大,纳米铁与反应速率加快,会导致与反应的纳米铁减少,因此,当初始越小时的去除效果不一定越好,D不正确;
综上所述,本题选C。
4.(2023·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10mol L-1,TFAA的浓度为0.08mol L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是
A.t1时刻,体系中有E存在
B.t2时刻,体系中无F存在
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08mol L-1
【答案】AC
【分析】一定条件下,化合物E和TFAA合成H的反应路径中,共发生三个反应:
①E+TFAAF ②FG ③GH+TFAA
t1之后的某时刻,H为0.02 mol L-1,此时TFAA的浓度仍为0,则表明0.10mol L-1E、起始时的0.08mol L-1TFAA、G分解生成的0.02 mol L-1 TFAA全部参加反应,生成0.10mol L-1F;在t2时刻,H为0.08mol L-1,TFAA为0.06mol L-1,G为0.01 mol L-1,则F为0.01 mol L-1。
【解析】A.t1时刻,H的浓度小于0.02 mol L-1,此时反应③生成F的浓度小于0.02 mol L-1,参加反应①的H的浓度小于0.1 mol L-1,则参加反应E的浓度小于0.1 mol L-1,所以体系中有E存在,A正确;
B.由分析可知,t2时刻,H为0.08mol L-1,TFAA为0.06mol L-1,G为0.01 mol L-1,则F为0.01 mol L-1,所以体系中有F存在,B不正确;
C.t1之后的某时刻,H为0.02 mol L-1,此时TFAA的浓度仍为0,表明此时E和TFAA完全反应生成F,所以E和TFAA生成F的反应速率快,反应的活化能很小,C正确;
D.在t2时刻,H为0.08mol L-1,TFAA为0.06mol L-1,G为0.01 mol L-1,F为0.01 mol L-1,只有F、G全部转化为H和TFAA时,TFAA的浓度才能为0.08mol L-1,而GH+TFAA为可逆反应,所以反应达平衡后,TFAA的浓度一定小于0.08mol L-1,D不正确;
故选AC。
5.(2021·湖南卷)铁的配合物离子(用表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是
A.该过程的总反应为
B.浓度过大或者过小,均导致反应速率降低
C.该催化循环中元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
【答案】D
【解析】
A.由反应机理可知,HCOOH电离出氢离子后,HCOO-与催化剂结合,放出二氧化碳,然后又结合氢离子转化为氢气,所以化学方程式为HCOOHCO2↑+H2↑,故A正确;
B.若氢离子浓度过低,则反应Ⅲ→Ⅳ的反应物浓度降低,反应速率减慢,若氢离子浓度过高,则会抑制加酸的电离,使甲酸根浓度降低,反应Ⅰ→Ⅱ速率减慢,所以氢离子浓度过高或过低,均导致反应速率减慢,故B正确;
C.由反应机理可知,Fe在反应过程中,化学键数目发生变化,则化合价也发生变化,故C正确;
D.由反应进程可知,反应Ⅳ→Ⅰ能垒最大,反应速率最慢,对该过程的总反应起决定作用,故D错误;
故选D。
考点二 化学平衡及其移动
6.(2024·浙江6月卷)二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
I.
II.
向容积为的密闭容器中投入和,不同温度下,测得时(反应均未平衡)的相关数据见下表,下列说法不正确的是
温度() 400 500 600
乙烷转化率() 2.2 9.0 17.8
乙烯选择性() 92.6 80.0 61.8
注:乙烯选择性
A.反应活化能:
B.时,反应I的平均速率为:
C.其他条件不变,平衡后及时移除,可提高乙烯的产率
D.其他条件不变,增大投料比投料,平衡后可提高乙烷转化率
【答案】D
【解析】由表可知,相同温度下,乙烷在发生转化时,反应Ⅰ更易发生,则反应活化能:Ⅰ<Ⅱ,A正确;由表可知,500℃时,乙烷的转化率为9.0%,可得转化的乙烷的总物质的量为2mol×9.0%=0.18mol,而此温度下乙烯的选择性为80%,则转化为乙烯的乙烷的物质的量为0.18mol×80%=0.144mol,根据方程式可得,生成乙烯的物质的量为0.144mol,则反应I的平均速率为:,B正确;其他条件不变,平衡后及时移除,反应Ⅰ正向进行,可提高乙烯的产率,C正确;其他条件不变,增大投料比投料,平衡后CO2转化率提高,C2H6转化率降低,D错误。
7.(2023·北京卷)下列事实能用平衡移动原理解释的是
A.溶液中加入少量固体,促进分解
B.密闭烧瓶内的和的混合气体,受热后颜色加深
C.铁钢放入浓中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀反应过程中,加入少量固体,促进的产生
【答案】B
【解析】A.MnO2会催化 H2O2分解,与平衡移动无关,A项错误;
B.NO2转化为N2O4 的反应是放热反应,升温平衡逆向移动, NO2浓度增大,混合气体颜色加深,B项正确;
C.铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C项错误;
D.加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D项错误;
故选B。
8.(2022·天津卷)向恒温恒容密闭容器中通入2mol 和1mol ,反应达到平衡后,再通入一定量,达到新平衡时,下列有关判断错误的是
A.的平衡浓度增大 B.反应平衡常数增大
C.正向反应速率增大 D.的转化总量增大
【答案】B
【解析】A.平衡后,再通入一定量,平衡正向移动,的平衡浓度增大,A正确;
B.平衡常数是与温度有关的常数,温度不变,平衡常数不变,B错误;
C.通入一定量,反应物浓度增大,正向反应速率增大,C正确;
D.通入一定量,促进二氧化硫的转化,的转化总量增大,D正确;
故选B。
9.(2022·重庆卷)两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) p1=3.6×104Pa
反应2:2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) p2=4×103Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是
A.反应2的平衡常数为4×106Pa2 B.通入NH3,再次平衡后,总压强增大
C.平衡后总压强为4.36×105Pa D.缩小体积,再次平衡后总压强不变
【答案】B
【解析】A.反应2的平衡常数为,A正确;
B.刚性密闭容器,温度不变平衡常数不变,再次达平衡后,容器内各气体分压不变,总压强不变,B错误;
C., ,,,所以总压强为:,C正确;
D.达平衡后,缩小体积,平衡逆向移动,温度不变,平衡常数不变,再次平衡后总压强不变,D正确;
故选B。
10.(2022·江苏卷)用尿素水解生成的催化还原,是柴油机车辆尾气净化的主要方法。反应为,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中消耗,转移电子的数目为
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
【答案】B
【解析】A.由方程式可知,该反应是一个气体分子数增大的反应,即熵增的反应,反应△S>0,故A错误;
B.由方程式可知,反应平衡常数,故B正确;
C.由方程式可知,反应每消耗4mol氨气,反应转移12mol电子,则反应中消耗1mol氨气转移电子的数目为3mol×4××6.02×1023=3×6.02×1023,故C错误;
D.实际应用中,加入尿素的量越多,尿素水解生成的氨气过量,柴油机车辆排放的氨气对空气污染程度增大,故D错误;
故选B。
11.(2022·浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
A.实验①,,
B.实验②,时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
【答案】C
【解析】A.实验①中,0~20min,氨气浓度变化量为2.4010-3mol/L-2.0010-3mol/L=4.0010-4mol/L,v(NH3)==2.0010-5mol/(L·min),反应速率之比等于化学计量数之比,v(N2)=v(NH3)=1.0010-5mol/(L·min),A正确;
B.催化剂表面积大小只影响反应速率,不影响平衡,实验③中氨气初始浓度与实验①中一样,实验③达到平衡时氨气浓度为4.0010-4mol/L,则实验①达平衡时氨气浓度也为4.0010-4mol/L,而恒温恒容条件下,实验②相对于实验①为减小压强,平衡正向移动,因此实验②60min时处于平衡状态,x<0.4,即x≠0.4,B正确;
C.实验①、实验②中0~20min、20min~40min氨气浓度变化量都是4.0010-4mol/L,实验②中60min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨气初始浓度是实验②中氨气初始浓度的两倍,实验①60min时反应未达到平衡状态,相同条件下,增加氨气浓度,反应速率并没有增大,C错误;
D.对比实验①和实验③,氨气浓度相同,实验③中催化剂表面积是实验①中催化剂表面积的2倍,实验③先达到平衡状态,实验③的反应速率大,说明相同条件下,增加催化剂的表面积,反应速率增大,D正确;
答案选C。
12.(2022·北京卷)某多孔材料孔径大小和形状恰好将“固定”,能高选择性吸附。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
已知:
下列说法不正确的是
A.温度升高时不利于吸附
B.多孔材料“固定”,促进平衡正向移动
C.转化为的反应是
D.每获得时,转移电子的数目为
【答案】D
【分析】废气经过MOFs材料之后,NO2转化成N2O4被吸附,进而与氧气和水反应生成硝酸,从该过程中我们知道,NO2转化为N2O4的程度,决定了整个废气处理的效率。
【解析】A.从可以看出,这个是一个放热反应,升高温度之后,平衡逆向移动,导致生成的N2O4减少,不利于NO2的吸附,A正确;
B.多孔材料“固定”,从而促进平衡正向移动,B正确;
C.N2O4和氧气、水反应生成硝酸,其方程式为,C正确;
D.在方程式中,转移的电子数为4e-,则每获得,转移的电子数为0.4mol,即个数为,D错误;
故选D。
13.(2022·辽宁卷)某温度下,在恒容密闭容器中发生反应,有关数据如下:
时间段/ 产物Z的平均生成速率/
0~2 0.20
0~4 0.15
0~6 0.10
下列说法错误的是
A.时,Z的浓度大于
B.时,加入,此时
C.时,Y的体积分数约为33.3%
D.时,X的物质的量为
【答案】B
【解析】A.反应开始一段时间,随着时间的延长,反应物浓度逐渐减小,产物Z的平均生成速率逐渐减小,则内Z的平均生成速率大于内的,故时,Z的浓度大于,A正确;
B.时生成的Z的物质的量为,时生成的Z的物质的量为,故反应在时已达到平衡,设达到平衡时生了,列三段式:
根据,得,则Y的平衡浓度为,Z的平衡浓度为,平衡常数,时Y的浓度为,Z的浓度为,加入后Z的浓度变为,,反应正向进行,故,B错误;
C.反应生成的Y与Z的物质的量之比恒等于1∶2,反应体系中只有Y和Z为气体,相同条件下,体积之比等于物质的量之比,,故Y的体积分数始终约为33.3%,C正确;
D.由B项分析可知时反应处于平衡状态,此时生成Z为,则X的转化量为,初始X的物质的量为,剩余X的物质的量为,D正确;
故答案选B。
14.(2021·浙江卷)一定温度下:在的四氯化碳溶液()中发生分解反应:。在不同时刻测量放出的体积,换算成浓度如下表:
0 600 1200 1710 2220 2820 x
1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是
A.,生成的平均速率为
B.反应时,放出的体积为(标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
【答案】D
【解析】
A.,的变化量为(0.96-0.66)==0.3,在此时间段内的变化量为其2倍,即0.6,因此,生成的平均速率为,A说法不正确;
B.由表中数据可知,反应时,的变化量为(1.40-0.35)==1.05,其物质的量的变化量为1.050.1L=0.105mol,的变化量是其,即0.0525mol,因此,放出的在标准状况下的体积为0.0525mol 22.4L/mol=,B说法不正确;
C.反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,,C说法不正确;
D.分析表中数据可知,该反应经过1110s(600-1710,1710-2820)后的浓度会变为原来的,因此,的浓度由0.24变为0.12时,可以推测上表中的x为(2820+1110)=3930,D说法正确。
综上所述,本题选D。
15.(2020·浙江卷)一定条件下: 。在测定的相对分子质量时,下列条件中,测定结果误差最小的是( )
A. 温度、压强 B. 温度、压强
C. 温度、压强 D. 温度、压强
【答案】D
【解析】测定二氧化氮的相对分子质量,要使测定结果误差最小,应该使混合气体中NO2的含量越多越好,为了实现该目的,应该改变条件使平衡尽可以地逆向移动。该反应是一个反应前后气体分子数减小的放热反应,可以通过减小压强、升高温度使平衡逆向移动,则选项中,温度高的为130℃,压强低的为50kPa,结合二者选D。答案为D。
16.(2020·浙江卷)溶液与溶液发生反应:,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C. 加入固体,平衡逆向移动
D. 该反应的平衡常数
【答案】D
【解析】加入苯振荡,苯将I2萃取到苯层,水溶液中c(I2)减小,平衡正向移动,A正确;将5mL0.1mol/LKI溶液与1mL0.1mol/LFeCl3溶液混合,参与反应的Fe3+与I-物质的量之比为1:1,反应后I-一定过量,经苯2次萃取分离后,在水溶液中加入KSCN溶液呈血红色,说明水溶液中仍含有Fe3+,即Fe3+没有完全消耗,表明该化学反应存在限度,B正确;加入FeSO4固体溶于水电离出Fe2+,c(Fe2+)增大,平衡逆向移动,C正确;该反应的平衡常数K=,D错误;答案选D。
17.(2020·江苏卷)反应可用于纯硅的制备。下列有关该反应的说法正确的是
A. 该反应 、
B. 该反应的平衡常数
C. 高温下反应每生成1 mol Si需消耗
D 用E表示键能,该反应
【答案】B
【解析】SiCl4、H2、HCl为气体,且反应前气体系数之和小于反应后气体系数之和,因此该反应为熵增,即△S>0,故A错误;根据化学平衡常数的定义,该反应的平衡常数K=,故B正确;
高温不是标准状况下,因此不能直接用22.4L·mol-1计算,故C错误;△H=反应物键能总和-生成物键能总和,即△H=4E(Si-Cl)+2E(H-H)-4E(H-Cl) -2E(Si-Si),故D错误;答案为B。
考点三 化学反应速率、平衡图像分析
18.(2024·山东卷)逆水气变换反应:。一定压力下,按,物质的量之比投料,,温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为,,温度时反应速率常数k分别为。下列说法错误的是
A.
B.温度下达平衡时反应速率的比值:
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.温度下,改变初始投料比例,可使平衡时各组分摩尔分数与温度时相同
【答案】CD
【分析】由图可知,T1比T2反应速率速率快,则T1>T2;T1温度下达到平衡时反应物的摩尔分数低于T2温度下平衡时;由于起始CO2与H2的物质的量之比为1∶1,则达到平衡时CO2和H2的摩尔分数相等。
【解析】A.根据分析,T1比T2反应速率速率快,反应速率常数与温度有关,结合反应速率方程知k1>k2,A项正确;
B.反应的速率方程为v=kc0.5(H2)c(CO2),则,T1温度下达到平衡时反应物的摩尔分数低于T2温度下平衡时,则,B项正确;
C.温度不变,仅改变体系初始压力,虽然平衡不移动,但反应物的浓度改变,反应速率改变,反应达到平衡的时间改变,反应物摩尔分数随时间的变化曲线变化,C项错误;
D.T2温度下,改变初始投料比,相当于改变某一反应物的浓度,达到平衡时H2和CO2的摩尔分数不可能相等,故不能使平衡时各组分摩尔分数与T1温度时相同,D项错误;
答案选CD。
19.(2024·河北卷)在水溶液中,可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与形成配离子达平衡时,与的关系如图。
下列说法正确的是
A.的X、Y转化为配离子时,两溶液中的平衡浓度:
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时
C.由Y和Z分别制备等物质的量的配离子时,消耗的物质的量:
D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
【答案】B
【解析】A.的X、Y转化为配离子时,溶液中,则,根据图像可知,纵坐标约为时,溶液中,则溶液中的平衡浓度:,A错误;
B.Q点时,即,加入少量可溶性Y盐后,会消耗形成Y配离子,使得溶液中减小(沿横坐标轴向右移动),与曲线在Q点相交后,随着继续增大,X对应曲线位于Z对应曲线上方,即,则,B正确;
C.设金属离子形成配离子的离子方程式为金属离子配离子,则平衡常数,,即,故X、Y、Z三种金属离子形成配离子时结合的越多,对应曲线斜率越大,由题图知,曲线斜率:,则由Y、Z制备等物质的量的配离子时,消耗的物质的量:,C错误;
D.由P点状态移动到形成Y配离子的反应的平衡状态时,不变,增大,即增大、c(Y配离子)减小,则P点状态Y配离子的解离速率>生成速率,D错误;
本题选B。
20.(2024·黑吉辽卷)异山梨醇是一种由生物质制备的高附加值化学品,时其制备过程及相关物质浓度随时间变化如图所示,后异山梨醇浓度不再变化。下列说法错误的是
A.时,反应②正、逆反应速率相等
B.该温度下的平衡常数:①>②
C.平均速率(异山梨醇)
D.反应②加入催化剂不改变其平衡转化率
【答案】A
【解析】A.由图可知,3小时后异山梨醇浓度继续增大,后异山梨醇浓度才不再变化,所以时,反应②未达到平衡状态,即正、逆反应速率不相等,故A错误;
B.图像显示该温度下,后所有物质浓度都不再变化,且此时山梨醇转化完全,即反应充分,而1,4-失水山梨醇仍有剩余,即反应②正向进行程度小于反应①、反应限度小于反应①,所以该温度下的平衡常数:①>②,故B正确;
C.由图可知,在内异山梨醇的浓度变化量为0.042mol/kg,所以平均速率(异山梨醇)=,故C正确;
D.催化剂只能改变化学反应速率,不能改变物质平衡转化率,所以反应②加入催化剂不改变其平衡转化率,故D正确;
故答案为:A。
21.(2024·江苏卷)二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
①
②
、下,将一定比例、混合气匀速通过装有催化剂的绝热反应管。装置及L1、L2、L3…位点处(相邻位点距离相同)的气体温度、CO和的体积分数如图所示。下列说法正确的是
A.L4处与L5处反应①的平衡常数K相等
B.反应②的焓变
C.L6处的的体积分数大于L5处
D.混合气从起始到通过L1处,CO的生成速率小于的生成速率
【答案】C
【解析】L4处与L5处的温度不同,故反应①的平衡常数K不相等,A错误;由图像可知,L1-L3温度在升高,该装置为绝热装置,反应①为吸热反应,所以反应②为放热反应,ΔH2<0,B错误;从L5到L6,甲醇的体积分数逐渐增加,说明反应②在向右进行,反应②消耗 CO,而 CO 体积分数没有明显变化,说明反应①也在向右进行,反应①为气体分子数不变的反应,其向右进行时,n(H2O) 增大,反应②为气体分子数减小的反应,且没有H2O的消耗与生成,故 n总减小而n(H O)增加,即H2O的体积分数会增大,故L6处的 H2O的体积分数大于L5处,C正确;L1处CO 的体积分数大于 CH3OH,说明生成的 CO 的物质的量大于CH3OH,两者反应时间相同,说明CO的生成速率大于 CH3OH的生成速率,D错误。
22.(2024·湖南卷)恒压下,向某密闭容器中充入一定量的和,发生如下反应:
主反应:
副反应:
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数随投料比x(物质的量之比)的变化关系如图所示,下列说法正确的是
A.投料比x代表
B.曲线c代表乙酸的分布分数
C.,
D.L、M、N三点的平衡常数:
【答案】D
【解析】题干明确指出,图中曲线表示的是测得两种含碳产物的分布分数即分别为、,若投料比x代表,x越大,可看作是CH3OH的量增多,则对于主、副反应可知生成的CH3COOCH3越多,CH3COOCH3分布分数越高,则曲线a或曲线b表示CH3COOCH3分布分数,曲线c或曲线d表示CH3COOH分布分数,据此分析可知AB均正确,可知如此假设错误,则可知投料比x代表,曲线a或曲线b表示,曲线c或曲线d表示。根据分析可知,投料比x代表,A错误;曲线c表示CH3COOCH3分布分数,B错误;曲线a或曲线b表示,当同一投料比时,观察图像可知T2时大于T1时,而可知,温度越高则越大,说明温度升高主反应的平衡正向移动,;曲线c或曲线d表示,当同一投料比时,观察可知T1时大于T2时,而可知,温度越高则越小,说明温度升高副反应的平衡逆向移动,,C错误;L、M、N三点对应副反应,且,升高温度平衡逆向移动,,D正确。
23.(2023·广东卷)催化剂Ⅰ和Ⅱ均能催化反应。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是
A.使用Ⅰ和Ⅱ,反应历程都分4步进行 B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡 D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
【答案】C
【解析】A.由图可知两种催化剂均出现四个波峰,所以使用Ⅰ和Ⅱ,反应历程都分4步进行,A正确;
B.由图可知该反应是放热反应,所以达平衡时,升高温度平衡向左移动,R的浓度增大,B正确;
C.由图可知Ⅰ的最高活化能小于Ⅱ的最高活化能,所以使用Ⅰ时反应速率更快,反应体系更快达到平衡,C错误;
D.由图可知在前两个历程中使用Ⅰ活化能较低反应速率较快,后两个历程中使用Ⅰ活化能较高反应速率较慢,所以使用Ⅰ时,反应过程中M所能达到的最高浓度更大,D正确;
故选C。
24.(2023·海南卷)工业上苯乙烯的生产主要采用乙苯脱氢工艺:。某条件下无催化剂存在时,该反应的正、逆反应速率v随时间t的变化关系如图所示。下列说法正确的是
A.曲线①表示的是逆反应的关系
B.时刻体系处于平衡状态
C.反应进行到时,(为浓度商)
D.催化剂存在时,、都增大
【答案】BD
【解析】A.反应为乙苯制备苯乙烯的过程,开始反应物浓度最大,生成物浓度为0,所以曲线①表示的是正反应的关系,曲线表示的是逆反应的关系,故A错误;
B.t2时,正逆反应速率相等,体系处于平衡状态,故B正确;
C.反应进行到时,反应正向进行,故Q<K,故C错误;
D.催化剂能降低反应的活化能,使反应的、都增大,故D正确;
故选BD。
25.(2023·江苏卷)二氧化碳加氢制甲烷过程中的主要反应为
在密闭容器中,、时,平衡转化率、在催化剂作用下反应相同时间所测得的实际转化率随温度的变化如题图所示。的选择性可表示为。下列说法正确的是
A.反应的焓变
B.的平衡选择性随着温度的升高而增加
C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃
D.450℃时,提高的值或增大压强,均能使平衡转化率达到X点的值
【答案】D
【解析】A.由盖斯定律可知反应的焓变,A错误;
B.为放热反应,升高温度平衡逆向移动,的含量降低,故的平衡选择性随着温度的升高而降低,B错误;
C.由图可知温度范围约为350~400℃时二氧化碳实际转化率最高,为最佳温度范围,C错误;
D.450℃时,提高的值可提高二氧化碳的平衡转化率,增大压强反应I平衡正向移动,可提高二氧化碳的平衡转化率,均能使平衡转化率达到X点的值,D正确。
故选D。
26.(2023·湖南卷)向一恒容密闭容器中加入和一定量的,发生反应:。的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A.
B.反应速率:
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
【答案】B
【解析】A.一定条件下,增大水的浓度,能提高CH4的转化率,即x值越小,CH4的转化率越大,则,故A正确;
B.b点和c点温度相同,CH4的起始物质的量都为1mol,b点x值小于c点,则b点加水多,反应物浓度大,则反应速率:,故B错误;
C.由图像可知,x一定时,温度升高CH4的平衡转化率增大,说明正反应为吸热反应,温度升高平衡正向移动,K增大;温度相同,K不变,则点a、b、c对应的平衡常数:,故C正确;
D.该反应为气体分子数增大的反应,反应进行时压强发生改变,所以温度一定时,当容器内压强不变时,反应达到平衡状态,故D正确;
答案选B。
27.(2023·辽宁卷)一定条件下,酸性溶液与发生反应,(Ⅱ)起催化作用,过程中不同价态含粒子的浓度随时间变化如下图所示。下列说法正确的是
A.(Ⅲ)不能氧化
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,(Ⅱ)和(Ⅶ)不能大量共存
D.总反应为:
【答案】C
【分析】开始一段时间(大约13min前)随着时间的推移Mn(Ⅶ)浓度减小直至为0,Mn(Ⅲ)浓度增大直至达到最大值,结合图像,此时间段主要生成Mn(Ⅲ),同时先生成少量Mn(Ⅳ)后Mn(Ⅳ)被消耗;后来(大约13min后)随着时间的推移Mn(Ⅲ)浓度减少,Mn(Ⅱ)的浓度增大;据此作答。
【解析】A.由图像可知,随着时间的推移Mn(Ⅲ)的浓度先增大后减小,说明开始反应生成Mn(Ⅲ),后Mn(Ⅲ)被消耗生成Mn(Ⅱ),Mn(Ⅲ)能氧化H2C2O4,A项错误;
B.随着反应物浓度的减小,到大约13min时开始生成Mn(Ⅱ),Mn(Ⅱ)对反应起催化作用,13min后反应速率会增大,B项错误;
C.由图像可知,Mn(Ⅶ)的浓度为0后才开始生成Mn(Ⅱ),该条件下Mn(Ⅱ)和Mn(Ⅶ)不能大量共存,C项正确;
D.H2C2O4为弱酸,在离子方程式中应以化学式保留,总反应为2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,D项错误;
答案选C。
28.(2023·河北卷)在恒温恒容密闭容器中充入一定量,发生如下反应:
反应②和③的速率方程分别为和,其中分别为反应②和③的速率常数,反应③的活化能大于反应②。测得的浓度随时间的变化如下表。
0 1 2 3 4 5
0.160 0.113 0.080 0.056 0.040 0.028
下列说法正确的是
A.内,X的平均反应速率为
B.若增大容器容积,平衡时Y的产率增大
C.若,平衡时
D.若升高温度,平衡时减小
【答案】D
【解析】A.由表知内 c(W)=0.16-0.08=0.08mol/L,生成 c(X)=2 c(W)=0.16mol/L,但一部分X转化为Z,造成 c(X)<0.16mol/L,则v(X)<,故A错误;
B.过程①是完全反应,过程②是可逆反应,若增大容器容积相当于减小压强,对反应平衡向气体体积增大的方向移动,即逆向移动,X的浓度增大,平衡时Y的产率减小,故B错误;
C.由速率之比等于系数比,平衡时2v逆(X)=v正(Z),即,2=,若,平衡时,故C错误;
D.反应③的活化能大于反应②, H=正反应活化能-逆反应活化能<0,则,该反应是放热反应,升高温度,平衡逆向移动,则平衡时减小,故D正确;
故选D。
29.(2023·重庆卷)逆水煤气变换体系中存在以下两个反应:
反应Ⅰ:
反应Ⅱ:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法正确的是
A.反应Ⅰ的,反应Ⅱ的
B.点反应Ⅰ的平衡常数
C.点的压强是的3倍
D.若按投料,则曲线之间交点位置不变
【答案】C
【解析】A.随着温度的升高,甲烷含量减小、一氧化碳含量增大,则说明随着温度升高,反应Ⅱ逆向移动、反应Ⅰ正向移动,则反应Ⅱ为放热反应焓变小于零、反应Ⅰ为吸热反应焓变大于零,A错误;
B.点没有甲烷产物,且二氧化碳、一氧化碳含量相等,投料,则此时反应Ⅰ平衡时二氧化碳、氢气、一氧化碳、水的物质的量相等,反应Ⅰ的平衡常数,B错误;
C.点一氧化碳、甲烷物质的量相等,结合反应方程式的系数可知,生成水的总的物质的量为甲烷的3倍,结合阿伏加德罗定律可知,的压强是的3倍,C正确;
D.反应Ⅰ为气体分子数不变的反应、反应Ⅱ为气体分子数减小的反应;若按投料,相当于增加氢气的投料,会使得甲烷含量增大,导致甲烷、一氧化碳曲线之间交点位置发生改变,D错误;
故选C。
30.(2023·浙江卷)一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
【答案】C
【解析】A.反应I、Ⅲ为放热反应,相同物质的量的反应物,反应I放出的热量小于反应Ⅱ放出的热量,反应放出的热量越多,其焓变越小,因此反应焓变:反应I>反应Ⅱ,故A正确;
B.短时间里反应I得到的产物比反应Ⅱ得到的产物多,说明反应I的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应I<反应Ⅱ,故B正确;
C.增加浓度,平衡正向移动,但平衡时产物Ⅱ和产物I的比例可能降低,故C错误;
D.根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,故D正确。
综上所述,答案为C。
31.(2022·湖南卷)向体积均为1L的两恒容容器中分别充入和发生反应:,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. B.气体的总物质的量:
C.a点平衡常数: D.反应速率:
【答案】B
【解析】A.甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程PV=nRT可知,刚开始压强增大的原因是因为容器温度升高,则说明上述反应过程放热,即<0,故A错误;
B.根据A项分析可知,上述密闭溶液中的反应为放热反应,图中a点和c点的压强相等,因甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,则说明甲容器中气体的总物质的量此时相比乙容器在减小即气体总物质的量:na<nc,故B正确;
C.a点为平衡点,此时容器的总压为p,假设在恒温恒容条件下进行,则气体的压强之比等于气体的物质的量(物质的量浓度)之比,所以可设Y转化的物质的量浓度为xmol L 1,则列出三段式如下:,则有,计算得到x=0.75,那么化学平衡常数K=,又甲容器为绝热条件,等效为恒温条件下升温,平衡逆向移动,则平衡常数减小即平衡常数K<12,故C错误;
D.根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即Va正>Vb正,故D错误。
综上所述,答案为B。
32.(2022·广东卷)恒容密闭容器中,在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是
A.该反应的
B.a为随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入,H2的平衡转化率增大
【答案】C
【解析】A.从图示可以看出,平衡时升高温度,氢气的物质的量减少,则平衡正向移动,说明该反应的正反应是吸热反应,即ΔH>0,故A错误;
B.从图示可以看出,在恒容密闭容器中,随着温度升高氢气的平衡时的物质的量减少,则平衡随着温度升高正向移动,水蒸气的物质的量增加,而a曲线表示的是物质的量不随温度变化而变化,故B错误;
C.容器体积固定,向容器中充入惰性气体,没有改变各物质的浓度,平衡不移动,故C正确;
D.BaSO4是固体,向平衡体系中加入BaSO4,不能改变其浓度,因此平衡不移动,氢气的转化率不变,故D错误;
故选C。
33.(2022·广东卷)在相同条件下研究催化剂I、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,内,
【答案】D
【解析】A.由图可知,无催化剂时,随反应进行,生成物浓度也在增加,说明反应也在进行,故A错误;
B.由图可知,催化剂I比催化剂II催化效果好,说明催化剂I使反应活化能更低,反应更快,故B错误;
C.由图可知,使用催化剂II时,在0~2min 内Y的浓度变化了2.0mol/L,而a曲线表示的X的浓度变化了2.0mol/L,二者变化量之比不等于化学计量数之比,所以a曲线不表示使用催化剂II时X浓度随时间t的变化,故C错误;
D.使用催化剂I时,在0~2min 内,Y的浓度变化了4.0mol/L,则(Y) ===2.0,(X) =(Y) =2.0=1.0,故D正确;
答案选D。
34.(2022·北京卷)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
下列说法不正确的是
A.反应①为CaO+CO2=CaCO3;反应②为CaCO3+CH4CaO+2CO+2H2
B.t1~t3,n(H2)比n(CO)多,且生成H2速率不变,可能有副反应CH4C+2H2
C.t2时刻,副反应生成H2的速率大于反应②生成H2速率
D.t3之后,生成CO的速率为0,是因为反应②不再发生
【答案】C
【解析】A.由题干图1所示信息可知,反应①为CaO+CO2=CaCO3,结合氧化还原反应配平可得反应②为,A正确;
B.由题干图2信息可知,t1~t3,n(H2)比n(CO)多,且生成H2速率不变,且反应过程中始终未检测到CO2,在催化剂上有积碳,故可能有副反应,反应②和副反应中CH4和H2的系数比均为1:2,B正确;
C.由题干反应②方程式可知,H2和CO的反应速率相等,而t2时刻信息可知,H2的反应速率未变,仍然为2mmol/min,而CO变为1~2mmol/min之间,故能够说明副反应生成H2的速率小于反应②生成H2速率,C错误;
D.由题干图2信息可知,t3之后,CO的速率为0,CH4的速率逐渐增大,最终恢复到1,说明生成CO的速率为0,是因为反应②不再发生,而后副反应逐渐停止反应,D正确;
答案选C。
35.(2022·江苏卷)乙醇-水催化重整可获得。其主要反应为,,在、时,若仅考虑上述反应,平衡时和CO的选择性及的产率随温度的变化如图所示。
CO的选择性,下列说法正确的是
A.图中曲线①表示平衡时产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大可提高乙醇平衡转化率
D.一定温度下,加入或选用高效催化剂,均能提高平衡时产率
【答案】B
【分析】根据已知反应①,反应②,且反应①的热效应更大,温度升高的时候对反应①影响更大一些,根据选择性的含义,升温时CO选择性增大,同时CO2的选择性减小,所以图中③代表CO的选择性,①代表CO2的选择性,②代表H2的产率,以此解题。
【解析】A.由分析可知②代表H2的产率,故A错误;
B.由分析可知升高温度,平衡时CO的选择性增大,故B正确;
C.一定温度下,增大,可以认为开始时水蒸气物质的量不变,增大乙醇物质的量,乙醇的平衡转化率降低,故C错误;
D.加入或者选用高效催化剂,不会影响平衡时产率,故D错误;
故选B。
36.(2021·广东卷)反应经历两步:①;②。反应体系中、、的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为随t的变化曲线
B.时,
C.时,的消耗速率大于生成速率
D.后,
【答案】D
【分析】
由题中信息可知,反应经历两步:①;②。因此,图中呈不断减小趋势的a线为X的浓度随时间的变化曲线,呈不断增加趋势的线为Z的浓度随时间的变化曲线,先增加后减小的线为Y的浓度随时间的变化曲线。
【解析】
A.X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,由图可知,为随的变化曲线,A正确;
B.由图可知,分别代表3种不同物质的曲线相交于时刻,因此,时,B正确;
C.由图中信息可知,时刻以后,Y的浓度仍在不断减小,说明时刻反应两步仍在向正反应方向发生,而且反应①生成Y的速率小于反应②消耗Y的速率,即时的消耗速率大于生成速率,C正确;
D.由图可知,时刻反应①完成,X完全转化为Y,若无反应②发生,则,由于反应②的发生,时刻Y浓度的变化量为,变化量之比等于化学计量数之比,所以Z的浓度的变化量为,这种关系在后仍成立, 因此,D不正确。
综上所述,本题选D。
37.(2021·河北卷)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M) (k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是
A.0~30min时间段内,Y的平均反应速率为6.67×10-8mol L-1 min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
【答案】A
【解析】
A.由图中数据可知,时,M、Z的浓度分别为0.300和0.125 ,则M的变化量为0.5-0.300 =0.200 ,其中转化为Y的变化量为0.200-0.125 =0.075 。因此,时间段内,Y的平均反应速率为 ,A说法不正确;
B.由题中信息可知,反应①和反应②的速率之比为,Y和Z分别为反应①和反应②的产物,且两者与M的化学计量数相同(化学计量数均为1),因此反应开始后,体系中Y和Z的浓度之比等于 ,由于k1、k2为速率常数,故该比值保持不变,B说法正确;
C.结合A、B的分析可知因此反应开始后,在相同的时间内体系中Y和Z的浓度之比等于=,因此,如果反应能进行到底,反应结束时有 的M转化为Z,即的M转化为Z,C说法正确;
D.由以上分析可知,在相同的时间内生成Z较多、生成Y较少,因此,反应①的化学反应速率较小,在同一体系中,活化能较小的化学反应速率较快,故反应①的活化能比反应②的活化能大,D说法正确。
综上所述,相关说法不正确的只有A,故本题选A。
38.(2021·湖南卷)已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态I,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B.时改变的条件:向容器中加入C
C.平衡时A的体积分数:
D.平衡常数K:
【答案】BC
【分析】
根据图像可知,向恒温恒容密闭容器中充入1molA和3molB发生反应,反应时间从开始到t1阶段,正反应速率不断减小,t1-t2时间段,正反应速率不变,反应达到平衡状态,t2-t3时间段,改变条件使正反应速率逐渐增大,平衡向逆反应方向移动,t3以后反应达到新的平衡状态,据此结合图像分析解答。
【解析】
A.容器内发生的反应为A(g)+2B(g)3C(g),该反应是气体分子数不变的可逆反应,所以在恒温恒容条件下,气体的压强始终保持不变,则容器内压强不变,不能说明反应达到平衡状态,A错误;
B.根据图像变化曲线可知,t2t3过程中,t2时,瞬间不变,平衡过程中不断增大,则说明反应向逆反应方向移动,且不是“突变”图像,属于“渐变”过程,所以排除温度与催化剂等影响因素,改变的条件为:向容器中加入C,B正确;
C.最初加入体系中的A和B的物质的量的比值为1:3,当向体系中加入C时,平衡逆向移动,最终A和B各自物质的量增加的比例为1:2,因此平衡时A的体积分数(II)>(I),C正确;
D.平衡常数K与温度有关,因该反应在恒温条件下进行,所以K保持不变,D错误。
故选BC。
39.(2020·江苏卷)CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A. 升高温度、增大压强均有利于提高CH4的平衡转化率
B. 曲线B表示CH4的平衡转化率随温度的变化
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
【答案】BD
【解析】甲烷和二氧化碳反应是吸热反应,升高温度,平衡向吸热反应即正向移动,甲烷转化率增大,甲烷和二氧化碳反应是体积增大的反应,增大压强,平衡逆向移动,甲烷转化率减小,故A错误;根据两个反应得到总反应为CH4(g)+2CO2(g)===H2(g)+3CO(g) +H2O (g),加入的CH4与CO2物质的量相等,CO2消耗量大于CH4,因此CO2的转化率大于CH4,因此曲线B表示CH4的平衡转化率随温度变化,故B正确;使用高效催化剂,只能提高反应速率,但不能改变平衡转化率,故C错误;800K时甲烷的转化率为X点,可以通过改变二氧化碳的量来提高甲烷的转化率达到Y点的值,故D正确。综上所述,答案为BD。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
