江苏省启东中学2024-2025学年高二上学期第一次月考试题 化学 (含答案)
文档属性
| 名称 | 江苏省启东中学2024-2025学年高二上学期第一次月考试题 化学 (含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-17 15:50:47 | ||
图片预览



文档简介
江苏省启东中学2024~2025学年度第一学期第一次月考
高二化学
注意事项:
1.本试卷分为选择题和非选择题两部分,共100分,考试时间75分钟。
2.将选择题答案涂在答题卡的对应位置上,非选择题的答案卡的指定栏目内。
可能用到的相对原子质量:H:1 C:12 O:16 Cu:64 Zn:65 Ag:108
一、单项选择题:共16题,每题3分,共48分。每题只有一个选项最符合题意。
1. 下列关于化学反应与能量变化的说法正确的是
A. 图1所示装置可将化学能转化为电能
B. 图2可表示晶体与晶体反应的能量变化
C. 图3所示的锌锰干电池中在正极发生还原反应
D. 图4所示装置可验证金属活动性:M2. 下列关于反应+2CO(g) △H=-49 kJ·mol-1的说法不正确的是
A. 保持其他条件不变,平衡时升高温度,v正<v逆
B. 保持其他条件不变,平衡时通入Cl2,达到新平衡时变小
C. 反应生成1 mol TiCl4,转移电子数目为
D. 及时分离出CO,有利于TiCl4生成
3. 某密闭容器中进行如下反应:3X(g)+Y(g)2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y做反应物,则X、Y的初始物质的量之比的范围应满足
A. 1<<3 B. << C. <<4 D. 1<<5
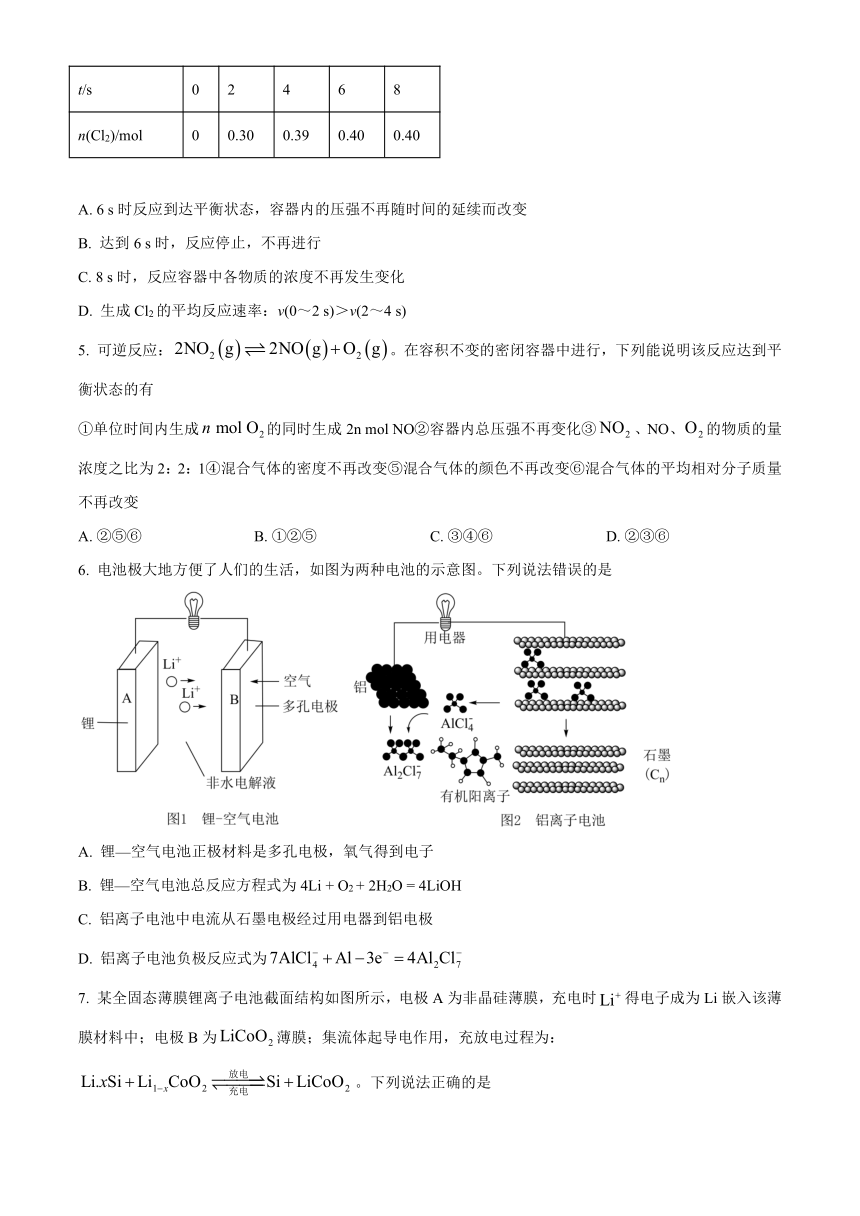
4. 一定条件下,向2 L恒容密闭容器中充入1 mol COCl2(g),发生反应COCl2(g)Cl2(g)+CO(g),反应过程中测得的有关数据如下表所示,下列说法不正确的是
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.30 0.39 0.40 0.40
A. 6 s时反应到达平衡状态,容器内的压强不再随时间的延续而改变
B. 达到6 s时,反应停止,不再进行
C. 8 s时,反应容器中各物质的浓度不再发生变化
D. 生成Cl2的平均反应速率:v(0~2 s)>v(2~4 s)
5. 可逆反应:。在容积不变的密闭容器中进行,下列能说明该反应达到平衡状态的有
①单位时间内生成的同时生成2n mol NO②容器内总压强不再变化③、NO、的物质的量浓度之比为2:2:1④混合气体的密度不再改变⑤混合气体的颜色不再改变⑥混合气体的平均相对分子质量不再改变
A. ②⑤⑥ B. ①②⑤ C. ③④⑥ D. ②③⑥
6. 电池极大地方便了人们的生活,如图为两种电池的示意图。下列说法错误的是
A. 锂—空气电池正极材料是多孔电极,氧气得到电子
B. 锂—空气电池总反应方程式为4Li + O2 + 2H2O = 4LiOH
C. 铝离子电池中电流从石墨电极经过用电器到铝电极
D. 铝离子电池负极反应式为
7. 某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时得电子成为Li嵌入该薄膜材料中;电极B为薄膜;集流体起导电作用,充放电过程为:。下列说法正确的是
A. 放电时非晶硅薄膜是正极
B. 中硅元素的化合价是+4
C 放电时,外电路通过amol电子时,LiPON薄膜电解质损失
D. 放电时正极反应为
8. 温度为时,向恒容密闭容器中充入和,发生反应:,反应过程中的物质的量与部分时间的关系如下图所示。下列说法正确的是
A. 0~50s时,的平均速率
B. 时,容器中物质的量可能为
C. 时,起始向容器中充入和,达平衡时,的物质的量大于
D. 时,起始向容器中充入、和,反应向正方向进行
9. 目前,丁烷脱氢制丁烯研究已取得重大突破,利用计算机技术测得在催化剂表面的反应历程如图所示,其中催化剂表面上的物质用*标注,TS表示过渡态物质。下列说法错误的是
A. 该历程中决速步骤为C4H9*+H*=C4H8*+2H*
B. 催化剂可降低反应活化能
C. C4H10→C4H8+H2,该反应有非极性键形成
D. 该反应的热化学方程式为:C4H10(g)=C4H8(g)+H2(g) △H=+0.06NAeV
10. 在一定温度下,将一定质量混合气体在密闭容器中发生反应aA(g)+bB(g)cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
A. a+b>c+d
B. 平衡向右移动
C. 重新达平衡时,A气体浓度增大
D. 重新达平衡时,B的体积分数减小
11. 分析如下操作对 2NO2N2O4平衡影响的实验,说法正确的是
步骤1:活塞从Ⅰ处→拉至Ⅱ处
步骤2:活塞从Ⅱ处一推向Ⅰ处
A. 步骤1,减小压强,平衡右移
B. 步骤1,混合气颜色变浅,平衡右移
C. 步骤2,浓度商Q<平衡常数K,平衡右移
D. 步骤2,混合气颜色先变深后变浅,变深的原因是生成了更多NO2
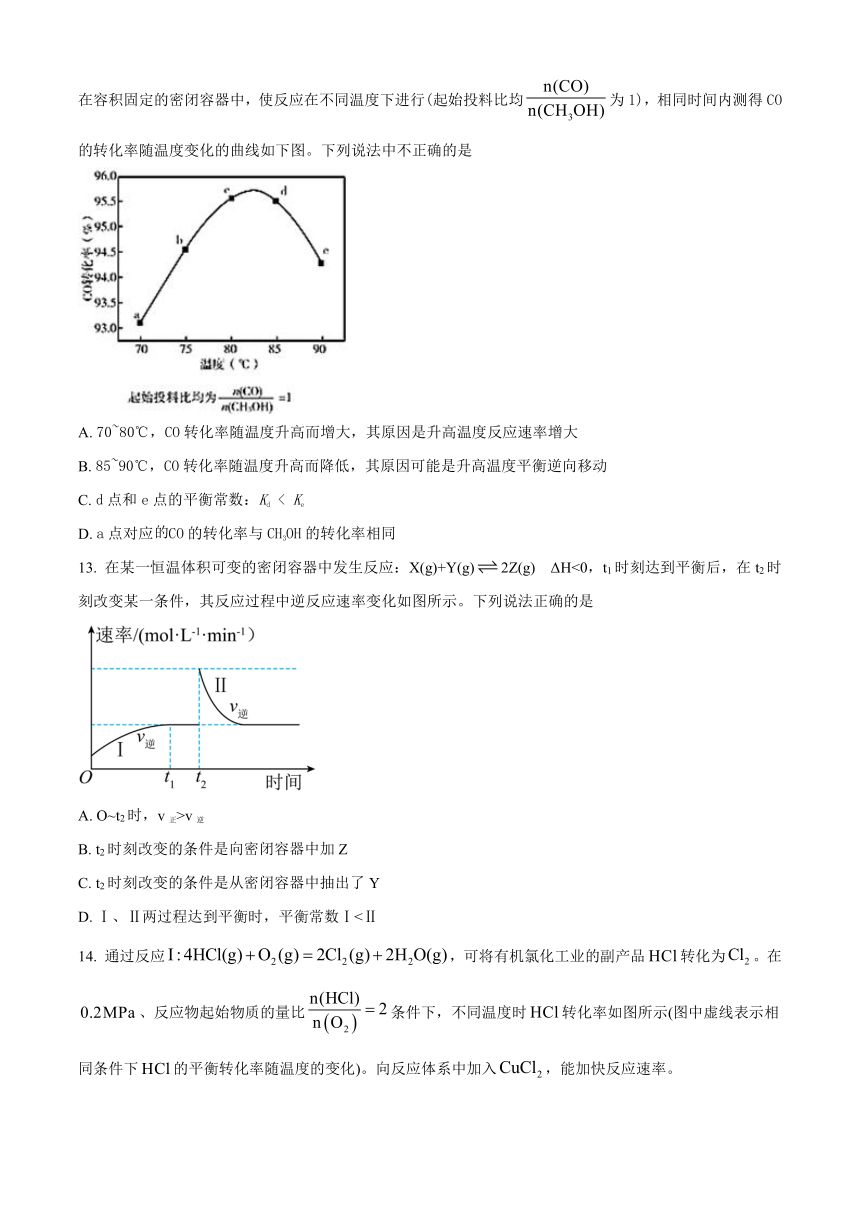
12. 甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
A. 70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B. 85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C. d点和e点的平衡常数:Kd < Ke
D. a点对应CO的转化率与CH3OH的转化率相同
13. 在某一恒温体积可变的密闭容器中发生反应:X(g)+Y(g)2Z(g) ΔH<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程中逆反应速率变化如图所示。下列说法正确的是
A. O~t2时,v正>v逆
B. t2时刻改变的条件是向密闭容器中加Z
C. t2时刻改变的条件是从密闭容器中抽出了Y
D. Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
14. 通过反应,可将有机氯化工业的副产品转化为。在、反应物起始物质的量比条件下,不同温度时转化率如图所示(图中虚线表示相同条件下的平衡转化率随温度的变化)。向反应体系中加入,能加快反应速率。
反应II:
反应III:
下列说法正确的是
A. 反应的
B. 230至时,转化率降低是因为温度升高,平衡向逆反应方向移动
C. 保持其他条件不变,时,使用,能使转化率从点的值升至点的值
D. 在、条件下,若起始条件下,的转化率可能能达到点的值
15. 中科院物理研究所研发的双极膜可充电,电池解决了传统电池的体积与硬度问题,该电池工作原理如图所示:
已知双极膜夹层间的能够解离成和分别向两极移动。下列说法正确的是
A. 放电时,B电极反应为:
B. 放电时,通过a膜移向Zn电极
C. 放电时,电流方向为:B电极→用电器→A电极→双极膜→B电极
D. 放电时,理论上电极A质量减少65g时,需要消耗22.4L
16. 是一种液体燃料。利用和合成的主要反应为
反应Ⅰ
反应Ⅱ
在密闭容器中,,时,平衡转化率、在催化剂作用下反应tmin所测得的实际转化率及的选择性随温度的变化如图所示。的选择性可表示为。
下列说法不正确的是
A. 0~tmin内,240℃下反应Ⅰ的速率比在280℃下大
B. 从220℃~280℃,的平衡产率先增大后缓慢减小
C. 280℃时增大压强,的转化率可能大于40%
D. 需研发低温下转化率高和选择性高的催化剂
二、非选择题:共题,共52分。
17. 工业上可利用或来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(、、)如下表所示:
化学反应 平衡常数符号 平衡常数值
500℃ 700℃ 800℃
① 2.5 0.34 0.15
② 1.0 1.70 2.52
③
请回答下列问题:
(1)根据反应①与②可推导出___________(用、表示);___________0(用“>”或“<”表示);
(2)根据反应①与②可推导出___________(用、表示);
(3)恒温恒容下,对反应①,下列各项可作为该反应达到平衡状态的标志的是___________
A. 压强不再变化 B. 气体密度不再变化
C. 气体平均相对分子质量不再变化 D.
(4)恒容、500℃下,测得反应②在某时刻时,、、、的浓度分别为、、、,则此时___________(填“>”“=”或“<”),达平衡时的浓度为___________
(5)下列图像符合反应③的是___________
A. B.
C. D.
18. 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。
请回答下列问题:
(1)甲池为___________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为___________。
(2)乙池中A(石墨)电极的名称为___________(填“正极”“负极”“阴极”或“阳极”),总反应式为___________。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为___________mL(标准状况),丙池中___________极析出___________g铜。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将___________(填“增大”“减小”或“不变”);丙中溶液的pH将___________(填“增大”“减小”或“不变”),若将丙中溶液复原,需加入___________。
19. 将转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因此加氢制甲醇被广泛关注。与在催化剂作用下主要发生以下反应:
ⅰ.
ⅱ.
ⅲ.
(1) ___________,反应ⅲ在___________ (填“高温”“低温”或“任意温度”)下能自发进行。在恒容绝热条件下,起始投料按充入容器中,若只发生反应ⅲ,则下列可作为该条件下反应ⅲ达到平衡的判断依据的是___________ (填标号)。
A.与的比值不变 B.不变 C.容器内气体压强不变
(2)将1mol和3mol充入体积为2L的密闭容器中,只发生反应ⅰ和ⅱ。在190~250℃、8MPa下,以CuO-ZnO、CuO-Zn@作催化剂,研究反应相同时间在不同催化剂的作用下,转化率、选择性、收率与温度的关系如图a、图b;280~360℃下,在某催化剂作用下探究的平衡转化率及的选择性随温度变化的关系如图c.已知:选择性=(生成目标产物所消耗的反应物的物质的量÷参与反应的反应物的物质的量)×100%。
①分析图a和图b,在该压强下反应的最适宜催化剂为___________。
②分析图c,随着反应温度的升高,平衡转化率增大,但甲醇选择性降低的原因是___________。
③312℃时,若起始压强为,反应ⅱ的___________(为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)工业上还可用电催化制甲醇实现资源综合利用,图示装置(设电解质溶液均呈酸性)工作时,阳极的电极反应式为___________,若阴极只生成甲醇,则每转移6mol电子时,阴极室溶液质量增加___________g。
江苏省启东中学2024~2025学年度第一学期第一次月考
高二化学
注意事项:
1.本试卷分为选择题和非选择题两部分,共100分,考试时间75分钟。
2.将选择题答案涂在答题卡的对应位置上,非选择题的答案卡的指定栏目内。
可能用到的相对原子质量:H:1 C:12 O:16 Cu:64 Zn:65 Ag:108
一、单项选择题:共16题,每题3分,共48分。每题只有一个选项最符合题意。
【1题答案】
【答案】C
【2题答案】
【答案】B
【3题答案】
【答案】D
【4题答案】
【答案】B
【5题答案】
【答案】A
【6题答案】
【答案】B
【7题答案】
【答案】D
【8题答案】
【答案】C
【9题答案】
【答案】A
【10题答案】
【答案】A
【11题答案】
【答案】C
【12题答案】
【答案】C
【13题答案】
【答案】B
【14题答案】
【答案】D
【15题答案】
【答案】C
【16题答案】
【答案】B
二、非选择题:共题,共52分。
【17题答案】
【答案】(1) ①. ②. <
(2) (3)AC
(4) ①. > ②. 0.75 (5)A
【18题答案】
【答案】(1) ①. 原电池 ②.
(2) ①. 阳极 ②.
(3) ①. 280 ②. D ③. 1.6
(4) ①. 减小 ②. 增大 ③. HCl
【19题答案】
【答案】(1) ①. -90.4kJ·mol 1 ②. 低温 ③. BC
(2) ①. Cu-ZnO@ SiO2 ②. 温度升高,反应Ⅱ(吸热反应)平衡正向移动程度大于反应I(放热反应)平衡逆向移动的程度,使CO2的转化率增大;温度升高反应I平衡逆向移动,使甲醇的选择性降低 ③.
(3) ①. 2H2O-4e-=O2↑+4H+ ②. 50
高二化学
注意事项:
1.本试卷分为选择题和非选择题两部分,共100分,考试时间75分钟。
2.将选择题答案涂在答题卡的对应位置上,非选择题的答案卡的指定栏目内。
可能用到的相对原子质量:H:1 C:12 O:16 Cu:64 Zn:65 Ag:108
一、单项选择题:共16题,每题3分,共48分。每题只有一个选项最符合题意。
1. 下列关于化学反应与能量变化的说法正确的是
A. 图1所示装置可将化学能转化为电能
B. 图2可表示晶体与晶体反应的能量变化
C. 图3所示的锌锰干电池中在正极发生还原反应
D. 图4所示装置可验证金属活动性:M
A. 保持其他条件不变,平衡时升高温度,v正<v逆
B. 保持其他条件不变,平衡时通入Cl2,达到新平衡时变小
C. 反应生成1 mol TiCl4,转移电子数目为
D. 及时分离出CO,有利于TiCl4生成
3. 某密闭容器中进行如下反应:3X(g)+Y(g)2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y做反应物,则X、Y的初始物质的量之比的范围应满足
A. 1<<3 B. << C. <<4 D. 1<<5
4. 一定条件下,向2 L恒容密闭容器中充入1 mol COCl2(g),发生反应COCl2(g)Cl2(g)+CO(g),反应过程中测得的有关数据如下表所示,下列说法不正确的是
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.30 0.39 0.40 0.40
A. 6 s时反应到达平衡状态,容器内的压强不再随时间的延续而改变
B. 达到6 s时,反应停止,不再进行
C. 8 s时,反应容器中各物质的浓度不再发生变化
D. 生成Cl2的平均反应速率:v(0~2 s)>v(2~4 s)
5. 可逆反应:。在容积不变的密闭容器中进行,下列能说明该反应达到平衡状态的有
①单位时间内生成的同时生成2n mol NO②容器内总压强不再变化③、NO、的物质的量浓度之比为2:2:1④混合气体的密度不再改变⑤混合气体的颜色不再改变⑥混合气体的平均相对分子质量不再改变
A. ②⑤⑥ B. ①②⑤ C. ③④⑥ D. ②③⑥
6. 电池极大地方便了人们的生活,如图为两种电池的示意图。下列说法错误的是
A. 锂—空气电池正极材料是多孔电极,氧气得到电子
B. 锂—空气电池总反应方程式为4Li + O2 + 2H2O = 4LiOH
C. 铝离子电池中电流从石墨电极经过用电器到铝电极
D. 铝离子电池负极反应式为
7. 某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时得电子成为Li嵌入该薄膜材料中;电极B为薄膜;集流体起导电作用,充放电过程为:。下列说法正确的是
A. 放电时非晶硅薄膜是正极
B. 中硅元素的化合价是+4
C 放电时,外电路通过amol电子时,LiPON薄膜电解质损失
D. 放电时正极反应为
8. 温度为时,向恒容密闭容器中充入和,发生反应:,反应过程中的物质的量与部分时间的关系如下图所示。下列说法正确的是
A. 0~50s时,的平均速率
B. 时,容器中物质的量可能为
C. 时,起始向容器中充入和,达平衡时,的物质的量大于
D. 时,起始向容器中充入、和,反应向正方向进行
9. 目前,丁烷脱氢制丁烯研究已取得重大突破,利用计算机技术测得在催化剂表面的反应历程如图所示,其中催化剂表面上的物质用*标注,TS表示过渡态物质。下列说法错误的是
A. 该历程中决速步骤为C4H9*+H*=C4H8*+2H*
B. 催化剂可降低反应活化能
C. C4H10→C4H8+H2,该反应有非极性键形成
D. 该反应的热化学方程式为:C4H10(g)=C4H8(g)+H2(g) △H=+0.06NAeV
10. 在一定温度下,将一定质量混合气体在密闭容器中发生反应aA(g)+bB(g)cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6mol/l,恒温下将密闭容器的容积扩大一倍,重新达到平衡时,测得B气体的浓度为 0.4mol/l,下列叙述中正确的是( )
A. a+b>c+d
B. 平衡向右移动
C. 重新达平衡时,A气体浓度增大
D. 重新达平衡时,B的体积分数减小
11. 分析如下操作对 2NO2N2O4平衡影响的实验,说法正确的是
步骤1:活塞从Ⅰ处→拉至Ⅱ处
步骤2:活塞从Ⅱ处一推向Ⅰ处
A. 步骤1,减小压强,平衡右移
B. 步骤1,混合气颜色变浅,平衡右移
C. 步骤2,浓度商Q<平衡常数K,平衡右移
D. 步骤2,混合气颜色先变深后变浅,变深的原因是生成了更多NO2
12. 甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
A. 70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B. 85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C. d点和e点的平衡常数:Kd < Ke
D. a点对应CO的转化率与CH3OH的转化率相同
13. 在某一恒温体积可变的密闭容器中发生反应:X(g)+Y(g)2Z(g) ΔH<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程中逆反应速率变化如图所示。下列说法正确的是
A. O~t2时,v正>v逆
B. t2时刻改变的条件是向密闭容器中加Z
C. t2时刻改变的条件是从密闭容器中抽出了Y
D. Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
14. 通过反应,可将有机氯化工业的副产品转化为。在、反应物起始物质的量比条件下,不同温度时转化率如图所示(图中虚线表示相同条件下的平衡转化率随温度的变化)。向反应体系中加入,能加快反应速率。
反应II:
反应III:
下列说法正确的是
A. 反应的
B. 230至时,转化率降低是因为温度升高,平衡向逆反应方向移动
C. 保持其他条件不变,时,使用,能使转化率从点的值升至点的值
D. 在、条件下,若起始条件下,的转化率可能能达到点的值
15. 中科院物理研究所研发的双极膜可充电,电池解决了传统电池的体积与硬度问题,该电池工作原理如图所示:
已知双极膜夹层间的能够解离成和分别向两极移动。下列说法正确的是
A. 放电时,B电极反应为:
B. 放电时,通过a膜移向Zn电极
C. 放电时,电流方向为:B电极→用电器→A电极→双极膜→B电极
D. 放电时,理论上电极A质量减少65g时,需要消耗22.4L
16. 是一种液体燃料。利用和合成的主要反应为
反应Ⅰ
反应Ⅱ
在密闭容器中,,时,平衡转化率、在催化剂作用下反应tmin所测得的实际转化率及的选择性随温度的变化如图所示。的选择性可表示为。
下列说法不正确的是
A. 0~tmin内,240℃下反应Ⅰ的速率比在280℃下大
B. 从220℃~280℃,的平衡产率先增大后缓慢减小
C. 280℃时增大压强,的转化率可能大于40%
D. 需研发低温下转化率高和选择性高的催化剂
二、非选择题:共题,共52分。
17. 工业上可利用或来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(、、)如下表所示:
化学反应 平衡常数符号 平衡常数值
500℃ 700℃ 800℃
① 2.5 0.34 0.15
② 1.0 1.70 2.52
③
请回答下列问题:
(1)根据反应①与②可推导出___________(用、表示);___________0(用“>”或“<”表示);
(2)根据反应①与②可推导出___________(用、表示);
(3)恒温恒容下,对反应①,下列各项可作为该反应达到平衡状态的标志的是___________
A. 压强不再变化 B. 气体密度不再变化
C. 气体平均相对分子质量不再变化 D.
(4)恒容、500℃下,测得反应②在某时刻时,、、、的浓度分别为、、、,则此时___________(填“>”“=”或“<”),达平衡时的浓度为___________
(5)下列图像符合反应③的是___________
A. B.
C. D.
18. 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。
请回答下列问题:
(1)甲池为___________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为___________。
(2)乙池中A(石墨)电极的名称为___________(填“正极”“负极”“阴极”或“阳极”),总反应式为___________。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为___________mL(标准状况),丙池中___________极析出___________g铜。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将___________(填“增大”“减小”或“不变”);丙中溶液的pH将___________(填“增大”“减小”或“不变”),若将丙中溶液复原,需加入___________。
19. 将转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因此加氢制甲醇被广泛关注。与在催化剂作用下主要发生以下反应:
ⅰ.
ⅱ.
ⅲ.
(1) ___________,反应ⅲ在___________ (填“高温”“低温”或“任意温度”)下能自发进行。在恒容绝热条件下,起始投料按充入容器中,若只发生反应ⅲ,则下列可作为该条件下反应ⅲ达到平衡的判断依据的是___________ (填标号)。
A.与的比值不变 B.不变 C.容器内气体压强不变
(2)将1mol和3mol充入体积为2L的密闭容器中,只发生反应ⅰ和ⅱ。在190~250℃、8MPa下,以CuO-ZnO、CuO-Zn@作催化剂,研究反应相同时间在不同催化剂的作用下,转化率、选择性、收率与温度的关系如图a、图b;280~360℃下,在某催化剂作用下探究的平衡转化率及的选择性随温度变化的关系如图c.已知:选择性=(生成目标产物所消耗的反应物的物质的量÷参与反应的反应物的物质的量)×100%。
①分析图a和图b,在该压强下反应的最适宜催化剂为___________。
②分析图c,随着反应温度的升高,平衡转化率增大,但甲醇选择性降低的原因是___________。
③312℃时,若起始压强为,反应ⅱ的___________(为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)工业上还可用电催化制甲醇实现资源综合利用,图示装置(设电解质溶液均呈酸性)工作时,阳极的电极反应式为___________,若阴极只生成甲醇,则每转移6mol电子时,阴极室溶液质量增加___________g。
江苏省启东中学2024~2025学年度第一学期第一次月考
高二化学
注意事项:
1.本试卷分为选择题和非选择题两部分,共100分,考试时间75分钟。
2.将选择题答案涂在答题卡的对应位置上,非选择题的答案卡的指定栏目内。
可能用到的相对原子质量:H:1 C:12 O:16 Cu:64 Zn:65 Ag:108
一、单项选择题:共16题,每题3分,共48分。每题只有一个选项最符合题意。
【1题答案】
【答案】C
【2题答案】
【答案】B
【3题答案】
【答案】D
【4题答案】
【答案】B
【5题答案】
【答案】A
【6题答案】
【答案】B
【7题答案】
【答案】D
【8题答案】
【答案】C
【9题答案】
【答案】A
【10题答案】
【答案】A
【11题答案】
【答案】C
【12题答案】
【答案】C
【13题答案】
【答案】B
【14题答案】
【答案】D
【15题答案】
【答案】C
【16题答案】
【答案】B
二、非选择题:共题,共52分。
【17题答案】
【答案】(1) ①. ②. <
(2) (3)AC
(4) ①. > ②. 0.75 (5)A
【18题答案】
【答案】(1) ①. 原电池 ②.
(2) ①. 阳极 ②.
(3) ①. 280 ②. D ③. 1.6
(4) ①. 减小 ②. 增大 ③. HCl
【19题答案】
【答案】(1) ①. -90.4kJ·mol 1 ②. 低温 ③. BC
(2) ①. Cu-ZnO@ SiO2 ②. 温度升高,反应Ⅱ(吸热反应)平衡正向移动程度大于反应I(放热反应)平衡逆向移动的程度,使CO2的转化率增大;温度升高反应I平衡逆向移动,使甲醇的选择性降低 ③.
(3) ①. 2H2O-4e-=O2↑+4H+ ②. 50
同课章节目录
