江苏省南航附中2015-2016学年高二上学期期末考试化学试题
文档属性
| 名称 | 江苏省南航附中2015-2016学年高二上学期期末考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 342.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-25 20:13:30 | ||
图片预览




文档简介
南航附中2015-2016学年度第一学期期末考试
高 二 化 学
命题人:李玉屏 审核人:王秀芳
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24
Al-27 Cl-35.5 Fe-56 Cu-64 Ag-108 [来源CCccC:21世纪教育网]
一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本部分23题,每小题3分,共69分)。
1.中共十八大报告中提出:“加强生态文明 ( http: / / www.21cnjy.com )宣传教育,增强全民节约意识、环保意识、生态意识,形成合理消费的社会风尚,营造爱护生态环境的良好风气。”下列行为不利于“生态文明”建设的是
A.在化学反应中要考虑“原子经济性”以提高效率
B.资源的开发和利用,要考虑可持续发展的原则
C.要加强对工业“三废”的治理,以保护环境
D.将废弃的塑料袋回收进行露天焚烧,以解决“白色污染”问题
2.下列表示物质结构的化学用语或模型正确的是
A.苯分子的比例模型: B.CO2的电子式:
C.Cl-离子的结构示意图: D.乙烯的结构式:CH2=CH2
3.下列物质中只含有共价键的是
A.N2 B.MgCl2 C.Na2O D.Na2O2
4.下列有关铝的叙述中不正确的是( )
A.铝合金的强度和硬度都比纯铝的大
B.铝制的容器可以贮存浓硫酸或浓硝酸
C.铝表面的氧化膜可用盐酸或氢氧化钠溶液除去
D.将金属钠加入到氯化铝溶液中可制得铝
5.能在强酸性溶液中大量共存的一组离子是
A.K+、Fe2+、Cl―、 B.Na+、Ba2+、Cl―、
C.、Fe3+、Cl―、SCN― D.K+、Mg2+、、
6.漂白粉常用于消毒和漂白,其中的有效成分属于
A. 氧化物 B.酸 C.碱 D.盐
7.I可用于治疗甲亢,有关I的说法正确的是( )
A. 中子数为131 B. 质子数为131 C. 电子数53 D. 质量数53
8.乙醇和乙酸是生活中两种常见的有机物。下列说法正确的是( )
A. 乙醇、乙酸互为同分异构体
B. 乙醇、乙酸都能与钠反应
C. 乙醇、乙酸都能与NaOH溶液反应
D. 乙醇、乙酸都能使紫色石蕊试液变红色
9.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X Y Z
① NaOH溶液 Al(OH)3 稀硫酸
② KOH溶液 SiO2 稀盐酸
③ O2 N2 H2
④ FeCl3溶液 Cu 浓硝酸
A、①③ B、①④ C、②④ D、②③
10.下列反应的离子方程式书写正确的是
A.氢氧化钠溶液中通入氯气:Cl2+OH―ClO―+Cl―+H2O
B.铁与硫酸铁溶液反应:Fe+Fe3+2Fe2+
C.氢氧化镁与稀盐酸反应:Mg(OH)2+2H+Mg2++2H2O
D.碳酸氢钠溶液中滴入氢氧化钠溶液:OH―+H2O+CO2↑
11.反应4NH3+5O24NO+6H2O是工业制硝酸的重要一步,有关该反应的说法正确的是
A.NH3是氧化剂 B.NH3被氧化
C.NO只是还原剂 D.生成60gNO转移的5mol电子
12.下列离子的检验方法和结论正确的是
A.向某溶液中滴加几滴双氧水后再滴加2滴KSCN溶液,溶液变成血红色,则原溶液中一定含有Fe2+
B.向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则原溶液中一定含有SO42-
C.向某溶液中加入稀盐酸产生无色气体, 产生的气体使澄清石灰水变浑浊,则原溶液中一定有CO32-
D.向某溶液中滴加NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定含 有NH4+
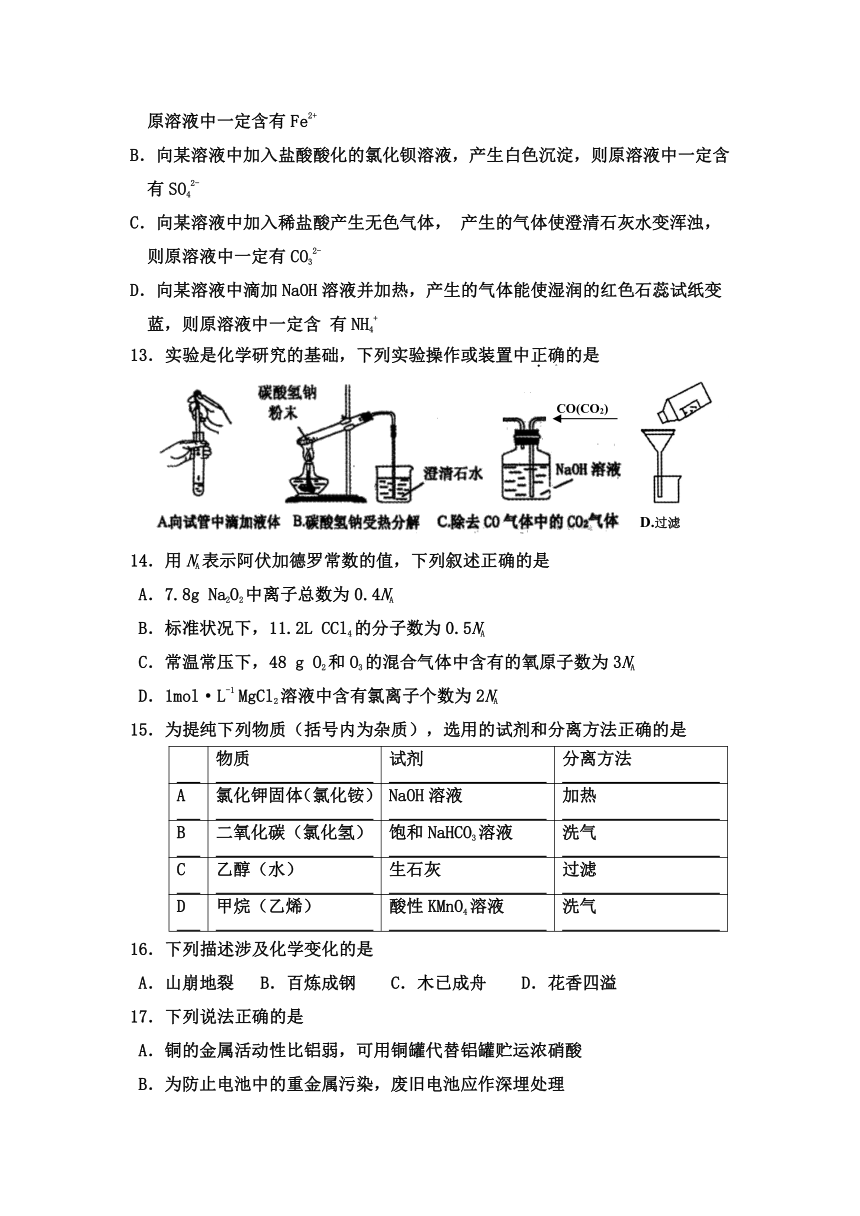
13.实验是化学研究的基础,下列实验操作或装置中正确的是
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.7.8g Na2O2中离子总数为0.4NA
B.标准状况下,11.2L CCl4的分子数为0.5NA
C.常温常压下,48 g O2和O3的混合气体中含有的氧原子数为3NA
D.1mol·L-1 MgCl2溶液中含有氯离子个数为2NA
15.为提纯下列物质(括号内为杂质),选用的试剂和分离方法正确的是
物质 试剂 分离方法
A 氯化钾固体(氯化铵) NaOH溶液 加热
B 二氧化碳(氯化氢) 饱和NaHCO3溶液 洗气
C 乙醇(水) 生石灰 过滤
D 甲烷(乙烯) 酸性KMnO4溶液 洗气
16.下列描述涉及化学变化的是
A.山崩地裂 B.百炼成钢 C.木已成舟 D.花香四溢
17.下列说法正确的是
A.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
B.为防止电池中的重金属污染,废旧电池应作深埋处理
C.利用太阳能等清洁能源代替化石燃料有利于节约资源保护环境
D.氢氧化铝具有两性,既可溶于盐酸也可溶于氨水
18.下列反应中,开始时放出氢气的速率最大的是( )
选项 金属 酸溶液的浓度和体积 温度/℃
A 2.4g 锌片 3mol L﹣1硫酸100mL 40
B 2.4g锌粉 1mol L﹣1硫酸300mL 30
C 2.4g锌粉 3mol L﹣1硫酸100mL 40
D 5.6g锌片 3mol L﹣1硫酸200mL 30
19.下列有机反应方程式书写正确的是( )
A.;
B.CH2===CH2+Br2―→CH3CHBr2
C. CH3COOH+CH3CH2OHCH3CH2OCH2CH3+H2O
D. CH4+Cl2CH3Cl+HCl
20.符合右图能量变化的反应是
A.H+HH—H
B.H—C1H+C1
C.Mg+2HClMgCl2+H2↑
D.H2SO4+2NaOHNa2SO4+2H2O
21.某学生用锌片、铜片、发光二极管、滤纸 ( http: / / www.21cnjy.com )、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
( http: / / www.21cnjy.com )
A.铜片上的电极反应:Cu2++2e﹣=Cu
B.锌片为电池的负极
C.外电路中电子由铜片经导线流向锌片
D.电池工作时电能直接转化为化学能
22.X、Y、Z、W、R是5种短周期元素,其原子序数依次增加。X是元素周期表
中原子半径最小的的元素, Y原子最外层电子数是次外层电子数的3倍,Z、W、
R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子
的核外电子数之和相等,且Z在同周期中原子半径最大。下列说法正确的是
A.元素W、R的最高价氧化物的水化物都是强酸
B.元素Y与Z可以形成化合物Z2Y2 和Z2Y,两种物质中阴阳离子个数比不同
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY< XmR
D.元素Z、W的离子具有相同的电子层排布
23.为测定某铁铜合金的组成,现将5.6 g该合金(表面氧化膜成分为Fe2O3
和CuO)加入到过量稀硫酸中,完全反应后产生气体672 mL,并得到浅绿色溶
液A(不含Cu2+离子)和不溶物B。过滤,将B加入到适量的某浓度的硝酸中,
完全溶解后,得NO、NO2的混合气896 mL,经测定该混合气中V(NO)∶V(NO2) = 3∶
1。再将A也加入到足量同浓度的硝酸中充分反应,用排水法收集产生的气体结
果得一烧瓶气体,(不从水中移出烧瓶)紧接着向烧瓶中通入224 mL O2,气体
能恰好完全溶于水(以上所有气体体积都已换算成标准状况时的数据)。下列结
论正确的是
A.合金中氧元素的物质的量是0.01 mol
B.合金中铁单质的质量是1.68 g
C.溶液A中存在的阳离子只有Fe2+离子
D.不溶物B为铜单质且质量是1.6 g
第Ⅱ卷(非选择题,共31分)
二、 非选择题(本部分3题,共31分)
24、(共15分)
(1) (5分)我国新修订的《环境保护法》已于2015年1月1日起施行,体现了加强生态文明建设的新要求。
①“APEC蓝”为2014年科技热词之首。较多地排放下列气体不利于蓝天出现的是________(填字母,下同)。
a. NO2 b. N2 c. CO2
②含有下列离子的废水不需要处理就可排放的是________。
a. Cr2O b. Pb2+ c. Ca2+
③臭氧层被称为人类和生物的保护伞。下列物质中,不会造成臭氧层空洞的是________。
a. 氟氯烃 b. 二氧化碳 c. 氮氧化物
④燃煤是形成雾霾天气的罪魁祸首之一。向煤中 ( http: / / www.21cnjy.com )加入一定量的 进行“脱硫”可以减少SO2的排放。该反应的化学方程式为 。
(2)(5分)关注食品安全,保持营养均衡,关爱身体健康.
①某食品的外包装上印有的相 ( http: / / www.21cnjy.com )关配料为:淀粉、大豆油、蔬菜、加碘盐、碳酸氢铵、苯甲酸。其中,能同时为人体提供热量和必需的脂肪酸的配料是________; 碳酸氢铵的作用是________。
②青霉素适合治疗的疾病是________ 。
感冒发烧 b. 细菌感染 c. 胃酸过多
③阿司匹林具有 ______ 作用。长期大量服用阿司匹林,其水解产物水
杨酸 可导致患者出现头痛、恶心等病状,需静脉注射小苏打
(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状
缓解。写出水杨酸与小苏打反应的化学方程式:____________________。
(3)(5分)材料是人类赖以生存和发展的重要物质基础,合理使用材料可以改善我们的生活。
①在下列材料中,属于无机非金属材料的是________。属于塑料制品的是________。
a. 涤纶 b. 聚氯乙烯塑料 c. 氮化硅陶瓷 d. 玻璃钢
②玻璃、陶瓷、水泥的生产中,不需要使用石灰石作原料的是________(填“玻璃”、“陶瓷”或“水泥”)。
③氧气和四氯化硅蒸气在旋转的高温炉中反 ( http: / / www.21cnjy.com )应(发生置换反应),其产物之一可制得光导纤维,该反应的化学方程式为______________________。
④钢铁在潮湿的空气中容易发生电化学 ( http: / / www.21cnjy.com )腐蚀,写出一种防止钢铁生锈的方法:_______________________________________________________。
(6分)在下图所示的物质转化关系中,A是用于制造汽车发动机的耐高温陶
瓷材料,A由两种元素组成,且两种元 ( http: / / www.21cnjy.com )素化合价的绝对值相等。常温下,C、F、M是无色无味的气体单质,D、H是固体单质。E是常见的两性氧化物,L是常见的液体。B、G是汽车尾气中的主要污染气体,所含元素均为第2周期元素。反应②常用于汽车尾气的处理。
请回答下列问题:
(1)I的电子式为
(2)A的化学式为
(3)写出③的离子方程式
(4)写出反应④的化学方程式
26. (10分)Na2S2O3·5H2O是 ( http: / / www.21cnjy.com )常用的脱氧剂、定影剂和还原剂。它是无色易溶于水的晶体,不溶于乙醇,Na2S2O3·5H2O在40~45℃熔化,48℃分解。下图是有关物质的溶解度曲线。
已知:Na2SO3+SNa2S2O3,制备Na2S2O3·5H2O的实验流程如下:
(1) 趁热过滤的原因是________。趁热过滤后滤渣的主要成分是________(写化学式)。
(2) 结晶的方法是________。
(3) 洗涤抽滤后得到的晶体,可采用的洗涤液是________。
A. 无水乙醇 B. 饱和NaCl溶液 C. 水
(4) 工业上制得的Na2S2O3·5H2O产品中可能含有少量的Na2SO3和Na2SO4杂质。为测定产品成分,准确称取1.508 0 g 样品,加入蒸馏水完全溶解后配成溶液。将配成的溶液平均分成两份。向一份溶液中加入适量甲醛溶液预处理(防止Na2SO3与I2反应),然后向其中加入0.050 0 mol/L I2溶液,发生反应:2S2O+I2===S4O+2I-,当反应恰好完全时,共消耗I2溶液25.00 mL。向另一份溶液中加入足量的稀硫酸溶液,微热至充分反应,使生成的SO2全部逸出,测得SO2在标准状况下体积为67.2 mL。
已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
(摩尔质量:Na2S2O3·5H2O:248 g/mol Na2SO3:126 g/mol Na2SO4:142 g/mol)
① 1.508 0 g 样品中含有Na2S2O3·5H2O质量是________。
② 通过计算确定样品的成分及各成分的物质的量之比(写出计算过程)。
南航附中2015-2016学年度第一学期期末考试
高二化学答题卷
二、 非选择题(本部分3题,共31分)
24、(共15分)
(1) ① ________ 。② ________。③ ________。
④ 。
(2)①________; ________。②________ 。
③ ______ 。
________________________________________ 。
(3)①________。________。②________
③______________________。
④_______________________________________________________。
25(6分)(1) (2)
(3)
(4)
26、(1) __________________________________________ 。
________________________ 。
(2) ________________。(3) ________________。
(4) ① ________________。
②
标准答案:
1 2 3 4 5 6 7 8 9 10 11 12
D A A D D D C B B C B D
13 14 15 16 17 18 19 20 21 22 23
C C B B C C D B B D A
24、(共15分)
(1) ① _a_______ 。② _c_______。③ _b_______。
④ CaCO3 ( http: / / www.21cnjy.com ) 。 2CaCO3+O3+2SO2=2CaSO4+2CO2
(2)①___大豆油_____; ___疏松剂_____。②_____b___ 。
③ 解热镇痛______ 。
__略______________________________________ 。
(3)①___c_____。____b____。②__陶瓷______
③___SiCl4+O2=SiO2+2Cl2___________________。
④_涂油漆、镀金属、制成不锈钢等________________________。
25、(1) : : (2)AlN
(3)2Al+2H2O+2OH-=2AlO2-+3H2↑
(4)3NO2+H2O=2HNO3+NO
26、(1)防止温度降低而使Na2S2O3晶体析出;S
(2)直接蒸发结晶易使Na2S2O3 5H2O熔化、分解;
(4)A;
(4)由关系式 I2--2Na2S2O3,25mL溶液中含有的Na2S2O3,n(Na2S2O3 5H2O)=2×n(I2)=2×0.05×0.02=0.0002(mol),配成的500mL溶液中的n(Na2S2O3 5H2O)=0.002×20=0.04(mol),m(Na2S2O3 5H2O)=0.04×248=9.92(g),产品的中Na2S2O3 5H2O的纯度为:9.92÷10×100%=99.2%,答案为:99.2%.
D.过滤
CO(CO2)
COOH
OH
A
B
C
D
E
G
B
H
F
C
I
J
M
K
N
G
F
放电
F
一定条件
电解
催化剂
NaOH溶液
G
①
一定条件
②
③
+
+
L
④
学校___________ 班级 姓名_____________ 考试号
………………密……………封……………线……………内……………不……………要……………答……………题………………
高 二 化 学
命题人:李玉屏 审核人:王秀芳
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24
Al-27 Cl-35.5 Fe-56 Cu-64 Ag-108 [来源CCccC:21世纪教育网]
一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本部分23题,每小题3分,共69分)。
1.中共十八大报告中提出:“加强生态文明 ( http: / / www.21cnjy.com )宣传教育,增强全民节约意识、环保意识、生态意识,形成合理消费的社会风尚,营造爱护生态环境的良好风气。”下列行为不利于“生态文明”建设的是
A.在化学反应中要考虑“原子经济性”以提高效率
B.资源的开发和利用,要考虑可持续发展的原则
C.要加强对工业“三废”的治理,以保护环境
D.将废弃的塑料袋回收进行露天焚烧,以解决“白色污染”问题
2.下列表示物质结构的化学用语或模型正确的是
A.苯分子的比例模型: B.CO2的电子式:
C.Cl-离子的结构示意图: D.乙烯的结构式:CH2=CH2
3.下列物质中只含有共价键的是
A.N2 B.MgCl2 C.Na2O D.Na2O2
4.下列有关铝的叙述中不正确的是( )
A.铝合金的强度和硬度都比纯铝的大
B.铝制的容器可以贮存浓硫酸或浓硝酸
C.铝表面的氧化膜可用盐酸或氢氧化钠溶液除去
D.将金属钠加入到氯化铝溶液中可制得铝
5.能在强酸性溶液中大量共存的一组离子是
A.K+、Fe2+、Cl―、 B.Na+、Ba2+、Cl―、
C.、Fe3+、Cl―、SCN― D.K+、Mg2+、、
6.漂白粉常用于消毒和漂白,其中的有效成分属于
A. 氧化物 B.酸 C.碱 D.盐
7.I可用于治疗甲亢,有关I的说法正确的是( )
A. 中子数为131 B. 质子数为131 C. 电子数53 D. 质量数53
8.乙醇和乙酸是生活中两种常见的有机物。下列说法正确的是( )
A. 乙醇、乙酸互为同分异构体
B. 乙醇、乙酸都能与钠反应
C. 乙醇、乙酸都能与NaOH溶液反应
D. 乙醇、乙酸都能使紫色石蕊试液变红色
9.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X Y Z
① NaOH溶液 Al(OH)3 稀硫酸
② KOH溶液 SiO2 稀盐酸
③ O2 N2 H2
④ FeCl3溶液 Cu 浓硝酸
A、①③ B、①④ C、②④ D、②③
10.下列反应的离子方程式书写正确的是
A.氢氧化钠溶液中通入氯气:Cl2+OH―ClO―+Cl―+H2O
B.铁与硫酸铁溶液反应:Fe+Fe3+2Fe2+
C.氢氧化镁与稀盐酸反应:Mg(OH)2+2H+Mg2++2H2O
D.碳酸氢钠溶液中滴入氢氧化钠溶液:OH―+H2O+CO2↑
11.反应4NH3+5O24NO+6H2O是工业制硝酸的重要一步,有关该反应的说法正确的是
A.NH3是氧化剂 B.NH3被氧化
C.NO只是还原剂 D.生成60gNO转移的5mol电子
12.下列离子的检验方法和结论正确的是
A.向某溶液中滴加几滴双氧水后再滴加2滴KSCN溶液,溶液变成血红色,则原溶液中一定含有Fe2+
B.向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则原溶液中一定含有SO42-
C.向某溶液中加入稀盐酸产生无色气体, 产生的气体使澄清石灰水变浑浊,则原溶液中一定有CO32-
D.向某溶液中滴加NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定含 有NH4+
13.实验是化学研究的基础,下列实验操作或装置中正确的是
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.7.8g Na2O2中离子总数为0.4NA
B.标准状况下,11.2L CCl4的分子数为0.5NA
C.常温常压下,48 g O2和O3的混合气体中含有的氧原子数为3NA
D.1mol·L-1 MgCl2溶液中含有氯离子个数为2NA
15.为提纯下列物质(括号内为杂质),选用的试剂和分离方法正确的是
物质 试剂 分离方法
A 氯化钾固体(氯化铵) NaOH溶液 加热
B 二氧化碳(氯化氢) 饱和NaHCO3溶液 洗气
C 乙醇(水) 生石灰 过滤
D 甲烷(乙烯) 酸性KMnO4溶液 洗气
16.下列描述涉及化学变化的是
A.山崩地裂 B.百炼成钢 C.木已成舟 D.花香四溢
17.下列说法正确的是
A.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
B.为防止电池中的重金属污染,废旧电池应作深埋处理
C.利用太阳能等清洁能源代替化石燃料有利于节约资源保护环境
D.氢氧化铝具有两性,既可溶于盐酸也可溶于氨水
18.下列反应中,开始时放出氢气的速率最大的是( )
选项 金属 酸溶液的浓度和体积 温度/℃
A 2.4g 锌片 3mol L﹣1硫酸100mL 40
B 2.4g锌粉 1mol L﹣1硫酸300mL 30
C 2.4g锌粉 3mol L﹣1硫酸100mL 40
D 5.6g锌片 3mol L﹣1硫酸200mL 30
19.下列有机反应方程式书写正确的是( )
A.;
B.CH2===CH2+Br2―→CH3CHBr2
C. CH3COOH+CH3CH2OHCH3CH2OCH2CH3+H2O
D. CH4+Cl2CH3Cl+HCl
20.符合右图能量变化的反应是
A.H+HH—H
B.H—C1H+C1
C.Mg+2HClMgCl2+H2↑
D.H2SO4+2NaOHNa2SO4+2H2O
21.某学生用锌片、铜片、发光二极管、滤纸 ( http: / / www.21cnjy.com )、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
( http: / / www.21cnjy.com )
A.铜片上的电极反应:Cu2++2e﹣=Cu
B.锌片为电池的负极
C.外电路中电子由铜片经导线流向锌片
D.电池工作时电能直接转化为化学能
22.X、Y、Z、W、R是5种短周期元素,其原子序数依次增加。X是元素周期表
中原子半径最小的的元素, Y原子最外层电子数是次外层电子数的3倍,Z、W、
R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子
的核外电子数之和相等,且Z在同周期中原子半径最大。下列说法正确的是
A.元素W、R的最高价氧化物的水化物都是强酸
B.元素Y与Z可以形成化合物Z2Y2 和Z2Y,两种物质中阴阳离子个数比不同
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY< XmR
D.元素Z、W的离子具有相同的电子层排布
23.为测定某铁铜合金的组成,现将5.6 g该合金(表面氧化膜成分为Fe2O3
和CuO)加入到过量稀硫酸中,完全反应后产生气体672 mL,并得到浅绿色溶
液A(不含Cu2+离子)和不溶物B。过滤,将B加入到适量的某浓度的硝酸中,
完全溶解后,得NO、NO2的混合气896 mL,经测定该混合气中V(NO)∶V(NO2) = 3∶
1。再将A也加入到足量同浓度的硝酸中充分反应,用排水法收集产生的气体结
果得一烧瓶气体,(不从水中移出烧瓶)紧接着向烧瓶中通入224 mL O2,气体
能恰好完全溶于水(以上所有气体体积都已换算成标准状况时的数据)。下列结
论正确的是
A.合金中氧元素的物质的量是0.01 mol
B.合金中铁单质的质量是1.68 g
C.溶液A中存在的阳离子只有Fe2+离子
D.不溶物B为铜单质且质量是1.6 g
第Ⅱ卷(非选择题,共31分)
二、 非选择题(本部分3题,共31分)
24、(共15分)
(1) (5分)我国新修订的《环境保护法》已于2015年1月1日起施行,体现了加强生态文明建设的新要求。
①“APEC蓝”为2014年科技热词之首。较多地排放下列气体不利于蓝天出现的是________(填字母,下同)。
a. NO2 b. N2 c. CO2
②含有下列离子的废水不需要处理就可排放的是________。
a. Cr2O b. Pb2+ c. Ca2+
③臭氧层被称为人类和生物的保护伞。下列物质中,不会造成臭氧层空洞的是________。
a. 氟氯烃 b. 二氧化碳 c. 氮氧化物
④燃煤是形成雾霾天气的罪魁祸首之一。向煤中 ( http: / / www.21cnjy.com )加入一定量的 进行“脱硫”可以减少SO2的排放。该反应的化学方程式为 。
(2)(5分)关注食品安全,保持营养均衡,关爱身体健康.
①某食品的外包装上印有的相 ( http: / / www.21cnjy.com )关配料为:淀粉、大豆油、蔬菜、加碘盐、碳酸氢铵、苯甲酸。其中,能同时为人体提供热量和必需的脂肪酸的配料是________; 碳酸氢铵的作用是________。
②青霉素适合治疗的疾病是________ 。
感冒发烧 b. 细菌感染 c. 胃酸过多
③阿司匹林具有 ______ 作用。长期大量服用阿司匹林,其水解产物水
杨酸 可导致患者出现头痛、恶心等病状,需静脉注射小苏打
(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状
缓解。写出水杨酸与小苏打反应的化学方程式:____________________。
(3)(5分)材料是人类赖以生存和发展的重要物质基础,合理使用材料可以改善我们的生活。
①在下列材料中,属于无机非金属材料的是________。属于塑料制品的是________。
a. 涤纶 b. 聚氯乙烯塑料 c. 氮化硅陶瓷 d. 玻璃钢
②玻璃、陶瓷、水泥的生产中,不需要使用石灰石作原料的是________(填“玻璃”、“陶瓷”或“水泥”)。
③氧气和四氯化硅蒸气在旋转的高温炉中反 ( http: / / www.21cnjy.com )应(发生置换反应),其产物之一可制得光导纤维,该反应的化学方程式为______________________。
④钢铁在潮湿的空气中容易发生电化学 ( http: / / www.21cnjy.com )腐蚀,写出一种防止钢铁生锈的方法:_______________________________________________________。
(6分)在下图所示的物质转化关系中,A是用于制造汽车发动机的耐高温陶
瓷材料,A由两种元素组成,且两种元 ( http: / / www.21cnjy.com )素化合价的绝对值相等。常温下,C、F、M是无色无味的气体单质,D、H是固体单质。E是常见的两性氧化物,L是常见的液体。B、G是汽车尾气中的主要污染气体,所含元素均为第2周期元素。反应②常用于汽车尾气的处理。
请回答下列问题:
(1)I的电子式为
(2)A的化学式为
(3)写出③的离子方程式
(4)写出反应④的化学方程式
26. (10分)Na2S2O3·5H2O是 ( http: / / www.21cnjy.com )常用的脱氧剂、定影剂和还原剂。它是无色易溶于水的晶体,不溶于乙醇,Na2S2O3·5H2O在40~45℃熔化,48℃分解。下图是有关物质的溶解度曲线。
已知:Na2SO3+SNa2S2O3,制备Na2S2O3·5H2O的实验流程如下:
(1) 趁热过滤的原因是________。趁热过滤后滤渣的主要成分是________(写化学式)。
(2) 结晶的方法是________。
(3) 洗涤抽滤后得到的晶体,可采用的洗涤液是________。
A. 无水乙醇 B. 饱和NaCl溶液 C. 水
(4) 工业上制得的Na2S2O3·5H2O产品中可能含有少量的Na2SO3和Na2SO4杂质。为测定产品成分,准确称取1.508 0 g 样品,加入蒸馏水完全溶解后配成溶液。将配成的溶液平均分成两份。向一份溶液中加入适量甲醛溶液预处理(防止Na2SO3与I2反应),然后向其中加入0.050 0 mol/L I2溶液,发生反应:2S2O+I2===S4O+2I-,当反应恰好完全时,共消耗I2溶液25.00 mL。向另一份溶液中加入足量的稀硫酸溶液,微热至充分反应,使生成的SO2全部逸出,测得SO2在标准状况下体积为67.2 mL。
已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
(摩尔质量:Na2S2O3·5H2O:248 g/mol Na2SO3:126 g/mol Na2SO4:142 g/mol)
① 1.508 0 g 样品中含有Na2S2O3·5H2O质量是________。
② 通过计算确定样品的成分及各成分的物质的量之比(写出计算过程)。
南航附中2015-2016学年度第一学期期末考试
高二化学答题卷
二、 非选择题(本部分3题,共31分)
24、(共15分)
(1) ① ________ 。② ________。③ ________。
④ 。
(2)①________; ________。②________ 。
③ ______ 。
________________________________________ 。
(3)①________。________。②________
③______________________。
④_______________________________________________________。
25(6分)(1) (2)
(3)
(4)
26、(1) __________________________________________ 。
________________________ 。
(2) ________________。(3) ________________。
(4) ① ________________。
②
标准答案:
1 2 3 4 5 6 7 8 9 10 11 12
D A A D D D C B B C B D
13 14 15 16 17 18 19 20 21 22 23
C C B B C C D B B D A
24、(共15分)
(1) ① _a_______ 。② _c_______。③ _b_______。
④ CaCO3 ( http: / / www.21cnjy.com ) 。 2CaCO3+O3+2SO2=2CaSO4+2CO2
(2)①___大豆油_____; ___疏松剂_____。②_____b___ 。
③ 解热镇痛______ 。
__略______________________________________ 。
(3)①___c_____。____b____。②__陶瓷______
③___SiCl4+O2=SiO2+2Cl2___________________。
④_涂油漆、镀金属、制成不锈钢等________________________。
25、(1) : : (2)AlN
(3)2Al+2H2O+2OH-=2AlO2-+3H2↑
(4)3NO2+H2O=2HNO3+NO
26、(1)防止温度降低而使Na2S2O3晶体析出;S
(2)直接蒸发结晶易使Na2S2O3 5H2O熔化、分解;
(4)A;
(4)由关系式 I2--2Na2S2O3,25mL溶液中含有的Na2S2O3,n(Na2S2O3 5H2O)=2×n(I2)=2×0.05×0.02=0.0002(mol),配成的500mL溶液中的n(Na2S2O3 5H2O)=0.002×20=0.04(mol),m(Na2S2O3 5H2O)=0.04×248=9.92(g),产品的中Na2S2O3 5H2O的纯度为:9.92÷10×100%=99.2%,答案为:99.2%.
D.过滤
CO(CO2)
COOH
OH
A
B
C
D
E
G
B
H
F
C
I
J
M
K
N
G
F
放电
F
一定条件
电解
催化剂
NaOH溶液
G
①
一定条件
②
③
+
+
L
④
学校___________ 班级 姓名_____________ 考试号
………………密……………封……………线……………内……………不……………要……………答……………题………………
同课章节目录
