人教版必修2化学课件:第2章第1节 《化学能与热能》(共48张PPT)
文档属性
| 名称 | 人教版必修2化学课件:第2章第1节 《化学能与热能》(共48张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-25 22:40:48 | ||
图片预览









文档简介
课件48张PPT。第二章 化学反应与能量第1节 化学能与热能
(课时1)1、了解化学反应热的本质。
2、知道断裂化学键和形成化学键中的能量变化
3、知道化学键与化学反应中能量变化关系
赤 本课主要是介绍化学反应与能量的转化关系。从能源与人类的使用现状着手,并提出设问化石燃料通过燃烧释放出的能量的来源引入。再具体的从化学键的角度认识化学反应的实质——断裂旧的化学键,形成新的化学键。断键成键的过程中伴随着能量的变化,这就导致化学反应中存在能量变化的原因。
该课时中学生要清楚化学反应中的能量与化学键的关系,通过具体的反应(氢气和氯气反应)详细学习断键和成键中的能量变化情况,同时明确化学反应是释放能量还是吸收能量取决于反应物的总能量和生成物的总能量的相对大小。
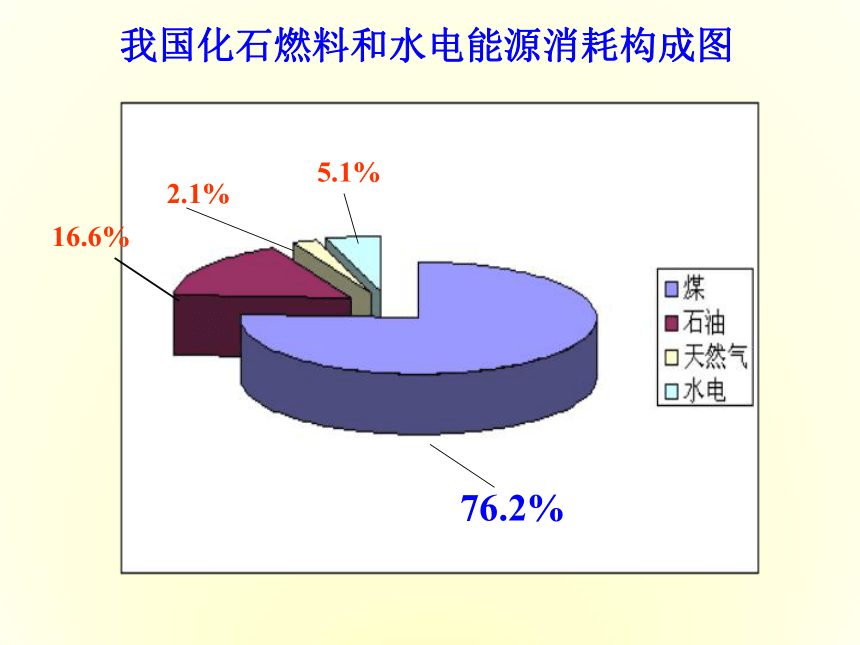
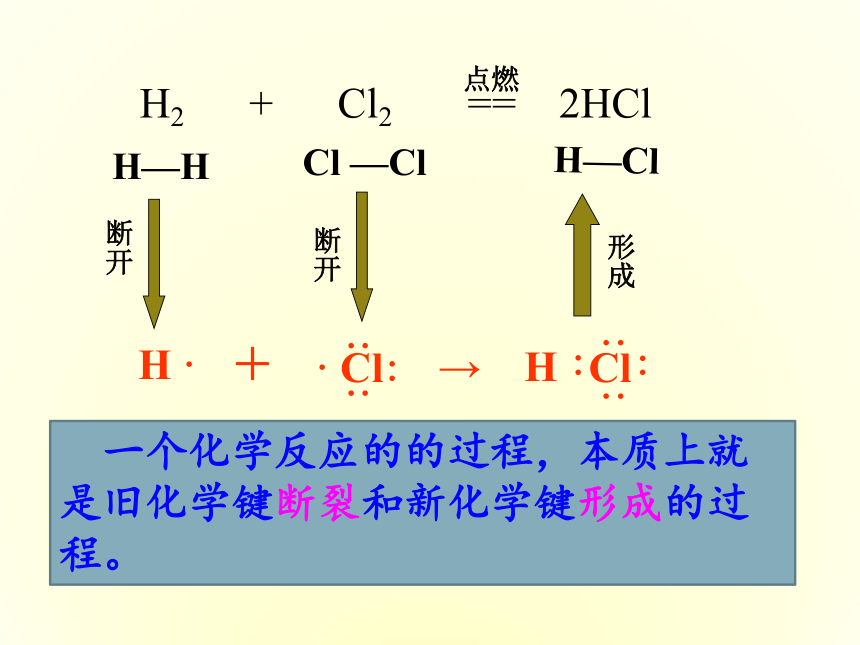
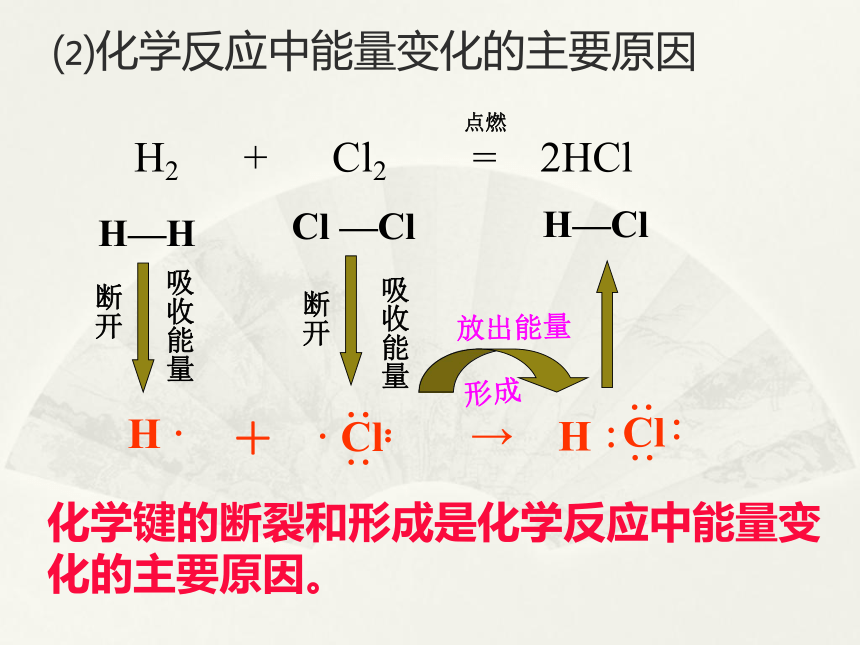
能源与人类 能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可回避的能源危机。16.6%2.1%5.1%76.2%我国化石燃料和水电能源消耗构成图 煤、石油、天然气的主要化学成分是烃类等有机物(煤中含有大量的碳),它们燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么关系?石灰石(主要成分是碳酸钙)要经过高温煅烧才能变成生石灰,高温提供的热能在石灰石的分解反应中起到什么作用?你知道吗? 不同的燃料其组成不同,燃烧后放出的热量也不相等。为什么不同的燃料燃烧时放出的热量会不同?燃料在燃烧反应中产生的热能来自哪里?⑴化学反应的本质是什么? 以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。1、化学反应中能量的变化H ·+H—H Cl —ClH—Cl 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。⑵化学反应中能量变化的主要原因H ·+H—H Cl —ClH—Cl化学键的断裂和形成是化学反应中能量变化的主要原因。⑶从化学键的观点来分析能量的变化那么:一个化学反应是否为放热还是吸热怎么判断呢?可由所有断键吸收的总能量与所有形成新键放出的总能量的相对大小判断 实验测得,在25℃、101 KPa条件下,将1 mol H2 (H-H)变为2 mol H原子需吸收436 kJ能量,而2 mol H原子变成1 mol H2 (H-H)放出436 KJ能量,这个能量就是H-H的键能。某些化学键的键能(KJ/mol)对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?键能越大含该键的分子越稳定化学键越牢固 在反应H2 + Cl2 = 2HCl中,已知H-H 键能为436 kJ,Cl-Cl键能为247 kJ,H-Cl键能为431 kJ,判断该反应是 反应(放热或吸热) 放热(1)化学键断裂时需要吸收能量。吸收总能量为:E(吸)=436 kJ+247 kJ=683 kJ,
(2)化学键形成时需要释放能量。释放总能量为:E(放)=431 kJ+431 kJ=862 kJ> E(吸) ,
(3)反应中放出的热量的计算:
862 kJ - 683 kJ=179 kJ 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。看图讨论:水由高处向低处流要释放能量(势能转换为动能)分析化学反应反应物的总能量 > 生成物的总能量化学反应放出能量 将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为势能)分析化学反应反应物的总能量 < 生成物的总能量化学反应吸收能量反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量 化学反应的过程,可以看成是能量的“贮存”或“释放”的过程(1)如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
(2)如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。能量公式化E(反应物)=E(生成物)+Q(能量守恒定律)E(反应物)-E(生成物)=QQ>0为放热反应Q<0为吸热反应第一节 化学能与热能(第2课时)1.了解化学能与热能的相互转化。
2.掌握吸热反应和放热反应的概念。
3.理解反应吸放热与反应条件之间的关系。 本课从木炭、铁丝等的燃烧中引入化学反应与热能的转化,并思考其中隐藏的规律。接着对化学反应从热量的角度的分类,并介绍吸热反应和放热反应。然后体验化学能与热能的相互转化,并结合生活经验归纳常见的吸热反应和放热反应。并从常见的吸热反应和放热反应中归纳出反应吸放热与反应条件的关系。最后自主阅读教材学习人类对能源的利用,并播放视频加深印象。
本课重点常见吸热反应与放热反应,采用从实验中体验化学能与热能的相互转化,并从生活中举例归纳常见的吸放热反应。进而归纳出的反应吸放热与条件的关系。减少学生对知识的记忆,学会用举反例的方法来判断问题。并精选了常考的习题检测学生的对知识的掌握。你知道其中能量的转化形式吗?反应中的能量变化白磷的燃烧氨的燃烧化学反应伴随着热量的放出1)化学反应的发生会伴随哪些变化,变化过程中遵循什么规律?
2)化学反应中的能量变化主要以什么形式体现?①物质变化——质量守恒
②能量变化——能量守恒热量放热反应——化学能转化成热能
吸热反应——热能转化成化学能化学反应1)Al与稀盐酸反应【实验2-1】气泡上升2Al + 6H+ === 2Al3+ + 3H2↑放热金属与酸反应是放热反应。铝与盐酸反应的能量变化体验化学能与热能的相互转化2)稀盐酸与NaOH反应【实验2-3】H+ + OH- == H2O高放热酸碱中和反应是放热反应。盐酸与氢氧化钠反应3)Ba(OH)2·8H2O晶体与NH4Cl反应【实验2-2】Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O刺鼻气味糊状粘在一起降低吸热氢氧化钡晶体与氯化铵晶体反应的能量变化根据实验现象与生活经验,归纳常见的放热反应和吸热反应有哪些?并举例。常见的放热反应和吸热反应放热反应燃料的燃烧(与O2的反应)
中和反应
活泼金属与水或酸的反应
大部分化合反应(生石灰和水)
物质的缓慢氧化
铝热反应吸热反应C+CO2
H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大部分分解反应
多数铵盐溶于水1.工业上N2、H2合成氨的反应是放热的可逆反应,则其逆反应NH3的分解是吸热反应还是放热反应?吸热反应2.水结冰是否属于放热反应?为什么?不属于;因为水结冰不属于化学反应,吸热反应或放热反应必须是化学反应中的热量变化。酸与碱的中和反应是吸热反应还是放热反应?【实验2-3】酸碱反应的本质就是H++OH-=H2O。
可得出推论:酸碱中和反应都是放热反应。
反应中H+和OH-离子的量相等,生成水的量相等,放出的热量也相等。中和反应后溶液的温度比反应前盐酸和氢氧化钠溶液的温度高。盐酸和氢氧化钠溶液的反应过程中放出热量,使溶液混合物的温度升高。分析:盐酸与氢氧化钠反应中和热的概念:酸与碱发生中和反应生成1 mol H2O 时所释放的热量称为中和热。注:(1)中和反应都放出热量
(2)稀溶液中,强酸与强碱的中和热为定值:57.3 kJ/mol1 L 1 mol/L的硫酸溶液与2 L 2 mol/L的NaOH溶液完全反应,放出114.6 kJ的热量,有人由此得出强酸与强碱反应的中和热为114.6 kJ/mol。这种结论是否正确,为什么?错,因为酸与碱发生中和反应生成1 mol H2O 时所释放的热量称为中和热。1.社会发展与能源利用2.人类利用能源的三个阶段柴草时期中国古代制陶图化石能源时期多能源结构时期太阳能、化石能源、水能、 风能、潮汐能、地热能、生物质能、核能以 及氢能。常见的能源主要有以下十种:1.下列说法错误的是( )
A.若N2+3H2 2NH3正向是放热反应,则逆向是吸热反应
B.碳燃烧部分化学能转化为热能
C.冰变成水是吸热反应
D.煤、石油、天然气是非再生能源,所以应大力开发新能源如太阳能、氢能等C2.下列反应属于放热反应的是( )
A.Ba(OH)2·8H2O晶体和NH4Cl晶体的反应
B.能量变化如右图所示的反应
C.不需要加热的反应
D.断键吸收的热量比成键放出
的热量少的反应D3.下列变化属于放热反应的
是 (填序号)
①浓硫酸的稀释 ②生石灰变成熟石灰 ③鞭炮爆炸 ④Na与H2O反应 ⑤Na2O2与H2O或CO2反应 ⑥H2还原CuO ②③④⑤4.下图中能表示灼热的炭与二氧化碳反应的能量变化的是( )D谢谢!
(课时1)1、了解化学反应热的本质。
2、知道断裂化学键和形成化学键中的能量变化
3、知道化学键与化学反应中能量变化关系
赤 本课主要是介绍化学反应与能量的转化关系。从能源与人类的使用现状着手,并提出设问化石燃料通过燃烧释放出的能量的来源引入。再具体的从化学键的角度认识化学反应的实质——断裂旧的化学键,形成新的化学键。断键成键的过程中伴随着能量的变化,这就导致化学反应中存在能量变化的原因。
该课时中学生要清楚化学反应中的能量与化学键的关系,通过具体的反应(氢气和氯气反应)详细学习断键和成键中的能量变化情况,同时明确化学反应是释放能量还是吸收能量取决于反应物的总能量和生成物的总能量的相对大小。
能源与人类 能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可回避的能源危机。16.6%2.1%5.1%76.2%我国化石燃料和水电能源消耗构成图 煤、石油、天然气的主要化学成分是烃类等有机物(煤中含有大量的碳),它们燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么关系?石灰石(主要成分是碳酸钙)要经过高温煅烧才能变成生石灰,高温提供的热能在石灰石的分解反应中起到什么作用?你知道吗? 不同的燃料其组成不同,燃烧后放出的热量也不相等。为什么不同的燃料燃烧时放出的热量会不同?燃料在燃烧反应中产生的热能来自哪里?⑴化学反应的本质是什么? 以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。1、化学反应中能量的变化H ·+H—H Cl —ClH—Cl 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。⑵化学反应中能量变化的主要原因H ·+H—H Cl —ClH—Cl化学键的断裂和形成是化学反应中能量变化的主要原因。⑶从化学键的观点来分析能量的变化那么:一个化学反应是否为放热还是吸热怎么判断呢?可由所有断键吸收的总能量与所有形成新键放出的总能量的相对大小判断 实验测得,在25℃、101 KPa条件下,将1 mol H2 (H-H)变为2 mol H原子需吸收436 kJ能量,而2 mol H原子变成1 mol H2 (H-H)放出436 KJ能量,这个能量就是H-H的键能。某些化学键的键能(KJ/mol)对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?键能越大含该键的分子越稳定化学键越牢固 在反应H2 + Cl2 = 2HCl中,已知H-H 键能为436 kJ,Cl-Cl键能为247 kJ,H-Cl键能为431 kJ,判断该反应是 反应(放热或吸热) 放热(1)化学键断裂时需要吸收能量。吸收总能量为:E(吸)=436 kJ+247 kJ=683 kJ,
(2)化学键形成时需要释放能量。释放总能量为:E(放)=431 kJ+431 kJ=862 kJ> E(吸) ,
(3)反应中放出的热量的计算:
862 kJ - 683 kJ=179 kJ 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。看图讨论:水由高处向低处流要释放能量(势能转换为动能)分析化学反应反应物的总能量 > 生成物的总能量化学反应放出能量 将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为势能)分析化学反应反应物的总能量 < 生成物的总能量化学反应吸收能量反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量 化学反应的过程,可以看成是能量的“贮存”或“释放”的过程(1)如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
(2)如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。能量公式化E(反应物)=E(生成物)+Q(能量守恒定律)E(反应物)-E(生成物)=QQ>0为放热反应Q<0为吸热反应第一节 化学能与热能(第2课时)1.了解化学能与热能的相互转化。
2.掌握吸热反应和放热反应的概念。
3.理解反应吸放热与反应条件之间的关系。 本课从木炭、铁丝等的燃烧中引入化学反应与热能的转化,并思考其中隐藏的规律。接着对化学反应从热量的角度的分类,并介绍吸热反应和放热反应。然后体验化学能与热能的相互转化,并结合生活经验归纳常见的吸热反应和放热反应。并从常见的吸热反应和放热反应中归纳出反应吸放热与反应条件的关系。最后自主阅读教材学习人类对能源的利用,并播放视频加深印象。
本课重点常见吸热反应与放热反应,采用从实验中体验化学能与热能的相互转化,并从生活中举例归纳常见的吸放热反应。进而归纳出的反应吸放热与条件的关系。减少学生对知识的记忆,学会用举反例的方法来判断问题。并精选了常考的习题检测学生的对知识的掌握。你知道其中能量的转化形式吗?反应中的能量变化白磷的燃烧氨的燃烧化学反应伴随着热量的放出1)化学反应的发生会伴随哪些变化,变化过程中遵循什么规律?
2)化学反应中的能量变化主要以什么形式体现?①物质变化——质量守恒
②能量变化——能量守恒热量放热反应——化学能转化成热能
吸热反应——热能转化成化学能化学反应1)Al与稀盐酸反应【实验2-1】气泡上升2Al + 6H+ === 2Al3+ + 3H2↑放热金属与酸反应是放热反应。铝与盐酸反应的能量变化体验化学能与热能的相互转化2)稀盐酸与NaOH反应【实验2-3】H+ + OH- == H2O高放热酸碱中和反应是放热反应。盐酸与氢氧化钠反应3)Ba(OH)2·8H2O晶体与NH4Cl反应【实验2-2】Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O刺鼻气味糊状粘在一起降低吸热氢氧化钡晶体与氯化铵晶体反应的能量变化根据实验现象与生活经验,归纳常见的放热反应和吸热反应有哪些?并举例。常见的放热反应和吸热反应放热反应燃料的燃烧(与O2的反应)
中和反应
活泼金属与水或酸的反应
大部分化合反应(生石灰和水)
物质的缓慢氧化
铝热反应吸热反应C+CO2
H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大部分分解反应
多数铵盐溶于水1.工业上N2、H2合成氨的反应是放热的可逆反应,则其逆反应NH3的分解是吸热反应还是放热反应?吸热反应2.水结冰是否属于放热反应?为什么?不属于;因为水结冰不属于化学反应,吸热反应或放热反应必须是化学反应中的热量变化。酸与碱的中和反应是吸热反应还是放热反应?【实验2-3】酸碱反应的本质就是H++OH-=H2O。
可得出推论:酸碱中和反应都是放热反应。
反应中H+和OH-离子的量相等,生成水的量相等,放出的热量也相等。中和反应后溶液的温度比反应前盐酸和氢氧化钠溶液的温度高。盐酸和氢氧化钠溶液的反应过程中放出热量,使溶液混合物的温度升高。分析:盐酸与氢氧化钠反应中和热的概念:酸与碱发生中和反应生成1 mol H2O 时所释放的热量称为中和热。注:(1)中和反应都放出热量
(2)稀溶液中,强酸与强碱的中和热为定值:57.3 kJ/mol1 L 1 mol/L的硫酸溶液与2 L 2 mol/L的NaOH溶液完全反应,放出114.6 kJ的热量,有人由此得出强酸与强碱反应的中和热为114.6 kJ/mol。这种结论是否正确,为什么?错,因为酸与碱发生中和反应生成1 mol H2O 时所释放的热量称为中和热。1.社会发展与能源利用2.人类利用能源的三个阶段柴草时期中国古代制陶图化石能源时期多能源结构时期太阳能、化石能源、水能、 风能、潮汐能、地热能、生物质能、核能以 及氢能。常见的能源主要有以下十种:1.下列说法错误的是( )
A.若N2+3H2 2NH3正向是放热反应,则逆向是吸热反应
B.碳燃烧部分化学能转化为热能
C.冰变成水是吸热反应
D.煤、石油、天然气是非再生能源,所以应大力开发新能源如太阳能、氢能等C2.下列反应属于放热反应的是( )
A.Ba(OH)2·8H2O晶体和NH4Cl晶体的反应
B.能量变化如右图所示的反应
C.不需要加热的反应
D.断键吸收的热量比成键放出
的热量少的反应D3.下列变化属于放热反应的
是 (填序号)
①浓硫酸的稀释 ②生石灰变成熟石灰 ③鞭炮爆炸 ④Na与H2O反应 ⑤Na2O2与H2O或CO2反应 ⑥H2还原CuO ②③④⑤4.下图中能表示灼热的炭与二氧化碳反应的能量变化的是( )D谢谢!
