人教版必修2化学课件:第1章第2节《元素周期律》(共41张PPT)
文档属性
| 名称 | 人教版必修2化学课件:第1章第2节《元素周期律》(共41张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 904.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-25 22:52:09 | ||
图片预览









文档简介
课件41张PPT。第一章 元素周期表第2节 元素周期律(课时1)1、掌握原子核外电子的排布规律2、元素性质与原子结构的关系 本课设计主线:原子结构——原子结构递变规律——元素性质递变规律——课堂检测。首先借用“核外电子运动的视频导入课堂,并发出与本课知识相关的设问,讲述原子核外电子的排布,从电子层、电子的能量及电子排布三个角度共同分析,总结出原子核外电子的排布规律;同时依据材料总结原子的电子层排布、原子半径及化合价的排布规律,从而引出问题:结构与性质的关系,接着通过实验或数据,总结第同一周期或同一主族的元素金属性或非金属的递变规律,最后通过课堂练习巩固本课所学知识。
在讲述金属性及非金属的递变规律时,一定要依据实验或数据,同时强调一定要学生明确判断金属性或非金属性的标准,让学生区别氢化物或最高价氧化物对应水化物的区别。结论:
1、在一个体积小、相对空间大(但绝对空间小)的原子核外作高速运动(速度接近光速)。
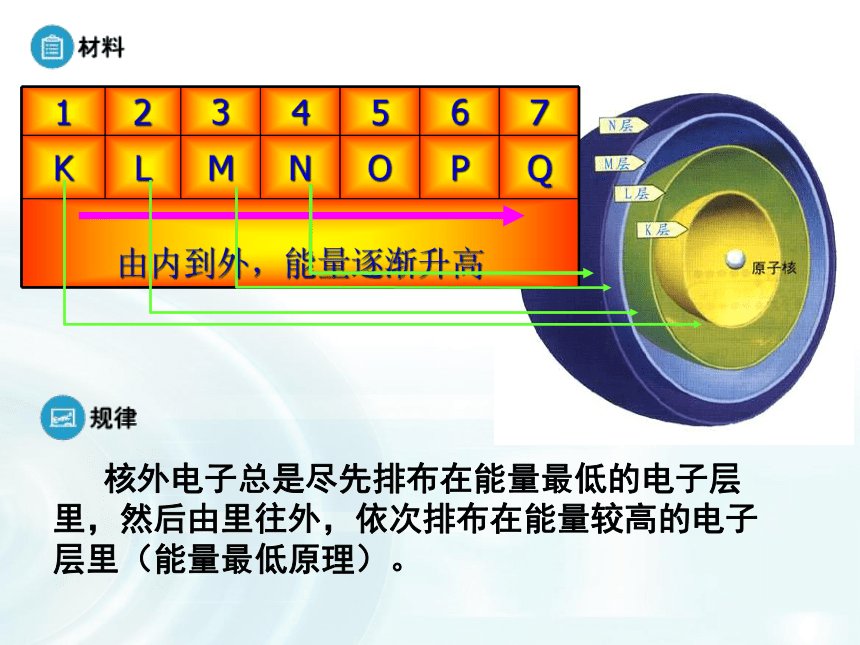
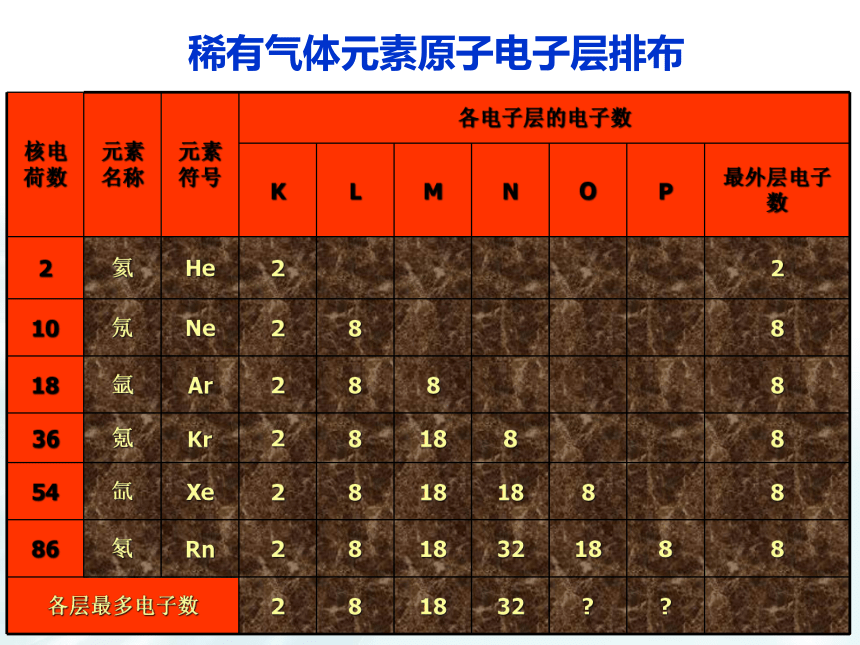
2、电子的运动是有一定规则的。核外电子运动 人们将电子运动的区域简化为不连续的壳层,称之为“电子层”。1、电子层2、电子的能量 所有电子都具有一定的能量,在多电子原子里,各电子所具有的能量不尽相同,能量低的电子在离核较近的区域运动,能量较高的电子在离核较远的区域运动。 3、核外电子的排布规律(分析表1-2)一、原子核外电子的排布 核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。稀有气体元素原子电子层排布(1)各电子层最多能容纳的电子数为 2n2(2)最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。(3)次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。(1)各电子层最多能容纳的电子数为 2n2(2)最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。(3)次外层电子数不能超过 18 ,倒数第三层电子数能超过 32 。(4)核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。核外电子的排布规律:a、四条规律相互制约
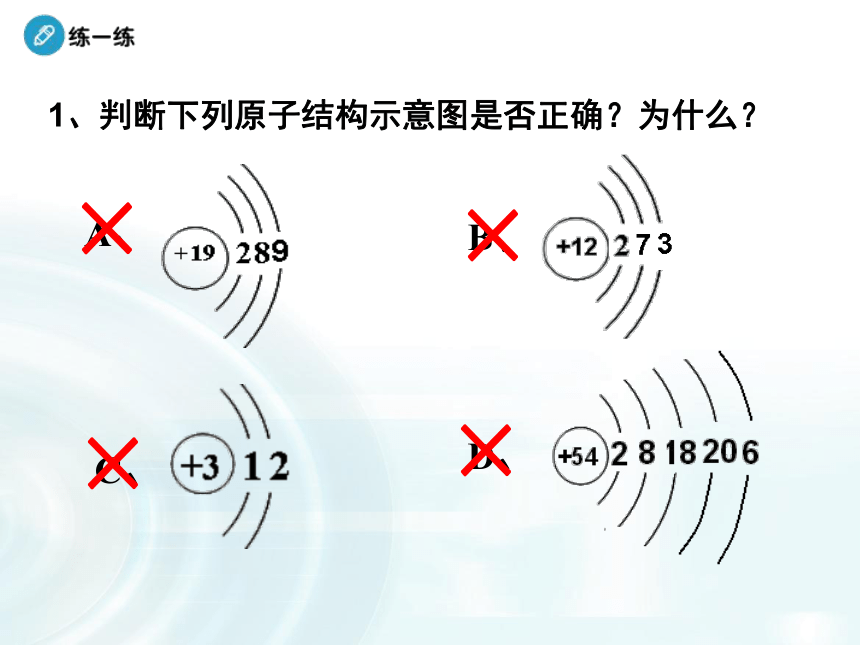
b、最外电子层中排满 8 个电子(He为2个电子)时,为相对稳定结构,其它为不稳定结构 1、判断下列原子结构示意图是否正确?为什么?
A、 B、D、C、××××2、根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;______
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;______
(3)C元素的次外层电子数是最外层电子数的1/4;________
硅硼 氖表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 最外层电子数1→2最外层电子数1→8最外层电子数1→8二、元素周期律结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。 表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 原子半径 大→小原子半径 大→小结论:随着原子序数的递增,元素原子半径呈现周期性变化。 表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 主要化合价:正价+1→0主要化合价:正价+1→+5,负价:-4 →-1 → 0主要化合价:正价+1→+7,负价:-4 →-1→0结论:随着原子序数的递增,元素主要化合价呈现周期性变化。 为什么随原子序数的递增,元素原子的电子层排布、原子半径、化合价呈现周期性变化呢? 随原子序数的递增,元素原子核外电子排布的周期性变化,决定了原子半径、化合价呈现周期性变化。 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢? 元素的金属性和非金属性的强弱根据什么来判断?①金属与水或酸反应越容易,金属性越强;
②最高价氧化物对应的水化物(氢氧化物)
碱性越强,金属性越强;
③金属单质与某些盐溶液反应置换另一金属。元素金属性强弱判断依据:①非金属与H2化合越容易,非金属性越强;
②气态氢化物越稳定, 非金属性越强;
③最高价氧化物对应的水化物(含氧酸)
酸性越强,非金属性越强;
④非金属与某些盐溶液反应置换另一非金属元素非金属性强弱判断依据:∴镁的金属性比钠弱。 1、实验(1)镁与冷水和热水反应比较钠比镁与水反应剧烈(1)比较钠比镁与水反应的难易程度?加热前,镁条表面附着 ,加热沸腾后有 冒出,溶液变 色。少量无色气泡较多无色气泡粉红镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。∴镁的金属性比铝强。(2)镁与铝与盐酸反应比较有大量气泡产生,试管烫手,反应速度很快。有大量气泡产生,试管烫手,反应速度快。比较镁和铝与盐酸反应的难易程度? NaOH
( ) Mg(OH)2Al(OH)3
( )浮于水面,熔成小球,四处游动,嘶嘶作响,溶液变红;与酸反应更为剧烈。 强碱中强碱两性氢
氧化物 所以: Na Mg Al
金属性逐渐 .减弱 常温下和加热时,遇水无明显现象;与酸反应剧烈,放出无色气体。 2、讨论 上述实验证明,第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐 ,非金属性逐渐 。 对其他周期元素性质进行研究,也可以得到类似的结论。 ∴ 同一周期元素,从左到右, 金属性逐渐减弱,非金属性逐渐增强。4、结论减弱增强 比较第三周期非金属与氢气反应条件及含氧酸的酸性强弱 (P16)3、阅读元素周期表中元素性质递变规律相同增多从1-2或1-8相同从大到小从小到大从+1 -- +7或-4 -- -1相同减弱增强增强 减弱失减弱,得增强失增强,得减弱氧化性增强,还原性减弱还原性增强,氧化性减弱碱性逐渐减弱,酸性逐渐增强碱性逐渐增强,酸性逐渐减弱生成由难渐易稳定性逐渐增强生成由易渐难稳定性逐渐减弱元素周期律方式元素性质变化趋势结论随着原子序数的递增元素原子的最外层电子排布1→8
(H,He)元素原子半径大→小元素化合价+1→+7
-4→-1→0元素金属性
与非金属性金属性减弱
非金属性增强呈现周期性变化 随着原子序数的递增,元素的性质呈现周期性变化 ,这叫做元素周期律。1.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为( )
A.6 B.8 C.12 D.16AC2、下列变化的比较, 不正确的是( )
A.酸性强弱: HClO4>H2SO4>H3PO4>H2SiO3
B.原子半径大小: Na>S>O
C.碱性强弱: KOH>NaOH>LiOH????
D.?还原性强弱: F->Cl->I-D 第2节 元素周期律课时2第一章 元素周期表1、了解两性元素2、了解元素最高化合价与元素周期表位置的关系3、了解元素周期表及周期律在其他方面的应用 本课首先利用结构、位置与性质三者之间的关系导入新课,进而引出元素周期表及周期律在其他方面的应用;首先巩固元素周期表及周期律在元素位置、性质及结构方面的应用,然后再说明在元素金属性及非金属性方面的应用;再而介绍在元素的化合价判断方面的应用。最后简单介绍在其他领域的应用元素周期表及周期律具体又有哪些应用呢?一、元素的位、构、性三者之间的关系应用1、结构决定位置原子序数=核电荷数
周期序数=电子层数
主族序数=最外层电子数2、结构决定性质 最外层电子数=主族元素的最高正价数=8-负价数最外层电子数和原子半径原子得失电子的能力元素的金属性、非金属性强弱单质的氧化性、还原性强弱3、位置决定性质二、金属与非金属性 分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图:同周期:从左到右,递变性 氧化性增强
非金属性逐渐增强金属性逐渐增强原子半径逐渐增大金属性逐渐增强还原性逐渐增强原子半径逐渐减小非金属性逐渐增强非金属性依次增强 什么元素的金属性最强?什么元素的非金属性最强它们分别位于元素周期表中的什么位置?三、元素的化合价与元素在周期表中的位置关系
(1)主族元素:
最高正价数 = 主族序数 = 最外层电子数?
(2)非金属元素:
|最高正价|+|最低负价|= 8?四、其他应用(P18)(1)预言未知元素并证实.
(2)分界处找半导体材料.
(3)在非金属区域找制农药元素.
(4)过度区寻找催化剂和耐高温、耐腐蚀的合金材料.1、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场, 已知它与氧元素同族, 与K同周期, 关于硒的说法中不正确的是( )
A.原子序数为34????????????????
B.最高价氧化物的水化物的分子式为H2SeO4
C.Se的非金属性比Br弱????????
D.气态氢化物的稳定性比硫化氢气体强D2、有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。
由此可推知(填元素符号):
V是____、W是____、X是_____、Y是____、Z是_____H O Al S K
在讲述金属性及非金属的递变规律时,一定要依据实验或数据,同时强调一定要学生明确判断金属性或非金属性的标准,让学生区别氢化物或最高价氧化物对应水化物的区别。结论:
1、在一个体积小、相对空间大(但绝对空间小)的原子核外作高速运动(速度接近光速)。
2、电子的运动是有一定规则的。核外电子运动 人们将电子运动的区域简化为不连续的壳层,称之为“电子层”。1、电子层2、电子的能量 所有电子都具有一定的能量,在多电子原子里,各电子所具有的能量不尽相同,能量低的电子在离核较近的区域运动,能量较高的电子在离核较远的区域运动。 3、核外电子的排布规律(分析表1-2)一、原子核外电子的排布 核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。稀有气体元素原子电子层排布(1)各电子层最多能容纳的电子数为 2n2(2)最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。(3)次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。(1)各电子层最多能容纳的电子数为 2n2(2)最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。(3)次外层电子数不能超过 18 ,倒数第三层电子数能超过 32 。(4)核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(能量最低原理)。核外电子的排布规律:a、四条规律相互制约
b、最外电子层中排满 8 个电子(He为2个电子)时,为相对稳定结构,其它为不稳定结构 1、判断下列原子结构示意图是否正确?为什么?
A、 B、D、C、××××2、根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;______
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;______
(3)C元素的次外层电子数是最外层电子数的1/4;________
硅硼 氖表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 最外层电子数1→2最外层电子数1→8最外层电子数1→8二、元素周期律结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。 表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 原子半径 大→小原子半径 大→小结论:随着原子序数的递增,元素原子半径呈现周期性变化。 表5-5 1~18号元素的核外电子排布、原子半径和主要化合价 主要化合价:正价+1→0主要化合价:正价+1→+5,负价:-4 →-1 → 0主要化合价:正价+1→+7,负价:-4 →-1→0结论:随着原子序数的递增,元素主要化合价呈现周期性变化。 为什么随原子序数的递增,元素原子的电子层排布、原子半径、化合价呈现周期性变化呢? 随原子序数的递增,元素原子核外电子排布的周期性变化,决定了原子半径、化合价呈现周期性变化。 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢? 元素的金属性和非金属性的强弱根据什么来判断?①金属与水或酸反应越容易,金属性越强;
②最高价氧化物对应的水化物(氢氧化物)
碱性越强,金属性越强;
③金属单质与某些盐溶液反应置换另一金属。元素金属性强弱判断依据:①非金属与H2化合越容易,非金属性越强;
②气态氢化物越稳定, 非金属性越强;
③最高价氧化物对应的水化物(含氧酸)
酸性越强,非金属性越强;
④非金属与某些盐溶液反应置换另一非金属元素非金属性强弱判断依据:∴镁的金属性比钠弱。 1、实验(1)镁与冷水和热水反应比较钠比镁与水反应剧烈(1)比较钠比镁与水反应的难易程度?加热前,镁条表面附着 ,加热沸腾后有 冒出,溶液变 色。少量无色气泡较多无色气泡粉红镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。∴镁的金属性比铝强。(2)镁与铝与盐酸反应比较有大量气泡产生,试管烫手,反应速度很快。有大量气泡产生,试管烫手,反应速度快。比较镁和铝与盐酸反应的难易程度? NaOH
( ) Mg(OH)2Al(OH)3
( )浮于水面,熔成小球,四处游动,嘶嘶作响,溶液变红;与酸反应更为剧烈。 强碱中强碱两性氢
氧化物 所以: Na Mg Al
金属性逐渐 .减弱 常温下和加热时,遇水无明显现象;与酸反应剧烈,放出无色气体。 2、讨论 上述实验证明,第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐 ,非金属性逐渐 。 对其他周期元素性质进行研究,也可以得到类似的结论。 ∴ 同一周期元素,从左到右, 金属性逐渐减弱,非金属性逐渐增强。4、结论减弱增强 比较第三周期非金属与氢气反应条件及含氧酸的酸性强弱 (P16)3、阅读元素周期表中元素性质递变规律相同增多从1-2或1-8相同从大到小从小到大从+1 -- +7或-4 -- -1相同减弱增强增强 减弱失减弱,得增强失增强,得减弱氧化性增强,还原性减弱还原性增强,氧化性减弱碱性逐渐减弱,酸性逐渐增强碱性逐渐增强,酸性逐渐减弱生成由难渐易稳定性逐渐增强生成由易渐难稳定性逐渐减弱元素周期律方式元素性质变化趋势结论随着原子序数的递增元素原子的最外层电子排布1→8
(H,He)元素原子半径大→小元素化合价+1→+7
-4→-1→0元素金属性
与非金属性金属性减弱
非金属性增强呈现周期性变化 随着原子序数的递增,元素的性质呈现周期性变化 ,这叫做元素周期律。1.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为( )
A.6 B.8 C.12 D.16AC2、下列变化的比较, 不正确的是( )
A.酸性强弱: HClO4>H2SO4>H3PO4>H2SiO3
B.原子半径大小: Na>S>O
C.碱性强弱: KOH>NaOH>LiOH????
D.?还原性强弱: F->Cl->I-D 第2节 元素周期律课时2第一章 元素周期表1、了解两性元素2、了解元素最高化合价与元素周期表位置的关系3、了解元素周期表及周期律在其他方面的应用 本课首先利用结构、位置与性质三者之间的关系导入新课,进而引出元素周期表及周期律在其他方面的应用;首先巩固元素周期表及周期律在元素位置、性质及结构方面的应用,然后再说明在元素金属性及非金属性方面的应用;再而介绍在元素的化合价判断方面的应用。最后简单介绍在其他领域的应用元素周期表及周期律具体又有哪些应用呢?一、元素的位、构、性三者之间的关系应用1、结构决定位置原子序数=核电荷数
周期序数=电子层数
主族序数=最外层电子数2、结构决定性质 最外层电子数=主族元素的最高正价数=8-负价数最外层电子数和原子半径原子得失电子的能力元素的金属性、非金属性强弱单质的氧化性、还原性强弱3、位置决定性质二、金属与非金属性 分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图:同周期:从左到右,递变性 氧化性增强
非金属性逐渐增强金属性逐渐增强原子半径逐渐增大金属性逐渐增强还原性逐渐增强原子半径逐渐减小非金属性逐渐增强非金属性依次增强 什么元素的金属性最强?什么元素的非金属性最强它们分别位于元素周期表中的什么位置?三、元素的化合价与元素在周期表中的位置关系
(1)主族元素:
最高正价数 = 主族序数 = 最外层电子数?
(2)非金属元素:
|最高正价|+|最低负价|= 8?四、其他应用(P18)(1)预言未知元素并证实.
(2)分界处找半导体材料.
(3)在非金属区域找制农药元素.
(4)过度区寻找催化剂和耐高温、耐腐蚀的合金材料.1、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场, 已知它与氧元素同族, 与K同周期, 关于硒的说法中不正确的是( )
A.原子序数为34????????????????
B.最高价氧化物的水化物的分子式为H2SeO4
C.Se的非金属性比Br弱????????
D.气态氢化物的稳定性比硫化氢气体强D2、有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。
由此可推知(填元素符号):
V是____、W是____、X是_____、Y是____、Z是_____H O Al S K
