人教版必修2化学课件:第1章第3节《化学键》(共42张PPT)
文档属性
| 名称 | 人教版必修2化学课件:第1章第3节《化学键》(共42张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 811.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-25 22:52:53 | ||
图片预览









文档简介
课件42张PPT。第一章 物质结构 元素周期律第三节 化学键(第1课时)离子键1.了解离子键的概念。
2.掌握离子键的形成过程和形成条件。
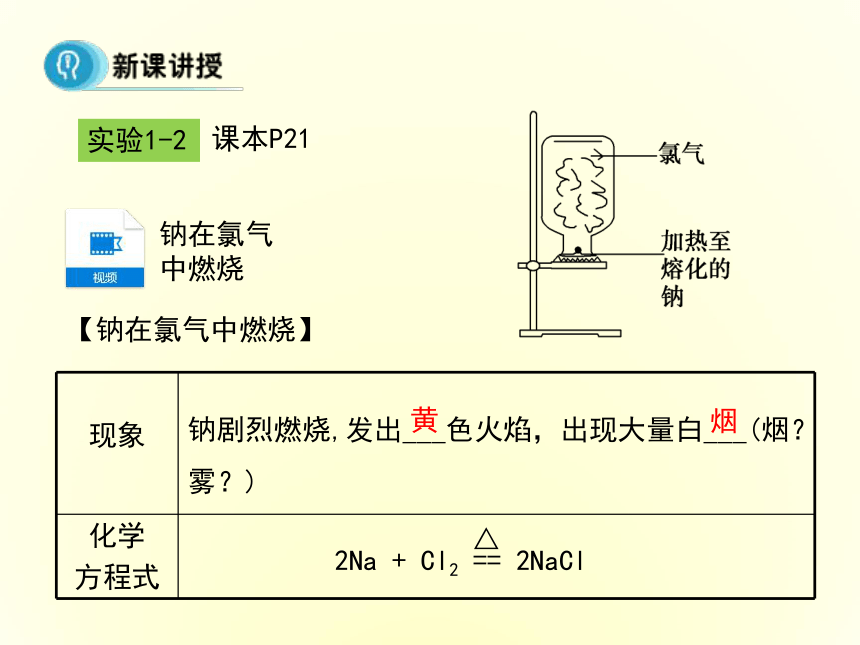
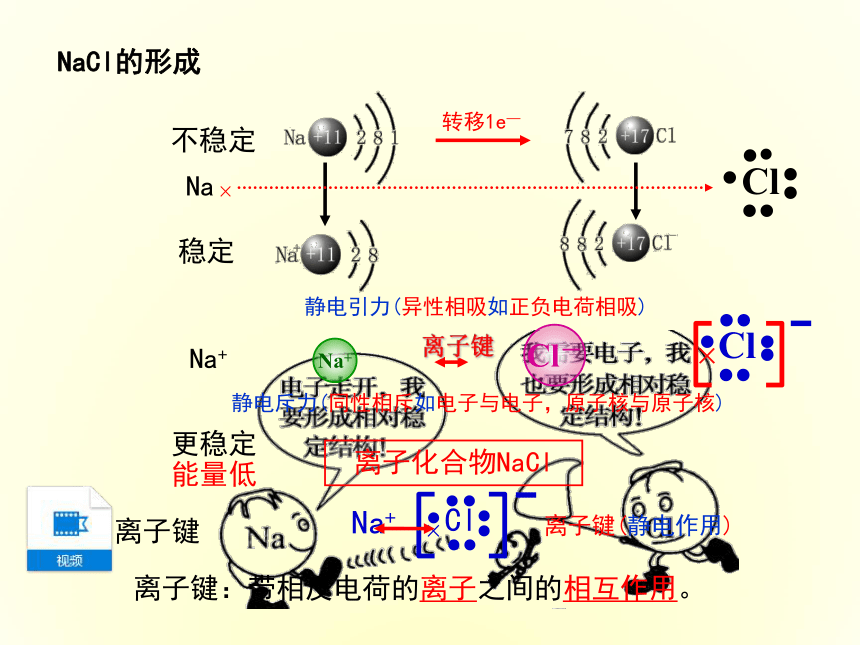
3.能熟练地用电子式表示离子化合物的形成过程。 本课首先从元素周期表中出发,让学生回忆目前的元素种类,并指明目前的化合物种类,引导学生分析元素形成化合物时需要一种作用,进而引入“化学键”的概念;然后从Na与Cl2的实验入手,分析Na元素与Cl元素的形成过程,最终确定活泼金属与活泼非金属之间形成的化学键——“离子键”,并归纳形成“离子键”的微粒、条件及其存在。
在讲“电子式”时,注意从原子的“电子式”入手,结合稳定结构分析原子的得失电子情况,从而过渡到阴、阳离子的“电子式”,再根据“离子化合物”的构成微粒,确定“离子化合物”的“电子式”,注重对相同离子的处理。最后用“电子式”表示出“离子化合物”的形成过程。118种元素3800万种物质元素组成原子分子构成化学键实验1-2课本P21【钠在氯气中燃烧】钠剧烈燃烧,发出___色火焰,出现大量白___(烟?雾?)黄烟钠在氯气中燃烧NaCl的形成不稳定稳定更稳定 能量低Na+静电引力(异性相吸如正负电荷相吸)Na+Cl-静电斥力(同性相斥如电子与电子,原子核与原子核)离子键离子化合物NaCl离子键(静电作用)离子键:带相反电荷的离子之间的相互作用。离子键在氯化钠晶体中,Na+和Cl- 之间存在哪些作用力?1.Na+离子和Cl-离子间的静电相互吸引作用。3.因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的化学键。2.阴阳离子间电子与电子、原子核与原子核间的相互排斥作用。一、离子键带相反电荷的(阴阳)离子之间的相互作用称为离子键得失电子阴阳离子静电作用活泼金属 + 活泼非金属包括:正价原子团如:NH4+包括:负价原子团如:OH-注意:并非所有金属元素和非金属元素组成的都是离子键,如AlCl3等。1.离子键2.离子化合物由离子键构成的化合物叫做离子化合物。下列哪些物质中存在离子键?
Na2O MgCl2 SO2 HCl
Na2O2 NaOH KNO3 NH4ClNa2OMgCl2Na2O2NaOHKNO3NH4Cl1.概念:
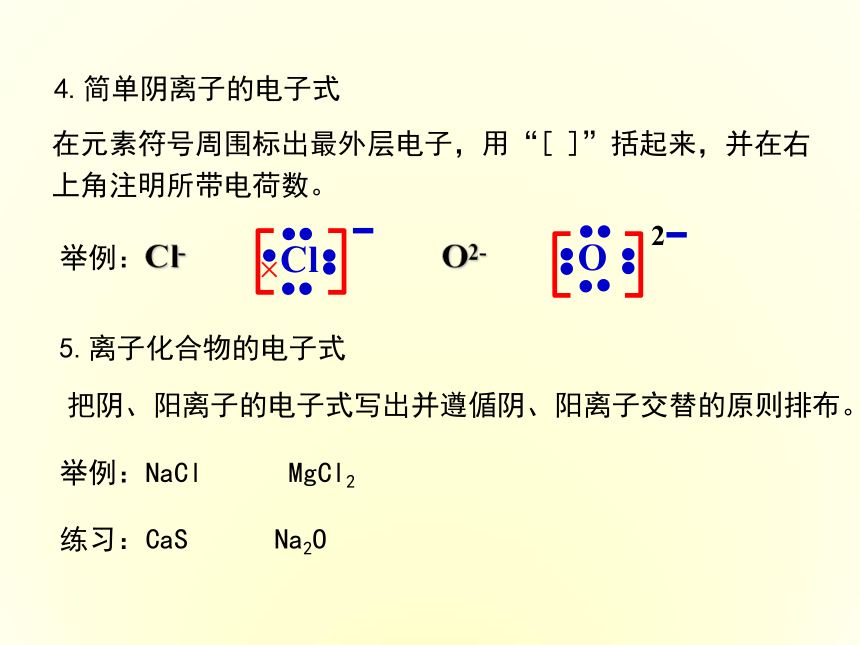
在元素符号周围用·或×表示原子的____________的式子。2.原子的电子式3.阳离子的电子式 最外层电子 (1)简单阳离子电子式就是离子符号 (2)复杂阳离子 H+ Na+ (尽可能对称,电子尽可能分布在元素符号的上、下、左、右4个位置,每个位置不超过2个电子)H Na Mg Al C N O F二、电子式5.离子化合物的电子式 把阴、阳离子的电子式写出并遵偱阴、阳离子交替的原则排布。举例:NaCl MgCl2 练习:CaS Na2O 4.简单阴离子的电子式 在元素符号周围标出最外层电子,用“[ ]”括起来,并在右上角注明所带电荷数。举例:Cl- O2- 6.用电子式表示离子化合物形成过程Na1 Cl1确定原子的个数Na + Cl写出电子式写出电子式+Na2 S1确定原子的个数2Na + S写出电子式写出电子式二、用电子式表示下列物质形成过程1.MgCl22.Na2S一、写出下列物质的电子式
1.NaBr 2.CaF2 3. CaO 1.下列说法正确的是( )
A.离子键就是阴阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系能量降低
D.离子化合物CaCl2中,两个氯离子间也存在离子键 C3.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.溶于水 B.熔点较高
C.水溶液能导电 D.熔融状态能导电2.下列不是离子化合物的是( )
A.H2O B.Na2S
C.KOH D.NH4NO3 AD4.下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A.10与19 B.6与16
C.11与17 D.14与85.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.Na2O的电 子式:
B.质量数为37的氯原子:
C.Br-的电子式:
D.Ar的结构示意图: CC第一章 物质结构 元素周期律第3节 化学键(课时2)1、知道共价键的概念和共价化合物的概念。
2、掌握共价键的形成条件条件。
3、能熟练地用电子式表示简单共价化合物的形成过程。 本课首先从复习离子键的形成出发,让学生回忆活泼金属与活泼非金属之间形成的化学键,然后提出问题:非金属元素与非金属元素之间能否形成“离子键”,然后用图示表示H原子与Cl原子形成化学键的过程,最后归纳总结“共价键”的微粒、条件、分类及其存在。
在讲共价化合物的表示形式时,要注意“电子式”和“结构式”的对应,引导学生分析原子的最外层电子数,进而结合8电子稳定结构判断所形成的共价键的数目,从而可快速写出“结构式”,再写出“电子式”的方法。在表示“共价键”的形成过程时,要注意与“离子键”的区别。然后通过分析,掌握“离子键”与“共价键”在物质中的存在情况。最后归纳总结“化学键”的概念、分类等知识。⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程 箭头左方相同的原子可以合并,
箭头右方相同的微粒不可以合并。注
意共 价 键 H· 和 原子形成HCl过程中,能否形成离子键?为什么?HCl分子不是通过离子键来形成,是通过什么方式结合的呢?不能,因非金属元素的原子均有获得电子的倾向。我只有一个电子,太少了我也少一个电子eH 原子Cl 原子eeeeeee二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有,行吗?eeeeeee愿意愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?eeeeeeee不稳定共用1对e—稳定共价化合物HCl更稳定 能量低共价键共价键共价键共价键:原子间通过共用电子对所形成的相互作用。HCl的形成共价键得失电子阴阳离子静电作用 活泼金属 + 活泼非金属包括:
正价原子团
如:NH4+包括:
负价原子团
如:OH-1.共价键概念:原子间通过共用电子对所形成的相互作用。 共用
电子对原子静电作用非金属元素 + 非金属元素
【不活泼金属元素】判断下列物质中哪些仅含有共价键?KFCH4MgCl 2H2OH2O2Na2O2个例:AlCl3CH4H2OH2O2只要有离子键的化
合物阴阳
离子一定有离
子键,可能
有共价键2. 共价化合物只有共价键的化合
物,原子通过共用
电子对形成分子的
化合物分子只有共价键 活金属元素
+
活非金属元素
(除氯化铝)非金属元素
+
非金属元素
(共价化合物只含共价键,熔融时不发生电离,故液态时不导电)从元素种类角度判断,下列物质:
属于离子化合物有___________;
共价化合物有_________。
①He __________ ②H2 __________
③CaO__________ ④CO2 _________
⑤CaF2 __________ ⑥MgS __________
⑦AlCl3 __________ ⑧Na2SO4 __________
⑨HNO3 _________ ⑩Mg(OH)2 __________③ ⑤ ⑥ ⑧ ⑩ ④ ⑦ ⑨3. 共价键的分类共用电子对不偏移共用电子对偏移有不同种非金属元素形成有同种非金属元素形成非极性键极性键共价键极性键与非极性键判定依据:(不显电性)(吸电子能力强的显负电性,
吸电子能力弱的显正电性)00+1-1看成键元素是否相同。4. 用电子式表示共价化合物形成过程 H2 O1确定原子的个数2H + O写出电子式写出电子式2H×+ H1 Cl1确定原子的个数 H + Cl写出电子式写出电子式+H—O—HO=C=O5. 结构式
在化学上,常用一根短线表示一对共用电子对。四、化学键
1. 概念:使_____相结合或______相结合的作用力。离子原子离子键共价键2. 分类注意:稀有气体是单原子分子,所以稀有气体中不存在化学键。3. 从化学键角度理解化学反应:
①若只有化学键的断裂或只有化学键的形成一定是化学反应吗?
②所以必须__________________________才是化学反应。既有旧键断裂,又有新键形成离子化合物共价化合物 反应物化学键断裂(分子变成原子),生成物化学键形成 (原子结合成分子)过程。通过共用电子对方式形成共价键通过得失电子方式形成离子键达
到
8
电
子
稳
定
结
构形成阴阳离子构成离子化合物形成分子构成共价化合物1.下列叙述正确的是( )
A.离子化合物可能含有共价键
B.常温下的气体分子中一定含有共价键
C.共价化合物中可能含有离子键
D.单质分子中不存在化学键A2.下列分子的电子式书写正确的是( )
A.氨
B.四氯化碳
C.氮 气
D.二氧化碳 C 3.下表物质所含化学键类型、所属化合物类型完全正确的一组是( )
A4.按要求写出下列化学式。
(1)由非金属元素组成的离子化合物___________
(2)含金属元素的共价化合物_________________
(3)含极性键的离子化合物___________________
(4)含非极性键的离子化合物_________________
(5)含极性和非极性键的共价化合物____________
NH4Cl AlCl3 NaOH Na2O2 H2O2
2.掌握离子键的形成过程和形成条件。
3.能熟练地用电子式表示离子化合物的形成过程。 本课首先从元素周期表中出发,让学生回忆目前的元素种类,并指明目前的化合物种类,引导学生分析元素形成化合物时需要一种作用,进而引入“化学键”的概念;然后从Na与Cl2的实验入手,分析Na元素与Cl元素的形成过程,最终确定活泼金属与活泼非金属之间形成的化学键——“离子键”,并归纳形成“离子键”的微粒、条件及其存在。
在讲“电子式”时,注意从原子的“电子式”入手,结合稳定结构分析原子的得失电子情况,从而过渡到阴、阳离子的“电子式”,再根据“离子化合物”的构成微粒,确定“离子化合物”的“电子式”,注重对相同离子的处理。最后用“电子式”表示出“离子化合物”的形成过程。118种元素3800万种物质元素组成原子分子构成化学键实验1-2课本P21【钠在氯气中燃烧】钠剧烈燃烧,发出___色火焰,出现大量白___(烟?雾?)黄烟钠在氯气中燃烧NaCl的形成不稳定稳定更稳定 能量低Na+静电引力(异性相吸如正负电荷相吸)Na+Cl-静电斥力(同性相斥如电子与电子,原子核与原子核)离子键离子化合物NaCl离子键(静电作用)离子键:带相反电荷的离子之间的相互作用。离子键在氯化钠晶体中,Na+和Cl- 之间存在哪些作用力?1.Na+离子和Cl-离子间的静电相互吸引作用。3.因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的化学键。2.阴阳离子间电子与电子、原子核与原子核间的相互排斥作用。一、离子键带相反电荷的(阴阳)离子之间的相互作用称为离子键得失电子阴阳离子静电作用活泼金属 + 活泼非金属包括:正价原子团如:NH4+包括:负价原子团如:OH-注意:并非所有金属元素和非金属元素组成的都是离子键,如AlCl3等。1.离子键2.离子化合物由离子键构成的化合物叫做离子化合物。下列哪些物质中存在离子键?
Na2O MgCl2 SO2 HCl
Na2O2 NaOH KNO3 NH4ClNa2OMgCl2Na2O2NaOHKNO3NH4Cl1.概念:
在元素符号周围用·或×表示原子的____________的式子。2.原子的电子式3.阳离子的电子式 最外层电子 (1)简单阳离子电子式就是离子符号 (2)复杂阳离子 H+ Na+ (尽可能对称,电子尽可能分布在元素符号的上、下、左、右4个位置,每个位置不超过2个电子)H Na Mg Al C N O F二、电子式5.离子化合物的电子式 把阴、阳离子的电子式写出并遵偱阴、阳离子交替的原则排布。举例:NaCl MgCl2 练习:CaS Na2O 4.简单阴离子的电子式 在元素符号周围标出最外层电子,用“[ ]”括起来,并在右上角注明所带电荷数。举例:Cl- O2- 6.用电子式表示离子化合物形成过程Na1 Cl1确定原子的个数Na + Cl写出电子式写出电子式+Na2 S1确定原子的个数2Na + S写出电子式写出电子式二、用电子式表示下列物质形成过程1.MgCl22.Na2S一、写出下列物质的电子式
1.NaBr 2.CaF2 3. CaO 1.下列说法正确的是( )
A.离子键就是阴阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系能量降低
D.离子化合物CaCl2中,两个氯离子间也存在离子键 C3.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.溶于水 B.熔点较高
C.水溶液能导电 D.熔融状态能导电2.下列不是离子化合物的是( )
A.H2O B.Na2S
C.KOH D.NH4NO3 AD4.下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A.10与19 B.6与16
C.11与17 D.14与85.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.Na2O的电 子式:
B.质量数为37的氯原子:
C.Br-的电子式:
D.Ar的结构示意图: CC第一章 物质结构 元素周期律第3节 化学键(课时2)1、知道共价键的概念和共价化合物的概念。
2、掌握共价键的形成条件条件。
3、能熟练地用电子式表示简单共价化合物的形成过程。 本课首先从复习离子键的形成出发,让学生回忆活泼金属与活泼非金属之间形成的化学键,然后提出问题:非金属元素与非金属元素之间能否形成“离子键”,然后用图示表示H原子与Cl原子形成化学键的过程,最后归纳总结“共价键”的微粒、条件、分类及其存在。
在讲共价化合物的表示形式时,要注意“电子式”和“结构式”的对应,引导学生分析原子的最外层电子数,进而结合8电子稳定结构判断所形成的共价键的数目,从而可快速写出“结构式”,再写出“电子式”的方法。在表示“共价键”的形成过程时,要注意与“离子键”的区别。然后通过分析,掌握“离子键”与“共价键”在物质中的存在情况。最后归纳总结“化学键”的概念、分类等知识。⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程 箭头左方相同的原子可以合并,
箭头右方相同的微粒不可以合并。注
意共 价 键 H· 和 原子形成HCl过程中,能否形成离子键?为什么?HCl分子不是通过离子键来形成,是通过什么方式结合的呢?不能,因非金属元素的原子均有获得电子的倾向。我只有一个电子,太少了我也少一个电子eH 原子Cl 原子eeeeeee二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有,行吗?eeeeeee愿意愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?eeeeeeee不稳定共用1对e—稳定共价化合物HCl更稳定 能量低共价键共价键共价键共价键:原子间通过共用电子对所形成的相互作用。HCl的形成共价键得失电子阴阳离子静电作用 活泼金属 + 活泼非金属包括:
正价原子团
如:NH4+包括:
负价原子团
如:OH-1.共价键概念:原子间通过共用电子对所形成的相互作用。 共用
电子对原子静电作用非金属元素 + 非金属元素
【不活泼金属元素】判断下列物质中哪些仅含有共价键?KFCH4MgCl 2H2OH2O2Na2O2个例:AlCl3CH4H2OH2O2只要有离子键的化
合物阴阳
离子一定有离
子键,可能
有共价键2. 共价化合物只有共价键的化合
物,原子通过共用
电子对形成分子的
化合物分子只有共价键 活金属元素
+
活非金属元素
(除氯化铝)非金属元素
+
非金属元素
(共价化合物只含共价键,熔融时不发生电离,故液态时不导电)从元素种类角度判断,下列物质:
属于离子化合物有___________;
共价化合物有_________。
①He __________ ②H2 __________
③CaO__________ ④CO2 _________
⑤CaF2 __________ ⑥MgS __________
⑦AlCl3 __________ ⑧Na2SO4 __________
⑨HNO3 _________ ⑩Mg(OH)2 __________③ ⑤ ⑥ ⑧ ⑩ ④ ⑦ ⑨3. 共价键的分类共用电子对不偏移共用电子对偏移有不同种非金属元素形成有同种非金属元素形成非极性键极性键共价键极性键与非极性键判定依据:(不显电性)(吸电子能力强的显负电性,
吸电子能力弱的显正电性)00+1-1看成键元素是否相同。4. 用电子式表示共价化合物形成过程 H2 O1确定原子的个数2H + O写出电子式写出电子式2H×+ H1 Cl1确定原子的个数 H + Cl写出电子式写出电子式+H—O—HO=C=O5. 结构式
在化学上,常用一根短线表示一对共用电子对。四、化学键
1. 概念:使_____相结合或______相结合的作用力。离子原子离子键共价键2. 分类注意:稀有气体是单原子分子,所以稀有气体中不存在化学键。3. 从化学键角度理解化学反应:
①若只有化学键的断裂或只有化学键的形成一定是化学反应吗?
②所以必须__________________________才是化学反应。既有旧键断裂,又有新键形成离子化合物共价化合物 反应物化学键断裂(分子变成原子),生成物化学键形成 (原子结合成分子)过程。通过共用电子对方式形成共价键通过得失电子方式形成离子键达
到
8
电
子
稳
定
结
构形成阴阳离子构成离子化合物形成分子构成共价化合物1.下列叙述正确的是( )
A.离子化合物可能含有共价键
B.常温下的气体分子中一定含有共价键
C.共价化合物中可能含有离子键
D.单质分子中不存在化学键A2.下列分子的电子式书写正确的是( )
A.氨
B.四氯化碳
C.氮 气
D.二氧化碳 C 3.下表物质所含化学键类型、所属化合物类型完全正确的一组是( )
A4.按要求写出下列化学式。
(1)由非金属元素组成的离子化合物___________
(2)含金属元素的共价化合物_________________
(3)含极性键的离子化合物___________________
(4)含非极性键的离子化合物_________________
(5)含极性和非极性键的共价化合物____________
NH4Cl AlCl3 NaOH Na2O2 H2O2
