人教版必修2化学课件:第4章第1节 《开发利用金属矿物和海水资源》(共60张PPT)
文档属性
| 名称 | 人教版必修2化学课件:第4章第1节 《开发利用金属矿物和海水资源》(共60张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-25 22:55:06 | ||
图片预览











文档简介
课件60张PPT。第四章 化学与自然资源的开发利用第1节 开发利用金属矿物和海水资源
(课时1)1、了解金属在自然界中存在的形式。
2、掌握金属冶炼的一般方法和原理。
3、掌握铝热反应原理及实验。
4、了解合理开发和利用金属矿物资源的意义。
5、认识和体会化学在自然资源开发和利用中的意义和作用。本节课从金属矿物和金属在自然界中的存在形式引入,通过金属冶炼的基本原理,使学生认识到化学是冶金工业的重要科学基础,化学方法是由金属化合物转变成金属单质的惟一方式,金属活动性和氧化还原反应发生的条件是选择金属冶炼方式的主要依据。在学生掌握金属冶炼的一般原理的基础上,把不同金属的冶炼方法和铝热反应作为本节课的重点。
以高炉炼铁的实例总结热还原法冶炼金属的原理,并由此引出铝热反应(同时配置实验视频),利用学生弄清楚铝热反应的实质和特点;以金属活动性和氧化还原反应发生的条件为线索总结其它金属的冶炼方法,有助于学生理解金属冶炼过程的实质。金矿铂矿漂亮的金属矿物金属的使用促进了人类文明的发展。
自然界中,除少数金属(如金、铂)以游离态存在,绝大多数金属以化合态存在。
我们在生产和生活中使用的金属制品基本上都是单质形态。
怎样可以将金属化合物转变为单质呢?
【提示】将金属从其化合物中还原出来,用于生产和制造各种金属材料的过程,在工业上称为金属的冶炼。高炉炼铁(一)热还原法①加热或高温条件下用还原剂还原金属的氧化物。
②常用的还原剂有:H2、 CO、C(焦炭) 、活泼金属(如Al ) 。
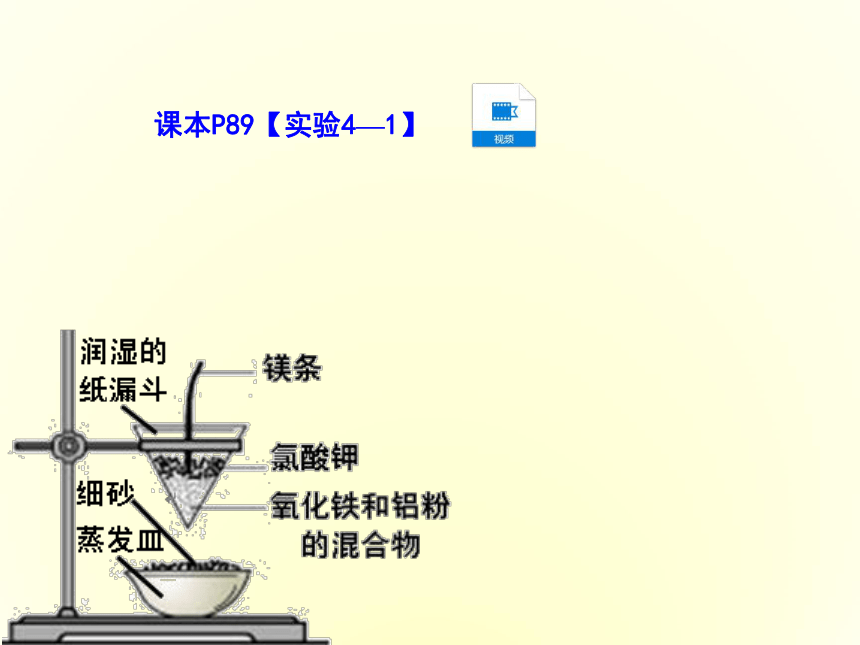
③适用于金属活动顺序表中Zn~Cu的中等活泼性金属。一、金属冶炼的方法课本P89【实验4—1】课本P89【实验4—1】 镁条剧烈燃烧,发出耀眼的白光,产生大量烟,纸漏斗的下部被烧穿,有熔融物落入蒸发皿中。铝热反应反应方程式:铝热反应的应用:(1)焊接钢轨。反应现象:(2)冶炼高熔点金属(如:钒、铬、锰等)。 试写出利用铝热反应冶炼下列金属的化学方程式
①钒(V、+5价)、 ②铬(Cr、+3价) 、 ③锰(Mn、+4价)K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au(二)电解法①适用于金属活动顺序表中K~Al的活泼金属。②电解其熔融盐或氧化物。冰晶石的作用:降低Al2O3的熔点(2050℃ →1200℃) 工业上电解法制镁用MgCl2而不用MgO,电解法制铝用Al2O3而不用AlCl3,为什么?(已知熔点: MgO为2852℃、MgCl2为718℃; Al2O3为2050℃、AlCl3为190℃) ①MgO熔点高、耗能大
②AlCl3共价化合物熔融不导电。K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au(二)电解法①适用于金属活动顺序表中K~Al的活泼金属。②电解其熔融盐或氧化物。(三) 法①适用于金属活动顺序表中 及其以后的 金属。
②加热分解其氧化物。K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au(四)物理方法:适用于以 态存在的金属,如金和铂。“淘金” 的原理:金的密度比沙大,用水洗法可淘去泥土沙粒。马达加斯加街头淘金者【我能自学】位于Cu之后的不活泼金属怎么冶炼,请同学们自学课本P88内容,并完成以下填空:Hg AgHg不活泼热分解游离二、金属冶炼的原理金属的冶炼过程的实质是:电解法、热还原法和热分解法冶炼金属时:
①金属元素的化合价如何变化?
②金属离子是得电子还是失电子?(1)提高金属矿物的利用率
(2)减少金属的使用量
(3)加强金属资源的回收和再利用
(4)使用其他材料代替金属材料(1)节约矿物资源
(2)节约能源
(3)减少环境污染 【查一查】阅读课本P89最后一自然段,完成下表。三、合理开发和利用金属矿物资源二、金属冶炼的原理一、金属的冶炼方法三、合理开发和利用金属矿物资源电解法热还原法热分解法物理方法铝热反应:易 难减弱1.冶炼金属常用以下几种方法:
①以C、CO或 H2作还原剂还原
②利用铝热反应原理用Al还原
③电解法
④热分解法
下列金属各采用哪种方法还原最佳(填序号)?
(1)Fe、Zn、Cu等中等活泼的金属( )
(2)Na、Mg、Al等活泼金属( )
(3)Hg、Ag等不活泼金属( )
(4)V、Cr、Mn、W等高熔点金属( )①③④② 2.铝能冶炼某些熔点高、硬度大的金属,是因为铝( )
A.具有导电性和导热性
B.具有还原性,且生成氧化铝时放出大量热
C.在空气中燃烧,发出耀眼的白光
D.是一种金属,且密度小,熔点较低B 3.下列氧化物不能跟铝粉组成铝热剂的是( )
A.WO3 B.MnO2 C.MgO D.V2O5C 4.下列叙述正确的是( )
A.工业上用电解熔融氯化钠的方法制取钠
B.钠加入氯化镁的饱和溶液中可以制取镁
C.电解冶炼铝的原料是氯化铝
D.碳在高温下能还原氧化铝中的铝A第四章 化学与自然资源的开发利用第2课时 海水资源的开发利用第一节 开发利用金属矿物和海水资源1.了解海水资源及其利用。
2.了解海水淡化的方法,掌握海水的蒸馏。
3.掌握海水化学资源的开发和利用,即海水制盐,从海水中提取碘、溴、镁。
4.了解海水综合利用的重要方向。本节课从各种丰富多样的海洋资源引入,通过数据列表、图片、视频等多种形式的内容展现,使学生认识海水资源的特点、掌握水资源和化学资源的获取方法与化学原理,以及涉及的基本实验操作方法。本节课以海水化学资源的开发和利用,即海水制盐,海水提碘、提溴、提镁作为教学重点。
在讲授粗盐精制时注意总结物质提纯方案设计的一般思路;在讲从海水提取碘、溴时,注意引导学生阅读教材,增强学生的阅读和理解能力;在讲从海水提取镁时,注意引导学生分析讨论实验方案。海洋中的生物资源海洋中的矿产资源海洋中的水资源和化学资源海水中水的储量约为1.3×109 亿吨,占地球总水量 97%元素种类很多,总计含有80多种元素许多元素的富集程度很低海水资源的特点:1、海水水资源的利用主要包括哪些途径?2、海水淡化的方法主要有什么?阅读课本 P90 第二自然段内容,回答下列问题:二、海水资源的开发利用用于循环冷却1.水资源的利用海水淡化的方法主要有蒸馏法、电渗析法、离子交换法 等。原理:加热到水的沸点,液态水变成水蒸气,与海水中的盐分离,水蒸气冷凝得淡水。特点:历史最久,技术和工艺比较成熟,但成本较高。●蒸馏法适用范围:沸点相差较大的液体混合物。
注意事项:①温度计的水银球置于蒸馏烧瓶的支管口;②蒸馏烧瓶内加沸石防止暴沸;③冷凝管水流方向“下进上出”。海水淡化与能源技术相结合,能解决成本问题。●太阳能蒸发法按含量计:含O、H及Cl、Na、S、C、F、B、Br、Sr共13种元素的质量超过总量的99%,其他为微量元素,总计含有80多种元素。虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度却很低。所以,海水中化学资源的利用首先要解决元素的富集问题。2.海水中化学资源的利用首先要解决的问题是什么?1.海水中含量较多的元素是什么?主要以什么微粒形式存在于海水中?2.化学资源的开发利用这是一种传统的制盐方法:将海水引入盐田,在太阳照射下蒸发水,留下粗盐。 (1)海水制盐如何将粗盐的提纯?除杂试剂:①Na2CO3②NaOH③BaCl2试剂加入顺序:②③①④或③②①④或③①②④基本原则:先加BaCl2,后加Na2CO3,过滤后加盐酸④HCl粗盐中的杂质:泥沙、Ca2+、 Mg2+、 SO42-CaCO3Mg(OH)2BaSO4BaCO3过滤物质提纯的方案设计一般思路:分析混合物的组成根据杂质的特点选择除杂试剂和分离方法所加试剂的顺序、用量及过量后如何处理 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,阅读课本P91实验 4-2。思考每步操作的目的和注意事项。海带海带灰残渣含I-的溶液稀H2SO4
H2O2含I2的溶液溶液变为蓝色淀粉溶液 请写出该实验涉及的离子方程式 。
(2)海带提碘1.海带为什么不能用水冲洗?剪碎后,为什么要用酒精润湿?海带如果用水浸泡,碘化物会部分溶解而损耗,且海带不易燃烧。
酒精润湿可使海带易于灼烧完全,并缩短灼烧时间。2.若要从含I2的水溶液中提取I2,应用什么方法?用有机溶剂萃取水溶液中的I2,分液后再用蒸馏法将I2与有机溶剂分离开。紫红3.实验室萃取Br2、I2在什么仪器中进行?常用的萃取剂是什么?它们在萃取剂中一般呈现什么颜色?橙红有机溶剂,如CCl4 、苯将Br-转变为Br2是海水中提溴中关键的化学反应(见课本P91资料卡片“海水提溴”),你能否设计一个实验方案模拟这一生产过程?写出有关的化学方程式。(3)海水提溴Br2 + SO2 + 2H2O = 2HBr + H2SO42NaBr + Cl2 = Br2 +2NaCl2HBr + Cl2 = Br2 + 2HCl溴的沸点低,易挥发Mg无水MgCl2MgCl2溶液Mg(OH)2沉淀溶液试剂①试剂②熔融 电解海水
(含Mg2+)操作①石灰乳Mg2++Ca(OH)2=Mg(OH)2+Ca2+ 过滤 盐酸 Mg(OH)2+2HCl = MgCl+2H2O(4)海水提镁3.海水资源的综合利用 海水综合利用的重要方向是:海水淡化同化工生产结合、同能源技术结合。如从海水中制得的氯化钠除食用外,还用作工业原料,如生产烧碱、纯碱、金属钠以及氯气、盐酸、漂白粉等含氯化工产品。从海水中制取镁、钾、溴及其化工产品,是在传统制盐工业上的发展。从海水中获得其他物质和能量具有广阔的前景。例如,铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义。化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能等也是越来越受到重视和开发的新型能源。海水综合利用联合工业体系一例用到了哪些分离、提纯的方法?D1.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )D2.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①3.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水D4.在空气吹出法的工艺中,有选用纯碱溶液作溴蒸气吸收剂的,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是( )
A.两种吸收过程中,Br2只作氧化剂
B.两种吸收过程都发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱作还原剂
D.用纯碱溶液作吸收剂只发生了复分解反应B5.下列有关说法中不正确的是( )
A.工业上可利用海水制取镁
B.实验室可以海带为原料获得碘
C.工业上可用还原剂还原赤铁矿(含Fe2O3)获得铁
D.从海水中提取溴元素(以Br-形式存在),可以考虑向其中通入F2D6.海水是巨大的资源宝库,可以进行综合利用。从海水中提取食盐和溴的过程如下:
(1)请写出一种海水淡化的方法:______________。
(2)步骤Ⅰ获得Br2的离子方程式为________________________________________________________________________________________________。 (3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是________(填化学式)。其反应中生成2 mol HBr,则消耗________ mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是________________。答案:
(1)蒸馏法(其他合理答案均可)
(2)Cl2+2Br-=Br2+2Cl-
(3)Br2 1
(4)Cl2>Br2>SO27.某化学兴趣小组为探究市售加碘食盐中碘元素的存在形式进行了以下实验探究。实验中仅供选择的药品有:含碘食盐、0.5%的淀粉溶液、3% H2O2、稀硫酸、5%的KI溶液、蒸馏水,实验中所需化学仪器任选。
(1)提出假设:
假设①:加碘食盐中碘是以I2的形式存在,用________溶液进行验证。
假设②:加碘食盐中碘以I-的形式存在,用H2O2和淀粉可以进行验证,可能发生的反应的离子方程式为_____________________________________________________________________________________________________。
假设③:加碘食盐中碘以IO3-的形式存在,根据反应:IO3-+5I-+6H+=3I2+3H2O判断,检验IO3-的存在所选取的试剂为:KI溶液、淀粉溶液、稀H2SO4和蒸馏水。(2)实验方案及结论:
取少量加碘食盐加水溶解配制成溶液,分装到三支洁净试管中备用。答案:
(1)淀粉
2I-+H2O2+2H+=I2+2H2O
(2)
(课时1)1、了解金属在自然界中存在的形式。
2、掌握金属冶炼的一般方法和原理。
3、掌握铝热反应原理及实验。
4、了解合理开发和利用金属矿物资源的意义。
5、认识和体会化学在自然资源开发和利用中的意义和作用。本节课从金属矿物和金属在自然界中的存在形式引入,通过金属冶炼的基本原理,使学生认识到化学是冶金工业的重要科学基础,化学方法是由金属化合物转变成金属单质的惟一方式,金属活动性和氧化还原反应发生的条件是选择金属冶炼方式的主要依据。在学生掌握金属冶炼的一般原理的基础上,把不同金属的冶炼方法和铝热反应作为本节课的重点。
以高炉炼铁的实例总结热还原法冶炼金属的原理,并由此引出铝热反应(同时配置实验视频),利用学生弄清楚铝热反应的实质和特点;以金属活动性和氧化还原反应发生的条件为线索总结其它金属的冶炼方法,有助于学生理解金属冶炼过程的实质。金矿铂矿漂亮的金属矿物金属的使用促进了人类文明的发展。
自然界中,除少数金属(如金、铂)以游离态存在,绝大多数金属以化合态存在。
我们在生产和生活中使用的金属制品基本上都是单质形态。
怎样可以将金属化合物转变为单质呢?
【提示】将金属从其化合物中还原出来,用于生产和制造各种金属材料的过程,在工业上称为金属的冶炼。高炉炼铁(一)热还原法①加热或高温条件下用还原剂还原金属的氧化物。
②常用的还原剂有:H2、 CO、C(焦炭) 、活泼金属(如Al ) 。
③适用于金属活动顺序表中Zn~Cu的中等活泼性金属。一、金属冶炼的方法课本P89【实验4—1】课本P89【实验4—1】 镁条剧烈燃烧,发出耀眼的白光,产生大量烟,纸漏斗的下部被烧穿,有熔融物落入蒸发皿中。铝热反应反应方程式:铝热反应的应用:(1)焊接钢轨。反应现象:(2)冶炼高熔点金属(如:钒、铬、锰等)。 试写出利用铝热反应冶炼下列金属的化学方程式
①钒(V、+5价)、 ②铬(Cr、+3价) 、 ③锰(Mn、+4价)K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au(二)电解法①适用于金属活动顺序表中K~Al的活泼金属。②电解其熔融盐或氧化物。冰晶石的作用:降低Al2O3的熔点(2050℃ →1200℃) 工业上电解法制镁用MgCl2而不用MgO,电解法制铝用Al2O3而不用AlCl3,为什么?(已知熔点: MgO为2852℃、MgCl2为718℃; Al2O3为2050℃、AlCl3为190℃) ①MgO熔点高、耗能大
②AlCl3共价化合物熔融不导电。K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au(二)电解法①适用于金属活动顺序表中K~Al的活泼金属。②电解其熔融盐或氧化物。(三) 法①适用于金属活动顺序表中 及其以后的 金属。
②加热分解其氧化物。K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au(四)物理方法:适用于以 态存在的金属,如金和铂。“淘金” 的原理:金的密度比沙大,用水洗法可淘去泥土沙粒。马达加斯加街头淘金者【我能自学】位于Cu之后的不活泼金属怎么冶炼,请同学们自学课本P88内容,并完成以下填空:Hg AgHg不活泼热分解游离二、金属冶炼的原理金属的冶炼过程的实质是:电解法、热还原法和热分解法冶炼金属时:
①金属元素的化合价如何变化?
②金属离子是得电子还是失电子?(1)提高金属矿物的利用率
(2)减少金属的使用量
(3)加强金属资源的回收和再利用
(4)使用其他材料代替金属材料(1)节约矿物资源
(2)节约能源
(3)减少环境污染 【查一查】阅读课本P89最后一自然段,完成下表。三、合理开发和利用金属矿物资源二、金属冶炼的原理一、金属的冶炼方法三、合理开发和利用金属矿物资源电解法热还原法热分解法物理方法铝热反应:易 难减弱1.冶炼金属常用以下几种方法:
①以C、CO或 H2作还原剂还原
②利用铝热反应原理用Al还原
③电解法
④热分解法
下列金属各采用哪种方法还原最佳(填序号)?
(1)Fe、Zn、Cu等中等活泼的金属( )
(2)Na、Mg、Al等活泼金属( )
(3)Hg、Ag等不活泼金属( )
(4)V、Cr、Mn、W等高熔点金属( )①③④② 2.铝能冶炼某些熔点高、硬度大的金属,是因为铝( )
A.具有导电性和导热性
B.具有还原性,且生成氧化铝时放出大量热
C.在空气中燃烧,发出耀眼的白光
D.是一种金属,且密度小,熔点较低B 3.下列氧化物不能跟铝粉组成铝热剂的是( )
A.WO3 B.MnO2 C.MgO D.V2O5C 4.下列叙述正确的是( )
A.工业上用电解熔融氯化钠的方法制取钠
B.钠加入氯化镁的饱和溶液中可以制取镁
C.电解冶炼铝的原料是氯化铝
D.碳在高温下能还原氧化铝中的铝A第四章 化学与自然资源的开发利用第2课时 海水资源的开发利用第一节 开发利用金属矿物和海水资源1.了解海水资源及其利用。
2.了解海水淡化的方法,掌握海水的蒸馏。
3.掌握海水化学资源的开发和利用,即海水制盐,从海水中提取碘、溴、镁。
4.了解海水综合利用的重要方向。本节课从各种丰富多样的海洋资源引入,通过数据列表、图片、视频等多种形式的内容展现,使学生认识海水资源的特点、掌握水资源和化学资源的获取方法与化学原理,以及涉及的基本实验操作方法。本节课以海水化学资源的开发和利用,即海水制盐,海水提碘、提溴、提镁作为教学重点。
在讲授粗盐精制时注意总结物质提纯方案设计的一般思路;在讲从海水提取碘、溴时,注意引导学生阅读教材,增强学生的阅读和理解能力;在讲从海水提取镁时,注意引导学生分析讨论实验方案。海洋中的生物资源海洋中的矿产资源海洋中的水资源和化学资源海水中水的储量约为1.3×109 亿吨,占地球总水量 97%元素种类很多,总计含有80多种元素许多元素的富集程度很低海水资源的特点:1、海水水资源的利用主要包括哪些途径?2、海水淡化的方法主要有什么?阅读课本 P90 第二自然段内容,回答下列问题:二、海水资源的开发利用用于循环冷却1.水资源的利用海水淡化的方法主要有蒸馏法、电渗析法、离子交换法 等。原理:加热到水的沸点,液态水变成水蒸气,与海水中的盐分离,水蒸气冷凝得淡水。特点:历史最久,技术和工艺比较成熟,但成本较高。●蒸馏法适用范围:沸点相差较大的液体混合物。
注意事项:①温度计的水银球置于蒸馏烧瓶的支管口;②蒸馏烧瓶内加沸石防止暴沸;③冷凝管水流方向“下进上出”。海水淡化与能源技术相结合,能解决成本问题。●太阳能蒸发法按含量计:含O、H及Cl、Na、S、C、F、B、Br、Sr共13种元素的质量超过总量的99%,其他为微量元素,总计含有80多种元素。虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度却很低。所以,海水中化学资源的利用首先要解决元素的富集问题。2.海水中化学资源的利用首先要解决的问题是什么?1.海水中含量较多的元素是什么?主要以什么微粒形式存在于海水中?2.化学资源的开发利用这是一种传统的制盐方法:将海水引入盐田,在太阳照射下蒸发水,留下粗盐。 (1)海水制盐如何将粗盐的提纯?除杂试剂:①Na2CO3②NaOH③BaCl2试剂加入顺序:②③①④或③②①④或③①②④基本原则:先加BaCl2,后加Na2CO3,过滤后加盐酸④HCl粗盐中的杂质:泥沙、Ca2+、 Mg2+、 SO42-CaCO3Mg(OH)2BaSO4BaCO3过滤物质提纯的方案设计一般思路:分析混合物的组成根据杂质的特点选择除杂试剂和分离方法所加试剂的顺序、用量及过量后如何处理 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,阅读课本P91实验 4-2。思考每步操作的目的和注意事项。海带海带灰残渣含I-的溶液稀H2SO4
H2O2含I2的溶液溶液变为蓝色淀粉溶液 请写出该实验涉及的离子方程式 。
(2)海带提碘1.海带为什么不能用水冲洗?剪碎后,为什么要用酒精润湿?海带如果用水浸泡,碘化物会部分溶解而损耗,且海带不易燃烧。
酒精润湿可使海带易于灼烧完全,并缩短灼烧时间。2.若要从含I2的水溶液中提取I2,应用什么方法?用有机溶剂萃取水溶液中的I2,分液后再用蒸馏法将I2与有机溶剂分离开。紫红3.实验室萃取Br2、I2在什么仪器中进行?常用的萃取剂是什么?它们在萃取剂中一般呈现什么颜色?橙红有机溶剂,如CCl4 、苯将Br-转变为Br2是海水中提溴中关键的化学反应(见课本P91资料卡片“海水提溴”),你能否设计一个实验方案模拟这一生产过程?写出有关的化学方程式。(3)海水提溴Br2 + SO2 + 2H2O = 2HBr + H2SO42NaBr + Cl2 = Br2 +2NaCl2HBr + Cl2 = Br2 + 2HCl溴的沸点低,易挥发Mg无水MgCl2MgCl2溶液Mg(OH)2沉淀溶液试剂①试剂②熔融 电解海水
(含Mg2+)操作①石灰乳Mg2++Ca(OH)2=Mg(OH)2+Ca2+ 过滤 盐酸 Mg(OH)2+2HCl = MgCl+2H2O(4)海水提镁3.海水资源的综合利用 海水综合利用的重要方向是:海水淡化同化工生产结合、同能源技术结合。如从海水中制得的氯化钠除食用外,还用作工业原料,如生产烧碱、纯碱、金属钠以及氯气、盐酸、漂白粉等含氯化工产品。从海水中制取镁、钾、溴及其化工产品,是在传统制盐工业上的发展。从海水中获得其他物质和能量具有广阔的前景。例如,铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义。化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能等也是越来越受到重视和开发的新型能源。海水综合利用联合工业体系一例用到了哪些分离、提纯的方法?D1.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )D2.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①3.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水D4.在空气吹出法的工艺中,有选用纯碱溶液作溴蒸气吸收剂的,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是( )
A.两种吸收过程中,Br2只作氧化剂
B.两种吸收过程都发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱作还原剂
D.用纯碱溶液作吸收剂只发生了复分解反应B5.下列有关说法中不正确的是( )
A.工业上可利用海水制取镁
B.实验室可以海带为原料获得碘
C.工业上可用还原剂还原赤铁矿(含Fe2O3)获得铁
D.从海水中提取溴元素(以Br-形式存在),可以考虑向其中通入F2D6.海水是巨大的资源宝库,可以进行综合利用。从海水中提取食盐和溴的过程如下:
(1)请写出一种海水淡化的方法:______________。
(2)步骤Ⅰ获得Br2的离子方程式为________________________________________________________________________________________________。 (3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是________(填化学式)。其反应中生成2 mol HBr,则消耗________ mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是________________。答案:
(1)蒸馏法(其他合理答案均可)
(2)Cl2+2Br-=Br2+2Cl-
(3)Br2 1
(4)Cl2>Br2>SO27.某化学兴趣小组为探究市售加碘食盐中碘元素的存在形式进行了以下实验探究。实验中仅供选择的药品有:含碘食盐、0.5%的淀粉溶液、3% H2O2、稀硫酸、5%的KI溶液、蒸馏水,实验中所需化学仪器任选。
(1)提出假设:
假设①:加碘食盐中碘是以I2的形式存在,用________溶液进行验证。
假设②:加碘食盐中碘以I-的形式存在,用H2O2和淀粉可以进行验证,可能发生的反应的离子方程式为_____________________________________________________________________________________________________。
假设③:加碘食盐中碘以IO3-的形式存在,根据反应:IO3-+5I-+6H+=3I2+3H2O判断,检验IO3-的存在所选取的试剂为:KI溶液、淀粉溶液、稀H2SO4和蒸馏水。(2)实验方案及结论:
取少量加碘食盐加水溶解配制成溶液,分装到三支洁净试管中备用。答案:
(1)淀粉
2I-+H2O2+2H+=I2+2H2O
(2)
