2024年秋浙教版科学九年级上册周复习课件--第06讲物质的转化 课件(22页ppt)
文档属性
| 名称 | 2024年秋浙教版科学九年级上册周复习课件--第06讲物质的转化 课件(22页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-10-18 09:38:02 | ||
图片预览






文档简介
(共22张PPT)
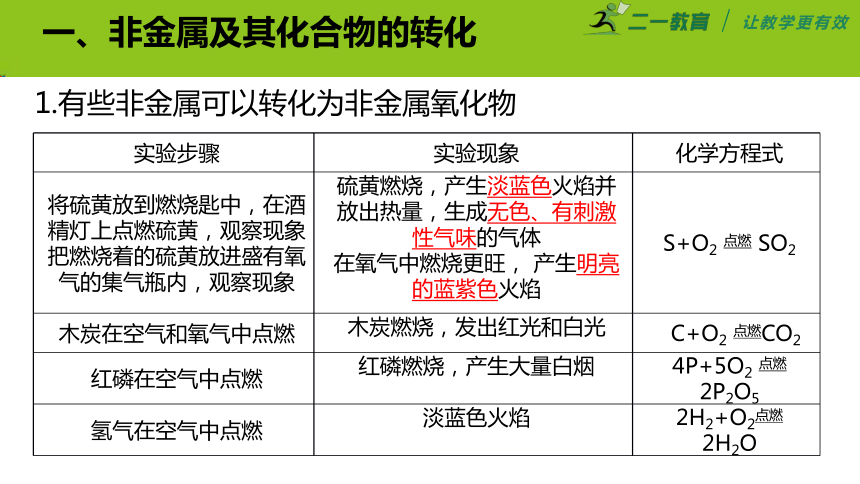
06 物质的转化
九上秋周巩固提高-chen
一、非金属及其化合物的转化
1.有些非金属可以转化为非金属氧化物
实验步骤 实验现象 化学方程式
将硫黄放到燃烧匙中,在酒精灯上点燃硫黄,观察现象 把燃烧着的硫黄放进盛有氧气的集气瓶内,观察现象 硫黄燃烧,产生淡蓝色火焰并放出热量,生成无色、有刺激性气味的气体 在氧气中燃烧更旺, 产生明亮的蓝紫色火焰 S+O2 点燃 SO2
木炭在空气和氧气中点燃 木炭燃烧,发出红光和白光 C+O2 点燃CO2
红磷在空气中点燃 红磷燃烧,产生大量白烟 4P+5O2 点燃2P2O5
氢气在空气中点燃 淡蓝色火焰 2H2+O2点燃 2H2O
一、非金属及其化合物的转化
2.非金属氧化物可以转化生成酸,不稳定的酸受热分解后又重新生成非金属氧化物(以CO2与碳酸的转化实验为例)
3.非金属的转化链条
非金属 → 非金属氧化物 → 酸 → 盐
二、金属及其化合物的转化
1.有的金属与非金属可以发生反应,转化成化合物(以铁粉和硫黄反应的实验为例)
其他一些金属与非金属也可以发生反应
实验步骤 实验现象 化学方程式
取少量铁粉放在白纸上,再取少量硫黄与铁粉混合。用磁铁接近混合物,观察现象 铁粉能被磁铁吸引
把混合物放进试管内,用酒精灯加热,观察现象 铁粉和硫黄反应发光,生成黑色固体,同时放出大量的热,反应的 Fe+S △ FeS
将生成物倒在白纸上,观察生成物的外观,再用磁铁靠近生成物,观察磁铁能否吸引生成物 生成物呈块状,不能被磁铁吸引
铁丝在氧气中点燃 剧烈燃烧,火星四射 3Fe+2O2点燃 Fe3O4
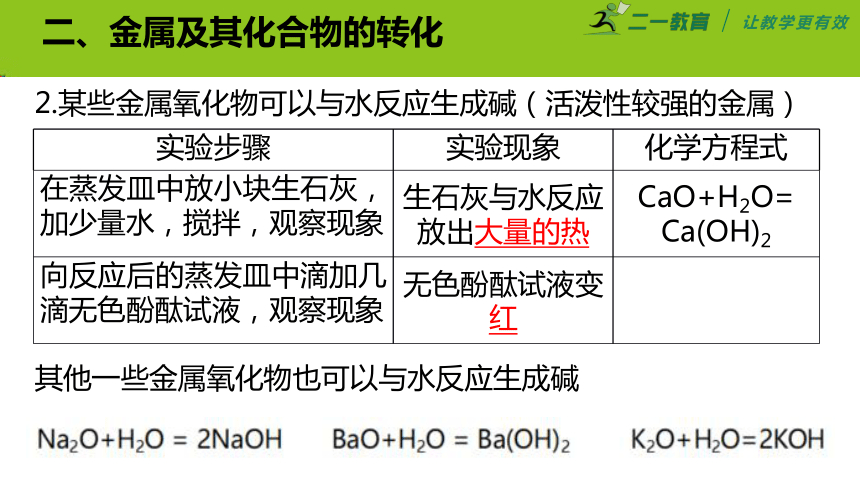
二、金属及其化合物的转化
2.某些金属氧化物可以与水反应生成碱(活泼性较强的金属)
其他一些金属氧化物也可以与水反应生成碱
实验步骤 实验现象 化学方程式
在蒸发皿中放小块生石灰,加少量水,搅拌,观察现象 生石灰与水反应放出大量的热 CaO+H2O= Ca(OH)2
向反应后的蒸发皿中滴加几滴无色酚酞试液,观察现象 无色酚酞试液变红
二、金属及其化合物的转化
3.金属的转化链条
金属 → 金属氧化物→ 碱 → 盐和水
(只有BaO、K2O、CaO、Na2O能与水反应)
金属 + 非金属单质 → 盐
三、金属的冶炼
1.金属在自然界中的存在
在自然界中,仅有少数金属(银铂金化学性质非常稳定)是以游离态(即单质)的形式存在的,大多数金属(化学性质活泼)是以化合态的形式存在的。
三、金属的冶炼
2金属的冶炼原理与方法
(1)冶炼原理:金属冶炼就是要把金属从化合态变成游离态。
(2)冶炼方法:
用C、CO、H2等还原剂与金属氧化物反应
夺取金属氧化物中的氧,得到金属单质
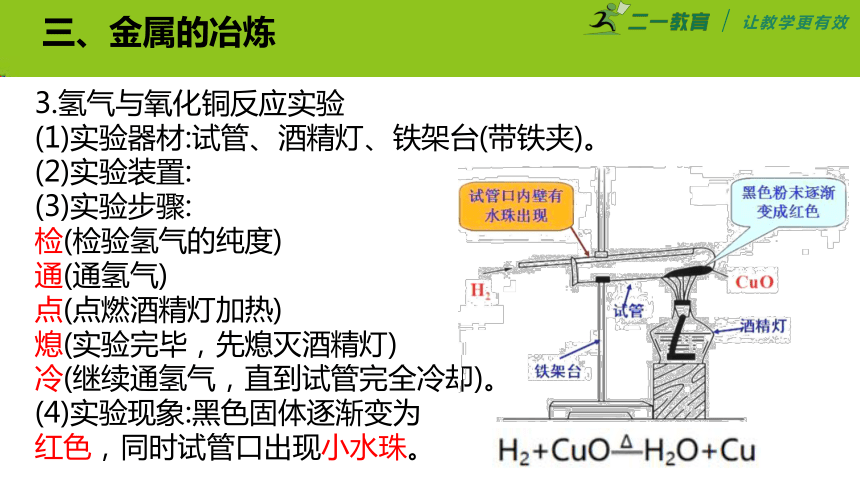
三、金属的冶炼
3.氢气与氧化铜反应实验
(1)实验器材:试管、酒精灯、铁架台(带铁夹)。
(2)实验装置:
(3)实验步骤:
检(检验氢气的纯度)
通(通氢气)
点(点燃酒精灯加热)
熄(实验完毕,先熄灭酒精灯)
冷(继续通氢气,直到试管完全冷却)。
(4)实验现象:黑色固体逐渐变为
红色,同时试管口出现小水珠。
三、金属的冶炼
(5)注意事项
①试管口应略向下倾斜,且试管口不能塞塞子。向下倾斜的目的是避免反应中生成的水倒流而
炸裂试管。
②氧化铜要铺在试管底部,目的
是增大反应物的受热面积,加快
反应速率。
③通氢气的导管应插到试管底部
的氧化铜上方,一是为了让氢气
与氧化铜充分接触,二是易把试
管里的空气排净,加热后不易发生危险。
三、金属的冶炼
(5)注意事项
④实验之前先通氢气后加热,目的是排出试管内的空气,防止氢气和空气混合加热时发生爆炸。
实验结束后先熄灭酒精灯,继续
通氢气,直至试管冷却为止。目
的是防止生成的铜在温度较高时
再次被氧气氧化成氧化铜,使实
验失败。
⑤因为要先通氢气,实验结束后
还要通氢气,所以实际所用氢气
的量要远大于理论用量。
三、金属的冶炼
4.氧化还原反应
(1)还原反应:含氧化合物里的氧被夺取的反应,叫做还原反应。如CuO中的氧被C、H2、CO等夺取,CuO发生了还原反应变成了Cu。
(2)还原性:能从含氧化合物中夺取氧的性质叫做还原性。
(3)还原剂:具有还原性的物质可做还原剂。C、H2、CO是常见的还原剂。
拓展:被还原剂还原的物质叫氧化剂,氧化剂被还原,还原剂被氧化。氧化和还原的本质就是电子的得失,氧化剂得电子被还原,化合价降低;还原剂失电子被氧化,化合价升高。还原与氧化同时发生。
三、金属的冶炼
5.铁的冶炼
(1)反应原理:在高温下,用还原剂(主要是一氧化碳 )从铁矿石中把铁还原出来。
(2)反应方程式:
(3)实验现象:红色的固体逐渐变为黑色(铁粉),同时产生能使澄清石灰水变浑浊的气体。
(4)尾气处理:一氧化碳有毒,
不能直接排放到空气中,可
将尾气点燃或收集。
三、金属的冶炼
5.铁的冶炼
三、金属的冶炼
6. 化合物的之间的转化关系
溶洞形成:
钟乳石形成:
三、金属的冶炼
7.有关纯度问题的计算
纯度 = 纯物质的质量/不纯物质的总质量 x 100%
、
(1)根据混合物的质量及纯度,计算纯净物的质量。
纯净物的质量=混合物的总质量x纯度。
m纯=m总xA%
(2)根据纯净物的质量,及化学式,求其中组成元素的质量。
组成元素的质量=纯净物的质量x纯净物中某组成元素的质量分数
注:混合物中多种物质都含有某种元素时,计算混合物中某元素质量,要合并计算
四、物质的鉴别鉴定分离及除杂
1.物质的鉴别与鉴定
物质的鉴别就是根据已知几种物质的不同特性,用实验方法将它们一一区别(一般只需要区别出不同就算鉴别成功)。物质的鉴定要求较高,往往要排除一些可能会产生干扰的物质的存在。
(1)物理方法:根据特性(如颜色、气味、溶解性、溶解吸放热进行观察分析、判断,得出结论)。
(2)化学方法:
①分别取少量待鉴别的溶液(若为固体应取少量配成容液)于试管中
②分别加入试剂充分反应。
③观察反应现象。
④根据反应现象分析、判断,得出结论。
四、物质的鉴别鉴定分离及除杂
2.可能存在几种物质的混合物中推理确定物质的组成
(1)一定存在或者不存在的物质
a.有色离子一定不存在于无色溶液中
b.产生沉淀、气体和水的离子不能共存于溶液中
c.沉淀是否能溶解于酸中来判断沉淀是否包BaSO4含和AgCl
d.有具体克重出现的推理中,通过计算一定存在的物质质量来确定某些可能存在的物质的必然性。
e.确定离子是否存在时,还需要考虑溶液不带电,不能只有阳离子没有阴离子,反之亦然。
(2)有可能存在的物质
四、物质的鉴别鉴定分离及除杂
3.杂质的除去与分离
(1)除杂的注意点
a.一般情况下所加的试剂要与杂质反应,不与要保留的物质反应。
b.除杂过程中不能增加新的杂质,也不能大量减少要保留的物质。
(2)除杂的常用方法
① 过滤/蒸馏法:即通过过滤,除去不溶性杂质(注:原来是固体的,最后要通过蒸发结晶烘干除去水分)
通过蒸馏,分离两种
不同沸点的液体。
四、物质的鉴别鉴定分离及除杂
④ 沉淀法:加入某种试剂,跟杂质反应形成沉淀,滤去沉淀,即可除去杂质。(注:加入的试剂需要适量,如果要加过量的话,要保证最后能除去)
例:NaOH溶液中少量的 Na2CO3
⑤ 化气法:加入某种试剂,跟杂质反应,化为气体逸出,即可除掉杂质。
例:NaCl溶液中少量的 Na2CO3
⑥ 加热分解法:通过加热,使杂质分解,从而除掉+杂质。
例:Na2CO3溶液中少量的 NaHCO3
五、材料的利用与发展
1.材料的发展历程:
石器→陶器→青铜器→钢铁→合成材料→新型材料。
金属的使用不仅与金属的活动性有关,还与金属冶炼的难易程度有关。
新型材料有:光电子信息材料、先进复合材料、超级陶瓷材料、新型金属材料、新型高分子材料、超导材料、纳米材料等
2.材料制造与环境保护
新材料的开发和利用大大促进了社会的发展,制造材料过程中会产生许多污染,这就要求在化学工业中,要及时处理三废,努力提高原料的利用率,减少废弃物的排放,增加产品的质量,从根本上降低生产对环境造成的污染。
五、材料的利用与发展
3.化学实验方案设计中需要考虑的因素
(1)科学性:制备过程中每步化学反应是否符合化学反应的规律,保证反应可以进行;
(2)简便性:设计方案考虑实际设备情况,操作过程尽可能简便易行,如反应所需的条件和设备是否简单;
(3)经济性:所需原料是否易获取、成本是否低廉,利用率要尽量高,能利用一些生活中的废旧物品;
(4)安全性:操作过程是否存在安全隐患,保证实验安全;
(5)环保性:生产过程是否会对环境造成污染,特别是有污染有毒尾气必须要处理。
06 物质的转化
九上秋周巩固提高-chen
一、非金属及其化合物的转化
1.有些非金属可以转化为非金属氧化物
实验步骤 实验现象 化学方程式
将硫黄放到燃烧匙中,在酒精灯上点燃硫黄,观察现象 把燃烧着的硫黄放进盛有氧气的集气瓶内,观察现象 硫黄燃烧,产生淡蓝色火焰并放出热量,生成无色、有刺激性气味的气体 在氧气中燃烧更旺, 产生明亮的蓝紫色火焰 S+O2 点燃 SO2
木炭在空气和氧气中点燃 木炭燃烧,发出红光和白光 C+O2 点燃CO2
红磷在空气中点燃 红磷燃烧,产生大量白烟 4P+5O2 点燃2P2O5
氢气在空气中点燃 淡蓝色火焰 2H2+O2点燃 2H2O
一、非金属及其化合物的转化
2.非金属氧化物可以转化生成酸,不稳定的酸受热分解后又重新生成非金属氧化物(以CO2与碳酸的转化实验为例)
3.非金属的转化链条
非金属 → 非金属氧化物 → 酸 → 盐
二、金属及其化合物的转化
1.有的金属与非金属可以发生反应,转化成化合物(以铁粉和硫黄反应的实验为例)
其他一些金属与非金属也可以发生反应
实验步骤 实验现象 化学方程式
取少量铁粉放在白纸上,再取少量硫黄与铁粉混合。用磁铁接近混合物,观察现象 铁粉能被磁铁吸引
把混合物放进试管内,用酒精灯加热,观察现象 铁粉和硫黄反应发光,生成黑色固体,同时放出大量的热,反应的 Fe+S △ FeS
将生成物倒在白纸上,观察生成物的外观,再用磁铁靠近生成物,观察磁铁能否吸引生成物 生成物呈块状,不能被磁铁吸引
铁丝在氧气中点燃 剧烈燃烧,火星四射 3Fe+2O2点燃 Fe3O4
二、金属及其化合物的转化
2.某些金属氧化物可以与水反应生成碱(活泼性较强的金属)
其他一些金属氧化物也可以与水反应生成碱
实验步骤 实验现象 化学方程式
在蒸发皿中放小块生石灰,加少量水,搅拌,观察现象 生石灰与水反应放出大量的热 CaO+H2O= Ca(OH)2
向反应后的蒸发皿中滴加几滴无色酚酞试液,观察现象 无色酚酞试液变红
二、金属及其化合物的转化
3.金属的转化链条
金属 → 金属氧化物→ 碱 → 盐和水
(只有BaO、K2O、CaO、Na2O能与水反应)
金属 + 非金属单质 → 盐
三、金属的冶炼
1.金属在自然界中的存在
在自然界中,仅有少数金属(银铂金化学性质非常稳定)是以游离态(即单质)的形式存在的,大多数金属(化学性质活泼)是以化合态的形式存在的。
三、金属的冶炼
2金属的冶炼原理与方法
(1)冶炼原理:金属冶炼就是要把金属从化合态变成游离态。
(2)冶炼方法:
用C、CO、H2等还原剂与金属氧化物反应
夺取金属氧化物中的氧,得到金属单质
三、金属的冶炼
3.氢气与氧化铜反应实验
(1)实验器材:试管、酒精灯、铁架台(带铁夹)。
(2)实验装置:
(3)实验步骤:
检(检验氢气的纯度)
通(通氢气)
点(点燃酒精灯加热)
熄(实验完毕,先熄灭酒精灯)
冷(继续通氢气,直到试管完全冷却)。
(4)实验现象:黑色固体逐渐变为
红色,同时试管口出现小水珠。
三、金属的冶炼
(5)注意事项
①试管口应略向下倾斜,且试管口不能塞塞子。向下倾斜的目的是避免反应中生成的水倒流而
炸裂试管。
②氧化铜要铺在试管底部,目的
是增大反应物的受热面积,加快
反应速率。
③通氢气的导管应插到试管底部
的氧化铜上方,一是为了让氢气
与氧化铜充分接触,二是易把试
管里的空气排净,加热后不易发生危险。
三、金属的冶炼
(5)注意事项
④实验之前先通氢气后加热,目的是排出试管内的空气,防止氢气和空气混合加热时发生爆炸。
实验结束后先熄灭酒精灯,继续
通氢气,直至试管冷却为止。目
的是防止生成的铜在温度较高时
再次被氧气氧化成氧化铜,使实
验失败。
⑤因为要先通氢气,实验结束后
还要通氢气,所以实际所用氢气
的量要远大于理论用量。
三、金属的冶炼
4.氧化还原反应
(1)还原反应:含氧化合物里的氧被夺取的反应,叫做还原反应。如CuO中的氧被C、H2、CO等夺取,CuO发生了还原反应变成了Cu。
(2)还原性:能从含氧化合物中夺取氧的性质叫做还原性。
(3)还原剂:具有还原性的物质可做还原剂。C、H2、CO是常见的还原剂。
拓展:被还原剂还原的物质叫氧化剂,氧化剂被还原,还原剂被氧化。氧化和还原的本质就是电子的得失,氧化剂得电子被还原,化合价降低;还原剂失电子被氧化,化合价升高。还原与氧化同时发生。
三、金属的冶炼
5.铁的冶炼
(1)反应原理:在高温下,用还原剂(主要是一氧化碳 )从铁矿石中把铁还原出来。
(2)反应方程式:
(3)实验现象:红色的固体逐渐变为黑色(铁粉),同时产生能使澄清石灰水变浑浊的气体。
(4)尾气处理:一氧化碳有毒,
不能直接排放到空气中,可
将尾气点燃或收集。
三、金属的冶炼
5.铁的冶炼
三、金属的冶炼
6. 化合物的之间的转化关系
溶洞形成:
钟乳石形成:
三、金属的冶炼
7.有关纯度问题的计算
纯度 = 纯物质的质量/不纯物质的总质量 x 100%
、
(1)根据混合物的质量及纯度,计算纯净物的质量。
纯净物的质量=混合物的总质量x纯度。
m纯=m总xA%
(2)根据纯净物的质量,及化学式,求其中组成元素的质量。
组成元素的质量=纯净物的质量x纯净物中某组成元素的质量分数
注:混合物中多种物质都含有某种元素时,计算混合物中某元素质量,要合并计算
四、物质的鉴别鉴定分离及除杂
1.物质的鉴别与鉴定
物质的鉴别就是根据已知几种物质的不同特性,用实验方法将它们一一区别(一般只需要区别出不同就算鉴别成功)。物质的鉴定要求较高,往往要排除一些可能会产生干扰的物质的存在。
(1)物理方法:根据特性(如颜色、气味、溶解性、溶解吸放热进行观察分析、判断,得出结论)。
(2)化学方法:
①分别取少量待鉴别的溶液(若为固体应取少量配成容液)于试管中
②分别加入试剂充分反应。
③观察反应现象。
④根据反应现象分析、判断,得出结论。
四、物质的鉴别鉴定分离及除杂
2.可能存在几种物质的混合物中推理确定物质的组成
(1)一定存在或者不存在的物质
a.有色离子一定不存在于无色溶液中
b.产生沉淀、气体和水的离子不能共存于溶液中
c.沉淀是否能溶解于酸中来判断沉淀是否包BaSO4含和AgCl
d.有具体克重出现的推理中,通过计算一定存在的物质质量来确定某些可能存在的物质的必然性。
e.确定离子是否存在时,还需要考虑溶液不带电,不能只有阳离子没有阴离子,反之亦然。
(2)有可能存在的物质
四、物质的鉴别鉴定分离及除杂
3.杂质的除去与分离
(1)除杂的注意点
a.一般情况下所加的试剂要与杂质反应,不与要保留的物质反应。
b.除杂过程中不能增加新的杂质,也不能大量减少要保留的物质。
(2)除杂的常用方法
① 过滤/蒸馏法:即通过过滤,除去不溶性杂质(注:原来是固体的,最后要通过蒸发结晶烘干除去水分)
通过蒸馏,分离两种
不同沸点的液体。
四、物质的鉴别鉴定分离及除杂
④ 沉淀法:加入某种试剂,跟杂质反应形成沉淀,滤去沉淀,即可除去杂质。(注:加入的试剂需要适量,如果要加过量的话,要保证最后能除去)
例:NaOH溶液中少量的 Na2CO3
⑤ 化气法:加入某种试剂,跟杂质反应,化为气体逸出,即可除掉杂质。
例:NaCl溶液中少量的 Na2CO3
⑥ 加热分解法:通过加热,使杂质分解,从而除掉+杂质。
例:Na2CO3溶液中少量的 NaHCO3
五、材料的利用与发展
1.材料的发展历程:
石器→陶器→青铜器→钢铁→合成材料→新型材料。
金属的使用不仅与金属的活动性有关,还与金属冶炼的难易程度有关。
新型材料有:光电子信息材料、先进复合材料、超级陶瓷材料、新型金属材料、新型高分子材料、超导材料、纳米材料等
2.材料制造与环境保护
新材料的开发和利用大大促进了社会的发展,制造材料过程中会产生许多污染,这就要求在化学工业中,要及时处理三废,努力提高原料的利用率,减少废弃物的排放,增加产品的质量,从根本上降低生产对环境造成的污染。
五、材料的利用与发展
3.化学实验方案设计中需要考虑的因素
(1)科学性:制备过程中每步化学反应是否符合化学反应的规律,保证反应可以进行;
(2)简便性:设计方案考虑实际设备情况,操作过程尽可能简便易行,如反应所需的条件和设备是否简单;
(3)经济性:所需原料是否易获取、成本是否低廉,利用率要尽量高,能利用一些生活中的废旧物品;
(4)安全性:操作过程是否存在安全隐患,保证实验安全;
(5)环保性:生产过程是否会对环境造成污染,特别是有污染有毒尾气必须要处理。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
