5.3从微观结构看物质的多样性 课件(共33页)—高中化学苏教版(2019)必修第一册高一上学期
文档属性
| 名称 | 5.3从微观结构看物质的多样性 课件(共33页)—高中化学苏教版(2019)必修第一册高一上学期 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-18 17:18:03 | ||
图片预览










文档简介
(共32张PPT)
同素异形现象
同分异构现象
晶体与非晶体
专题5 微观结构与物质的多样性
第三单元从微观结构看物质的多样性
课前导入
当我们面对丰富多彩的物质世界时,不知你是否想过:至今人类发现的元素仅百余种,为什么却能形成数千万种不同的物质?科学家的探索告诉我们,只有深入研究物质的微观结构,才能更好地认识物质的多样性,并利用已有的物质创造出更多性能优异的新物质,以满足现代文明的各种需要,不断提高人类的生活质量。
同素异形现象
物质的结构决定了物质的存在形态和性质。即便是由同种元素组成的单质,若构成单质的原子之间的连接方式不同,就会形成存在形态和性质不同的物质。研究发现,在一定条件下,金刚石、石墨在纯氧中完全燃烧均只生成二氧化碳气体,它们在一定条件下能相互转化,说明它们都是碳元素的单质。金刚石晶体无色透明,有光泽,十分坚硬,可做装饰品,可用于切割玻璃、花岗岩,可做地质和
石油勘探的钻头等。石墨呈灰黑色,质地较软,能导电,可做
润滑剂和电极等。为什么它们的性质有如此大的差异呢?
碳元素形成的单质不仅有金刚石、石墨,还有富勒烯(fullerene,包括C60、C70和单层或多层的纳米碳管)等。同一种元素能够形成几种不同的单质,这种现象称为同素异形现象(allotropism)。这些单质之间互称为该元素的同素异形体(allotrope)。
同素异形现象
金刚石
金刚石的结构模型
纳米碳管的结构模型
石墨的结构模型
碳纳米管
石墨
同素异形现象
金刚石和石墨晶体中碳原子的成键方式和排列方式均不同。金刚石晶体中每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构。而石墨晶体为层状结构,层内碳原子间以共价键结合,每一层内碳原子排列成平面六边形,一个个六边形排列成平面网状结构,层间存在分子间作用力。C60是由60个碳原子形成的封闭笼状分子,形似足球,人们又称它为“足球烯”
同素异形现象
碳的另一种同素异形体—石墨烯(graphene),是一种由碳原子构成的二维层状的碳材料,是目前最理想的纳米材料之一,是构成其他石墨材料的基本单元。
它具有优异的光学、电学、力学特性,在材料学、能源、生物医学和药物传递等方面具有广泛的应用前景。
臭氧和臭氧层
除碳元素外,氧、硫、磷等元素也存在着同素异形现象。氧气在放电或紫外线照射下能转化为臭氧(O3)。例如,打雷闪电时,有少量臭氧生成。
臭氧在通常状况下是淡蓝色气体,有鱼腥味,氧化性极强。自然界90%的臭氧集中在离地面15~50 km的大气平流层中,它是由氧气吸收太阳紫外线辐射而生成的。臭氧层能使地球上的生物免受太阳光中紫外线的伤害。20世纪80年代的测量结果表明,臭氧层开始变薄,甚至出现空洞。关于臭氧层被破坏的原因有多种解释,一般认为氟氯烃(氟利昂,广泛用于制冷剂和发泡剂等)的大量使用和喷气式飞机、火箭、导弹将大量废气排放到高空,加速了臭氧分解。保护高空臭氧层是科学研究的重要课题。通过世界各国长期以来的努力,目前臭氧层正在逐渐恢复。
同分异构现象
同种元素可以形成不同的单质。分子式相同的物质,是否也会表现出结构和性质上的差异呢?
用不同颜色的小球代表碳、氢原子,用塑料棒代表原子间形成的共价键,依据碳、氢原子形成共价键的特征,制作分子式为C4H10的有机化合物的分子结构模型。你可以制作出几种不同的分子结构模型?
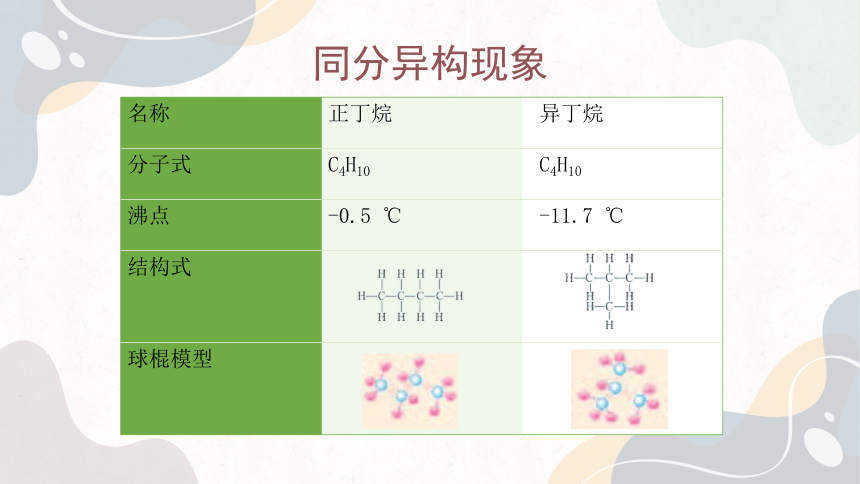
名称 正丁烷 异丁烷
分子式 C4H10 C4H10
沸点 -0.5 ℃ -11.7 ℃
结构式
球棍模型
同分异构现象
同分异构现象
研究发现,某些化合物分子式相同,但性质却有差异,分子结构也不同。化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象(isomerism)。分子式相同而结构不同
的化合物互称为同分异构体(isomer)。有机化合物中同分异构现象的普遍存在,是有机化合物种类繁多的原因之一。
同分异构现象
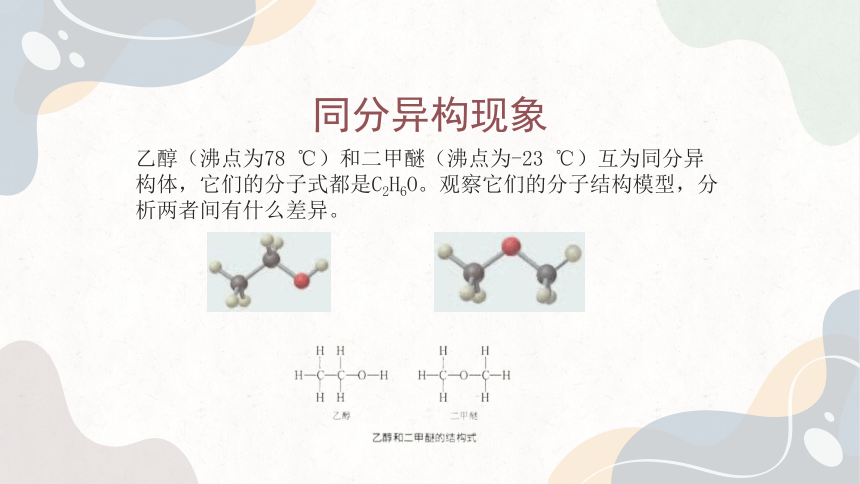
乙醇(沸点为78 ℃)和二甲醚(沸点为-23 ℃)互为同分异构体,它们的分子式都是C2H6O。观察它们的分子结构模型,分析两者间有什么差异。
同分异构现象
一、分子结构
乙醇的分子结构为CH3CH2OH,含有一个羟基(-OH)。可以看作是乙基(-CH2CH3)和羟基相连。
由于羟基的存在,乙醇分子间能形成氢键。氢键的作用使得乙醇分子间的作用力增强,从而导致其沸点相对较高。
二甲醚的分子结构为,是一个氧原子连接两个甲基(-CH3)
同分异构现象
二、性质差异的原因
物理性质:
沸点差异:正如前面提到的,乙醇因为分子间氢键作用沸点为 78℃,而二甲醚分子间不能形成氢键,分子间作用力相对较弱,沸点仅为 -23℃。
化学性质:
反应活性:由于乙醇含有羟基,具有一定的酸性,可以与活泼金属如钠反应生成氢气和乙醇钠。二甲醚则不具有这种性质。
氧化反应:乙醇可以在一定条件下被氧化为乙醛、乙酸等,二甲醚相对较为稳定,不容易被氧化。
综上所述,乙醇和二甲醚虽然分子式相同,但由于分子结构的差异,导致它们在物理性质和化学性质上有很大的不同。
晶体与非晶体
常见的固态物质一般可分为晶体和非晶体。
氯化钠、金刚石、干冰等物质属于晶体,具有规则的几何外形和固定的熔点。
石蜡、玻璃、橡胶等物质属于非晶体,它们没有固定的熔点,一般也不具备规则的几何外形。
晶体与非晶体
在日常生活中我们会遇到许多晶体,如金刚石、雪花、水晶等。这些晶体在外观上有什么特点?它们的物理性质(如硬度、熔点、沸点、导电性等)有什么特点?
金刚石
水晶
氯化钠
雪花
晶体与非晶体
金刚石
外观特点:颜色上,有各种颜色,从无色到黑色都有,以无色的为最佳,多数金刚石大多带些黄色。
形态上,纯净的金刚石是一种无色透明的正八面体形状的固体,也会有其他不规则形状如巴拉斯球状金刚石,其外形似球、滴状或梨形,表面可能具有特殊花纹。
光泽方面,具有很强的光泽度,经过打磨后光彩夺目。
物理性质特点:
硬度:是天然存在的最硬的物质,莫氏硬度为 10,这使得它可以用于工业中的切割工具等。
熔点:非常高,在 3550℃-4000℃之间。
沸点:极高,但具体数值一般不常提及。
导电性:几乎不导电,属于绝缘体,但唯 Ⅱb 型金刚石具良好的半导体性能。
折射率和色散性能:折射率非常高,色散性能也很强,所以会反射出五彩缤纷的闪光
晶体与非晶体
雪花:
外观特点:
基本形状是六角形,这是因为雪花属于六方晶系。其形状多种多样,有柱状、片状、枝状、星状等,单个雪花的大小通常在 0.05 - 4.6 毫米之间。由于冰晶面会对光进行漫反射,所以雪的颜色看起来是白色的,但冰晶实际是无色透明的。
物理性质特点:
硬度:非常小,质地柔软,容易被挤压变形。
熔点:熔点较低,在标准大气压下,雪的熔点为 0℃,当温度高于 0℃时,雪花会逐渐融化成水。
沸点:水在标准大气压下的沸点是 100℃,雪花融化成水后,水的沸点依然是 100℃。
导电性:本身不导电,但融化后的雪水因为含有杂质等可能会有一定的导电性,但导电性很弱
晶体与非晶体
水晶:
外观特点:
颜色丰富,有无色、乳白色、烟色、茶色、黑色等非彩色水晶,也有紫色、黄色、紫黄色、红色、粉红色、绿色、蓝色等彩色水晶。
晶体通常呈六面体或八面体形状,几何棱角分明,具有玻璃光泽,透明度较高的水晶看起来晶莹剔透。
物理性质特点:
硬度:硬度较高,一般在 7 左右,比玻璃硬,所以可以用来划玻璃。
熔点:熔点较高,具体数值因水晶的种类和成分会有所不同,但一般在 1700℃以上。
沸点:沸点也较高,但同样具体数值不常被提及。
导电性:天然水晶具有压电性,在机械振动表现于电器上时,有高 Q 值、低动率、高敏锐性、高稳定性等优良频率特性。
晶体与非晶体
用X射线进行晶体的衍射实验时发现,在晶体内部,构成晶体的微粒在空间呈有规则的重复排列。
晶体规则的几何外形是其内部构成微粒有规则排列的结果。
常见的几类晶体
在食盐晶体中,带正电的钠离子与带负电的氯离子相互作用,形成了如图所示的立方体结构。像这样由阴、阳离子按一定方式有规则地排列形成的晶体叫作离子晶体
常见的几类晶体
干冰等由分子构成的物质所形成的晶体属于分子晶体
(molecular crystal)。分子晶体是分子之间依靠分子间作用力
按一定规则排列形成的。
常见的几类晶体
在石英晶体中,硅原子和相邻的氧原子以共价键结合。每个硅原子和相邻的四个氧原子结合,每个氧原子和相邻的两个硅原子结合,向空间伸展,形成彼此连接的空间网状结构,因此石英晶体中不存在单个分子。金刚石晶体中每个碳原子与相邻的四个碳原子也以共价键结合,形成空间网状结构。像石英、金刚石这样的晶体称为共价晶体(covalent crystal)。
常见的几类晶体
此外,还有一类晶体称为金属晶体(metallic crystal)。金
属晶体有共同的物理特性,如有金属光泽,能导电和传热,有
延展性等。
常见的几类晶体
混合型晶体(又称过渡型晶体)是指晶体内部同时存在着若干种不同的作用力,具有若干种晶体的结构和性质。以下是关于混合型晶体的一些介绍:
典型代表 —— 石墨:
结构特点:在石墨晶体中,每个碳原子通过sp2杂化与其他碳原子形成平面大分子(大共轭分子),由多层这样的平面大分子排列构成石墨。平面层内,每个碳原子采用sp2杂化轨道与相邻的三个碳原子以 σ 键相连结,形成正六角形联接的平面网状结构层。每个碳原子还剩下一个p电子,其轨道与杂化轨道平面垂直,参与形成同层碳原子之间的 π 键,即大 π 键。
作用力类型:层内碳原子之间距离为142pm,以共价键结合;相邻两层间的距离为335pm,层与层之间的引力较弱,类似于分子间力。大 π 键中的电子沿层面方向的活动能力很强,类似于金属中的自由电子。
晶体类型的判断方法
(1)根据构成晶体的微粒和微粒间的作用力判断。
(2)根据各类晶体的特征性质判断,一般来说:
①熔、沸点低的化合物属于分子晶体。
②熔、沸点较高,且在水溶液中或熔融状态下能导电的化合物为离子晶体。
③熔、沸点很高,不溶于一般溶剂的物质为共价晶体。
④能导电、传热、有延展性的为金属晶体。
晶体类型的判断方法
(3)根据物质的类别判断:
①活泼金属氧化物、强碱和绝大多数的盐是离子晶体。
②大多数非金属单质(金刚石、石墨、晶体硅、晶体硼等除外),非金属氢化物、非金属氧化物(SiO2等除外),几乎所有的酸、绝大多数有机物是分子晶体。
③固态的金属和合金是金属晶体。
④常见的共价晶体:单质有金刚石、晶体硅、晶体硼等;化合物有二氧化硅、碳化硅等。
液晶
液晶(liquid crystal)是一种介于晶体和液体之间的中间态物质。液晶兼有液体和晶体的部分性质,如液体的易流动性、晶态物质分子的有序排列等,因而表现出一些独特的性质。通常,只有那些分子较大、分子形状呈长形或碟形的有机化合物,才易形成液晶态。液晶广泛应用于数码显示、电光学快门、图像显示等方面,在信息技术领域中占有重要的地位。
1、下列各项描述的结论正确的是( )
选项 描述 结论
A 由同种元素组成的物质一定是纯净物 正确
B 科学家合成了一种新型的化合物N4 正确
C 红磷转化为白磷是物理变化 错误
D 纳米泡沫碳和金刚石是同素异形体 错误
C
课堂练习
课堂练习
2.有M、N、Q三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如下表所示。
晶体 熔点/℃ 硬度 水溶性 导电性 水溶液与Ag+反应
M 811 较大 易溶 水溶液(或熔融 状态)导电 白色沉淀
N 3 500 很大 不溶 不导电 不反应
Q -114.2 很小 极易溶 液态 不导电 白色沉淀
(1)三种晶体的化学式分别为M: ,N: ,Q: 。
(2)晶体的类型分别为M: ,N: ,Q: 。
(3)晶体中粒子间的作用分别为M: ,N: ,Q: 。
课堂练习
答案:(1)NaCl C HCl
(2)离子晶体 共价晶体 分子晶体
(3)离子键 共价键 分子间作用力
感谢您的观看
同素异形现象
同分异构现象
晶体与非晶体
专题5 微观结构与物质的多样性
第三单元从微观结构看物质的多样性
课前导入
当我们面对丰富多彩的物质世界时,不知你是否想过:至今人类发现的元素仅百余种,为什么却能形成数千万种不同的物质?科学家的探索告诉我们,只有深入研究物质的微观结构,才能更好地认识物质的多样性,并利用已有的物质创造出更多性能优异的新物质,以满足现代文明的各种需要,不断提高人类的生活质量。
同素异形现象
物质的结构决定了物质的存在形态和性质。即便是由同种元素组成的单质,若构成单质的原子之间的连接方式不同,就会形成存在形态和性质不同的物质。研究发现,在一定条件下,金刚石、石墨在纯氧中完全燃烧均只生成二氧化碳气体,它们在一定条件下能相互转化,说明它们都是碳元素的单质。金刚石晶体无色透明,有光泽,十分坚硬,可做装饰品,可用于切割玻璃、花岗岩,可做地质和
石油勘探的钻头等。石墨呈灰黑色,质地较软,能导电,可做
润滑剂和电极等。为什么它们的性质有如此大的差异呢?
碳元素形成的单质不仅有金刚石、石墨,还有富勒烯(fullerene,包括C60、C70和单层或多层的纳米碳管)等。同一种元素能够形成几种不同的单质,这种现象称为同素异形现象(allotropism)。这些单质之间互称为该元素的同素异形体(allotrope)。
同素异形现象
金刚石
金刚石的结构模型
纳米碳管的结构模型
石墨的结构模型
碳纳米管
石墨
同素异形现象
金刚石和石墨晶体中碳原子的成键方式和排列方式均不同。金刚石晶体中每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构。而石墨晶体为层状结构,层内碳原子间以共价键结合,每一层内碳原子排列成平面六边形,一个个六边形排列成平面网状结构,层间存在分子间作用力。C60是由60个碳原子形成的封闭笼状分子,形似足球,人们又称它为“足球烯”
同素异形现象
碳的另一种同素异形体—石墨烯(graphene),是一种由碳原子构成的二维层状的碳材料,是目前最理想的纳米材料之一,是构成其他石墨材料的基本单元。
它具有优异的光学、电学、力学特性,在材料学、能源、生物医学和药物传递等方面具有广泛的应用前景。
臭氧和臭氧层
除碳元素外,氧、硫、磷等元素也存在着同素异形现象。氧气在放电或紫外线照射下能转化为臭氧(O3)。例如,打雷闪电时,有少量臭氧生成。
臭氧在通常状况下是淡蓝色气体,有鱼腥味,氧化性极强。自然界90%的臭氧集中在离地面15~50 km的大气平流层中,它是由氧气吸收太阳紫外线辐射而生成的。臭氧层能使地球上的生物免受太阳光中紫外线的伤害。20世纪80年代的测量结果表明,臭氧层开始变薄,甚至出现空洞。关于臭氧层被破坏的原因有多种解释,一般认为氟氯烃(氟利昂,广泛用于制冷剂和发泡剂等)的大量使用和喷气式飞机、火箭、导弹将大量废气排放到高空,加速了臭氧分解。保护高空臭氧层是科学研究的重要课题。通过世界各国长期以来的努力,目前臭氧层正在逐渐恢复。
同分异构现象
同种元素可以形成不同的单质。分子式相同的物质,是否也会表现出结构和性质上的差异呢?
用不同颜色的小球代表碳、氢原子,用塑料棒代表原子间形成的共价键,依据碳、氢原子形成共价键的特征,制作分子式为C4H10的有机化合物的分子结构模型。你可以制作出几种不同的分子结构模型?
名称 正丁烷 异丁烷
分子式 C4H10 C4H10
沸点 -0.5 ℃ -11.7 ℃
结构式
球棍模型
同分异构现象
同分异构现象
研究发现,某些化合物分子式相同,但性质却有差异,分子结构也不同。化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象(isomerism)。分子式相同而结构不同
的化合物互称为同分异构体(isomer)。有机化合物中同分异构现象的普遍存在,是有机化合物种类繁多的原因之一。
同分异构现象
乙醇(沸点为78 ℃)和二甲醚(沸点为-23 ℃)互为同分异构体,它们的分子式都是C2H6O。观察它们的分子结构模型,分析两者间有什么差异。
同分异构现象
一、分子结构
乙醇的分子结构为CH3CH2OH,含有一个羟基(-OH)。可以看作是乙基(-CH2CH3)和羟基相连。
由于羟基的存在,乙醇分子间能形成氢键。氢键的作用使得乙醇分子间的作用力增强,从而导致其沸点相对较高。
二甲醚的分子结构为,是一个氧原子连接两个甲基(-CH3)
同分异构现象
二、性质差异的原因
物理性质:
沸点差异:正如前面提到的,乙醇因为分子间氢键作用沸点为 78℃,而二甲醚分子间不能形成氢键,分子间作用力相对较弱,沸点仅为 -23℃。
化学性质:
反应活性:由于乙醇含有羟基,具有一定的酸性,可以与活泼金属如钠反应生成氢气和乙醇钠。二甲醚则不具有这种性质。
氧化反应:乙醇可以在一定条件下被氧化为乙醛、乙酸等,二甲醚相对较为稳定,不容易被氧化。
综上所述,乙醇和二甲醚虽然分子式相同,但由于分子结构的差异,导致它们在物理性质和化学性质上有很大的不同。
晶体与非晶体
常见的固态物质一般可分为晶体和非晶体。
氯化钠、金刚石、干冰等物质属于晶体,具有规则的几何外形和固定的熔点。
石蜡、玻璃、橡胶等物质属于非晶体,它们没有固定的熔点,一般也不具备规则的几何外形。
晶体与非晶体
在日常生活中我们会遇到许多晶体,如金刚石、雪花、水晶等。这些晶体在外观上有什么特点?它们的物理性质(如硬度、熔点、沸点、导电性等)有什么特点?
金刚石
水晶
氯化钠
雪花
晶体与非晶体
金刚石
外观特点:颜色上,有各种颜色,从无色到黑色都有,以无色的为最佳,多数金刚石大多带些黄色。
形态上,纯净的金刚石是一种无色透明的正八面体形状的固体,也会有其他不规则形状如巴拉斯球状金刚石,其外形似球、滴状或梨形,表面可能具有特殊花纹。
光泽方面,具有很强的光泽度,经过打磨后光彩夺目。
物理性质特点:
硬度:是天然存在的最硬的物质,莫氏硬度为 10,这使得它可以用于工业中的切割工具等。
熔点:非常高,在 3550℃-4000℃之间。
沸点:极高,但具体数值一般不常提及。
导电性:几乎不导电,属于绝缘体,但唯 Ⅱb 型金刚石具良好的半导体性能。
折射率和色散性能:折射率非常高,色散性能也很强,所以会反射出五彩缤纷的闪光
晶体与非晶体
雪花:
外观特点:
基本形状是六角形,这是因为雪花属于六方晶系。其形状多种多样,有柱状、片状、枝状、星状等,单个雪花的大小通常在 0.05 - 4.6 毫米之间。由于冰晶面会对光进行漫反射,所以雪的颜色看起来是白色的,但冰晶实际是无色透明的。
物理性质特点:
硬度:非常小,质地柔软,容易被挤压变形。
熔点:熔点较低,在标准大气压下,雪的熔点为 0℃,当温度高于 0℃时,雪花会逐渐融化成水。
沸点:水在标准大气压下的沸点是 100℃,雪花融化成水后,水的沸点依然是 100℃。
导电性:本身不导电,但融化后的雪水因为含有杂质等可能会有一定的导电性,但导电性很弱
晶体与非晶体
水晶:
外观特点:
颜色丰富,有无色、乳白色、烟色、茶色、黑色等非彩色水晶,也有紫色、黄色、紫黄色、红色、粉红色、绿色、蓝色等彩色水晶。
晶体通常呈六面体或八面体形状,几何棱角分明,具有玻璃光泽,透明度较高的水晶看起来晶莹剔透。
物理性质特点:
硬度:硬度较高,一般在 7 左右,比玻璃硬,所以可以用来划玻璃。
熔点:熔点较高,具体数值因水晶的种类和成分会有所不同,但一般在 1700℃以上。
沸点:沸点也较高,但同样具体数值不常被提及。
导电性:天然水晶具有压电性,在机械振动表现于电器上时,有高 Q 值、低动率、高敏锐性、高稳定性等优良频率特性。
晶体与非晶体
用X射线进行晶体的衍射实验时发现,在晶体内部,构成晶体的微粒在空间呈有规则的重复排列。
晶体规则的几何外形是其内部构成微粒有规则排列的结果。
常见的几类晶体
在食盐晶体中,带正电的钠离子与带负电的氯离子相互作用,形成了如图所示的立方体结构。像这样由阴、阳离子按一定方式有规则地排列形成的晶体叫作离子晶体
常见的几类晶体
干冰等由分子构成的物质所形成的晶体属于分子晶体
(molecular crystal)。分子晶体是分子之间依靠分子间作用力
按一定规则排列形成的。
常见的几类晶体
在石英晶体中,硅原子和相邻的氧原子以共价键结合。每个硅原子和相邻的四个氧原子结合,每个氧原子和相邻的两个硅原子结合,向空间伸展,形成彼此连接的空间网状结构,因此石英晶体中不存在单个分子。金刚石晶体中每个碳原子与相邻的四个碳原子也以共价键结合,形成空间网状结构。像石英、金刚石这样的晶体称为共价晶体(covalent crystal)。
常见的几类晶体
此外,还有一类晶体称为金属晶体(metallic crystal)。金
属晶体有共同的物理特性,如有金属光泽,能导电和传热,有
延展性等。
常见的几类晶体
混合型晶体(又称过渡型晶体)是指晶体内部同时存在着若干种不同的作用力,具有若干种晶体的结构和性质。以下是关于混合型晶体的一些介绍:
典型代表 —— 石墨:
结构特点:在石墨晶体中,每个碳原子通过sp2杂化与其他碳原子形成平面大分子(大共轭分子),由多层这样的平面大分子排列构成石墨。平面层内,每个碳原子采用sp2杂化轨道与相邻的三个碳原子以 σ 键相连结,形成正六角形联接的平面网状结构层。每个碳原子还剩下一个p电子,其轨道与杂化轨道平面垂直,参与形成同层碳原子之间的 π 键,即大 π 键。
作用力类型:层内碳原子之间距离为142pm,以共价键结合;相邻两层间的距离为335pm,层与层之间的引力较弱,类似于分子间力。大 π 键中的电子沿层面方向的活动能力很强,类似于金属中的自由电子。
晶体类型的判断方法
(1)根据构成晶体的微粒和微粒间的作用力判断。
(2)根据各类晶体的特征性质判断,一般来说:
①熔、沸点低的化合物属于分子晶体。
②熔、沸点较高,且在水溶液中或熔融状态下能导电的化合物为离子晶体。
③熔、沸点很高,不溶于一般溶剂的物质为共价晶体。
④能导电、传热、有延展性的为金属晶体。
晶体类型的判断方法
(3)根据物质的类别判断:
①活泼金属氧化物、强碱和绝大多数的盐是离子晶体。
②大多数非金属单质(金刚石、石墨、晶体硅、晶体硼等除外),非金属氢化物、非金属氧化物(SiO2等除外),几乎所有的酸、绝大多数有机物是分子晶体。
③固态的金属和合金是金属晶体。
④常见的共价晶体:单质有金刚石、晶体硅、晶体硼等;化合物有二氧化硅、碳化硅等。
液晶
液晶(liquid crystal)是一种介于晶体和液体之间的中间态物质。液晶兼有液体和晶体的部分性质,如液体的易流动性、晶态物质分子的有序排列等,因而表现出一些独特的性质。通常,只有那些分子较大、分子形状呈长形或碟形的有机化合物,才易形成液晶态。液晶广泛应用于数码显示、电光学快门、图像显示等方面,在信息技术领域中占有重要的地位。
1、下列各项描述的结论正确的是( )
选项 描述 结论
A 由同种元素组成的物质一定是纯净物 正确
B 科学家合成了一种新型的化合物N4 正确
C 红磷转化为白磷是物理变化 错误
D 纳米泡沫碳和金刚石是同素异形体 错误
C
课堂练习
课堂练习
2.有M、N、Q三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如下表所示。
晶体 熔点/℃ 硬度 水溶性 导电性 水溶液与Ag+反应
M 811 较大 易溶 水溶液(或熔融 状态)导电 白色沉淀
N 3 500 很大 不溶 不导电 不反应
Q -114.2 很小 极易溶 液态 不导电 白色沉淀
(1)三种晶体的化学式分别为M: ,N: ,Q: 。
(2)晶体的类型分别为M: ,N: ,Q: 。
(3)晶体中粒子间的作用分别为M: ,N: ,Q: 。
课堂练习
答案:(1)NaCl C HCl
(2)离子晶体 共价晶体 分子晶体
(3)离子键 共价键 分子间作用力
感谢您的观看
