2.2.2 构成物质的微观粒子 课件(共29张PPT)—初中化学科粤版(2024)九年级上册
文档属性
| 名称 | 2.2.2 构成物质的微观粒子 课件(共29张PPT)—初中化学科粤版(2024)九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-18 17:09:45 | ||
图片预览








文档简介
(共29张PPT)
课题2 构成物质的微观粒子
原子的构成
PART 01
1.对科学家对原子结构的探索历程
1808年,道尔顿认为原子是一个不可再分的实心球体;
1897年,汤姆孙发现了电子;
1904年,汤姆孙提出了原子的“枣糕模型”;
1911年,卢瑟福提出了有核原子模型;
1913年,玻尔改进了卢瑟福的模型;
现在的原子结构模型——电子云模型比玻尔模型又有很大的改进。
2.原子的结构
原子
(不显电性)
原子核
(带正电)
核外电子
(带负电)
质子
中子
(每个电子带1个单位
的负电荷)
(不带电)
(每个质子带1个单位的正电荷)
核电荷数 原子核所带的正电荷数
原子结构示意图
原子种类 质子数 中子数 核外电子数
氢 1 0 1
氧 8 8 8
钠 11 12 11
氯 17 18 17
碳-12 6 6 6
碳-13 6 7 6
碳-14 6 8 6
观察下表,你能发现什么?
1.原子中:
核电荷数=质子数=核外电子数
2.在原子中,质子数不一定等于中子数
4.原子种类不同,核内质子数不同
3.不是所有的原子都有中子(氢原子)
5.同一种原子,质子数=核外电子数,
所带电荷的电量相等且电性相反,
故整个原子不显电性。
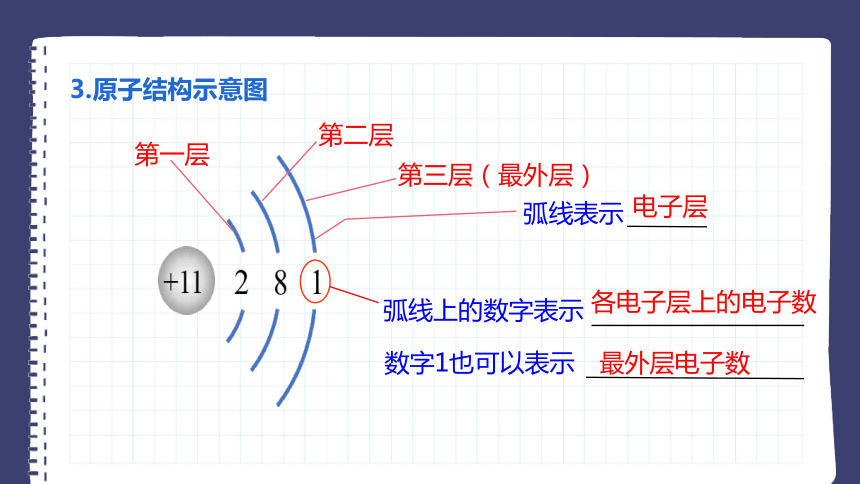
3.原子结构示意图
第一层
第二层
第三层(最外层)
弧线表示
数字1也可以表示
弧线上的数字表示
电子层
各电子层上的电子数
最外层电子数
下图是1—18号原子结构示意图,你能观察找出什么规律吗?
氢(H)
氦(He)
锂(Li)
铍(Be)
硼(B)
碳(C)
氮(N)
氧(O)
氟(F)
氖(Ne)
钠(Na)
镁(Mg)
铝(Al)
硅(Si)
磷(P)
硫(S)
氯(Cl)
氩(Ar)
电子分层排布规律
1.第一层最多排 个,第二层最多排 个,
最外层电子数不超过 个,(第一层为最外层时,不超过 个)。
2.核外电子总是先排在离核较近的电子层,排满第一层,再依次
排第二层,第三层。
2
8
8
2
3.第一层2个电子为稳定结构;其他层作最外层,8个电子为稳定
结构。
原子种类与原子结构的关系
原子种类 最外层电子数 化学性质
稀有气体原子
金属原子
非金属原子
=8(He为2)
不易得失电子
相对稳定
一般<4
易失电子
形成稳定结构
一般≥4
易得电子
形成稳定结构
原子的化学性质主要取决于原子的最外层电子数
1.下列有关原子构成的叙述正确的是( )。
A.原子是实心球体,不可以再分
B.原子的质量主要集中在原子核上
C.原子核由质子、中子和电子构成
D.原子不显电性是因为原子中不存在带电粒子
随堂练习
B
2.如图为某元素原子的结构示意图。下列有关叙述不正确的是( )
A.该原子的质子数为11
B.该原子的结构示意图中x=1
C.该元素属于活泼的非金属元素
D.该元素的原子在化学反应中容易失去电子
随堂练习
C
相对原子质量
PART 02
1个氢原子的质量为1.674×10-27kg
1个碳原子的质量为1.993×10-26kg
这么小的数字,书写和运算都很不方便,有没有其他的方法来表示呢?
原子虽小,但仍然具有一定的质量。
相对原子质量
1.定义:以一个碳—12原子(原子核中有6个质子和6个中子)的实际质量(1.993×10-26kg)的1/12作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量。
近似计算:相对原子质量≈质子数+中子数
2.计算公式
3.单位:相对原子质量是一个比值,它的单位为“1”,一般
省略不写
随堂练习
C
1.已知某铁原子的实际质量为m g,其相对原子质量为56。银(Ag)的相对原子质量为108,银(Ag)原子的质量为( )
A. B. C. D.
2.关于相对原子质量,下列叙述正确的是( )
A.相对原子质量就是原子质量
B.两种原子的质量之比等于它们的相对原子质量之比
C.硫原子的相对原子质量是
D.采用相对原子质量后,就增大了原子的质量
随堂练习
B
离子
PART 03
1.定义:原子得到或失去核外电子形成的带电荷的微观粒子。
2.离子的分类
阳离子:带正电荷的原子或原子团
例如:Na+ Mg2+
钠离子 镁离子
阴离子:带负电荷的原子或原子团
例如: Cl- O2-
氯离子 氧离子
1.离子的概念
2.观察活动
[实验2-2]把装满氯气的集气瓶倒扣于加热至熔化的金属钠上,你观察到什么现象?
目的:观察钠在氯气中燃烧
现象:
钠在氯气中剧烈燃烧,生成白烟
结论:
生成的白烟实际上是一种白色的固体小颗粒,它的化学名称叫氯化钠(NaCl),就是我们日常生活中用到的食盐的主要成分。
+11
失去1个电子
+11
Na+
Na
Cl
+17
得到1个电子
+17
Cl-
当点燃的钠与氯气相遇时,氯气的分子(Cl2)分成单个的氯原子(Cl),与钠原子(Na)发生了下述变化:
氯化钠(NaCl)
相互
作用
氯化钠的生成过程
氯化钠是由数目极多的钠离子和氯离子相互结合而构成的物质。像氯化钠这样的物质,是由离子构成的。由此可见:离子也是构成物质的一种微观粒子。
由离子构成的物质,阴、阳离子是保持其化学性质的最小微观粒子。如保持氯化钠化学性质的最小微观粒子是钠离子和氯离子。
3.离子符号的写法
在元素符号(或原子团)的右上角标明离子所带的电荷,数字在前,正负号在后。当离子带1个单位的正电荷或1个单位的负电荷时,“1”省略不写。如阳离子Na+、Mg2+、Al3+、等;阴离子Cl-、SO42-等。
4.离子符号的意义
每个镁离子带2个单位的正电荷
表示2个镁离子(镁离子的个数)
Mg2+
2
分 子 原 子 离 子
不同点
相同点 联 系 5.原子、分子、离子及物质之间的关系
都是构成物质的微粒;小;不断运动;有间隔
不带电,在化学变化中可分
不带电,在化学变化中不可分
带电的微粒
分子 原子 离子
分解
结合
得失电子
物质
构成
构 成
构成
1.下列对分子、原子、离子的认识,不正确的是( )
A.带电的粒子不一定是离子
B.分子一定是由原子构成的
C.分子、原子等微粒都是真实存在的
D.由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成
随堂练习
D
随堂练习
C
2.如图是元素周期表中部分元素的微粒结构示意图,依照此示意图,下列描述正确的是( )
A.示意图①、②、③、④表示的全部是原子结构
B.示意图①的最外层电子数为8,所以它是稀有气体元素
C.示意图②的核电荷数x=12
D.示意图④若表示的是离子结构,则它的最外层电子数y=7
随堂练习
B
3.如图所示是四种粒子的结构示意图,下列说法不正确的是( )
A.②③的结构相对较为稳定
B.它们表示四种元素
C.①表示的粒子在化学反应中易得到电子
D.②③都表示阳离子
谢谢观看
课题2 构成物质的微观粒子
原子的构成
PART 01
1.对科学家对原子结构的探索历程
1808年,道尔顿认为原子是一个不可再分的实心球体;
1897年,汤姆孙发现了电子;
1904年,汤姆孙提出了原子的“枣糕模型”;
1911年,卢瑟福提出了有核原子模型;
1913年,玻尔改进了卢瑟福的模型;
现在的原子结构模型——电子云模型比玻尔模型又有很大的改进。
2.原子的结构
原子
(不显电性)
原子核
(带正电)
核外电子
(带负电)
质子
中子
(每个电子带1个单位
的负电荷)
(不带电)
(每个质子带1个单位的正电荷)
核电荷数 原子核所带的正电荷数
原子结构示意图
原子种类 质子数 中子数 核外电子数
氢 1 0 1
氧 8 8 8
钠 11 12 11
氯 17 18 17
碳-12 6 6 6
碳-13 6 7 6
碳-14 6 8 6
观察下表,你能发现什么?
1.原子中:
核电荷数=质子数=核外电子数
2.在原子中,质子数不一定等于中子数
4.原子种类不同,核内质子数不同
3.不是所有的原子都有中子(氢原子)
5.同一种原子,质子数=核外电子数,
所带电荷的电量相等且电性相反,
故整个原子不显电性。
3.原子结构示意图
第一层
第二层
第三层(最外层)
弧线表示
数字1也可以表示
弧线上的数字表示
电子层
各电子层上的电子数
最外层电子数
下图是1—18号原子结构示意图,你能观察找出什么规律吗?
氢(H)
氦(He)
锂(Li)
铍(Be)
硼(B)
碳(C)
氮(N)
氧(O)
氟(F)
氖(Ne)
钠(Na)
镁(Mg)
铝(Al)
硅(Si)
磷(P)
硫(S)
氯(Cl)
氩(Ar)
电子分层排布规律
1.第一层最多排 个,第二层最多排 个,
最外层电子数不超过 个,(第一层为最外层时,不超过 个)。
2.核外电子总是先排在离核较近的电子层,排满第一层,再依次
排第二层,第三层。
2
8
8
2
3.第一层2个电子为稳定结构;其他层作最外层,8个电子为稳定
结构。
原子种类与原子结构的关系
原子种类 最外层电子数 化学性质
稀有气体原子
金属原子
非金属原子
=8(He为2)
不易得失电子
相对稳定
一般<4
易失电子
形成稳定结构
一般≥4
易得电子
形成稳定结构
原子的化学性质主要取决于原子的最外层电子数
1.下列有关原子构成的叙述正确的是( )。
A.原子是实心球体,不可以再分
B.原子的质量主要集中在原子核上
C.原子核由质子、中子和电子构成
D.原子不显电性是因为原子中不存在带电粒子
随堂练习
B
2.如图为某元素原子的结构示意图。下列有关叙述不正确的是( )
A.该原子的质子数为11
B.该原子的结构示意图中x=1
C.该元素属于活泼的非金属元素
D.该元素的原子在化学反应中容易失去电子
随堂练习
C
相对原子质量
PART 02
1个氢原子的质量为1.674×10-27kg
1个碳原子的质量为1.993×10-26kg
这么小的数字,书写和运算都很不方便,有没有其他的方法来表示呢?
原子虽小,但仍然具有一定的质量。
相对原子质量
1.定义:以一个碳—12原子(原子核中有6个质子和6个中子)的实际质量(1.993×10-26kg)的1/12作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量。
近似计算:相对原子质量≈质子数+中子数
2.计算公式
3.单位:相对原子质量是一个比值,它的单位为“1”,一般
省略不写
随堂练习
C
1.已知某铁原子的实际质量为m g,其相对原子质量为56。银(Ag)的相对原子质量为108,银(Ag)原子的质量为( )
A. B. C. D.
2.关于相对原子质量,下列叙述正确的是( )
A.相对原子质量就是原子质量
B.两种原子的质量之比等于它们的相对原子质量之比
C.硫原子的相对原子质量是
D.采用相对原子质量后,就增大了原子的质量
随堂练习
B
离子
PART 03
1.定义:原子得到或失去核外电子形成的带电荷的微观粒子。
2.离子的分类
阳离子:带正电荷的原子或原子团
例如:Na+ Mg2+
钠离子 镁离子
阴离子:带负电荷的原子或原子团
例如: Cl- O2-
氯离子 氧离子
1.离子的概念
2.观察活动
[实验2-2]把装满氯气的集气瓶倒扣于加热至熔化的金属钠上,你观察到什么现象?
目的:观察钠在氯气中燃烧
现象:
钠在氯气中剧烈燃烧,生成白烟
结论:
生成的白烟实际上是一种白色的固体小颗粒,它的化学名称叫氯化钠(NaCl),就是我们日常生活中用到的食盐的主要成分。
+11
失去1个电子
+11
Na+
Na
Cl
+17
得到1个电子
+17
Cl-
当点燃的钠与氯气相遇时,氯气的分子(Cl2)分成单个的氯原子(Cl),与钠原子(Na)发生了下述变化:
氯化钠(NaCl)
相互
作用
氯化钠的生成过程
氯化钠是由数目极多的钠离子和氯离子相互结合而构成的物质。像氯化钠这样的物质,是由离子构成的。由此可见:离子也是构成物质的一种微观粒子。
由离子构成的物质,阴、阳离子是保持其化学性质的最小微观粒子。如保持氯化钠化学性质的最小微观粒子是钠离子和氯离子。
3.离子符号的写法
在元素符号(或原子团)的右上角标明离子所带的电荷,数字在前,正负号在后。当离子带1个单位的正电荷或1个单位的负电荷时,“1”省略不写。如阳离子Na+、Mg2+、Al3+、等;阴离子Cl-、SO42-等。
4.离子符号的意义
每个镁离子带2个单位的正电荷
表示2个镁离子(镁离子的个数)
Mg2+
2
分 子 原 子 离 子
不同点
相同点 联 系 5.原子、分子、离子及物质之间的关系
都是构成物质的微粒;小;不断运动;有间隔
不带电,在化学变化中可分
不带电,在化学变化中不可分
带电的微粒
分子 原子 离子
分解
结合
得失电子
物质
构成
构 成
构成
1.下列对分子、原子、离子的认识,不正确的是( )
A.带电的粒子不一定是离子
B.分子一定是由原子构成的
C.分子、原子等微粒都是真实存在的
D.由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成
随堂练习
D
随堂练习
C
2.如图是元素周期表中部分元素的微粒结构示意图,依照此示意图,下列描述正确的是( )
A.示意图①、②、③、④表示的全部是原子结构
B.示意图①的最外层电子数为8,所以它是稀有气体元素
C.示意图②的核电荷数x=12
D.示意图④若表示的是离子结构,则它的最外层电子数y=7
随堂练习
B
3.如图所示是四种粒子的结构示意图,下列说法不正确的是( )
A.②③的结构相对较为稳定
B.它们表示四种元素
C.①表示的粒子在化学反应中易得到电子
D.②③都表示阳离子
谢谢观看
同课章节目录
