2024-2025学年度北京三十五中高二10月月考化学(PDF版,无答案)
文档属性
| 名称 | 2024-2025学年度北京三十五中高二10月月考化学(PDF版,无答案) |

|
|
| 格式 | |||
| 文件大小 | 967.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-19 10:58:47 | ||
图片预览



文档简介
北京市第三十五中学 2024-2025 学年度第一学期 10月月考 高二化学
2023 级高二化学 10 月月考
2024.10
行政班 教 学班 姓名 学 号
试卷说明:试卷分值100 ,考试时间 60分钟。I 卷为选择题, II 卷为主观题。
I 卷
一、选择题(共 20 个小题,每题 3 分,共 60 分。每小题只有一个正确选项,请将正确答案填在机读卡相应
的题号处)
1. 下列设备工作时,将化学能转化为热能的是
A B C D
燃气灶 铅蓄电池 太阳能热水器 风力发电
2 .提高能源的利用率已成为国际能源研究的热点课题。下列相关措施使用不当的是
A .使燃料充分燃烧 B .加强能源利用的科技投入
C .加大能源开采力度 D .合理使用能源
3.下列变化中,属于吸热反应的是
A .铝粉与氧化铁粉末反应 B .碳酸钙受热分解
C .酸碱中和反应 D .氧化钙溶于水
4 .下列食品添加剂中,其使用目的与反应速率有关的是
A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂
..
5.下列说法中,正确的是
A .能够自发进行的反应一定是放热反应
B .凡是熵增大的反应都是自发反应
C .要判断反应进行的方向,必须综合考虑体系的焓变和熵变
D .非自发反应在任何条件下都不能实现
6 .一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s) + CO2(g) 2CO(g) ,
不能判断反应已经达到化学平衡状态的是
A .v(CO2 )= 2v(CO)
B .容器中混合气体的密度不变
C .容器中总压强不变
D .容器中 CO2 的体积分数不变
第 1 页 共 8 页
北京市第三十五中学 2024-2025 学年度第一学期 10月月考 高二化学
7.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
...
下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→①放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
...
8.某同学为了估算反应H g Cl g 2HCl g 的ΔH,构建如下图循环.下列说法不正确的是 2 2
A.ΔH ΔH1 ΔH2 ΔH3
B.ΔH1、ΔH2、ΔH3均可由相应的键能数据得到
C.按照该过程所示,断开的化学键均为非极性共价键
D.该循环过程不一定表示反应的真实历程
9 .在10L的密闭容器中投入 20 mol N2和 40 molH2进行反应N 2(g) + 3H2(g) 2NH3(g) ,
2 min末N 2 的物质的量由 20 mol减小到 8 mol ,则0~ 2 min内 用 H2的 浓度变化表示的 平均反应
速率是
A .1.2 mol/(L·min) B .1.8 mol/(L·min) C .0.6 mol/(L·min) D .2 mol/(L·min)
..
10 .下列有关化学平衡常数K的说法中,正确的是
A .K值越大,反应的转化率越大 B .K的大小与起始浓度有关
C .温度越高,K值越大 D .K值越大,正向反应进行的程度越小
..
11 .下列说法中正确的是
A .催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大化学反应速率
B .有气体参加的化学反应,若增大压强,可增加活化分子的百分数,从而增大反应速率
C .升高温度,增加反应物分子中活化分子的百分数,从而增大化学反应速率
D .增大反应物浓度,增大单位体积内活化分子的百分数,从而增大有效碰撞次数
12 .某温度下,恒容密闭容器内发生反应:H2(g) +I2 (g) 2HI(g) Δ H< 0 ,该温度下,
K=43。某时刻,测得容器内 H2 、I2 、HI 的浓度依次为 0.01 mol/L 、0.01 mol/L、0.02 mol/L。
一段时间后,下列情况与事实相符的是
A .混合气体颜色变深 B .混合气体密度变大
C .氢气的体积分数变小 D .容器内压强变小
第 2 页 共 8 页
北京市第三十五中学 2024-2025 学年度第一学期 10月月考 高二化学
..
13.下列依据热化学方程式得出的结论中,正确的是
A.已知N2(g) + 3H2(g) 2NH3(g) H = -92.4 -1 kJ mol ,则在一定条件下将2 mol N2和6mol H2置于
一密闭容器中充分反应,放出的热量为184.8 kJ
B.已知C(石墨,s) C(金刚石,s) H > 0,则金刚石比石墨稳定
-
C.在稀溶液中:H+(aq) + -1 OH (aq) H2O(l) H= - 57.3 kJ mol ,若将含1mol H2SO4的溶液与含1mol
Ba(OH)2的溶液混合,放出的热量为57.3 kJ
D.已知S(s) + O2(g) SO2(g) H1;S(g) + O2(g) SO2(g) H2;则 H2 < H1
..
14.下列事实不能用平衡移动原理解释的是
A.血红蛋白(Hb)可与氧气结合:Hb+O2 HbO2,CO比O2更易和Hb结合,当空气中的CO浓度大时,
易造成人体缺氧,严重时导致死亡
B.在NO2和N2O4组成的体系中:2NO2(g) N2O4(g),恒温缩小容积,平衡后气体颜色比原平衡深
C.Na(l) + KCl(l) 2NaCl(l) + K(g),工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
D.高压条件有利于合成氨反应
...
15.某反应过程的能量变化如图所示。下列说法中,不正确的是
A.该反应为放热反应
B.曲线b表示有催化剂参与的反应过程
C.反应i 的 H>0
D.反应i比反应ii的速率大
16.采用催化技术可以使汽车尾气中的NO和CO发生如下反应从而消除污染:
催化剂
2NO 2CO N 2 CO2 .
某小组用恒容容器进行三组实验,实验开始时NO的浓度均为6.00 10 3mol / L ,三组实验中CO的浓度随时
...
间的变化如图所示.下列说法不正确的是
A.当容器中CO 的浓度保持恒定时,反应达到化学平衡状态 2
B.在实验Ⅰ中,达到平衡时NO的浓度为3.00 10 3mol / L
C.若实验Ⅱ比实验Ⅲ的温度低,则NO和CO的反应为吸热反应
D.实验Ⅰ和实验Ⅱ的差异,可能是由于采用了效果不同的催化剂
17 .化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol 化学键时释放(或
1
吸收)出的能量。已知白磷和 P4O6 的分子结构如图所示,现提供以下化学键的键能(kJ ·mol ):P—P:198
P—O:360 O=O:498,则反应 P4(白磷)+3O2= P4O6 的反应热△H 为
. 1 1A -1638 kJ ·mol B .+1638 kJ ·mol
. 1 . 1 C -126 kJ ·mol D +126 kJ ·mol
第 3 页 共 8 页
北京市第三十五中学 2024-2025 学年度第一学期 10月月考 高二化学
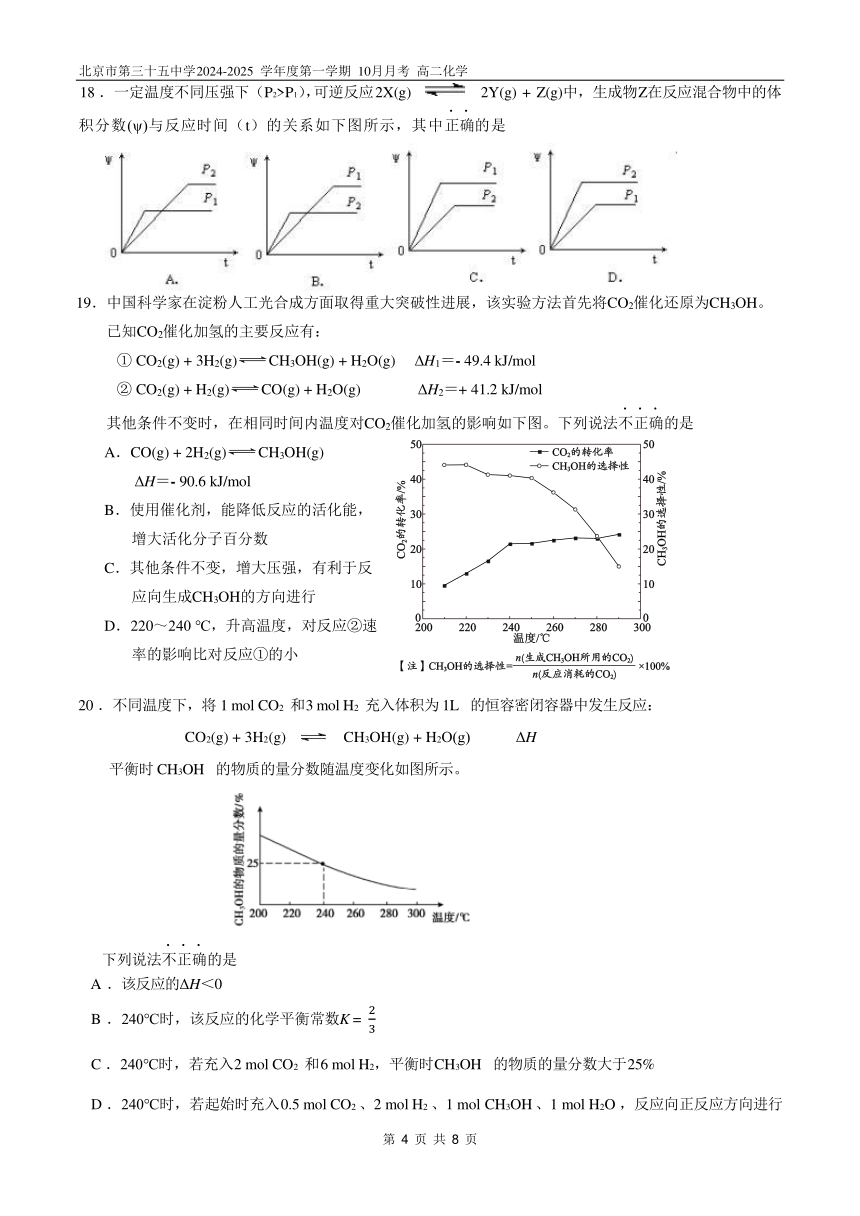
18 .一定温度不同压强下(P2>P1),可逆反应 2X(g) 2Y(g) + Z(g)中,生成物 Z在反应混合物中的体
..
积分数(ψ)与反应时间(t)的关系如下图所示,其中正确的是
19.中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。
已知CO2催化加氢的主要反应有:
① CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
② CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
...
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如下图。下列说法不正确的是
A.CO(g) + 2H2(g) CH3OH(g)
ΔH=- 90.6 kJ/mol
B.使用催化剂,能降低反应的活化能,
增大活化分子百分数
C.其他条件不变,增大压强,有利于反
应向生成CH3OH的方向进行
D.220~240 ℃,升高温度,对反应②速
率的影响比对反应①的小
20 .不同温度下,将 1 mol CO2 和 3 mol H2 充入体积为 1L 的恒容密闭容器中发生反应:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH
平衡时 CH3OH 的物质的量分数随温度变化如图所示。
...
下列说法不正确的是
A .该反应的 ΔH<0
2
B .240℃时,该反应的化学平衡常数K =
3
C .240℃时,若充入 2 mol CO2 和 6 mol H2,平衡时 CH3OH 的物质的量分数大于 25%
D .240℃时,若起始时充入 0.5 mol CO2 、2 mol H2 、1 mol CH3OH 、1 mol H2O ,反应向正反应方向进行
第 4 页 共 8 页
北京市第三十五中学 2021-2022 学年度第一学期 10 月月考 高二化学
II 卷
二、填空题:请将答案填写在答题纸的相应题号处。
21.(14分)工业上使用黄铁矿FeS2制硫酸。
Ⅰ.掺烧FeS2和FeSO4,用于制铁精粉和硫酸
(1)已知:2FeSO4(s) === Fe2O3(s)+SO2(g)+SO3(g)为吸热反应。
25℃、101 kPa时,1 molFeS2固体在2.75 mol氧气中完全燃烧生成气态SO2和Fe2O3固体,放出826 kJ热量。
①FeS2与O2反应的热化学方程式为______。
②将FeS2与FeSO4掺烧(混合燃烧),其目的包括______(填字母)。
a. 节约燃料和能量 b. 为制备硫酸提供原料 c. 减少空气污染
(2)FeSO4常带一定量的结晶水。FeSO4·7H2O(s)分解脱水反应的能量变化如下图所示。
①ΔH3= kJ·mol-1。
②为维持炉内温度基本不变,FeSO4所带结晶水越多,掺烧比[n(FeS2) : n(FeSO4)]应______。(填“增
大”“减小”或“不变”)。
Ⅱ.传统工业中以黄铁矿为原料制备硫酸的原理如图所示:
(1)上述生产过程中采用了多种措施加快反应速率,如:______________.
(2)已知 : ,在不同温度和压强下,平衡时SO2 的转化率如下表所示:
①上述数据表明, 是______________(填“吸热”或“放热”)反应.
②结合平衡移动原理解释相同温度下达到平衡时SO2 的转化率随压强变化的原因:______________.
第 5 页 共 8 页
北京市第三十五中学 2021-2022 学年度第一学期 10 月月考 高二化学
22.(12分)CH 还原重整4 CO 既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效2
途径之一。
(1)甲烷干法重整(1000℃)
ⅰ.CH g CO g 2CO g 2H g H1 247kJ mol
1
4 2 2
. 1ⅱ CO2 g H2 g CO g H O g H2 41kJ mol 2
①反应ⅰ的平衡常数表达式为__________。
②对于反应ⅰ,既能加快反应速率又能提高CO 平衡转化率的措施是__________。 2
反应ⅱ为副反应,生产中要尽可能控制该反应,减少水的生成。
(2)甲烷超干重整(750℃)
CH4 g 3CO2 g 4CO g 2H O g H 2
H kJ mol 1① __________ 。
②CO2的转化原理如下图所示:恒压、750℃时,将混合气 n CH : n CO 1:3 通入反应器A,充分4 2
反应;待反应平衡后,改通He气,吹出反应器A内气体;如此往复切换通入的气体,实现CO2的高效转化
。
ⅰ.结合有关反应方程式,说明CaO对Fe3O4 氧化CO反应的影响__________。
ⅱ.反应达平衡后,改通He气,测得一段时间内CO物质的量上升,解释CO物质的量上升的原因_________
。
(3)从能源利用的角度,分析甲烷超干重整法的优点:__________。
第 6 页 共 8 页
北京市第三十五中学 2021-2022 学年度第一学期 10 月月考 高二化学
23(. 14分)某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10 3 mol·L 1
KMnO4溶液、0.40 mol·L 1草酸溶液。将KMnO4溶液与草酸溶液 按如下比例混合。
【设计实验】
序号 V(KMnO4) / mL V(草酸) /mL V(H2O) /mL 反应温度
① 2.0 2.0 0 20 oC
② 2.0 1.0 1.0 20 oC
(1)实验①和②的目的是__________。
(2)甲认为上述实验应控制pH相同,可加入的试剂是_________(填序号)。
a. 盐酸 b. 硫酸 c. 草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i. 紫
色溶液变为青色溶液,ii. 青色溶液逐渐褪至无色溶液。
资料:
(a)草酸是二元弱酸,其电离方程式:H C O H +HC O ;HC O H +C O
(b) Mn2+在溶液中无色;
(c) Mn3+无色,有强氧化性,发生反应Mn3++2C2O 2-4 [Mn(C2O 4)2] (青绿色)后氧化性减弱;
(d)MnO 2-4 呈绿色,在酸性条件下不稳定,迅速分解产生MnO -4 和MnO2。
(3)乙同学从氧化还原角度推测阶段i中可能产生了MnO 2-4 。
你认为该观点是否合理,并说明理由__________。
【深入探究】
进一步实验证明溶液中含有[Mn(C O 2 4)2] ,反应过程中MnO 4 和[Mn(C 2O4)2] 浓度随
时间的变化如下图。
(4)第i阶段中检测到有CO2气体产生,反应的离子方程式为___________。
(5)实验②在第ii阶段的反应速率较大,可能的原因是___________。
(6)据此推测,若在第ii阶段将c(H+)调节至0.2 mol/L,溶液褪至无色的时间会
_________(填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是(1)_________;(2)产生C 2- 3+2O4 和Mn 发生反应。
第 7 页 共 8 页
北京市第三十五中学 2021-2022 学年度第一学期 10 月月考 高二化学
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
草稿纸
第 8 页 共 8 页
2023 级高二化学 10 月月考
2024.10
行政班 教 学班 姓名 学 号
试卷说明:试卷分值100 ,考试时间 60分钟。I 卷为选择题, II 卷为主观题。
I 卷
一、选择题(共 20 个小题,每题 3 分,共 60 分。每小题只有一个正确选项,请将正确答案填在机读卡相应
的题号处)
1. 下列设备工作时,将化学能转化为热能的是
A B C D
燃气灶 铅蓄电池 太阳能热水器 风力发电
2 .提高能源的利用率已成为国际能源研究的热点课题。下列相关措施使用不当的是
A .使燃料充分燃烧 B .加强能源利用的科技投入
C .加大能源开采力度 D .合理使用能源
3.下列变化中,属于吸热反应的是
A .铝粉与氧化铁粉末反应 B .碳酸钙受热分解
C .酸碱中和反应 D .氧化钙溶于水
4 .下列食品添加剂中,其使用目的与反应速率有关的是
A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂
..
5.下列说法中,正确的是
A .能够自发进行的反应一定是放热反应
B .凡是熵增大的反应都是自发反应
C .要判断反应进行的方向,必须综合考虑体系的焓变和熵变
D .非自发反应在任何条件下都不能实现
6 .一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s) + CO2(g) 2CO(g) ,
不能判断反应已经达到化学平衡状态的是
A .v(CO2 )= 2v(CO)
B .容器中混合气体的密度不变
C .容器中总压强不变
D .容器中 CO2 的体积分数不变
第 1 页 共 8 页
北京市第三十五中学 2024-2025 学年度第一学期 10月月考 高二化学
7.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
...
下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→①放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
...
8.某同学为了估算反应H g Cl g 2HCl g 的ΔH,构建如下图循环.下列说法不正确的是 2 2
A.ΔH ΔH1 ΔH2 ΔH3
B.ΔH1、ΔH2、ΔH3均可由相应的键能数据得到
C.按照该过程所示,断开的化学键均为非极性共价键
D.该循环过程不一定表示反应的真实历程
9 .在10L的密闭容器中投入 20 mol N2和 40 molH2进行反应N 2(g) + 3H2(g) 2NH3(g) ,
2 min末N 2 的物质的量由 20 mol减小到 8 mol ,则0~ 2 min内 用 H2的 浓度变化表示的 平均反应
速率是
A .1.2 mol/(L·min) B .1.8 mol/(L·min) C .0.6 mol/(L·min) D .2 mol/(L·min)
..
10 .下列有关化学平衡常数K的说法中,正确的是
A .K值越大,反应的转化率越大 B .K的大小与起始浓度有关
C .温度越高,K值越大 D .K值越大,正向反应进行的程度越小
..
11 .下列说法中正确的是
A .催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大化学反应速率
B .有气体参加的化学反应,若增大压强,可增加活化分子的百分数,从而增大反应速率
C .升高温度,增加反应物分子中活化分子的百分数,从而增大化学反应速率
D .增大反应物浓度,增大单位体积内活化分子的百分数,从而增大有效碰撞次数
12 .某温度下,恒容密闭容器内发生反应:H2(g) +I2 (g) 2HI(g) Δ H< 0 ,该温度下,
K=43。某时刻,测得容器内 H2 、I2 、HI 的浓度依次为 0.01 mol/L 、0.01 mol/L、0.02 mol/L。
一段时间后,下列情况与事实相符的是
A .混合气体颜色变深 B .混合气体密度变大
C .氢气的体积分数变小 D .容器内压强变小
第 2 页 共 8 页
北京市第三十五中学 2024-2025 学年度第一学期 10月月考 高二化学
..
13.下列依据热化学方程式得出的结论中,正确的是
A.已知N2(g) + 3H2(g) 2NH3(g) H = -92.4 -1 kJ mol ,则在一定条件下将2 mol N2和6mol H2置于
一密闭容器中充分反应,放出的热量为184.8 kJ
B.已知C(石墨,s) C(金刚石,s) H > 0,则金刚石比石墨稳定
-
C.在稀溶液中:H+(aq) + -1 OH (aq) H2O(l) H= - 57.3 kJ mol ,若将含1mol H2SO4的溶液与含1mol
Ba(OH)2的溶液混合,放出的热量为57.3 kJ
D.已知S(s) + O2(g) SO2(g) H1;S(g) + O2(g) SO2(g) H2;则 H2 < H1
..
14.下列事实不能用平衡移动原理解释的是
A.血红蛋白(Hb)可与氧气结合:Hb+O2 HbO2,CO比O2更易和Hb结合,当空气中的CO浓度大时,
易造成人体缺氧,严重时导致死亡
B.在NO2和N2O4组成的体系中:2NO2(g) N2O4(g),恒温缩小容积,平衡后气体颜色比原平衡深
C.Na(l) + KCl(l) 2NaCl(l) + K(g),工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
D.高压条件有利于合成氨反应
...
15.某反应过程的能量变化如图所示。下列说法中,不正确的是
A.该反应为放热反应
B.曲线b表示有催化剂参与的反应过程
C.反应i 的 H>0
D.反应i比反应ii的速率大
16.采用催化技术可以使汽车尾气中的NO和CO发生如下反应从而消除污染:
催化剂
2NO 2CO N 2 CO2 .
某小组用恒容容器进行三组实验,实验开始时NO的浓度均为6.00 10 3mol / L ,三组实验中CO的浓度随时
...
间的变化如图所示.下列说法不正确的是
A.当容器中CO 的浓度保持恒定时,反应达到化学平衡状态 2
B.在实验Ⅰ中,达到平衡时NO的浓度为3.00 10 3mol / L
C.若实验Ⅱ比实验Ⅲ的温度低,则NO和CO的反应为吸热反应
D.实验Ⅰ和实验Ⅱ的差异,可能是由于采用了效果不同的催化剂
17 .化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol 化学键时释放(或
1
吸收)出的能量。已知白磷和 P4O6 的分子结构如图所示,现提供以下化学键的键能(kJ ·mol ):P—P:198
P—O:360 O=O:498,则反应 P4(白磷)+3O2= P4O6 的反应热△H 为
. 1 1A -1638 kJ ·mol B .+1638 kJ ·mol
. 1 . 1 C -126 kJ ·mol D +126 kJ ·mol
第 3 页 共 8 页
北京市第三十五中学 2024-2025 学年度第一学期 10月月考 高二化学
18 .一定温度不同压强下(P2>P1),可逆反应 2X(g) 2Y(g) + Z(g)中,生成物 Z在反应混合物中的体
..
积分数(ψ)与反应时间(t)的关系如下图所示,其中正确的是
19.中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。
已知CO2催化加氢的主要反应有:
① CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
② CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
...
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如下图。下列说法不正确的是
A.CO(g) + 2H2(g) CH3OH(g)
ΔH=- 90.6 kJ/mol
B.使用催化剂,能降低反应的活化能,
增大活化分子百分数
C.其他条件不变,增大压强,有利于反
应向生成CH3OH的方向进行
D.220~240 ℃,升高温度,对反应②速
率的影响比对反应①的小
20 .不同温度下,将 1 mol CO2 和 3 mol H2 充入体积为 1L 的恒容密闭容器中发生反应:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH
平衡时 CH3OH 的物质的量分数随温度变化如图所示。
...
下列说法不正确的是
A .该反应的 ΔH<0
2
B .240℃时,该反应的化学平衡常数K =
3
C .240℃时,若充入 2 mol CO2 和 6 mol H2,平衡时 CH3OH 的物质的量分数大于 25%
D .240℃时,若起始时充入 0.5 mol CO2 、2 mol H2 、1 mol CH3OH 、1 mol H2O ,反应向正反应方向进行
第 4 页 共 8 页
北京市第三十五中学 2021-2022 学年度第一学期 10 月月考 高二化学
II 卷
二、填空题:请将答案填写在答题纸的相应题号处。
21.(14分)工业上使用黄铁矿FeS2制硫酸。
Ⅰ.掺烧FeS2和FeSO4,用于制铁精粉和硫酸
(1)已知:2FeSO4(s) === Fe2O3(s)+SO2(g)+SO3(g)为吸热反应。
25℃、101 kPa时,1 molFeS2固体在2.75 mol氧气中完全燃烧生成气态SO2和Fe2O3固体,放出826 kJ热量。
①FeS2与O2反应的热化学方程式为______。
②将FeS2与FeSO4掺烧(混合燃烧),其目的包括______(填字母)。
a. 节约燃料和能量 b. 为制备硫酸提供原料 c. 减少空气污染
(2)FeSO4常带一定量的结晶水。FeSO4·7H2O(s)分解脱水反应的能量变化如下图所示。
①ΔH3= kJ·mol-1。
②为维持炉内温度基本不变,FeSO4所带结晶水越多,掺烧比[n(FeS2) : n(FeSO4)]应______。(填“增
大”“减小”或“不变”)。
Ⅱ.传统工业中以黄铁矿为原料制备硫酸的原理如图所示:
(1)上述生产过程中采用了多种措施加快反应速率,如:______________.
(2)已知 : ,在不同温度和压强下,平衡时SO2 的转化率如下表所示:
①上述数据表明, 是______________(填“吸热”或“放热”)反应.
②结合平衡移动原理解释相同温度下达到平衡时SO2 的转化率随压强变化的原因:______________.
第 5 页 共 8 页
北京市第三十五中学 2021-2022 学年度第一学期 10 月月考 高二化学
22.(12分)CH 还原重整4 CO 既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效2
途径之一。
(1)甲烷干法重整(1000℃)
ⅰ.CH g CO g 2CO g 2H g H1 247kJ mol
1
4 2 2
. 1ⅱ CO2 g H2 g CO g H O g H2 41kJ mol 2
①反应ⅰ的平衡常数表达式为__________。
②对于反应ⅰ,既能加快反应速率又能提高CO 平衡转化率的措施是__________。 2
反应ⅱ为副反应,生产中要尽可能控制该反应,减少水的生成。
(2)甲烷超干重整(750℃)
CH4 g 3CO2 g 4CO g 2H O g H 2
H kJ mol 1① __________ 。
②CO2的转化原理如下图所示:恒压、750℃时,将混合气 n CH : n CO 1:3 通入反应器A,充分4 2
反应;待反应平衡后,改通He气,吹出反应器A内气体;如此往复切换通入的气体,实现CO2的高效转化
。
ⅰ.结合有关反应方程式,说明CaO对Fe3O4 氧化CO反应的影响__________。
ⅱ.反应达平衡后,改通He气,测得一段时间内CO物质的量上升,解释CO物质的量上升的原因_________
。
(3)从能源利用的角度,分析甲烷超干重整法的优点:__________。
第 6 页 共 8 页
北京市第三十五中学 2021-2022 学年度第一学期 10 月月考 高二化学
23(. 14分)某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10 3 mol·L 1
KMnO4溶液、0.40 mol·L 1草酸溶液。将KMnO4溶液与草酸溶液 按如下比例混合。
【设计实验】
序号 V(KMnO4) / mL V(草酸) /mL V(H2O) /mL 反应温度
① 2.0 2.0 0 20 oC
② 2.0 1.0 1.0 20 oC
(1)实验①和②的目的是__________。
(2)甲认为上述实验应控制pH相同,可加入的试剂是_________(填序号)。
a. 盐酸 b. 硫酸 c. 草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:i. 紫
色溶液变为青色溶液,ii. 青色溶液逐渐褪至无色溶液。
资料:
(a)草酸是二元弱酸,其电离方程式:H C O H +HC O ;HC O H +C O
(b) Mn2+在溶液中无色;
(c) Mn3+无色,有强氧化性,发生反应Mn3++2C2O 2-4 [Mn(C2O 4)2] (青绿色)后氧化性减弱;
(d)MnO 2-4 呈绿色,在酸性条件下不稳定,迅速分解产生MnO -4 和MnO2。
(3)乙同学从氧化还原角度推测阶段i中可能产生了MnO 2-4 。
你认为该观点是否合理,并说明理由__________。
【深入探究】
进一步实验证明溶液中含有[Mn(C O 2 4)2] ,反应过程中MnO 4 和[Mn(C 2O4)2] 浓度随
时间的变化如下图。
(4)第i阶段中检测到有CO2气体产生,反应的离子方程式为___________。
(5)实验②在第ii阶段的反应速率较大,可能的原因是___________。
(6)据此推测,若在第ii阶段将c(H+)调节至0.2 mol/L,溶液褪至无色的时间会
_________(填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是(1)_________;(2)产生C 2- 3+2O4 和Mn 发生反应。
第 7 页 共 8 页
北京市第三十五中学 2021-2022 学年度第一学期 10 月月考 高二化学
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
草稿纸
第 8 页 共 8 页
同课章节目录
