2.1 原子 课件(共32张PPT) 2024-2025学年化学鲁教版九年级上册
文档属性
| 名称 | 2.1 原子 课件(共32张PPT) 2024-2025学年化学鲁教版九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-19 15:01:01 | ||
图片预览










文档简介
(共32张PPT)
第二单元 认识物质的构成
第一节
原 子
水分子很小,那构成水分子的氢原子和氧原子岂不更小 这么小的原子还能不能再分呢 1808年,道尔顿(J.Dalton,1766— 1844) 提出原子是一个不可再分的实心球,是构成物质的最微小的粒子。然而汤姆孙(J.J.Thomson,1856—1940)等人通过实验改变了人们的这种认识。1897年,汤姆孙等人认真分析了高压放电管的阴极射线,发现该射线是由一种带负电荷的粒子形成的粒子流,这种粒子就是电子。汤姆孙进行了一系列实验后发现,不论他使用的阴极材料是什么,都会发射出电子。这让他意识到,所有物质的原子中都有电子!既然原子中存在更小的粒子——电子,那么原子就是可分的。
一、原子的结构
原子里究竟有什么呢?若只有电子,怎么能保证原子为电中性呢?汤姆孙等人猜测原子中一定还有带正电的物质,并由此提出了新的原子模型“葡萄干布丁”模型:原子呈圆球状,充斥着正电荷,而带负电荷的电子则像一粒粒葡萄干一样镶嵌其中。
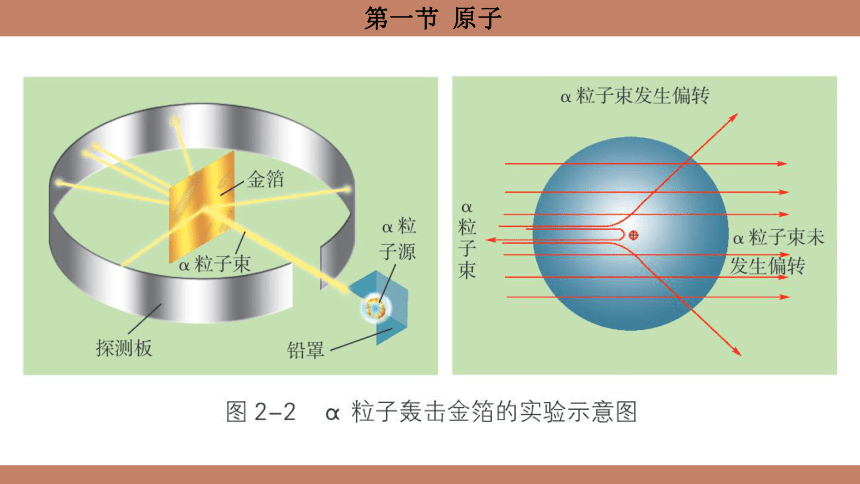
1911年,卢瑟福(E. Rutherford,1871—1937)和他的研究团队用一束带正电的、质量比电子大得多的高速α粒子轰击一张极薄的金箔。他们预测这些α粒子会毫不费力地击穿金原子,顺利到达对面的探测板上。实验结果却发现:绝大多数α粒子能穿过金箔且不改变原来的方向,但有一小部分却改变了原来的前进方向,甚至有极少数的α粒子被反弹了回来!
卢瑟福等人认为,极少数α粒子被反弹回来是因为它们和金原子中某种极为坚硬密实的核发生了“碰撞”。这个核很小、带正电,却集中了原子的大部分质量,称为原子核。从而推测原子是由原子核和核外电子构成的,电子在原子核外“很大”的空间里运动。
原子核很小,它的体积仅为原子体积的几千亿分之一。即使这样,原子核仍然是可以再分的。后来的研究表明,原子核是由带正电荷的质子和不带电的中子构成的,因此原子核带正电,其所带的正电荷数称为核电荷数。质子和中子的质量差不多、都比电子大得多,质子质量约为电子质量的1836倍,因此原子的质量几乎全部集中在原子核上。
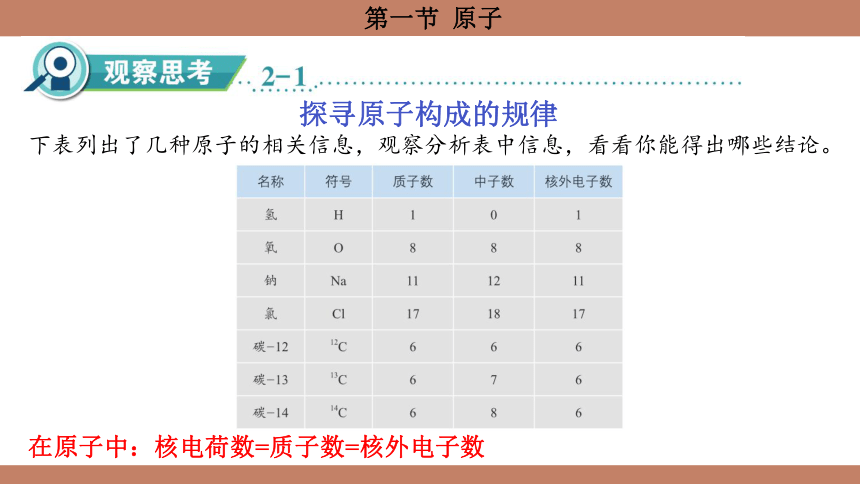
探寻原子构成的规律
下表列出了几种原子的相关信息,观察分析表中信息,看看你能得出哪些结论。
在原子中:核电荷数=质子数=核外电子数
制作原子结构模型
人类对原子结构的认识,是科学家们不懈追求、不断创新的过程。科学家们基于新的事实和证据,不断提出新的结构模型,深化和发展对原子结构的认识。
1.观察上图,结合你的学习,分析科学家否定前者模型的理由是什么,提出新模型的证据又是什么。
2.请发挥你的想象力和创造力,运用下列物品(也可以自己选择其他材料),小组合作,设计并制作科学家们提出的原子结构模型。
实验物品:不同颜色的太空泥、细铁丝、细线、木牙签、硬纸板、剪刀、固体胶等。
原子是构成物质的一种微观粒子,金、金刚石、石墨等都是由原子直接构成的。原子具有微观粒子的一般性质,如质量和体积都很小,相互之间有间隔,存在着相互作用,总是在不断地运动等。
二、计量原子的质量
虽然所有原子都非常微小,但是它们的质量仍存在差异。例如,1个氧原子的质量为2.657×10-26kg,1个铁原子的质量为9.288×10-26kg。这么小的数字,书写和运算都很不方便,为此国际上统一采用相对原子质量来计量原子的质量。
以一个碳-12 原子①实际质量(1.993×10-26 kg)的1/12作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量。
由上表可知:计量原子的质量时,采用“碳-12原子质量的1/12”作为基准,所得的相对原子质量数值要比采用“千克”作为基准所得的实际原子质量数值更简约,更便于比较和运算。
三、原子与离子、分子
在原子中,电子是体积最小、质量最轻的一种粒子。不同的原子含有的电子数目不同。例如,1个碳原子含有6个电子,1个氧原子含有8个电子。在多电子原子中,核外电子的能量是不同的。能量高的电子在离核较远的区域运动,能量低的电子在离核较近的区域运动。通常把电子在离核远近不同的区域运动称为电子的分层排布。
在化学反应中,原子核是不变的,发生改变的只是原子核外的电子。原子失去电子后变成带正电荷的阳离子,得到电子后变成带负电荷的阴离子。例如,钠原子(Na)失去1个电子,形成带1个单位正电荷的钠离子(Na+);氯原子(Cl)得到1个电子,形成带1个单位负电荷的氯离子(Cl-)。带相反电荷的钠离子和氯离子相互作用,就形成了新的物质——氯化钠(NaCl),它是食盐的主要成分。除氯化钠外,氧化镁(MgO)、氯化钾(KCl)等很多物质都是由离子构成的。
有些原子之间不是先转化成离子再构成物质的,而是原子之间直接结合形成分子,再由分子构成物质的。例如,1个氢原子(H)能与1个氯原子(Cl)结合,形成1个氯化氢分子(HCl),而1个氧原子(O)能与2个氢原子(H)结合,形成1个水分子(H2O)。
原子、分子、离子都是构成物质的微观粒子。
1.下列有关原子构成的叙述正确的是( )
A.原子是实心球体,不可以再分
B.原子的质量主要集中在原子核上
C.原子核由质子、中子和电子构成
D.原子不显电性是因为原子中不存在带电粒子
B
2.下列关于原子、分子、离子的认识不正确的是( )
A.原子和分子不带电,离子带电
B.原子得到或失去电子后变成离子
C.原子、分子和离子都能直接构成物质
D.原子不能直接结合形成分子
D
3. 2020年12月17日,嫦娥五号月球探测器圆满完成我国首次月球采样任务。科研人员发现带回的月壤中含有大量氦-3,它被视为核聚变的重要原料。氦-3原子核由两个质子和一个中子构成,如果用“●”“○”“·”分别表示质子、中子和电子,下列示意图能正确表示氦-3原子结构的是( )
A
4.我国化学家张青莲(1908-2006)在相对原子质量测定方面做出了创造性的贡献,他主持测定的铟(In)、铱(Ir)等十种元素的相对原子质量新值,被国际原子量委员会作为标准数据所采用。下列关于相对原子质量叙述正确的是( )
A.相对原子质量就是原子质量
B.两种原子的质量之比等于它们的相对原子质量之比
C.碳原子的相对原子质量是12g
D.采用相对原子质量,就是增大了原子的质量
B
谢谢观看
第二单元 认识物质的构成
第一节
原 子
水分子很小,那构成水分子的氢原子和氧原子岂不更小 这么小的原子还能不能再分呢 1808年,道尔顿(J.Dalton,1766— 1844) 提出原子是一个不可再分的实心球,是构成物质的最微小的粒子。然而汤姆孙(J.J.Thomson,1856—1940)等人通过实验改变了人们的这种认识。1897年,汤姆孙等人认真分析了高压放电管的阴极射线,发现该射线是由一种带负电荷的粒子形成的粒子流,这种粒子就是电子。汤姆孙进行了一系列实验后发现,不论他使用的阴极材料是什么,都会发射出电子。这让他意识到,所有物质的原子中都有电子!既然原子中存在更小的粒子——电子,那么原子就是可分的。
一、原子的结构
原子里究竟有什么呢?若只有电子,怎么能保证原子为电中性呢?汤姆孙等人猜测原子中一定还有带正电的物质,并由此提出了新的原子模型“葡萄干布丁”模型:原子呈圆球状,充斥着正电荷,而带负电荷的电子则像一粒粒葡萄干一样镶嵌其中。
1911年,卢瑟福(E. Rutherford,1871—1937)和他的研究团队用一束带正电的、质量比电子大得多的高速α粒子轰击一张极薄的金箔。他们预测这些α粒子会毫不费力地击穿金原子,顺利到达对面的探测板上。实验结果却发现:绝大多数α粒子能穿过金箔且不改变原来的方向,但有一小部分却改变了原来的前进方向,甚至有极少数的α粒子被反弹了回来!
卢瑟福等人认为,极少数α粒子被反弹回来是因为它们和金原子中某种极为坚硬密实的核发生了“碰撞”。这个核很小、带正电,却集中了原子的大部分质量,称为原子核。从而推测原子是由原子核和核外电子构成的,电子在原子核外“很大”的空间里运动。
原子核很小,它的体积仅为原子体积的几千亿分之一。即使这样,原子核仍然是可以再分的。后来的研究表明,原子核是由带正电荷的质子和不带电的中子构成的,因此原子核带正电,其所带的正电荷数称为核电荷数。质子和中子的质量差不多、都比电子大得多,质子质量约为电子质量的1836倍,因此原子的质量几乎全部集中在原子核上。
探寻原子构成的规律
下表列出了几种原子的相关信息,观察分析表中信息,看看你能得出哪些结论。
在原子中:核电荷数=质子数=核外电子数
制作原子结构模型
人类对原子结构的认识,是科学家们不懈追求、不断创新的过程。科学家们基于新的事实和证据,不断提出新的结构模型,深化和发展对原子结构的认识。
1.观察上图,结合你的学习,分析科学家否定前者模型的理由是什么,提出新模型的证据又是什么。
2.请发挥你的想象力和创造力,运用下列物品(也可以自己选择其他材料),小组合作,设计并制作科学家们提出的原子结构模型。
实验物品:不同颜色的太空泥、细铁丝、细线、木牙签、硬纸板、剪刀、固体胶等。
原子是构成物质的一种微观粒子,金、金刚石、石墨等都是由原子直接构成的。原子具有微观粒子的一般性质,如质量和体积都很小,相互之间有间隔,存在着相互作用,总是在不断地运动等。
二、计量原子的质量
虽然所有原子都非常微小,但是它们的质量仍存在差异。例如,1个氧原子的质量为2.657×10-26kg,1个铁原子的质量为9.288×10-26kg。这么小的数字,书写和运算都很不方便,为此国际上统一采用相对原子质量来计量原子的质量。
以一个碳-12 原子①实际质量(1.993×10-26 kg)的1/12作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量。
由上表可知:计量原子的质量时,采用“碳-12原子质量的1/12”作为基准,所得的相对原子质量数值要比采用“千克”作为基准所得的实际原子质量数值更简约,更便于比较和运算。
三、原子与离子、分子
在原子中,电子是体积最小、质量最轻的一种粒子。不同的原子含有的电子数目不同。例如,1个碳原子含有6个电子,1个氧原子含有8个电子。在多电子原子中,核外电子的能量是不同的。能量高的电子在离核较远的区域运动,能量低的电子在离核较近的区域运动。通常把电子在离核远近不同的区域运动称为电子的分层排布。
在化学反应中,原子核是不变的,发生改变的只是原子核外的电子。原子失去电子后变成带正电荷的阳离子,得到电子后变成带负电荷的阴离子。例如,钠原子(Na)失去1个电子,形成带1个单位正电荷的钠离子(Na+);氯原子(Cl)得到1个电子,形成带1个单位负电荷的氯离子(Cl-)。带相反电荷的钠离子和氯离子相互作用,就形成了新的物质——氯化钠(NaCl),它是食盐的主要成分。除氯化钠外,氧化镁(MgO)、氯化钾(KCl)等很多物质都是由离子构成的。
有些原子之间不是先转化成离子再构成物质的,而是原子之间直接结合形成分子,再由分子构成物质的。例如,1个氢原子(H)能与1个氯原子(Cl)结合,形成1个氯化氢分子(HCl),而1个氧原子(O)能与2个氢原子(H)结合,形成1个水分子(H2O)。
原子、分子、离子都是构成物质的微观粒子。
1.下列有关原子构成的叙述正确的是( )
A.原子是实心球体,不可以再分
B.原子的质量主要集中在原子核上
C.原子核由质子、中子和电子构成
D.原子不显电性是因为原子中不存在带电粒子
B
2.下列关于原子、分子、离子的认识不正确的是( )
A.原子和分子不带电,离子带电
B.原子得到或失去电子后变成离子
C.原子、分子和离子都能直接构成物质
D.原子不能直接结合形成分子
D
3. 2020年12月17日,嫦娥五号月球探测器圆满完成我国首次月球采样任务。科研人员发现带回的月壤中含有大量氦-3,它被视为核聚变的重要原料。氦-3原子核由两个质子和一个中子构成,如果用“●”“○”“·”分别表示质子、中子和电子,下列示意图能正确表示氦-3原子结构的是( )
A
4.我国化学家张青莲(1908-2006)在相对原子质量测定方面做出了创造性的贡献,他主持测定的铟(In)、铱(Ir)等十种元素的相对原子质量新值,被国际原子量委员会作为标准数据所采用。下列关于相对原子质量叙述正确的是( )
A.相对原子质量就是原子质量
B.两种原子的质量之比等于它们的相对原子质量之比
C.碳原子的相对原子质量是12g
D.采用相对原子质量,就是增大了原子的质量
B
谢谢观看
同课章节目录
