2016春人教版九年级化学下册课件:第十单元 实验活动6 酸、碱的化学性质(共23张PPT)
文档属性
| 名称 | 2016春人教版九年级化学下册课件:第十单元 实验活动6 酸、碱的化学性质(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-28 08:56:46 | ||
图片预览







文档简介
课件23张PPT。实验活动6
第十单元 酸和碱义务教育教科书(RJ)九年级化学下册
酸、碱的化学性质 在前面我们学习酸和碱的各化学性质时,大家都只是看到教师的演示实验,今天,让我们自己动手操作,来探究一下酸和碱的各项化学性质及酸碱的中和滴定实验。情境引入1.加深对酸和碱的主要性质的认识
2.通过实验解释生活的一些现象。实验目的
试管、药匙、蒸发皿、玻璃棒、
稀盐酸、稀硫酸、稀氢氧化钠溶液、
氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉实验用品
1.通过本单元的学习,我们认识了“酸”和“碱”请回答下列问题
(1)常见的酸 有 等,在它们的水溶液里由于存在相同的 (填符号) 因此,它们有很多相似的化学性质如:
(写两条即可)。
(2)常用的碱有 等 可作某些气体的干燥剂。在它们的水溶液里由于存在相同的 (填符号)因此,它们有很多相似的化学性质如: 。知识回顾:
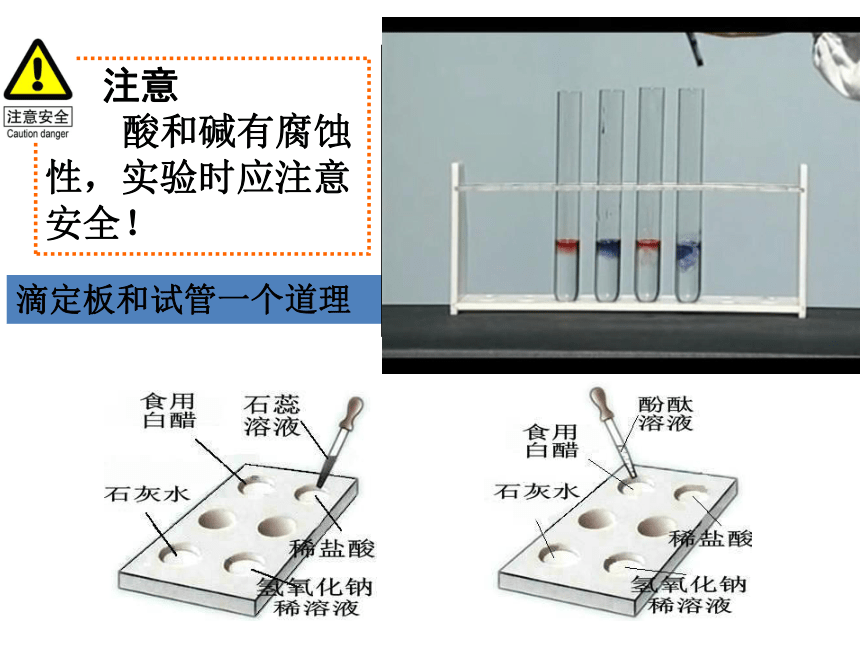
1. 酸和碱与指示剂的作用。实验步骤 注意
酸和碱有腐蚀
性,实验时应注意
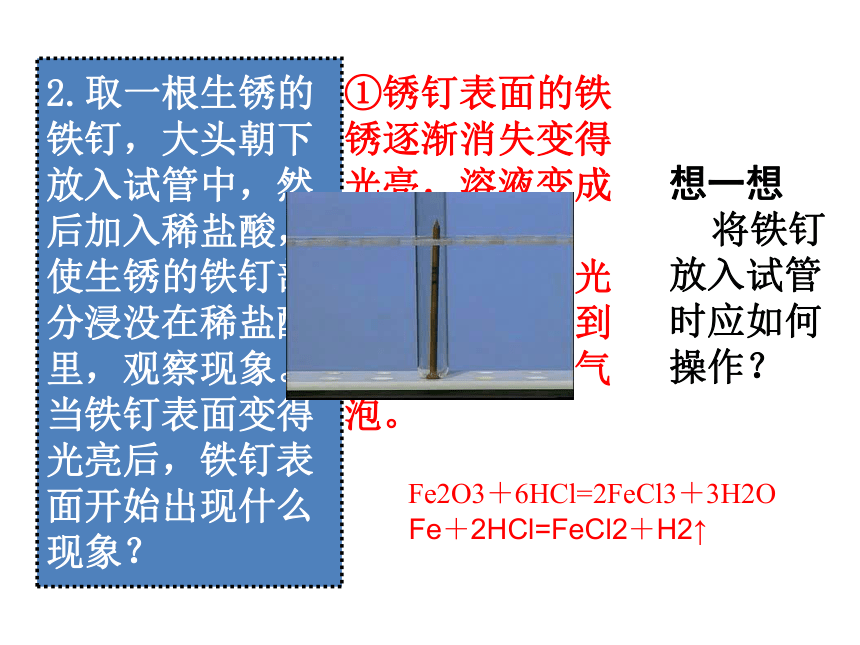
安全!滴定板和试管一个道理变成蓝色变成红色2.取一根生锈的
铁钉,大头朝下
放入试管中,然
后加入稀盐酸,
使生锈的铁钉部
分浸没在稀盐酸
里,观察现象。
当铁钉表面变得
光亮后,铁钉表
面开始出现什么
现象?①锈钉表面的铁
锈逐渐消失变得
光亮,溶液变成
黄色;
②当铁钉变得光
亮后,可观察到
铁钉表面出现气
泡。
想一想
将铁钉
放入试管
时应如何
操作?Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑ 3.在试管中加
入约2mL硫酸铜溶
液,然后滴入几滴
氢氧化钠溶液,观
察现象。然后再向
试管中加入稀盐酸
观察现象。硫酸铜和氢氧化钠反应氢氧化钠和硫酸铜反应产生不溶于水的蓝色沉淀,氢氧化铜不溶于水,但可以溶于盐酸中
1中出现蓝色沉淀,溶液由蓝色变为无色
2中蓝色沉淀消失,溶液由无色变为蓝色2NaOH+CuSO4==Na2SO4+Cu(OH)2↓
Cu(OH)2+2HCl==CuCl2+2H2O填一填 4.在一烧杯里
倒入少量氢氧化钠
的稀溶液,滴几滴
酚酞溶液,观察现
象。然后边用滴管
慢慢滴入稀盐酸,
边不断震荡烧杯,
至溶液颜色恰好变
为无色为止。取一
滴溶液在玻璃片上
置于酒精灯火焰上
烘烤,观察现象。①溶液呈红色;②玻璃片出现白色固体。HCl+NaOH=NaCl+H2O 5.取一小勺氢氧化钙放入一烧杯中,再将水
注入盛有氢氧化钙的烧杯中,并用玻璃棒搅拌,
观察现象。将石灰水置于两支试管中,分别滴入
紫色石蕊溶液和无色酚酞溶液,观察现象。将适
量(用药匙的柄把一端挑一点)的氢氧化钙粉末加
入一只洁净的试管中,再用胶头滴管吸取稀盐酸
加入这只试管中,震荡,观察现象。氢氧化钙的溶解性石灰水与酸碱指示剂的作用向氢氧化钙粉末中加入稀盐酸氢氧化钙和稀盐酸的反应Ca(OH)2 + 2HCl == CaCl2 + 2H2O 步骤1中试管中出现白色浑浊液体
步骤2中白色浑浊液体变为红色
步骤3中试管中仍然是红色浑浊液体
步骤4中红色浑浊液体变为无色澄清的溶液氢氧化钙能和稀盐酸发生中和反应,不需要加指示剂
也可以判断反应是否发生填一填①氢氧化钙不易溶于水,即微溶于水。②紫色石蕊溶液显示蓝色,无色酚酞
溶液显示红色。③氢氧化钙粉末逐渐溶解形成无色溶液。通过实验五:
可以验证氢氧化钙的那些性质? 1. 某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎么处理这些废水呢?你能写出化学方程式吗?巩固练习 2.小亮在做"盐酸中和氢氧化钠溶液“的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究:
〖探究目的〗探究所得溶液的酸碱性
〖提出猜想〗所得溶液可能呈碱性、也可能呈 性,还可能呈 性。
〖实验验证〗〖 分析与思考〗:
若无色酚酞溶液不变色,为了进一步确定溶液的酸碱性,小芳提出了以下方案:
方案一:________________________________________
方案二:________________________________________ 满
载
而
归这节课你收获了什么?交流共享及课堂感悟主要从酸和碱的化学性质的认识入手总结
小结实验中应该注意的事项
酸、碱的化学性质 在前面我们学习酸和碱的各化学性质时,大家都只是看到教师的演示实验,今天,让我们自己动手操作,来探究一下酸和碱的各项化学性质及酸碱的中和滴定实验。情境引入1.加深对酸和碱的主要性质的认识
2.通过实验解释生活的一些现象。实验目的
试管、药匙、蒸发皿、玻璃棒、
稀盐酸、稀硫酸、稀氢氧化钠溶液、
氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉实验用品
1.通过本单元的学习,我们认识了“酸”和“碱”请回答下列问题
(1)常见的酸 有 等,在它们的水溶液里由于存在相同的 (填符号) 因此,它们有很多相似的化学性质如:
(写两条即可)。
(2)常用的碱有 等 可作某些气体的干燥剂。在它们的水溶液里由于存在相同的 (填符号)因此,它们有很多相似的化学性质如: 。知识回顾:
1. 酸和碱与指示剂的作用。实验步骤 注意
酸和碱有腐蚀
性,实验时应注意
安全!滴定板和试管一个道理变成蓝色变成红色2.取一根生锈的
铁钉,大头朝下
放入试管中,然
后加入稀盐酸,
使生锈的铁钉部
分浸没在稀盐酸
里,观察现象。
当铁钉表面变得
光亮后,铁钉表
面开始出现什么
现象?①锈钉表面的铁
锈逐渐消失变得
光亮,溶液变成
黄色;
②当铁钉变得光
亮后,可观察到
铁钉表面出现气
泡。
想一想
将铁钉
放入试管
时应如何
操作?Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑ 3.在试管中加
入约2mL硫酸铜溶
液,然后滴入几滴
氢氧化钠溶液,观
察现象。然后再向
试管中加入稀盐酸
观察现象。硫酸铜和氢氧化钠反应氢氧化钠和硫酸铜反应产生不溶于水的蓝色沉淀,氢氧化铜不溶于水,但可以溶于盐酸中
1中出现蓝色沉淀,溶液由蓝色变为无色
2中蓝色沉淀消失,溶液由无色变为蓝色2NaOH+CuSO4==Na2SO4+Cu(OH)2↓
Cu(OH)2+2HCl==CuCl2+2H2O填一填 4.在一烧杯里
倒入少量氢氧化钠
的稀溶液,滴几滴
酚酞溶液,观察现
象。然后边用滴管
慢慢滴入稀盐酸,
边不断震荡烧杯,
至溶液颜色恰好变
为无色为止。取一
滴溶液在玻璃片上
置于酒精灯火焰上
烘烤,观察现象。①溶液呈红色;②玻璃片出现白色固体。HCl+NaOH=NaCl+H2O 5.取一小勺氢氧化钙放入一烧杯中,再将水
注入盛有氢氧化钙的烧杯中,并用玻璃棒搅拌,
观察现象。将石灰水置于两支试管中,分别滴入
紫色石蕊溶液和无色酚酞溶液,观察现象。将适
量(用药匙的柄把一端挑一点)的氢氧化钙粉末加
入一只洁净的试管中,再用胶头滴管吸取稀盐酸
加入这只试管中,震荡,观察现象。氢氧化钙的溶解性石灰水与酸碱指示剂的作用向氢氧化钙粉末中加入稀盐酸氢氧化钙和稀盐酸的反应Ca(OH)2 + 2HCl == CaCl2 + 2H2O 步骤1中试管中出现白色浑浊液体
步骤2中白色浑浊液体变为红色
步骤3中试管中仍然是红色浑浊液体
步骤4中红色浑浊液体变为无色澄清的溶液氢氧化钙能和稀盐酸发生中和反应,不需要加指示剂
也可以判断反应是否发生填一填①氢氧化钙不易溶于水,即微溶于水。②紫色石蕊溶液显示蓝色,无色酚酞
溶液显示红色。③氢氧化钙粉末逐渐溶解形成无色溶液。通过实验五:
可以验证氢氧化钙的那些性质? 1. 某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎么处理这些废水呢?你能写出化学方程式吗?巩固练习 2.小亮在做"盐酸中和氢氧化钠溶液“的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究:
〖探究目的〗探究所得溶液的酸碱性
〖提出猜想〗所得溶液可能呈碱性、也可能呈 性,还可能呈 性。
〖实验验证〗〖 分析与思考〗:
若无色酚酞溶液不变色,为了进一步确定溶液的酸碱性,小芳提出了以下方案:
方案一:________________________________________
方案二:________________________________________ 满
载
而
归这节课你收获了什么?交流共享及课堂感悟主要从酸和碱的化学性质的认识入手总结
小结实验中应该注意的事项
同课章节目录
