第三章第二节金属材料 课件 (共22张PPT) 人教版2019高中化学必修一
文档属性
| 名称 | 第三章第二节金属材料 课件 (共22张PPT) 人教版2019高中化学必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 24.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-20 14:31:33 | ||
图片预览







文档简介
(共22张PPT)
铝和氧化铝
第二节 金属材料
第二课时
铝、铝合金
氧化铝坩埚
刚玉
(氧化铝)
白刚玉
红刚玉
蓝刚玉
分析预测(推测)
实验探究
得出结论
铝、氧化铝有哪些性质?
(明确实验目标)
分析与预测 某种物质 具有的性质,一看 物质类别(分类),二看化合价(单质还可看 位构性)
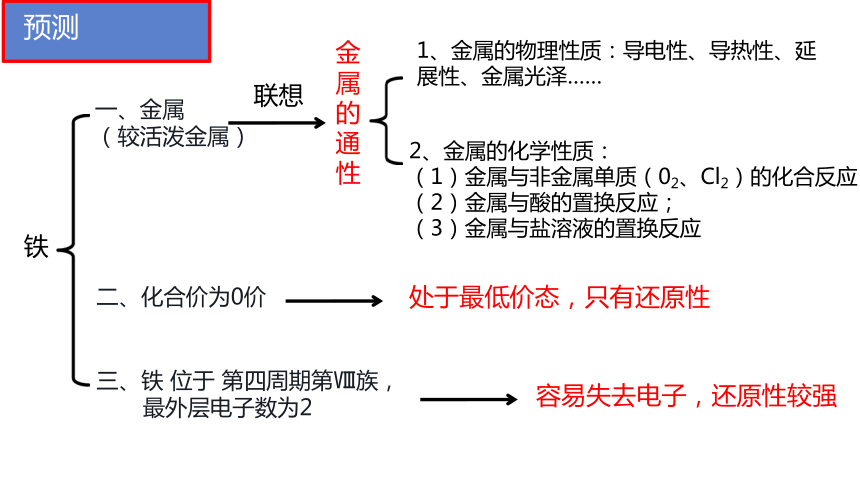
铁
一、金属
(较活泼金属)
二、化合价为0价
三、铁 位于 第四周期第Ⅷ族,
最外层电子数为2
联想
金
属
的
通
性
1、金属的物理性质:导电性、导热性、延展性、金属光泽……
2、金属的化学性质:
(1)金属与非金属单质(02、Cl2)的化合反应;
(2)金属与酸的置换反应;
(3)金属与盐溶液的置换反应
处于最低价态,只有还原性
容易失去电子,还原性较强
预测
刘波
铝
一、金属
(较活泼金属)
二、化合价为0价
三、铝 位于 第三周期第ⅢA族,
最外层电子数为3
联想
金
属
的
通
性
2、金属的化学性质:
(1)金属与非金属单质(02、Cl2)的化合反应;
(2)金属与酸的置换反应;
(3)金属与盐溶液的置换反应
处于最低价态,只有还原性
容易失去电子,还原性较强
1、金属的物理性质:导电性、导热性、延展性、金属光泽……
预测
位于金属与非金属的分界线(附近),既有金属性、也有非金属性
刘波
预测
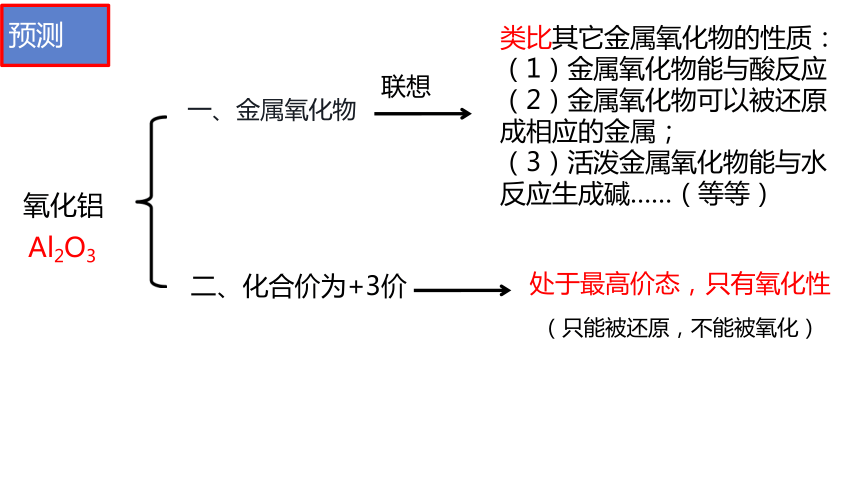
一、金属氧化物
氧化铝
Al2O3
联想
类比其它金属氧化物的性质:
(1)金属氧化物能与酸反应
(2)金属氧化物可以被还原成相应的金属;
(3)活泼金属氧化物能与水反应生成碱……(等等)
二、化合价为+3价
处于最高价态,只有氧化性
(只能被还原,不能被氧化)
实验探究
铝和氧化铝
【 实验3-4】 在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
铝、氧化铝的性质——与酸反应
记录实验现象
开始不太明显,后铝片_________,有无色气泡冒出,将点燃的木条放在试管口有_______
逐渐溶解
爆鸣声
铝和氧化铝
铝、氧化铝的性质——与酸反应
分析实验
化学方程式
离子方程式
Al2O3+6HCl===2AlCl3+3H2O、2Al+6HCl===2AlCl3+3H2↑
Al2O3+6H+===2Al3++3H2O、2Al+6H+===2Al3++3H2↑
铝和氧化铝
铝、氧化铝的性质——与酸反应
实验探究
铝和氧化铝
铝、氧化铝的性质——与碱反应
【实验3—5】 在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。(对比试验)观察现象。过一段时间后,将点燃的木条分别放在两支试管口。你观察到什么现象
记录实验现象
试管①中一开始无气泡产生,一段时间后,铝片______,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有_______
溶解
爆鸣声
铝和氧化铝
铝、氧化铝的性质——与碱反应
分析实验
Al2O3+2NaOH+3H2O===2Na[Al(OH)4]
( Al2O3+2OH-+3H2O===2[Al(OH)4]- )
铝和氧化铝
铝、氧化铝的性质——与碱反应
(四羟基合铝酸钠)
2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
(2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑)
原理运用
铝制餐具为何不宜用来蒸煮或长时间存放酸性或碱性食品?
由于Al和Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
(一)铝单质
1. 铝元素是地壳中含量最多的金属元素
2. 化学性质活泼,常温下就能与氧气反应,生成一层致密氧化铝薄膜
拓展:
3. 铝与酸的反应
(1) 铝与稀 H2SO4、HCl等(非氧化性酸)反应:
(2) 铝与稀硝酸(氧化性酸)反应:
(3) 铝与浓硝酸、浓硫酸:钝化(不加热时)
教师归纳拓展
4. 铝与强碱的反应(铝的特殊性):
注意:铝是唯一能与碱反应的金属,但只和强碱反应,不与弱碱反应(如氨水)。
5. 铝的制备:铝在地壳中主要以铝土矿 (又称矾土) 等矿物形式存在,提纯Al2O3 后,用 电解法 制备铝.
2Al+2NaOH+6H2O=== 2Na[Al(OH)4]+3H2↑
(四羟基合铝酸钠)
偏铝酸钠
2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
教师归纳拓展
6、铝热反应:
(二)氧化铝
1. 氧化铝是白色固体,熔点高,硬度大,难溶于水
2. 氧化铝(Al2O3 )是两性氧化物:Al2O3 既能与强酸反应生成盐和水,也能和强碱反应生成盐和水,属于两性氧化物
①Al2O3 与强酸反应:
②Al2O3 与强碱反应:
(氧化铝的特殊性)
注意: 氧化铝只能和强碱反应,不和弱碱反应。
3. Al2O3 的用途:①制耐火材料 ②冶炼铝
Al2O3+2NaOH+3H2O===2Na[Al(OH)4]
教师归纳拓展
Al(OH)3溶于盐酸:_________________________________________
Al(OH)3溶于NaOH溶液:____________________________________
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,如Al(OH)3
Al(OH)3+3HCl===AlCl3+3H2O
Al(OH)3+NaOH===Na[Al(OH)4]
(三)、氢氧化铝
教师归纳拓展
两性氢氧化物:
教师归纳拓展
Al是非常特殊的金属,关于铝、氧化铝和氢氧化铝,牢记有两性。
Al
具有金属性和非金属性
既能和酸反应,也能和碱反应
Al2O3
两性氧化物
既能和酸反应,也能和碱反应
Al(OH)3
两性氢氧化物
既能和酸反应,也能和碱反应
铝和氧化铝
第二节 金属材料
第二课时
铝、铝合金
氧化铝坩埚
刚玉
(氧化铝)
白刚玉
红刚玉
蓝刚玉
分析预测(推测)
实验探究
得出结论
铝、氧化铝有哪些性质?
(明确实验目标)
分析与预测 某种物质 具有的性质,一看 物质类别(分类),二看化合价(单质还可看 位构性)
铁
一、金属
(较活泼金属)
二、化合价为0价
三、铁 位于 第四周期第Ⅷ族,
最外层电子数为2
联想
金
属
的
通
性
1、金属的物理性质:导电性、导热性、延展性、金属光泽……
2、金属的化学性质:
(1)金属与非金属单质(02、Cl2)的化合反应;
(2)金属与酸的置换反应;
(3)金属与盐溶液的置换反应
处于最低价态,只有还原性
容易失去电子,还原性较强
预测
刘波
铝
一、金属
(较活泼金属)
二、化合价为0价
三、铝 位于 第三周期第ⅢA族,
最外层电子数为3
联想
金
属
的
通
性
2、金属的化学性质:
(1)金属与非金属单质(02、Cl2)的化合反应;
(2)金属与酸的置换反应;
(3)金属与盐溶液的置换反应
处于最低价态,只有还原性
容易失去电子,还原性较强
1、金属的物理性质:导电性、导热性、延展性、金属光泽……
预测
位于金属与非金属的分界线(附近),既有金属性、也有非金属性
刘波
预测
一、金属氧化物
氧化铝
Al2O3
联想
类比其它金属氧化物的性质:
(1)金属氧化物能与酸反应
(2)金属氧化物可以被还原成相应的金属;
(3)活泼金属氧化物能与水反应生成碱……(等等)
二、化合价为+3价
处于最高价态,只有氧化性
(只能被还原,不能被氧化)
实验探究
铝和氧化铝
【 实验3-4】 在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
铝、氧化铝的性质——与酸反应
记录实验现象
开始不太明显,后铝片_________,有无色气泡冒出,将点燃的木条放在试管口有_______
逐渐溶解
爆鸣声
铝和氧化铝
铝、氧化铝的性质——与酸反应
分析实验
化学方程式
离子方程式
Al2O3+6HCl===2AlCl3+3H2O、2Al+6HCl===2AlCl3+3H2↑
Al2O3+6H+===2Al3++3H2O、2Al+6H+===2Al3++3H2↑
铝和氧化铝
铝、氧化铝的性质——与酸反应
实验探究
铝和氧化铝
铝、氧化铝的性质——与碱反应
【实验3—5】 在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。(对比试验)观察现象。过一段时间后,将点燃的木条分别放在两支试管口。你观察到什么现象
记录实验现象
试管①中一开始无气泡产生,一段时间后,铝片______,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有_______
溶解
爆鸣声
铝和氧化铝
铝、氧化铝的性质——与碱反应
分析实验
Al2O3+2NaOH+3H2O===2Na[Al(OH)4]
( Al2O3+2OH-+3H2O===2[Al(OH)4]- )
铝和氧化铝
铝、氧化铝的性质——与碱反应
(四羟基合铝酸钠)
2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
(2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑)
原理运用
铝制餐具为何不宜用来蒸煮或长时间存放酸性或碱性食品?
由于Al和Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
(一)铝单质
1. 铝元素是地壳中含量最多的金属元素
2. 化学性质活泼,常温下就能与氧气反应,生成一层致密氧化铝薄膜
拓展:
3. 铝与酸的反应
(1) 铝与稀 H2SO4、HCl等(非氧化性酸)反应:
(2) 铝与稀硝酸(氧化性酸)反应:
(3) 铝与浓硝酸、浓硫酸:钝化(不加热时)
教师归纳拓展
4. 铝与强碱的反应(铝的特殊性):
注意:铝是唯一能与碱反应的金属,但只和强碱反应,不与弱碱反应(如氨水)。
5. 铝的制备:铝在地壳中主要以铝土矿 (又称矾土) 等矿物形式存在,提纯Al2O3 后,用 电解法 制备铝.
2Al+2NaOH+6H2O=== 2Na[Al(OH)4]+3H2↑
(四羟基合铝酸钠)
偏铝酸钠
2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
教师归纳拓展
6、铝热反应:
(二)氧化铝
1. 氧化铝是白色固体,熔点高,硬度大,难溶于水
2. 氧化铝(Al2O3 )是两性氧化物:Al2O3 既能与强酸反应生成盐和水,也能和强碱反应生成盐和水,属于两性氧化物
①Al2O3 与强酸反应:
②Al2O3 与强碱反应:
(氧化铝的特殊性)
注意: 氧化铝只能和强碱反应,不和弱碱反应。
3. Al2O3 的用途:①制耐火材料 ②冶炼铝
Al2O3+2NaOH+3H2O===2Na[Al(OH)4]
教师归纳拓展
Al(OH)3溶于盐酸:_________________________________________
Al(OH)3溶于NaOH溶液:____________________________________
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,如Al(OH)3
Al(OH)3+3HCl===AlCl3+3H2O
Al(OH)3+NaOH===Na[Al(OH)4]
(三)、氢氧化铝
教师归纳拓展
两性氢氧化物:
教师归纳拓展
Al是非常特殊的金属,关于铝、氧化铝和氢氧化铝,牢记有两性。
Al
具有金属性和非金属性
既能和酸反应,也能和碱反应
Al2O3
两性氧化物
既能和酸反应,也能和碱反应
Al(OH)3
两性氢氧化物
既能和酸反应,也能和碱反应
