4.1.1 定量认识空气的组成 课件 (共23张PPT)2024-2025学年化学鲁教版九年级上册
文档属性
| 名称 | 4.1.1 定量认识空气的组成 课件 (共23张PPT)2024-2025学年化学鲁教版九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-20 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
能设计实验并准确测得空气中氧气的含量,在实验过程中体会从混合气体中除去某种气体进而测定其含量的方法。
猜 谜
又无影来又无形,
巧笔丹青画不成。
三国之中助一阵,
从古到今留美名。
—风(即空气流动的现象)
空气与我们朝夕相伴,离开了空气我们将无法生存,你了解空气的组成吗?人类在探索空气组成的道路上经历了怎样的历程?
18世纪中叶以前,人们把空气看作是一种单一成分的物质。
18世纪70年代,法国化学家拉瓦锡通过实验得出“空气由氧气和氮气组成”的结论。
19世纪末,英国物理学家瑞利与化学家拉姆齐合作,发现了氩气。之后其他稀有气体陆续被发现。
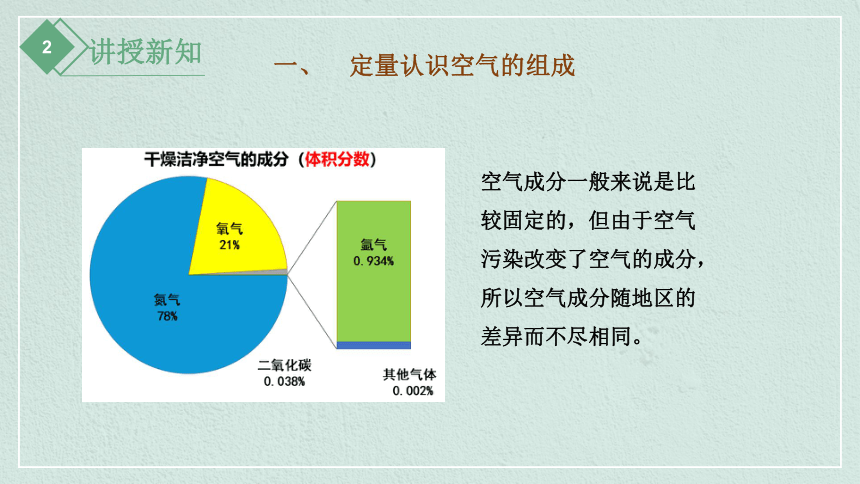
一、 定量认识空气的组成
空气成分一般来说是比较固定的,但由于空气污染改变了空气的成分,所以空气成分随地区的差异而不尽相同。
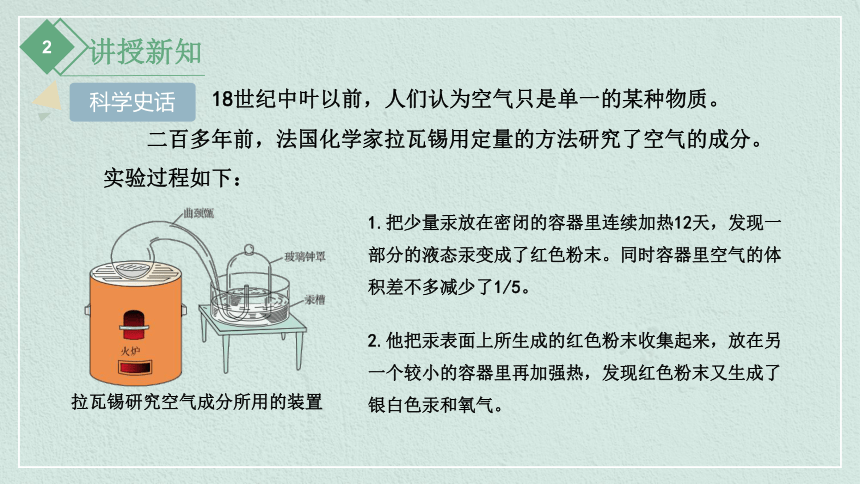
18世纪中叶以前,人们认为空气只是单一的某种物质。
二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。实验过程如下:
1.把少量汞放在密闭的容器里连续加热12天,发现一部分的液态汞变成了红色粉末。同时容器里空气的体积差不多减少了1/5。
拉瓦锡研究空气成分所用的装置
2.他把汞表面上所生成的红色粉末收集起来,放在另一个较小的容器里再加强热,发现红色粉末又生成了银白色汞和氧气。
科学史话
3.他把得到的氧气加入到前一个容器中剩余的4/5的气体中,得到的气体与空气的性质完全一样。
4.拉瓦锡还研究了剩余4/5气体的成分,发现它既不供给呼吸,也不支持燃烧,他认为这部分气体都是氮气。
通过上述实验,拉瓦锡得出了结论:
空气由氮气和氧气组成,其中氧气约占空气总体积的1/5。
直到19世纪末,英国物理学家瑞利和拉姆齐合作发现了稀有气体氩,之后各个稀有气体陆续被发现。
法国化学家拉瓦锡的贡献
汞 + 氧气 氧化汞(红色粉末)
加热
拉瓦锡通过实验得出空气由氧气和氮气组成
空气中约含1/5体积的氧气,你能通过实验测定空气中氧气的含量吗?
思路1:将其他气体除去,只剩下氧气,测定氧气体积。
思路2:将氧气除去,然后通过减少的体积来测定氧气的体积。
思考与交流
√
实验探究4-1 测定空气中氧气的含量
选择实验药品的依据
①木炭 + 氧气 二氧化碳
固 气 气
②铜 + 氧气 氧化铜
固 气 固
★
★
①所选物质只能与氧气反应,而不与其他气体反应;
②生成物为固体。
③磷 + 氧气 五氧化二磷
固 气 固
④镁 + 氧气 氧化镁
固 气 固
(也与氮气发生反应)
点燃
点燃
点燃
点燃
利用加热铜粉消耗密闭容器内的氧气而不产生新的气体。在加热的情况下,红色铜粉能跟空气中的氧气反应,生成黑色的氧化铜。
实验原理
文字表达式
铜
+ 氧气
氧化铜
加热
实验探究4-1 测定空气中氧气的含量
(1)装置不能漏气;
(2)加热时温度高一些,时间稍长一些;
(3)铜粉要足量;
(4)加热时要不断推拉注射器的活塞;
(5)冷却至室温将气球内的气体全部挤入注射器内。
实验成功的关键
①测量硬质玻璃管的容积。
②按图连接好装置,检查装置的气密性。
③在另一支干燥的硬质玻璃管中装入铜粉,塞上橡胶塞,一端用小气球密封。
④移动注射器活塞,在注射器中留下一定体积的气体,记录体积后插入橡胶塞中。
⑤根据酒精灯的高度,将硬质玻璃管固定在铁架台上。
⑥点燃酒精灯,先预热,后对准有铜粉的部位加热
⑦同时不断推拉注射器活塞。
⑧停止加热后,待试管冷却至室温,将气球内的气体全部挤入注射器内。待注射器活塞稳定后,记录注射器中气体的体积。
实验步骤
1.小气球的作用是什么
2.实验中不断推拉注射器的原因是什么
加热时,气体受热膨胀,为防止塞子冲出,小气球起缓冲作用。
使空气流动,氧气与铜粉充分接触,保证铜粉与氧气充分反应。
实验现象
红色物质加热后变成黑色物质,冷却至室温后,注射器内气体的体积减少了原体积的1/5
思考与交流
空气中氧气的体积约占空气体积的1/5
实验结论
空气是一种混合物
间接结论
空气中氮气约占空气总体积的4/5
氮气在加热条件下不与铜反应
如图所示,若实验前测得V1为60mL, V2为20mL,实验完毕后,在正常情况下消耗掉氧气约 mL。
16
V1
V2
①铜粉要足量,如果铜粉量不足,测得空气中氧气的体积分数是偏大还是偏小?
②装置必须密封,若密封不好,测得空气中氧气的体积分数是偏大还是偏小?
③加热时温度要高一些,时间要长一些,否则,测得空气中氧气的体积分数是偏大还是偏小?
偏小
偏小
偏小
思考与交流
④冷却至室温后,将气球内的气体全部挤入注射器。
若未冷却至室温就读取剩余气体的体积,测得空气中氧气的体积分数是偏大还是偏小?
若玻璃管冷却后,气球内的体积没有全部挤出,测得空气中氧气的体积分数是偏大还是偏小?
偏小
偏大
思考与交流
除了铜粉之外,我们还可以用红磷、白磷等测定空气中氧气的含量,一些测定装置如图,试着说出它们的优缺点
水
········
········
太阳光
白磷
(白磷的着火点是40℃,红磷的着火点是260℃)
思维扩展
注意:
①装置必须密封好,不能漏气;
②红磷必须足量,完全消耗掉集气瓶内的氧气;
③不能用木炭、硫粉等代替红磷。
④实验前,要夹紧弹簧夹。
实验现象:红磷燃烧,产生大量白烟,烧杯中的水倒流进集气瓶,液面上升约为集气瓶容积的1/5。
实验结论:①氧气约占空气体积的1/5;
②氮气不能燃烧,也不支持燃烧(不与红磷反应),且不溶于水。
偏大
偏小
偏小
产生气体
1.空气中按体积计算,含量最多的气体是( )
A. 氧气 B. 氮气 C. 二氧化碳 D. 稀有气体
2.在100升空气里氧气的体积大约是( )
A.78升 B.78% C.21升 D.1%
3.空气中氧气与氮气的体积比约为( )
A. 4:1 B. 1:4 C. 1:5 D. 5:1
B
C
B
4.欲除去密闭容器中空气中的氧气,且不产生其它气体,可选用的物质是( )
A.红磷 B.铝粉 C.铁丝 D.木炭
A
5.用如图所示的实验测定空气中氧气的含量,下列操作会使测定结果偏大的是( )
A.装置漏气
B.药匙中放入的红磷量不足
C.点燃红磷伸入瓶中时,没有立即塞紧瓶塞
D.红磷燃烧结束后,没等装置冷却就打开弹簧夹
C
6.以下四个实验装置,可用于“测定空气中氧气的含量”。请认真分析,回答下列问题。
(1)拉瓦锡用装置 (填写字母)定量研究了空气的成分,在密闭容器中,空气中的氧气与____反应,生成固态物质。人们沿着科学家的足迹,对反应物进行了优化,分别用铜粉、红磷等进行实验,其原理都是采用______(填“物理”或“化学”)方法,从混合气体中除去某种气体,从而达到物质的分离。
A
汞
化学
(2)实验过程中,需要不断推拉注射器活塞的装置是 (填写字母),利用此装置进行实验,可能造成实验误差的因素是 (答一条)。
(3)装置C、D的实验都用到了红磷,写出反应的文字表达式
________________________;反应结束后,待装置冷却至室温,打开弹簧夹,装置D中(试管容积为40mL),注射器活塞从10mL刻度处缓慢移动至 mL刻度处停止(误差忽略不计)。
B
反应前后气球的体积不相等
2
磷+氧气
五氧化二磷
点燃
能设计实验并准确测得空气中氧气的含量,在实验过程中体会从混合气体中除去某种气体进而测定其含量的方法。
猜 谜
又无影来又无形,
巧笔丹青画不成。
三国之中助一阵,
从古到今留美名。
—风(即空气流动的现象)
空气与我们朝夕相伴,离开了空气我们将无法生存,你了解空气的组成吗?人类在探索空气组成的道路上经历了怎样的历程?
18世纪中叶以前,人们把空气看作是一种单一成分的物质。
18世纪70年代,法国化学家拉瓦锡通过实验得出“空气由氧气和氮气组成”的结论。
19世纪末,英国物理学家瑞利与化学家拉姆齐合作,发现了氩气。之后其他稀有气体陆续被发现。
一、 定量认识空气的组成
空气成分一般来说是比较固定的,但由于空气污染改变了空气的成分,所以空气成分随地区的差异而不尽相同。
18世纪中叶以前,人们认为空气只是单一的某种物质。
二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。实验过程如下:
1.把少量汞放在密闭的容器里连续加热12天,发现一部分的液态汞变成了红色粉末。同时容器里空气的体积差不多减少了1/5。
拉瓦锡研究空气成分所用的装置
2.他把汞表面上所生成的红色粉末收集起来,放在另一个较小的容器里再加强热,发现红色粉末又生成了银白色汞和氧气。
科学史话
3.他把得到的氧气加入到前一个容器中剩余的4/5的气体中,得到的气体与空气的性质完全一样。
4.拉瓦锡还研究了剩余4/5气体的成分,发现它既不供给呼吸,也不支持燃烧,他认为这部分气体都是氮气。
通过上述实验,拉瓦锡得出了结论:
空气由氮气和氧气组成,其中氧气约占空气总体积的1/5。
直到19世纪末,英国物理学家瑞利和拉姆齐合作发现了稀有气体氩,之后各个稀有气体陆续被发现。
法国化学家拉瓦锡的贡献
汞 + 氧气 氧化汞(红色粉末)
加热
拉瓦锡通过实验得出空气由氧气和氮气组成
空气中约含1/5体积的氧气,你能通过实验测定空气中氧气的含量吗?
思路1:将其他气体除去,只剩下氧气,测定氧气体积。
思路2:将氧气除去,然后通过减少的体积来测定氧气的体积。
思考与交流
√
实验探究4-1 测定空气中氧气的含量
选择实验药品的依据
①木炭 + 氧气 二氧化碳
固 气 气
②铜 + 氧气 氧化铜
固 气 固
★
★
①所选物质只能与氧气反应,而不与其他气体反应;
②生成物为固体。
③磷 + 氧气 五氧化二磷
固 气 固
④镁 + 氧气 氧化镁
固 气 固
(也与氮气发生反应)
点燃
点燃
点燃
点燃
利用加热铜粉消耗密闭容器内的氧气而不产生新的气体。在加热的情况下,红色铜粉能跟空气中的氧气反应,生成黑色的氧化铜。
实验原理
文字表达式
铜
+ 氧气
氧化铜
加热
实验探究4-1 测定空气中氧气的含量
(1)装置不能漏气;
(2)加热时温度高一些,时间稍长一些;
(3)铜粉要足量;
(4)加热时要不断推拉注射器的活塞;
(5)冷却至室温将气球内的气体全部挤入注射器内。
实验成功的关键
①测量硬质玻璃管的容积。
②按图连接好装置,检查装置的气密性。
③在另一支干燥的硬质玻璃管中装入铜粉,塞上橡胶塞,一端用小气球密封。
④移动注射器活塞,在注射器中留下一定体积的气体,记录体积后插入橡胶塞中。
⑤根据酒精灯的高度,将硬质玻璃管固定在铁架台上。
⑥点燃酒精灯,先预热,后对准有铜粉的部位加热
⑦同时不断推拉注射器活塞。
⑧停止加热后,待试管冷却至室温,将气球内的气体全部挤入注射器内。待注射器活塞稳定后,记录注射器中气体的体积。
实验步骤
1.小气球的作用是什么
2.实验中不断推拉注射器的原因是什么
加热时,气体受热膨胀,为防止塞子冲出,小气球起缓冲作用。
使空气流动,氧气与铜粉充分接触,保证铜粉与氧气充分反应。
实验现象
红色物质加热后变成黑色物质,冷却至室温后,注射器内气体的体积减少了原体积的1/5
思考与交流
空气中氧气的体积约占空气体积的1/5
实验结论
空气是一种混合物
间接结论
空气中氮气约占空气总体积的4/5
氮气在加热条件下不与铜反应
如图所示,若实验前测得V1为60mL, V2为20mL,实验完毕后,在正常情况下消耗掉氧气约 mL。
16
V1
V2
①铜粉要足量,如果铜粉量不足,测得空气中氧气的体积分数是偏大还是偏小?
②装置必须密封,若密封不好,测得空气中氧气的体积分数是偏大还是偏小?
③加热时温度要高一些,时间要长一些,否则,测得空气中氧气的体积分数是偏大还是偏小?
偏小
偏小
偏小
思考与交流
④冷却至室温后,将气球内的气体全部挤入注射器。
若未冷却至室温就读取剩余气体的体积,测得空气中氧气的体积分数是偏大还是偏小?
若玻璃管冷却后,气球内的体积没有全部挤出,测得空气中氧气的体积分数是偏大还是偏小?
偏小
偏大
思考与交流
除了铜粉之外,我们还可以用红磷、白磷等测定空气中氧气的含量,一些测定装置如图,试着说出它们的优缺点
水
········
········
太阳光
白磷
(白磷的着火点是40℃,红磷的着火点是260℃)
思维扩展
注意:
①装置必须密封好,不能漏气;
②红磷必须足量,完全消耗掉集气瓶内的氧气;
③不能用木炭、硫粉等代替红磷。
④实验前,要夹紧弹簧夹。
实验现象:红磷燃烧,产生大量白烟,烧杯中的水倒流进集气瓶,液面上升约为集气瓶容积的1/5。
实验结论:①氧气约占空气体积的1/5;
②氮气不能燃烧,也不支持燃烧(不与红磷反应),且不溶于水。
偏大
偏小
偏小
产生气体
1.空气中按体积计算,含量最多的气体是( )
A. 氧气 B. 氮气 C. 二氧化碳 D. 稀有气体
2.在100升空气里氧气的体积大约是( )
A.78升 B.78% C.21升 D.1%
3.空气中氧气与氮气的体积比约为( )
A. 4:1 B. 1:4 C. 1:5 D. 5:1
B
C
B
4.欲除去密闭容器中空气中的氧气,且不产生其它气体,可选用的物质是( )
A.红磷 B.铝粉 C.铁丝 D.木炭
A
5.用如图所示的实验测定空气中氧气的含量,下列操作会使测定结果偏大的是( )
A.装置漏气
B.药匙中放入的红磷量不足
C.点燃红磷伸入瓶中时,没有立即塞紧瓶塞
D.红磷燃烧结束后,没等装置冷却就打开弹簧夹
C
6.以下四个实验装置,可用于“测定空气中氧气的含量”。请认真分析,回答下列问题。
(1)拉瓦锡用装置 (填写字母)定量研究了空气的成分,在密闭容器中,空气中的氧气与____反应,生成固态物质。人们沿着科学家的足迹,对反应物进行了优化,分别用铜粉、红磷等进行实验,其原理都是采用______(填“物理”或“化学”)方法,从混合气体中除去某种气体,从而达到物质的分离。
A
汞
化学
(2)实验过程中,需要不断推拉注射器活塞的装置是 (填写字母),利用此装置进行实验,可能造成实验误差的因素是 (答一条)。
(3)装置C、D的实验都用到了红磷,写出反应的文字表达式
________________________;反应结束后,待装置冷却至室温,打开弹簧夹,装置D中(试管容积为40mL),注射器活塞从10mL刻度处缓慢移动至 mL刻度处停止(误差忽略不计)。
B
反应前后气球的体积不相等
2
磷+氧气
五氧化二磷
点燃
同课章节目录
