4.3 氧气的实验室制取 课件 (共33张PPT)2024-2025学年化学鲁教版九年级上册
文档属性
| 名称 | 4.3 氧气的实验室制取 课件 (共33张PPT)2024-2025学年化学鲁教版九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-20 21:09:21 | ||
图片预览








文档简介
(共33张PPT)
1.初步学习探究氧气制取实验的操作;
2.知道实验室制取氧气的药品、原理、装置、操作、气体收集及其方案选择;
3.认识催化剂和催化作用。
氧气有这么多重要的用途,氧气又是怎样制得的?
供给呼吸
支持燃烧
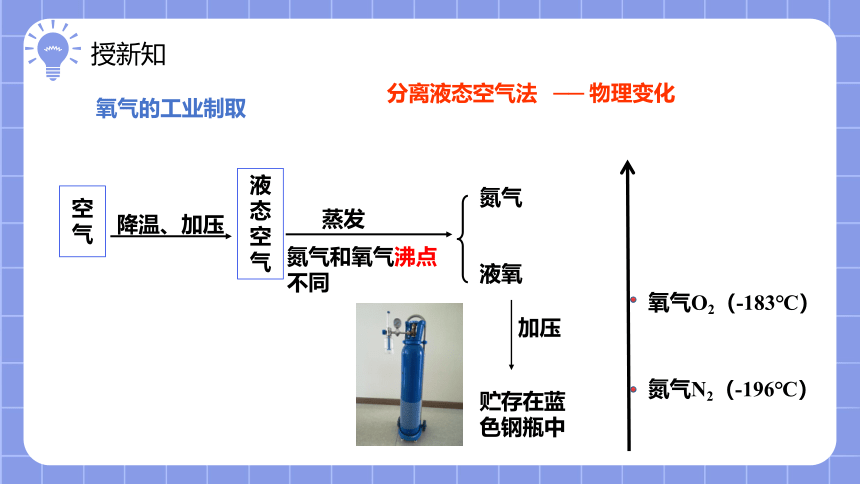
氧气的工业制取
分离液态空气法
加压
空气
液态空气
降温、加压
蒸发
氮气
液氧
氮气和氧气沸点不同
贮存在蓝色钢瓶中
── 物理变化
氮气N2(-196℃)
氧气O2(-183℃)
方法2 :分离液态空气法
通电
水 氢气+氧气
方法1:
实验室中制取气体一般要求安全快捷,经济,操作方便。
需要消耗大量的电能,反应速度慢。
流程、设备很复杂,成本高
实验室制取气体物质的思路分析
1.反应物是否容易获得
2. 实验条件是否容易控制
3.实验装置是否容易装配
4.实验操作是否安全可靠
5.选择气体发生装置和收集装置的依据
一、氧气的实验室制法
交流共享
(1)你认为下列哪些物质可作为实验室制取氧气的物质?
①水( H2O ) ②二氧化碳(CO2)
③食盐(主要成分为NaCl) ④高锰酸钾(KMnO4)
⑤过氧化氢( H2O2) ⑥甲烷(CH4)
⑦氯酸钾(KClO3)
√
√
√
1.反应物是否容易获得
水要消耗大量的电能,氯化钠、甲烷组成中不含氧,二氧化碳中氧不易变成氧气
(2)某同学认为:实验室制取气体的化学反应,应考虑以下几方面的因素。
A.原料是否容易获得 B.实验条件是否容易控制
C.实验装置是否容易装配 D.实验操作是否安全可靠
你是否同意他的观点 _______。
你还考虑了哪些因素?
2.实验条件是否容易控制
是否对环境造成污染、节约能源等。
同意
3.选择气体发生装置和收集装置的依据
气体发生装置的选择依据:
①反应物的状态(固体还是液体);
②反应的条件(是否需要加热)。
气体收集装置的选择依据:
①气体的溶解性;
②气体的密度(跟空气比较)。
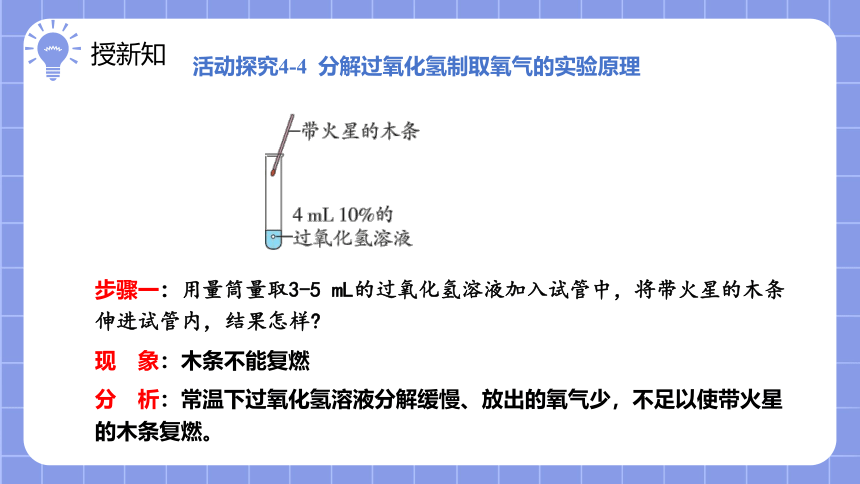
步骤一:用量筒量取3-5 mL的过氧化氢溶液加入试管中,将带火星的木条伸进试管内,结果怎样
现 象:木条不能复燃
分 析:常温下过氧化氢溶液分解缓慢、放出的氧气少,不足以使带火星的木条复燃。
活动探究4-4 分解过氧化氢制取氧气的实验原理
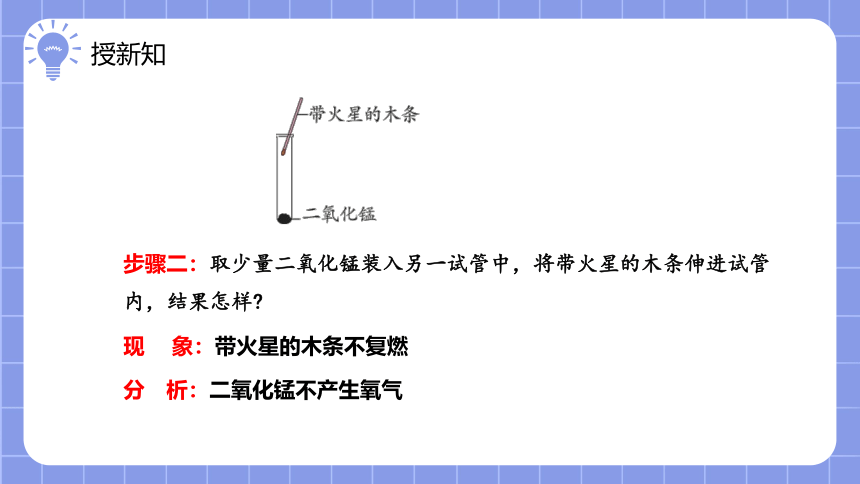
步骤二:取少量二氧化锰装入另一试管中,将带火星的木条伸进试管内,结果怎样
现 象:带火星的木条不复燃
分 析:二氧化锰不产生氧气
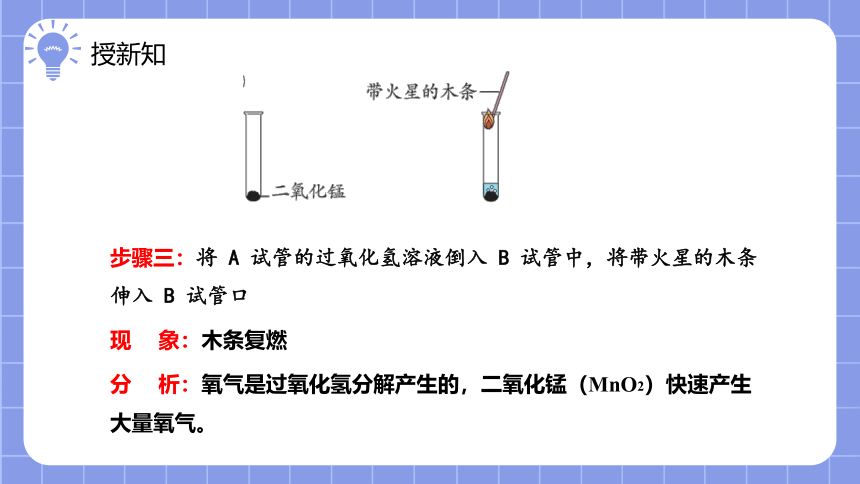
步骤三:将 A 试管的过氧化氢溶液倒入 B 试管中,将带火星的木条伸入 B 试管口
现 象:木条复燃
分 析:氧气是过氧化氢分解产生的,二氧化锰(MnO2)快速产生大量氧气。
步骤四: 待 B 试管中的现象不明显后,小心将上部液体倒出,再加入 3 ~5 mL 过氧化氢溶液,将带火星的木条伸入试管口
现 象:木条复燃
分 析:氧气是过氧化氢分解产生的,加入二氧化锰(MnO2)只是起加快产生氧气的作用。
活动分析:常温下过氧化氢溶液分解很慢,放出的氧气很少。加入二氧化锰后加速了过氧化氢溶液的分解,放出的氧气使带火星的木条复燃。
此反应中,二氧化锰既不是反应物也不是生成物,是催化剂,是反应条件,所以写在箭头的上方。
过氧化氢 水+氧气
H2O2 H2O O2
二氧化锰
(文字表达式)
1.催化剂
(1)催化剂:能改变其他物质的化学反应的速率,而本身的质量和化学性质,在反应前后都没有变化的物质叫催化剂。
(2)催化剂的特点:“一变” “二不变” 。
①“一变”:改变其他物质的化学反应速率。
(改变:可以是加快、也可以是减慢)
②“二不变”:本身的质量和化学性质都没有改变。
2.催化作用:催化剂在化学反应中所起的作用叫催化作用。
催化剂和催化作用
1.有了催化剂是否可以使生成物质量增加呢?
2.没有催化剂反应能否进行呢?
3.MnO2 是催化剂,这种说法对吗?
4.是否可用其他的物质代替二氧化锰作为过氧化氢分解的催化剂?
不能,只是改变反应的速率。
能进行,但反应速率较慢或不能进行。
不对,在过氧化氢分解制氧气的反应中二氧化锰是催化剂。
可以,比如可以用氧化铜、氧化铁等代替。
思考与交流
气体发生装置的设计原则:
1.根据反应物质的状态;
2.反应条件。
活动探究4-5 确定气体发生装置与收集装置
固体二氧化锰与过氧化氢溶液混合制取氧气的反应不需要加热
装置
特点
固液常温型
①便于添加液体反应物
②节约药品
③便于控制反应
便于随时添加液体反应物
①装置简单
②不便于添加反应物
分液漏斗
长颈漏斗
锥形瓶
气体收集装置的设计原则:
2.根据气体的密度。
1.根据气体的溶解性;
排水法
向上排空气法
向下排空气法
密度比空气大的气体
密度比空气小的气体
难溶于水或不易溶于水且不与水反应的气体
排空气法和排水法收集气体的比较
(1)排水法比排空气法收集的气体纯净,但含有一定的水蒸气,气体不干燥。
(2)排空气法收集的气体会含有一定的空气,不纯净,但收集到的气体比较干燥。
用排空气法和排水法虽然都能收集到氧气,但两种收集方法各有利弊。
知识归纳
过氧化氢溶液制取氧气的装置
或
简易装置
3.收集气体并检验
1.组装仪器,检查装置的气密性
2.加药品(先加固体后加液体)
关闭分液漏斗活塞,将导管放入水中,双手捂住锥形瓶,若导管口有气泡冒出,说明装置气密性良好。
检验方法:将带火星的木条伸入集气瓶内,如果木条复燃,则说明该气体就是氧气。
活动探究4-6 实验室用过氧化氢制取氧气
排空气法: 将带火星的木条放在集气瓶口,如果木条复燃,则说明氧气已经满了。
排水法: 集气瓶里的水完全排净,集气瓶口冒出大气泡,说明氧气已经满了。
验满
注意事项
(2)排水法收集氧气时,当导管口有均匀连续的气泡冒出时才开始收集。
(3)用向上排空气法收集气体时,导管口要接近集气瓶底部,为了使空气能排干净。
(1)长颈漏斗的下端管口必须伸到液面以下, 防止生成的气体从长颈漏斗口逸出。导管刚露出胶塞一点即可,使气体能顺利导出 。
(4)收集好的氧气正放在桌面上。
1.原理:高锰酸钾 锰酸钾+二氧化锰 + 氧气
加热
KMnO4 K2MnO4 MnO2 O2
加热高锰酸钾制取氧气
2.装置:
(1)在上图所示装置中,使用了哪些仪器?
(2)哪部分是气体发生装置,哪部分是气体收集装置?
编号 现象 原因
(1) 导管口有气泡冒出 分解产生气体
(2) 带火星的木条复燃 瓶中气体是氧气
能否用过氧化氢制氧气的装置来用于氯酸钾制氧气
为什么呢?
不 能
因为反应物的状态和反应条件不同
思考与交流
用过氧化氢制氧气发生装置的优点
(1)简单,易操作;
(2)不用加热,较安全;
(3)节约药品(可根据需要随时补充);
(4)分液漏斗可控制反应速率。
1.某同学设计了4种制氧气的方案:①氯酸钾和二氧化锰共热;②高锰酸钾受热;③高锰酸钾和氯酸钾共热;④二氧化锰受热。判断这四种方法( )
A.全正确 B.全不正确
C.①②③正确 D.只有①②正确
2.实验室用氯酸钾和二氧化锰混合加热制氧气,反应前后二氧化锰在固体混合物中质量分数是( )
A.由大到小 B.由小到大
C.不变 D.无法判断
B
C
3.在化学反应中,催化剂( )
A.质量减少
B.在化学反应后化学性质发生了变化
C.能使生成物的质量增加
D.能改变化学反应的速率
4.下列有关催化剂的说法正确的是( )
A.催化剂就是用来加快化学反应速率的
B.二氧化锰是催化剂
C.没有二氧化锰的催化,过氧化氢也能分解放出氧气
D.催化剂在化学反应前后的性质不变
D
C
5.实验室制取氧气,下列说法错误的是( )
A.装置①可用于高锰酸钾制取氧气
B.装置②可用于过氧化氢溶液制取氧气
C.装置③可用于收集氧气
D.装置④可用于收集氧气
C
6.两份质量相等的过氧化氢,在其中一份中加入少量二氧化锰,放出氧气的质量(纵坐标)与反应时间(横坐标)的关系正确的是( )
7.加热高锰酸钾制取氧气,刚产生气体时,试管内剩余固体种类( )
A.2种 B.3种 C.4种 D.5种
C
B
8.实验室中,利用下图所示装置可以制取某些气体,请回答下列问题。
(1)写出图中标号仪器的名称:①______;②_______;
(2)用过氧化氢和二氧化锰制取O2应选用的发生装置是_____(填字母,下同),要制取一瓶干燥的氧气最好选用的收集装置是____。
试管
集气瓶
B
C
1.初步学习探究氧气制取实验的操作;
2.知道实验室制取氧气的药品、原理、装置、操作、气体收集及其方案选择;
3.认识催化剂和催化作用。
氧气有这么多重要的用途,氧气又是怎样制得的?
供给呼吸
支持燃烧
氧气的工业制取
分离液态空气法
加压
空气
液态空气
降温、加压
蒸发
氮气
液氧
氮气和氧气沸点不同
贮存在蓝色钢瓶中
── 物理变化
氮气N2(-196℃)
氧气O2(-183℃)
方法2 :分离液态空气法
通电
水 氢气+氧气
方法1:
实验室中制取气体一般要求安全快捷,经济,操作方便。
需要消耗大量的电能,反应速度慢。
流程、设备很复杂,成本高
实验室制取气体物质的思路分析
1.反应物是否容易获得
2. 实验条件是否容易控制
3.实验装置是否容易装配
4.实验操作是否安全可靠
5.选择气体发生装置和收集装置的依据
一、氧气的实验室制法
交流共享
(1)你认为下列哪些物质可作为实验室制取氧气的物质?
①水( H2O ) ②二氧化碳(CO2)
③食盐(主要成分为NaCl) ④高锰酸钾(KMnO4)
⑤过氧化氢( H2O2) ⑥甲烷(CH4)
⑦氯酸钾(KClO3)
√
√
√
1.反应物是否容易获得
水要消耗大量的电能,氯化钠、甲烷组成中不含氧,二氧化碳中氧不易变成氧气
(2)某同学认为:实验室制取气体的化学反应,应考虑以下几方面的因素。
A.原料是否容易获得 B.实验条件是否容易控制
C.实验装置是否容易装配 D.实验操作是否安全可靠
你是否同意他的观点 _______。
你还考虑了哪些因素?
2.实验条件是否容易控制
是否对环境造成污染、节约能源等。
同意
3.选择气体发生装置和收集装置的依据
气体发生装置的选择依据:
①反应物的状态(固体还是液体);
②反应的条件(是否需要加热)。
气体收集装置的选择依据:
①气体的溶解性;
②气体的密度(跟空气比较)。
步骤一:用量筒量取3-5 mL的过氧化氢溶液加入试管中,将带火星的木条伸进试管内,结果怎样
现 象:木条不能复燃
分 析:常温下过氧化氢溶液分解缓慢、放出的氧气少,不足以使带火星的木条复燃。
活动探究4-4 分解过氧化氢制取氧气的实验原理
步骤二:取少量二氧化锰装入另一试管中,将带火星的木条伸进试管内,结果怎样
现 象:带火星的木条不复燃
分 析:二氧化锰不产生氧气
步骤三:将 A 试管的过氧化氢溶液倒入 B 试管中,将带火星的木条伸入 B 试管口
现 象:木条复燃
分 析:氧气是过氧化氢分解产生的,二氧化锰(MnO2)快速产生大量氧气。
步骤四: 待 B 试管中的现象不明显后,小心将上部液体倒出,再加入 3 ~5 mL 过氧化氢溶液,将带火星的木条伸入试管口
现 象:木条复燃
分 析:氧气是过氧化氢分解产生的,加入二氧化锰(MnO2)只是起加快产生氧气的作用。
活动分析:常温下过氧化氢溶液分解很慢,放出的氧气很少。加入二氧化锰后加速了过氧化氢溶液的分解,放出的氧气使带火星的木条复燃。
此反应中,二氧化锰既不是反应物也不是生成物,是催化剂,是反应条件,所以写在箭头的上方。
过氧化氢 水+氧气
H2O2 H2O O2
二氧化锰
(文字表达式)
1.催化剂
(1)催化剂:能改变其他物质的化学反应的速率,而本身的质量和化学性质,在反应前后都没有变化的物质叫催化剂。
(2)催化剂的特点:“一变” “二不变” 。
①“一变”:改变其他物质的化学反应速率。
(改变:可以是加快、也可以是减慢)
②“二不变”:本身的质量和化学性质都没有改变。
2.催化作用:催化剂在化学反应中所起的作用叫催化作用。
催化剂和催化作用
1.有了催化剂是否可以使生成物质量增加呢?
2.没有催化剂反应能否进行呢?
3.MnO2 是催化剂,这种说法对吗?
4.是否可用其他的物质代替二氧化锰作为过氧化氢分解的催化剂?
不能,只是改变反应的速率。
能进行,但反应速率较慢或不能进行。
不对,在过氧化氢分解制氧气的反应中二氧化锰是催化剂。
可以,比如可以用氧化铜、氧化铁等代替。
思考与交流
气体发生装置的设计原则:
1.根据反应物质的状态;
2.反应条件。
活动探究4-5 确定气体发生装置与收集装置
固体二氧化锰与过氧化氢溶液混合制取氧气的反应不需要加热
装置
特点
固液常温型
①便于添加液体反应物
②节约药品
③便于控制反应
便于随时添加液体反应物
①装置简单
②不便于添加反应物
分液漏斗
长颈漏斗
锥形瓶
气体收集装置的设计原则:
2.根据气体的密度。
1.根据气体的溶解性;
排水法
向上排空气法
向下排空气法
密度比空气大的气体
密度比空气小的气体
难溶于水或不易溶于水且不与水反应的气体
排空气法和排水法收集气体的比较
(1)排水法比排空气法收集的气体纯净,但含有一定的水蒸气,气体不干燥。
(2)排空气法收集的气体会含有一定的空气,不纯净,但收集到的气体比较干燥。
用排空气法和排水法虽然都能收集到氧气,但两种收集方法各有利弊。
知识归纳
过氧化氢溶液制取氧气的装置
或
简易装置
3.收集气体并检验
1.组装仪器,检查装置的气密性
2.加药品(先加固体后加液体)
关闭分液漏斗活塞,将导管放入水中,双手捂住锥形瓶,若导管口有气泡冒出,说明装置气密性良好。
检验方法:将带火星的木条伸入集气瓶内,如果木条复燃,则说明该气体就是氧气。
活动探究4-6 实验室用过氧化氢制取氧气
排空气法: 将带火星的木条放在集气瓶口,如果木条复燃,则说明氧气已经满了。
排水法: 集气瓶里的水完全排净,集气瓶口冒出大气泡,说明氧气已经满了。
验满
注意事项
(2)排水法收集氧气时,当导管口有均匀连续的气泡冒出时才开始收集。
(3)用向上排空气法收集气体时,导管口要接近集气瓶底部,为了使空气能排干净。
(1)长颈漏斗的下端管口必须伸到液面以下, 防止生成的气体从长颈漏斗口逸出。导管刚露出胶塞一点即可,使气体能顺利导出 。
(4)收集好的氧气正放在桌面上。
1.原理:高锰酸钾 锰酸钾+二氧化锰 + 氧气
加热
KMnO4 K2MnO4 MnO2 O2
加热高锰酸钾制取氧气
2.装置:
(1)在上图所示装置中,使用了哪些仪器?
(2)哪部分是气体发生装置,哪部分是气体收集装置?
编号 现象 原因
(1) 导管口有气泡冒出 分解产生气体
(2) 带火星的木条复燃 瓶中气体是氧气
能否用过氧化氢制氧气的装置来用于氯酸钾制氧气
为什么呢?
不 能
因为反应物的状态和反应条件不同
思考与交流
用过氧化氢制氧气发生装置的优点
(1)简单,易操作;
(2)不用加热,较安全;
(3)节约药品(可根据需要随时补充);
(4)分液漏斗可控制反应速率。
1.某同学设计了4种制氧气的方案:①氯酸钾和二氧化锰共热;②高锰酸钾受热;③高锰酸钾和氯酸钾共热;④二氧化锰受热。判断这四种方法( )
A.全正确 B.全不正确
C.①②③正确 D.只有①②正确
2.实验室用氯酸钾和二氧化锰混合加热制氧气,反应前后二氧化锰在固体混合物中质量分数是( )
A.由大到小 B.由小到大
C.不变 D.无法判断
B
C
3.在化学反应中,催化剂( )
A.质量减少
B.在化学反应后化学性质发生了变化
C.能使生成物的质量增加
D.能改变化学反应的速率
4.下列有关催化剂的说法正确的是( )
A.催化剂就是用来加快化学反应速率的
B.二氧化锰是催化剂
C.没有二氧化锰的催化,过氧化氢也能分解放出氧气
D.催化剂在化学反应前后的性质不变
D
C
5.实验室制取氧气,下列说法错误的是( )
A.装置①可用于高锰酸钾制取氧气
B.装置②可用于过氧化氢溶液制取氧气
C.装置③可用于收集氧气
D.装置④可用于收集氧气
C
6.两份质量相等的过氧化氢,在其中一份中加入少量二氧化锰,放出氧气的质量(纵坐标)与反应时间(横坐标)的关系正确的是( )
7.加热高锰酸钾制取氧气,刚产生气体时,试管内剩余固体种类( )
A.2种 B.3种 C.4种 D.5种
C
B
8.实验室中,利用下图所示装置可以制取某些气体,请回答下列问题。
(1)写出图中标号仪器的名称:①______;②_______;
(2)用过氧化氢和二氧化锰制取O2应选用的发生装置是_____(填字母,下同),要制取一瓶干燥的氧气最好选用的收集装置是____。
试管
集气瓶
B
C
同课章节目录
