福建省厦门第一中学2024-2025学年高一上学期10月月考 化学试卷(PDF版,无答案)
文档属性
| 名称 | 福建省厦门第一中学2024-2025学年高一上学期10月月考 化学试卷(PDF版,无答案) |

|
|
| 格式 | |||
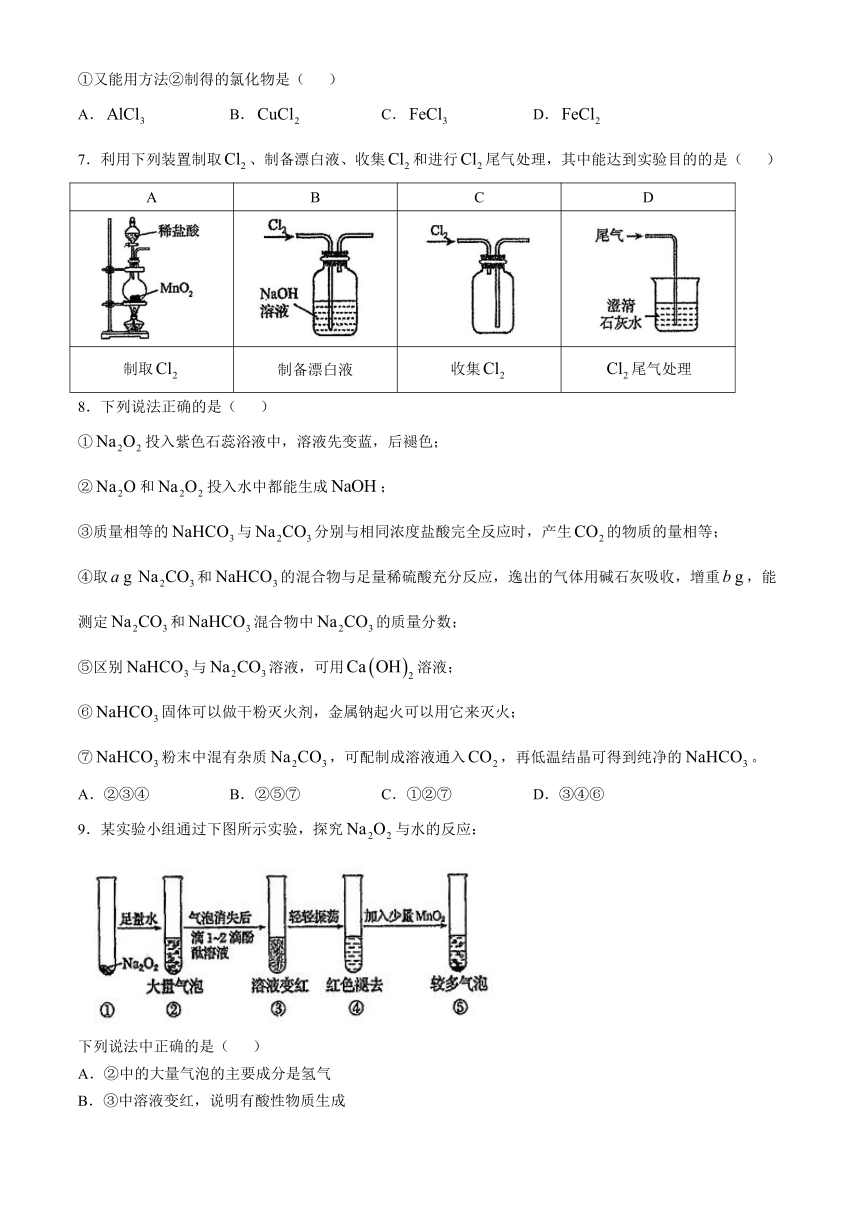
| 文件大小 | 402.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-20 23:27:35 | ||
图片预览



文档简介
厦门一中 2024—2025学年第一学期高一年 10月适应性训练
化学科
说明:本试卷满分 100分,考试时间 75分钟。
相对原子质量:H:1 B:11 C:12 O:16 Na:23 Al:27 S:32 Cl:35.5
一、选择题(本题共 14小题,每小题 3分,共 42分,每小题只有一个选项符合题意)
1.下列科技成果不属于化学成就的是( )
A.美国科学家罗杰发现“真核转录的分子基础”,获得诺贝尔奖。
B.我国研制的二十四面体铂纳米晶粒催化剂比传统铂催化剂的催化效率高 4倍。
C.美国科学家约翰等发现“宇宙微波背景辐射的黑体形式”,获得诺贝尔奖。
D.我国纳润公司用高分子材料生产的“隐形手套”,可保护人手不被浓硫酸腐蚀。
2.下列关于钠及化合物的叙述中,不正确的是( )
A.高压钠灯可用于道路照明 B.金属钠着火,可用泡沫灭火器灭火
C.NaHCO3可用作抗酸药 D.Na 2O2 可用作呼吸面具供氧剂
3.按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“酸
性氧化物—酸—碱—盐”顺序排列的是( )
A.NO2 、HNO3、Ba OH 2 、KNO3
B.CO2、H2CO3、NaOH、Ca HCO3 2
C.CO、HCl、Mg OH 2、MgCl2
D.NO、NaHSO4、NaOH、Na 2SO4
4 1.下列溶液中,Cl 的物质的量浓度与50 mL 3mol L NaCl溶液中Cl 物质的量浓度不相等的是( )
A.150 mL 3mol L 1 KCl溶液 B.150 mL 1mol L 1 AlCl3溶液
C 50 mL 3mol L 1. MgCl2 溶液 D.75 mL 1.5 mol L
1 MgCl2 溶液
5. NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,32 g O2中所含电子的数目为16NA
B. 28 g C2H4和C4H8 的混合气体中,含有的H原子个数为4NA
C 1.物质的量浓度为0.5 mol L 的MgCl2 溶液中,含有Cl
个数为 NA
D.标准状况下,11.2 L CCl4中含有分子的数目为0.5NA
6.制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得。既能用方法
①又能用方法②制得的氯化物是( )
A.AlCl3 B.CuCl2 C.FeCl3 D.FeCl2
7.利用下列装置制取Cl2、制备漂白液、收集Cl2和进行Cl2尾气处理,其中能达到实验目的的是( )
A B C D
制取Cl2 制备漂白液 收集Cl2 Cl2尾气处理
8.下列说法正确的是( )
①Na 2O2 投入紫色石蕊浴液中,溶液先变蓝,后褪色;
②Na 2O和Na 2O2 投入水中都能生成NaOH;
③质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的量相等;
④取 a g Na2CO3和NaHCO3的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰吸收,增重b g,能
测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数;
⑤区别NaHCO3与Na2CO3溶液,可用Ca OH 2 溶液;
⑥NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑦NaHCO3粉末中混有杂质Na2CO3,可配制成溶液通入CO2,再低温结晶可得到纯净的NaHCO3。
A.②③④ B.②⑤⑦ C.①②⑦ D.③④⑥
9.某实验小组通过下图所示实验,探究Na 2O2 与水的反应:
下列说法中正确的是( )
A.②中的大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有漂白性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
10.某同学购买了一瓶84消毒液,包装说明如下,下列分析不正确的是( )
净含量:500 mL
密度:1.19 g cm 3
主要成分:25% NaClO
使用方法:稀释100倍(体积比)后使用
注意事项:密封保存,易吸收空气中的CO2变质
A.84消毒液保存时不能口放置,需要密封保存
B.该84消毒液中NaClO 1的物质的量浓度约为 4 mol L
C.取100 mL 该84消毒稀释到体积为原来的100倍后用以消毒,稀释后的溶液中 c Na 约为
0.04 mol L 1
D.用NaClO固体配制含 25% NaClO的消毒液500 mL,需要称量的NaClO固体质量为142.8 g
11.同温同压下,质量相同的CO2、H2 、O2、CH4 、SO2 五种气体,下列说法错误的是( )
A.所占的体积由大到小的顺序是:H2 CH4 O2 CO2 SO2
B.所含分子由多到少的顺序是:H2 CH4 O2 CO2 SO2
C.所含的电子由多到少的顺序是:SO2 CO2 O2 CH4 H2
D.密度由大到小的顺序是:SO2 CO2 O2 CH4 H2
12.磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品。已知:1mol磷酸、
亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3 mol、 2 mol、1mol。下列推断正确的是( )
A.次磷酸与氢氰化钠反应能生成3种盐 B.NaH2PO4 、NaH2PO3、NaH2PO2 都是酸式盐
C.Na3PO2是正盐 D.H3PO3 是二元酸
13.固体单质A和气体单质B在容积一定的密闭容器中恰好完全反应生成气体C,相同温度下测得容器内
压强不变,若产物气体C的密度是原气体密度的 4倍,则判断正确的是( )
A.生成物C中,A元素的质量分数为50%
B.反应前后的气体质量之比一定是1: 4
C.单质A、B的摩尔质量之比是1: 4
D.生成物C中A、B两元素的原子个数比为3:1
14.根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A.无法判断a中溶液是否为饱和溶液
B. c中溶液溶质的质量分数为33.3%
C. b中溶液在加热过程中始终为饱和溶液
D.常用冷却热的饱和浴液的方法获得氯化钠晶体
二、填空题(本题包括 4小题,共 58分)
15.((21分)
Ⅰ.按要求写出下列相关反应的化学方程式。
(1)碳酸钠中滴加少量盐酸________________________________________
(2)过氧化钠和二氧化碳反应______________________________________
(3)氯气与水反应________________________________________________
(4)工业制备漂白粉的原理________________________________________
(5)漂白液在空气中起作用________________________________________
Ⅱ.利用氯元素价类二维图可以从不同角度研究含氯物质的性质及其转化关系。图中①~⑩均含氯元素。
回答下列问题:
(6)实验室制备气体单质①的化学方程式为_________________________。
(7)用玻璃棒蘸取①的饱和溶液滴在 pH试纸中部,观察到的现象如图所示:
使pH试纸变红的微粒X是________,使 pH试纸变白的微粒Y是________。(填微粒符号)
(8)④的化学式为________,________(填“属于”或“不属于”)酸性氧化物。
(9)工业制备②的方程式为:____________________,某一淡黄色粉末与⑥相似,也具有漂白性,这种粉
末能与②的水溶液反应生成⑧,请写出该反应的化学方程式____________________。
(10)比较等浓度的⑥和⑦溶液的酸性强弱________(填“可以”或“不可以”)用 pH试纸分别测定。
16.(16分)
利用“化学计量在实验中的应用”的相关知识进行填空:
(1)有一类物质的结构似“鸟巢”,如化学式为B5H9的五硼烷(见图)。含有 4.214 10
24个原子的五硼烷
的质量为________。
北京奥运会主体育场模 B5H9五硼烷
(2)在同温同压下,CO和CO2两种气体,密度比为________,若两者质量相等,其体积比为________。
(3)V L Al2 SO 3 2 4 3溶液中含有Al m g,若把此溶液取一半加水稀释至2V L,则稀释后溶液中SO4
的物质的量浓度为________。
(4)30 g RO2 3 中,核外电子总数比质子总数多6.02 10
23
个,则R 的摩尔质量为________。
3
(5)市售浓盐酸( 1.2 g cm )的质量分数约为36.5%,则该盐酸的物质的量浓度为________mol L 1
(结果保留一位小数),相当于在1L水中溶解标准状况下________L(结果保留整数)的HCl气体。现用
1.2 mol L 1的稀盐酸500 mL,应量取该市售浓盐酸________mL进行配制。
17.(7分)
现有m g含有Na 2O与Na 2O2 的混合物样品,某同学在实验室用如图装置(部分夹持仪器已省略)
测定Na 2O2 含量:
回答下列问题:
(1)Na 2O2 中阳离子与阴离子的个数之比为________。
(2)装置B有一明显错误,请指出________。
(3)装置D的作用是________;若无装置 D,样品中Na 2O2 的质量分数________(填“偏高”“偏低”或
“无影响”)。
(4)某学生设计了以下实验方案来测定该产品中Na 2O的质量分数,其操作流程和实验数据如图:
该氧化钠产品中Na 2O的质量分数为________。
18.(14分)
在抗击新冠肺炎疫情的战役中,84消毒液发挥着重要作用。实验小组对其进行研究。
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5% 6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发
生变性反应时变为白色固体物质。
③ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:
(1)反应①的化学方程式为______________________。
Ⅱ.探究84消毒液
实验 1:在鸡蛋清中加入不同浓度的消毒液,静置15 min现象如表:
序号 1-1 1-2 1-3 1-4
实验
操作
实验 实验液体表面产生大 液体中产生大量白色 液体中产生少量 液体中产生极少量白
现象 量气泡,无其他现象 固体 白色固体 色固体
实验 2:探究84消毒液漂白性的影响因素:
序号 2-1 2-2
取烧杯倒入30 mL浓度为1:100的84消
取四个烧杯,分别倒入30 mL浓度为1:100的
实验
操作 毒液,将烧杯放置在距离光源10 cm处进 84消毒液,并置于 20℃、30℃、40℃、50℃
ORP 水溶中加热,测量ORP变化行光照,测量 变化
测量
数据
【解释与结论】
(2)实验 1的目的是______________________。
(3)实验 2得出影响84消毒液失效的因素是______________________。
【反思与评价】
(4)生活中,84消毒液不能与洁厕灵(主要成分是浓盐酸)混合使用,其原因用化学方程式表示为
____________________________________________。
Ⅲ.定量检测某品牌84消毒液样品中NaClO的质量分数(不考虑消毒液中NaClO以外的物质与浓盐酸反
应)
实验过程:
①连接装置并检查气密性;②准确称量10 g“84消毒液”样品;③装药品,调节量气装置两边液面相平,
读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥________,视线与量气管凹液面相平并读取
数值。
(5)补全步骤⑤中的操作_________________________________________________。
(6)装置B的作用是________,D中试剂是________(填字母序号)。
a.碱石灰 b.浓硫酸 c.硫酸铜
1
(7)若其它操作均正确,测得产生氯气 216 mL(此时Vm 24.0 L mol )则此样品中NaClO的质量分
数为_______________(结果保留一位小数)。
化学科
说明:本试卷满分 100分,考试时间 75分钟。
相对原子质量:H:1 B:11 C:12 O:16 Na:23 Al:27 S:32 Cl:35.5
一、选择题(本题共 14小题,每小题 3分,共 42分,每小题只有一个选项符合题意)
1.下列科技成果不属于化学成就的是( )
A.美国科学家罗杰发现“真核转录的分子基础”,获得诺贝尔奖。
B.我国研制的二十四面体铂纳米晶粒催化剂比传统铂催化剂的催化效率高 4倍。
C.美国科学家约翰等发现“宇宙微波背景辐射的黑体形式”,获得诺贝尔奖。
D.我国纳润公司用高分子材料生产的“隐形手套”,可保护人手不被浓硫酸腐蚀。
2.下列关于钠及化合物的叙述中,不正确的是( )
A.高压钠灯可用于道路照明 B.金属钠着火,可用泡沫灭火器灭火
C.NaHCO3可用作抗酸药 D.Na 2O2 可用作呼吸面具供氧剂
3.按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“酸
性氧化物—酸—碱—盐”顺序排列的是( )
A.NO2 、HNO3、Ba OH 2 、KNO3
B.CO2、H2CO3、NaOH、Ca HCO3 2
C.CO、HCl、Mg OH 2、MgCl2
D.NO、NaHSO4、NaOH、Na 2SO4
4 1.下列溶液中,Cl 的物质的量浓度与50 mL 3mol L NaCl溶液中Cl 物质的量浓度不相等的是( )
A.150 mL 3mol L 1 KCl溶液 B.150 mL 1mol L 1 AlCl3溶液
C 50 mL 3mol L 1. MgCl2 溶液 D.75 mL 1.5 mol L
1 MgCl2 溶液
5. NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,32 g O2中所含电子的数目为16NA
B. 28 g C2H4和C4H8 的混合气体中,含有的H原子个数为4NA
C 1.物质的量浓度为0.5 mol L 的MgCl2 溶液中,含有Cl
个数为 NA
D.标准状况下,11.2 L CCl4中含有分子的数目为0.5NA
6.制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得。既能用方法
①又能用方法②制得的氯化物是( )
A.AlCl3 B.CuCl2 C.FeCl3 D.FeCl2
7.利用下列装置制取Cl2、制备漂白液、收集Cl2和进行Cl2尾气处理,其中能达到实验目的的是( )
A B C D
制取Cl2 制备漂白液 收集Cl2 Cl2尾气处理
8.下列说法正确的是( )
①Na 2O2 投入紫色石蕊浴液中,溶液先变蓝,后褪色;
②Na 2O和Na 2O2 投入水中都能生成NaOH;
③质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的量相等;
④取 a g Na2CO3和NaHCO3的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰吸收,增重b g,能
测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数;
⑤区别NaHCO3与Na2CO3溶液,可用Ca OH 2 溶液;
⑥NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑦NaHCO3粉末中混有杂质Na2CO3,可配制成溶液通入CO2,再低温结晶可得到纯净的NaHCO3。
A.②③④ B.②⑤⑦ C.①②⑦ D.③④⑥
9.某实验小组通过下图所示实验,探究Na 2O2 与水的反应:
下列说法中正确的是( )
A.②中的大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有漂白性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
10.某同学购买了一瓶84消毒液,包装说明如下,下列分析不正确的是( )
净含量:500 mL
密度:1.19 g cm 3
主要成分:25% NaClO
使用方法:稀释100倍(体积比)后使用
注意事项:密封保存,易吸收空气中的CO2变质
A.84消毒液保存时不能口放置,需要密封保存
B.该84消毒液中NaClO 1的物质的量浓度约为 4 mol L
C.取100 mL 该84消毒稀释到体积为原来的100倍后用以消毒,稀释后的溶液中 c Na 约为
0.04 mol L 1
D.用NaClO固体配制含 25% NaClO的消毒液500 mL,需要称量的NaClO固体质量为142.8 g
11.同温同压下,质量相同的CO2、H2 、O2、CH4 、SO2 五种气体,下列说法错误的是( )
A.所占的体积由大到小的顺序是:H2 CH4 O2 CO2 SO2
B.所含分子由多到少的顺序是:H2 CH4 O2 CO2 SO2
C.所含的电子由多到少的顺序是:SO2 CO2 O2 CH4 H2
D.密度由大到小的顺序是:SO2 CO2 O2 CH4 H2
12.磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品。已知:1mol磷酸、
亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3 mol、 2 mol、1mol。下列推断正确的是( )
A.次磷酸与氢氰化钠反应能生成3种盐 B.NaH2PO4 、NaH2PO3、NaH2PO2 都是酸式盐
C.Na3PO2是正盐 D.H3PO3 是二元酸
13.固体单质A和气体单质B在容积一定的密闭容器中恰好完全反应生成气体C,相同温度下测得容器内
压强不变,若产物气体C的密度是原气体密度的 4倍,则判断正确的是( )
A.生成物C中,A元素的质量分数为50%
B.反应前后的气体质量之比一定是1: 4
C.单质A、B的摩尔质量之比是1: 4
D.生成物C中A、B两元素的原子个数比为3:1
14.根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A.无法判断a中溶液是否为饱和溶液
B. c中溶液溶质的质量分数为33.3%
C. b中溶液在加热过程中始终为饱和溶液
D.常用冷却热的饱和浴液的方法获得氯化钠晶体
二、填空题(本题包括 4小题,共 58分)
15.((21分)
Ⅰ.按要求写出下列相关反应的化学方程式。
(1)碳酸钠中滴加少量盐酸________________________________________
(2)过氧化钠和二氧化碳反应______________________________________
(3)氯气与水反应________________________________________________
(4)工业制备漂白粉的原理________________________________________
(5)漂白液在空气中起作用________________________________________
Ⅱ.利用氯元素价类二维图可以从不同角度研究含氯物质的性质及其转化关系。图中①~⑩均含氯元素。
回答下列问题:
(6)实验室制备气体单质①的化学方程式为_________________________。
(7)用玻璃棒蘸取①的饱和溶液滴在 pH试纸中部,观察到的现象如图所示:
使pH试纸变红的微粒X是________,使 pH试纸变白的微粒Y是________。(填微粒符号)
(8)④的化学式为________,________(填“属于”或“不属于”)酸性氧化物。
(9)工业制备②的方程式为:____________________,某一淡黄色粉末与⑥相似,也具有漂白性,这种粉
末能与②的水溶液反应生成⑧,请写出该反应的化学方程式____________________。
(10)比较等浓度的⑥和⑦溶液的酸性强弱________(填“可以”或“不可以”)用 pH试纸分别测定。
16.(16分)
利用“化学计量在实验中的应用”的相关知识进行填空:
(1)有一类物质的结构似“鸟巢”,如化学式为B5H9的五硼烷(见图)。含有 4.214 10
24个原子的五硼烷
的质量为________。
北京奥运会主体育场模 B5H9五硼烷
(2)在同温同压下,CO和CO2两种气体,密度比为________,若两者质量相等,其体积比为________。
(3)V L Al2 SO 3 2 4 3溶液中含有Al m g,若把此溶液取一半加水稀释至2V L,则稀释后溶液中SO4
的物质的量浓度为________。
(4)30 g RO2 3 中,核外电子总数比质子总数多6.02 10
23
个,则R 的摩尔质量为________。
3
(5)市售浓盐酸( 1.2 g cm )的质量分数约为36.5%,则该盐酸的物质的量浓度为________mol L 1
(结果保留一位小数),相当于在1L水中溶解标准状况下________L(结果保留整数)的HCl气体。现用
1.2 mol L 1的稀盐酸500 mL,应量取该市售浓盐酸________mL进行配制。
17.(7分)
现有m g含有Na 2O与Na 2O2 的混合物样品,某同学在实验室用如图装置(部分夹持仪器已省略)
测定Na 2O2 含量:
回答下列问题:
(1)Na 2O2 中阳离子与阴离子的个数之比为________。
(2)装置B有一明显错误,请指出________。
(3)装置D的作用是________;若无装置 D,样品中Na 2O2 的质量分数________(填“偏高”“偏低”或
“无影响”)。
(4)某学生设计了以下实验方案来测定该产品中Na 2O的质量分数,其操作流程和实验数据如图:
该氧化钠产品中Na 2O的质量分数为________。
18.(14分)
在抗击新冠肺炎疫情的战役中,84消毒液发挥着重要作用。实验小组对其进行研究。
【查阅资料】
①84消毒液的有效成分为次氯酸钠(NaClO),有效含氯量5.5% 6.5%;NaClO溶液呈碱性。
②消毒杀菌的原理是使菌体蛋白质变性,变性程度越大,消毒液消毒杀菌效果越好。鸡蛋清中的蛋白质发
生变性反应时变为白色固体物质。
③ORP指84消毒液的漂白能力,ORP数值越大,84消毒液的漂白能力越强。
Ⅰ.制备84消毒液的有效成分NaClO
工业上能以食盐为原料制得次氯酸钠,其工业流程如图所示:
(1)反应①的化学方程式为______________________。
Ⅱ.探究84消毒液
实验 1:在鸡蛋清中加入不同浓度的消毒液,静置15 min现象如表:
序号 1-1 1-2 1-3 1-4
实验
操作
实验 实验液体表面产生大 液体中产生大量白色 液体中产生少量 液体中产生极少量白
现象 量气泡,无其他现象 固体 白色固体 色固体
实验 2:探究84消毒液漂白性的影响因素:
序号 2-1 2-2
取烧杯倒入30 mL浓度为1:100的84消
取四个烧杯,分别倒入30 mL浓度为1:100的
实验
操作 毒液,将烧杯放置在距离光源10 cm处进 84消毒液,并置于 20℃、30℃、40℃、50℃
ORP 水溶中加热,测量ORP变化行光照,测量 变化
测量
数据
【解释与结论】
(2)实验 1的目的是______________________。
(3)实验 2得出影响84消毒液失效的因素是______________________。
【反思与评价】
(4)生活中,84消毒液不能与洁厕灵(主要成分是浓盐酸)混合使用,其原因用化学方程式表示为
____________________________________________。
Ⅲ.定量检测某品牌84消毒液样品中NaClO的质量分数(不考虑消毒液中NaClO以外的物质与浓盐酸反
应)
实验过程:
①连接装置并检查气密性;②准确称量10 g“84消毒液”样品;③装药品,调节量气装置两边液面相平,
读数;④加入浓盐酸,当不再有气体生成;⑤冷却到室温;⑥________,视线与量气管凹液面相平并读取
数值。
(5)补全步骤⑤中的操作_________________________________________________。
(6)装置B的作用是________,D中试剂是________(填字母序号)。
a.碱石灰 b.浓硫酸 c.硫酸铜
1
(7)若其它操作均正确,测得产生氯气 216 mL(此时Vm 24.0 L mol )则此样品中NaClO的质量分
数为_______________(结果保留一位小数)。
同课章节目录
