【考点突破】专题05 分子和原子--人教版化学九年级上册期中真题专项练习(含答案)
文档属性
| 名称 | 【考点突破】专题05 分子和原子--人教版化学九年级上册期中真题专项练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 600.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-21 17:11:32 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
专题05 分子和原子
1.(2023九上·桐城期中)下列对宏观事实的微观解释,错误的是( )
A.墙内开花墙外香——分子是不断运动的
B.60000 L氧气在加压的情况下可装入容积为40L的钢瓶中——分子体积变小
C.氧气和液氧都能支持燃烧——物质的分子相同,其化学性质相同
D.水壶中的水烧开沸腾后,壶盖被顶起——水分子间的间隔增大
2.(2023九上·顺义期中)下列事实的微观解释不合理的是( )
A.CO和CO2化学性质不同一分子种类不同
B.干冰升华一分子体积变大
C.走过花圃闻到花香一分子在不断运动
D.一滴水中大约有1.67×1021个水分子一分子很小
3.(2020九上·西丰期中)从分子的角度解释下列事实,其中错误的是( )
A.热胀冷缩﹣﹣分子间有间隔
B.水结成冰﹣﹣分子停止运动
C.食物腐烂﹣﹣分子本身发生改变
D.一滴水中大约有1.67×1021个水分子﹣﹣分子很小
4.(2024九下·邵东期中)压瘪的乒乓球放入热水中重新鼓起来, 此过程中乒乓球内气体分子的( )
A.质量变大 B.体积变大 C.数目变多 D.间隔变大
5.(2023九上·慈利期中)从分子的角度分析并解释下列问题。
(1)氧气可用于抢救病人。保持氧气化学性质的最小粒子是 。
(2)过氧化氢溶液可用于消毒。构成过氧化氢的微粒是 。
(3)50mL的水和50mL的酒精混合后,总体积小于100mL: 。
(4)天气炎热时,更容易闻到花香: 。
6.(2023九上·蔡甸期中)物质是由各种微观粒子构成的。氩气的构成粒子是 ,铁的构成粒子是 ,五氧化二磷的构成粒子是 ,氯化钠的构成粒子是 。
7.(2023九上·南明期中)化学是在分子、原子层次上研究物质的科学。
(1)物质是由微观粒子构成的。请举例说明:
由分子构成的物质,例如 ;由原子构成的物质,例如 ;由离子构成的物质,例如 。
(2)微观粒子的性质:
①1滴水中大约有1.67×1021个水分子,说明 ;
②6000L氧气可装入容积为40L钢瓶中,说明 ;
③温度越高,分子运动速率越快,举例说明 。
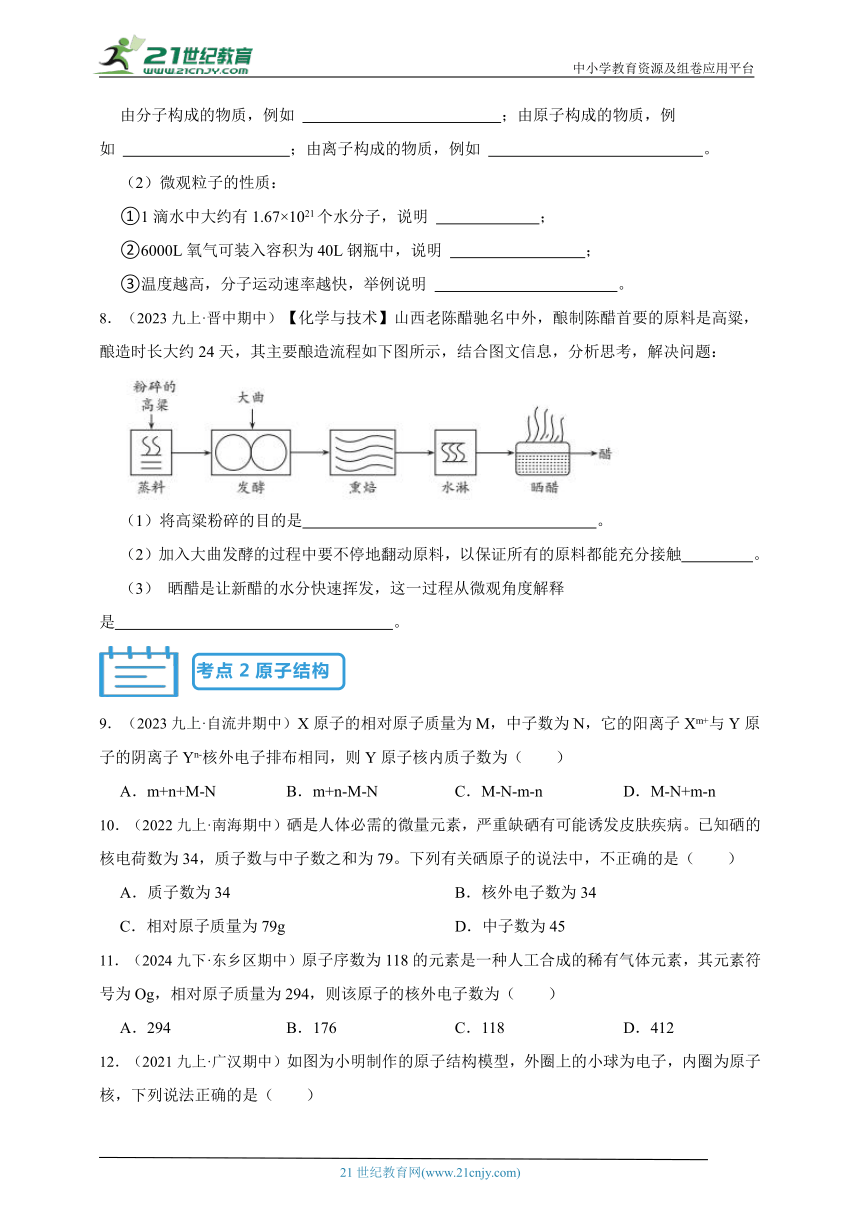
8.(2023九上·晋中期中)【化学与技术】山西老陈醋驰名中外,酿制陈醋首要的原料是高粱,酿造时长大约24天,其主要酿造流程如下图所示,结合图文信息,分析思考,解决问题:
(1)将高粱粉碎的目的是 。
(2)加入大曲发酵的过程中要不停地翻动原料,以保证所有的原料都能充分接触 。
(3) 晒醋是让新醋的水分快速挥发,这一过程从微观角度解释是 。
9.(2023九上·自流井期中)X原子的相对原子质量为M,中子数为N,它的阳离子Xm+与Y原子的阴离子Yn-核外电子排布相同,则Y原子核内质子数为( )
A.m+n+M-N B.m+n-M-N C.M-N-m-n D.M-N+m-n
10.(2022九上·南海期中)硒是人体必需的微量元素,严重缺硒有可能诱发皮肤疾病。已知硒的核电荷数为34,质子数与中子数之和为79。下列有关硒原子的说法中,不正确的是( )
A.质子数为34 B.核外电子数为34
C.相对原子质量为79g D.中子数为45
11.(2024九下·东乡区期中)原子序数为118的元素是一种人工合成的稀有气体元素,其元素符号为Og,相对原子质量为294,则该原子的核外电子数为( )
A.294 B.176 C.118 D.412
12.(2021九上·广汉期中)如图为小明制作的原子结构模型,外圈上的小球为电子,内圈为原子核,下列说法正确的是( )
A.该模型表示一种碳原子
B.该原子的核电荷数为4
C.该原子的相对原子质量为2
D.该原子核由2个质子和2个中子构成
13.(2024八下·滨城期中)下列关于Na、Na+两种粒子的判断中,正确的是( )
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同
④质量几乎相等 ⑤质子数相等 ⑥Na+比Na稳定
A.①②⑤ B.①③⑤⑥ C.①④⑤⑥ D.②③④
14.(2019九上·株洲期中)影响元素化学性质的最主要因素是()
A.原子的质子数 B.原子的电子层数
C.原子的最外层电子数 D.组成某种物质的原子个数
15.(2023九上·怀化期中)下列各组原子结构示意图中,所表示的两种元素具有相似化学性质的是( )
A. B.
C. D.
16.(2023九上·天河期中)2022年9月9日,中国国家航天局、国家原子能机构在北京发布了嫦娥五号最新科学成果,其中一个是发现月球新矿物:氦-3;已知地球上大量存在的是氦-4.下图所示是两种原子的结构示意图,关于两种原子说法错误的是( )
A.“●”表示质子,“○”表示中子
B.氦-3与氦-4是同种元素的不同原子
C.氦-3比氦-4的相对原子质量小
D.氦-3与氦-4的最外层电子数均为2,容易失去电子成为阳离子
17.(2023九上·武汉期中)某原子的相对质量为23,原子核内有12个中子,请写出该元素的名称并画出该原子的结构示意图 。
18.(2023九上·保定期中)结合所学知识填空或计算:
(1)日本所排放的核污水中含有的氚是氢元素的一种原子,它具有放射性,相对原子质量为3,则其原子核内的质子数为 ,中子数为 。
(2)某原子R的中子数为20,相对原子质量为39,则该原子形成的离子的核外电子数为 。
19.(2019九下·兰陵期中)我国自主研发的“硅衬底高光效氮化镓(GaN)发光二极管(简称LED)技术”已广泛应用于照明、显像等多个领域.请回答下列问题:
(1)有以下微粒的结构示意图:
上述微粒中,属于硅原子的是 (填序号),属于阳离子的是 (填序号),化学性质相似的是 (填序号),D粒子的化学符号为 .
(2)镓(Ga)的原子结构示意图如下,x= .磷化镓也是制造LED的一种材料,其化学式为 .
20.(2024八下·宁津期中)下表列出了几种原子中的粒子数:
原子 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钾 19 20 19
分析表中信息,下列说法正确的是( )
A.原子核内质子数等于中子数 B.原子核都由质子和中子构成
C.原子只由质子和电子构成 D.原子中质子数等于核外电子数
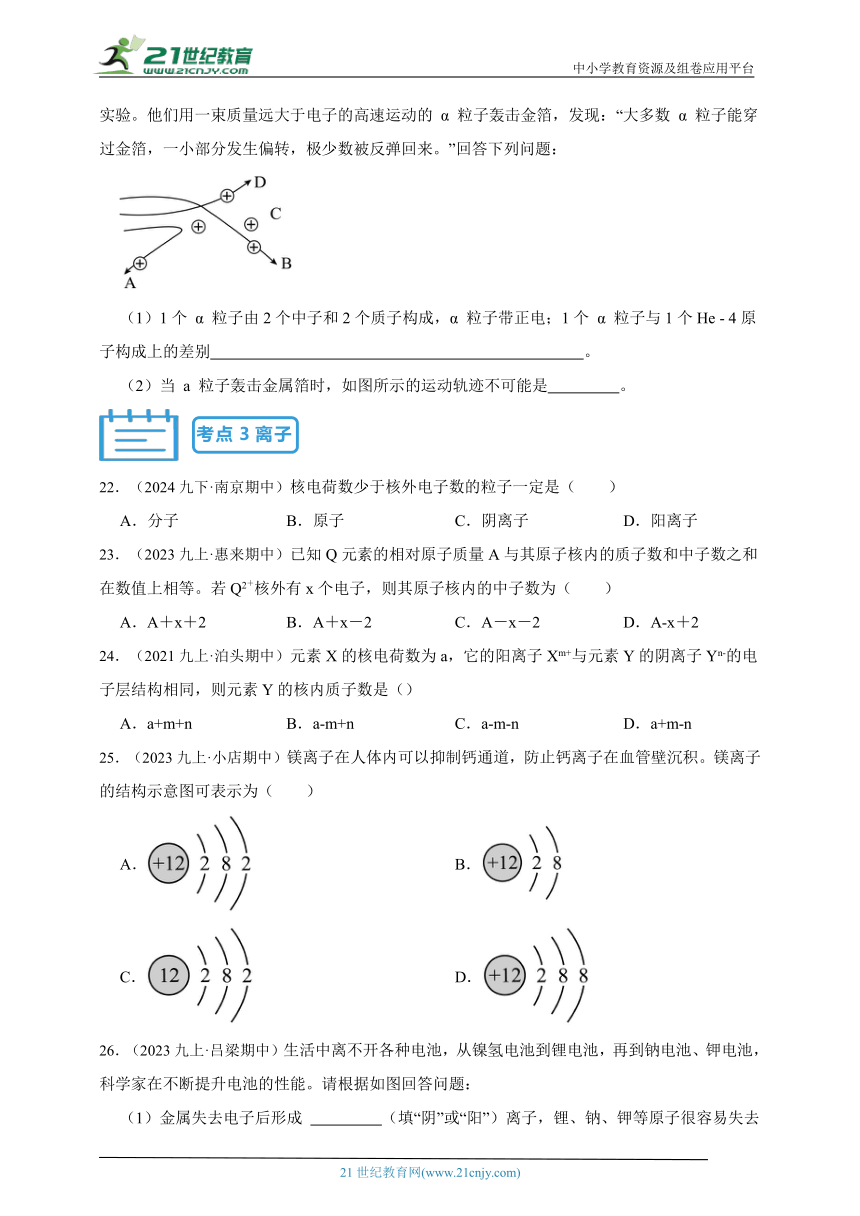
21.(2023九上·合江期中)1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的高速运动的 α 粒子轰击金箔,发现:“大多数 α 粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”回答下列问题:
(1)1个 α 粒子由2个中子和2个质子构成,α 粒子带正电;1个 α 粒子与1个He - 4原子构成上的差别 。
(2)当 a 粒子轰击金属箔时,如图所示的运动轨迹不可能是 。
22.(2024九下·南京期中)核电荷数少于核外电子数的粒子一定是( )
A.分子 B.原子 C.阴离子 D.阳离子
23.(2023九上·惠来期中)已知Q元素的相对原子质量A与其原子核内的质子数和中子数之和在数值上相等。若Q2+核外有x个电子,则其原子核内的中子数为( )
A.A+x+2 B.A+x-2 C.A-x-2 D.A-x+2
24.(2021九上·泊头期中)元素X的核电荷数为a,它的阳离子Xm+与元素Y的阴离子Yn-的电子层结构相同,则元素Y的核内质子数是()
A.a+m+n B.a-m+n C.a-m-n D.a+m-n
25.(2023九上·小店期中)镁离子在人体内可以抑制钙通道,防止钙离子在血管壁沉积。镁离子的结构示意图可表示为( )
A. B.
C. D.
26.(2023九上·吕梁期中)生活中离不开各种电池,从镍氢电池到锂电池,再到钠电池、钾电池,科学家在不断提升电池的性能。请根据如图回答问题:
(1)金属失去电子后形成 (填“阴”或“阳”)离子,锂、钠、钾等原子很容易失去电子变成离子,所以常被用作电池材料。这些元素具有相似的化学性质的原因 。
(2)研究表明,半径越大的离子越容易在电池正负极之间移动,充电速度越快。如图是锂、钠、钾三种金属的离子半径大小,电池容量相同的这三种电池,充满电的时间最短的 电池。
(3)请画出钠离子的离子结构示意图 。
27.(2023九上·石家庄期中)根据下列粒子结构示意图,回答问题。
(1)若E粒子带1个单位正电荷,则X= 。
(2)如图A、B、C、D四种粒子共表示 种元素,因为 决定元素的种类。
(3) D原子在化学反应中易 (填“得到”或“失去”)电子,因为 决定着元素的化学性质。
(4)由B元素和D元素组成的化合物的化学式为 。
(5)上述A--E结构示意图中具有相对稳定结构的是 (填字母代号)。
28.(2023九上·昌黎期中)建立宏观、微观和符号之间的相互联系是化学学科的特点。请根据下列信息回答有关问题:
图1图2
(1)图1为粒子之间的转化关系图,其中①表示的是 。
(2)图2中B、C属于同种元素,因为 相同。
(3)图2中A、B形成的化合物的化学式为 。
(4)图2中D为某粒子的结构示意图,当x=16时,则表示该粒子的符号为 。
29.(2020九上·昆明期中)有 A、B、C、D 四种元素,已知 A 元素核内没有中子;B 元素的单质是一种气体,这种气体能供给呼吸;C 元素核外有 2 个电子层,其中第二个电子层上的电子数是另一个电子层上电子数的 2 倍;D 元素的原子失去一个电子后的电子排布与氖原子的电子排布相同。则
(1)D 元素的离子符号是 。
(2)C 元素与 B 元素的单质充分反应的符号表达式为 。
(3)A、B 形成的化合物的化学式是 。
30.(2020九上·临洮期中)有A、B、C、D四种元素,A的原子核外有三个电子层,且第三电子层上的电子数比第二层上的电子数少1;B元素的某氧化物分子组成为BO3,其中B元素与氧元素的质量比为2∶3,且B原子核内的质子数与中子数相等;C2-和D+的电子层结构与氖原子相同。
(1)写出上述四种元素的元素符号:A ,B ,C ,D 。
(2)B元素形成常见单核离子为 ,由该离子形成的常见化合物,如 (任写一个符合要求的化学式 )。
(3)已知A元素的单质能与碘化钾 溶液发生反应,生成氯化钾和碘单质 ,这一反应的文字表达式 。
答案解析部分
1.【答案】B
【知识点】物质的微粒性;分子的定义与分子的特性
【解析】【解答】A、墙内开花墙外香:花中的分子在不断运动,可向四周扩散,故A不符合题意;
B、60000 L氧气在加压的情况下可装入容积为40L的钢瓶中,是因为分子间的间隔变小,故B符合题意;
C、氧气和液氧都能支持燃烧,是因为物质的分子相同,其化学性质相同,故C不符合题意;
D、水烧开以后易把壶盖冲起,由于水分子之间有间隔,在受热时,分子间的间隔变大,故D不符合题意;
故答案为:B。
【分析】根据分子的基本特征进行分析解答;
B、根据分子的体积和大小进行分析解答;
C、根据氧气和液氧的分子相同进行分析解答;
D、根据分子间存在间隔进行分析解答。
2.【答案】B
【知识点】物质的微粒性;分子的定义与分子的特性
【解析】【解答】A、 结构决定物质的性质,CO由一氧化碳分子构成,CO2由二氧化碳分子构成,一氧化碳和二氧化碳的结构不同,故它们的化学性质不同。该说法正确,不符合题意;
B、分子间有间隔,而干冰升华时,分子间的间隔变大,干冰的体积变大,但分子的体积不变,故该说法错误,符合题意;
C、分子的特性有,分子在运动。故走过花圃闻到花香,说明分子在做无规则的运动,该说法正确,不符合题意;
D、分子有质量,且分子很小。 一滴水中大约有1.67×1021个水分子说明分子很小,该说法正确,不符合题意。
故答案为:B.
【分析】A、根据物质的性质由结构决定,不同物质的结构不同,化学性质不同来解答;
B、根据物质的三态的转换,说明分子间的间隔发生变化来解答;
C、根据分子在做无规则的运动来解答;
D、根据分子很小,分子有质量来解答。
3.【答案】B
【知识点】分子和原子的区别和联系
【解析】【解答】A、热胀冷缩,是因为分子间的间隔随温度的变化而改变,故选项解释正确.
B、分子总是在不断的运动的,水结成冰,分子仍是在不断的运动的,故选项解释错误.
C、食物腐烂,有新物质生成,分子本身发生了改变,故选项解释正确.
D、一滴水中大约有1.67×1021个水分子,说明分子很小,故选项解释正确.
故选:B.
【分析】根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”,结合事实进行分析判断即可.本题难度不大,掌握分子的基本性质(可以简记为:“两小运间,同同不不”)及利用分子的基本性质分析和解决问题的方法是解答此类题的关键.
4.【答案】D
【知识点】分子的定义与分子的特性
【解析】【解答】 压瘪的乒乓球放入热水中重新鼓起来, 此过程中因温度升高,乒乓球内气体分子的间隔变大。
故选D
【分析】根据分子间存在间隔,随温度升高分子间隔变大分析。
5.【答案】(1)氧分子
(2)过氧化氢分子
(3)分子间有间隔
(4)分子在不断运动,并且温度越高
【知识点】物质的微粒性;分子的定义与分子的特性
【解析】【解答】(1)保持氧气化学性质的最小粒子是氧分子;
(2)构成过氧化氢的微粒是过氧化氢分子;
(3)50mL的水和50mL的酒精混合后,总体积小于100mL是因为分子间有间隔;
(4)天气炎热时,更容易闻到花香是因为温度越高,分子运动速率越快。
【分析】(1)根据分子是保持物质化学性质的最小粒子分析;
(2)根据过氧化氢是由过氧化氢分子分构成的分析;
(3)根据分子之间有间隔分析;
(4)根据温度越高,分子运动速率越快分析。
6.【答案】Ar;Fe;P2O5;Na+、Cl-
【知识点】物质的微粒性
【解析】【解答】解: 氩气的构成粒子是氩原子,符号为 Ar ;铁的构成粒子是铁原子,故符号为Fe;磷的构成粒子是由五氧化二磷分子构成,故符号为 P2O5 ;氯化钠的构成粒子是由钠离子和氯离子构成的,符号为 Na+、Cl- 。
【分析】根据物质由分子、原子、离子构成来解答。
7.【答案】(1)氧气、氮气、氯气、水;金属、固体非金属;氯化钠、硫酸镁、碳酸钙
(2)分子很小;分子间有间隔;夏天晒衣服干的更快
【知识点】物质的微粒性;分子的定义与分子的特性
【解析】【解答】 (1)、物质是由微观粒子构成的。请举例说明:
由分子构成的物质,例如 氧气、氮气、氯气、水等;由原子构成的物质,例如金属、固体非金属等;
由离子构成的物质,例如氯化钠、硫酸镁、碳酸钙等。
(2)、微观粒子的性质:
①1滴水中大约有1.67×1021个水分子,说明分子很小;
②6000L氧气可装入容积为40L钢瓶中,说明分子间有间隔;
③温度越高,分子运动速率越快,举例说明夏天晒衣服干的更快。
【分析】(1)根据物质由分子、原子、离子构成来解答;
(2)根据分子的特性有:分子很小、分子间有间隔、分子在运动来解答。
8.【答案】(1)在蒸料过程中增大了高粱的受热面积
(2)氧气
(3),温度越高,分子的运动速度越快
【知识点】分子的定义与分子的特性
【解析】【解答】(1) 将高粱粉碎的目的是在蒸料过程中增大了高粱的受热面;
(2)发酵过程中原理与氧气反应,不停翻动原料,可以保证原料能与氧气充分接触;
(3) 晒醋是让新醋的水分快速挥发,温度越高,分子的运动速度越快,新醋的水分可以更快的蒸发。
【分析】(1)粉碎可以增大物质的表面积;
(2)翻动可以增大反应物的接触程度;
(3)利用温度对分子运动速度的影响分析。
9.【答案】C
【知识点】原子和离子的相互转化;原子的有关数量计算
【解析】【解答】X原子的相对原子质量为M,中子数为N,相对原子质量=质子数+中子数,质子数=M-N,原子里,质子数=电子数,则电子数为M-N,阳离子Xm+的电子数=M-N-m,阴离子Yn-的电子数为M-N-m,Y原子核外电子数=M-N-m-n,核内质子数M-N-m-n。
故答案为:C。
【分析】根据相对原子质量=质子数+中子数,计算出X原子的质子数和电子数,根据原子得失电子形成离子,计算X离子的核外电子数,再计算Y原子的核内质子数。
10.【答案】C
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】原子里,核电荷数=核内质子数=核外电子数,相对原子质量=质子数+中子数。
A、硒的核电荷数为34,质子数为34,故A正确;
B、硒的核电荷数为34,核外电子数为34,故B正确;
C、质子数与中子数之和为79,相对原子质量为79,故C错误;
D、中子数为79-34=45,故D正确;
故答案为:C。
【分析】根据原子里,核电荷数=核内质子数=核外电子数,相对原子质量=质子数+中子数分析。
11.【答案】C
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】在原子结构中,原子序数=质子数=核电荷数=核外电子数,该原子序数为118,则其核外电子数也为118, 故答案为:C。
【分析】结合原子结构的数量关系解答题目。
12.【答案】D
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】A、由原子模型图,内圈为原子核,核外有2个电子,原子中核内质子数=核外电子数,核内质子数为2,则该模型表示的是氦原子,不符合题意;
B、由原子模型图,内圈为原子核,核外有2个电子,原子中核内质子数=核外电子数,核内质子数为2,该原子的核电荷数为2,不符合题意;
C、由模型可知该原子核内有2个质子和2个中子,相对原子质量为2+2=4,不符合题意;
D、由原子模型图,内圈为原子核,核内质子数和中子数均为2,符合题意。
故答案为:D。
【分析】原子由原子核、核外电子构成,原子核内有质子和中子,原子中核外电子数=质子数=核电荷数。
13.【答案】C
【知识点】原子和离子的相互转化;原子的有关数量计算
【解析】【解答】钠原子的结构示意图 ,与钠离子的结构示意图相比,Na、Na+核电荷数相同、质子数相同、核外电子数不等、电子层结构不同、原子的质量集中在原子核上,钠原子变钠离子,原子核没有改变,质量几乎相等,钠原子没有达到稳定结构,钠离子达到了相对稳定结构。
故答案为:C。
【分析】根据钠原子与钠离子的结构示意图比较分析。
14.【答案】C
【知识点】核外电子在化学反应中的作用
【解析】【解答】A、在化学变化中,质子数不发生变化,不能决定元素的化学性质,A不符合题意确;
B、在化学变化中,原子的电子层数能影响元素的化学性质,但不是最主要因素,B不符合题意;
C、在化学变化中,最外层电子数是失去、得到还是不变,决定元素的化学性质,是影响元素化学性质的最主要因素,C符合题意;
D、组成某种物质的原子个数,不影响元素化学性质,D不符合题意。
故答案为:C。
【分析】根据最外层电子数决定元素的化学性质分析
15.【答案】A
【知识点】核外电子在化学反应中的作用
【解析】【解答】A. 质子数为2的原子为He原子,质子数为10的原子为Ne原子,二者都是稀有气体元素,化学性质都表现为稳定,故符合题意;
B. 质子数为9的原子最外层有7个电子,不稳定,易得1个电子而形成稳定结构;质子数为11的原子最外层有1个电子,不稳定,易失去最外层的1个电子而形成稳定结构;化学性质不同,故不符合题意;
C. 虽然两种元素的原子的最外层电子数相同,但它们的化学性质却完全不同。质子数为2的He为稀有气体元素,化学性质稳定;而质子数为12的原子最外层电子数为2,不稳定,易失最外层的2个电子形成稳定结构,故不符合题意;
D. 质子数为12的原子最外层电子数为2,不稳定,易失最外层的2个电子形成稳定结构;质子数为8的原子最外层电子数为6,不稳定,易得2个电子形成稳定结构。两种元素化学性质无相似处,故不符合题意;
故答案为:A。
【分析】 原子的最外层电子数相同,元素的化学性质相似。
16.【答案】D
【知识点】原子的定义与构成;核外电子在化学反应中的作用
【解析】【解答】A、原子核由质子和中子构成,原子中质子数=电子数,由图示可知“●”表示质子,“○”表示中子 ,不符合题意;
B、 氦-3与氦-4质子数相同,中子数不同,是同种元素的不同原子 ,不符合题意;
C、相对原子质量由质子数和中子数决定,氦-3和氦-4质子数相等,中子数氦-3比氦-4少,则相对原子质量小 ,不符合题意;
D、 氦-3与氦-4的最外层电子数均为2,第一层为最外层2个电子达到了相对稳定结构,不容易得失电子,符合题意;
故选D
【分析】A、根据图示及原子构成分析;
B、根据氦-3与氦-4质子数相同,中子数不同分析;
C、根据相对原子质量=质子数和中子数分析;
D、根据第一层为最外层2个电子达到了相对稳定结构分析。
17.【答案】钠、
【知识点】原子结构示意图与离子结构示意图;原子的有关数量计算
【解析】【解答】相对原子质量≈质子数+中子数,故该原子的质子数为23-12=11,质子数=原子序数,11号元素是钠元素,在原子中,质子数=核外电子数,故该原子的核外电子排布为2、8、1,故该原子的结构示意图为:,故填:钠、 。
【分析】根据相对原子质量≈质子数+中子数,计算出质子数;
再根据在原子中,质子数=核外电子数,分析出该原子的核外电子排布为2、8、1。
18.【答案】(1)1;2
(2)18
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】(1)氚是氢元素的一种原子,其原子核内的质子数为1;中子数=相对原子质量-质子数=3-1=2;
(2)某原子R的中子数为20,相对原子质量为39,相对原子质量=质子数+中子数,该原子的质子数=39-20=19,原子里核内质子数等于核外电子数,其核外电子数为19,最外层电子数为1,容易失去电子形成的离子,该原子形成的离子的核外电子数为18。
【分析】(1)根据相对原子质量等于质子数加中子数分析;
(2)根据相对原子质量等于质子数加中子数,原子里核内质子数等于核外电子数,可分析该原子的核外电子数为19,形成的离子核外电子数为18。
19.【答案】(1)C;E;AB;S2﹣
(2)3;GaP
【知识点】原子结构示意图与离子结构示意图
【解析】【解答】(1)硅原子的质子数为14,故属于硅原子的是C;E的质子数大于电子数,属于阳离子,A、B的最外层电子数相同故化学性质相似;D的质子数是16,电子数是18,故是硫离子,离子符号为:S2﹣;
(2)质子数=核外电子数,所以x的值是31﹣2﹣8﹣18=3;镓的最外层电子数是3,所以在化合物中一般显+3价,磷原子最外层5个电子易得3个电子,在化合物中显﹣3价,根据化合物中各元素化合价代数和为零,磷化镓表示GaP。
【分析】(1)在离子中,核内质子数≠核外电子数,核内质子数>核外电子数,表示阳离子;核内质子数<核外电子数,表示阴离子。
质子数决定原子的种类。
最外层电子数相同的原子,其化学性质相似。
一个粒子的质子数比电子数少几个,此粒子表示离子,一个此离子变带有几个单位的负电荷。
(2)在原子中,质子数=核外电子数。
根据化合物中,各元素正负化合价代数和为零。
20.【答案】D
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】由题中信息可知,原子核内质子数等于核外电子数,与中子数没有必然关系;氢原子没有中子,所以原子中一定有的微粒是质子和电子;原子是由位于原子中心的原子核和核外电子构成,原子核是由质子和中子构成;
故答案为:D。
【分析】根据原子的构成及原子中有关微粒数量的关系结合表中数据进行分析判断。
21.【答案】(1)α粒子中没有电子,1个He-4原子中含有2个电子
(2)BC##CB
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】(1)1个α粒子由2个中子和2个质子构成,α粒子带正电;1个α粒子与1个He - 4原子构成上的差别:α粒子中没有电子,1个He-4原子中含有2个电子;
(2)当a粒子轰击金属箔时,如图所示的运动轨迹不可能是BC,因为α粒子带正电,金原子核带正电,同种电荷相互排斥。
【分析】(1)根据原子一般是由质子,中子、电子构成的分析;
(2)根据α粒子带正电,金原子核带正电分析。
22.【答案】C
【知识点】原子和离子的相互转化
【解析】【解答】 A.分子是由原子构成的,原子不显电性,则分子不显电性,A错误;
B.原子不显电性,B错误;
C.阴离子中,核电荷数=质子数<核外电子数,C正确;
D.阳离子中,核电荷数=质子数>核外电子数,D错误。
故答案为:C。
【分析】 阳离子是核电荷数多于核外电子数的粒子,带正电荷,据此结合常见粒子的电性进行分析判断。
23.【答案】C
【知识点】原子的有关数量计算
【解析】【解答】Q2+是指在原子中失去了两个电子,带了两个单位的正电荷,由于在原子中核内质子数等于核外电子数;设该元素的核内质子数为Y则由关系式:Y-2=x,所以Y=x+2,又因为相对原子质量=核内质子数+中子数,所以中子数=相对原子质量-质子数=A-(x+2)=A-x-2。
故答案为:C。
【分析】根据相对原子质量=质子数+中子数计算。
24.【答案】C
【知识点】原子和离子的相互转化
【解析】【解答】解:设元素Y的核电荷数是b,因为X的核电荷数为a,它的阳离子Xm+,所以它的离子中带有(a-m)个电子,因为阳离子Xm+与元素Y的阴离子Yn-电子层结构相同,即核外电子数相同,所以b+n=a-m,即b=a-m-n。
故答案为:C。
【分析】原子失去几个电子,那么它的离子就带有几个单位的正电荷;原子得到几个电子,那么它的离子就带有几个单位的负电荷。
25.【答案】B
【知识点】原子和离子的相互转化
【解析】【解答】镁是12号元素,其原子核内有12个质子,带正电,在化学反应中失去最外层的2个电子,核外电子排布变为2、8,故答案为:B
【分析】镁离子是镁原子失去2个电子形成的,据此分析。
26.【答案】(1)阳;原子最外层电子数相等
(2)钾或K
(3)
【知识点】原子和离子的相互转化;原子结构示意图与离子结构示意图
【解析】【解答】(1)金属失去电子形成阳离子,因为锂、钠、钾等原子的最外层电子数相同,因此化学性质相似,故答案为:阳;原子最外层电子数相等;
(2)半径越大的离子越容易在电池正负极之间移动,充电速度越快。结合图示可知钾的离子半径最大,因此充电时间最短,故答案为:钾或K;
(3)钠原子失去一个电子形成钠离子,核内有11个质子,核外电子排布为2、8,则离子结构示意图为,故答案为:。
【分析】(1)根据原子失去电子形成阳离子,化学性质相似时最外层电子数相同;
(2)根据题中的信息及图片信息进行分析;
(3) 根据原子结构示意图的画法进行分析。
27.【答案】(1)11
(2)2;质子数
(3)得到;最外层电子数
(4)
(5)AE
【知识点】原子和离子的相互转化;原子结构示意图与离子结构示意图
【解析】【解答】(1)若E粒子带1个单位正电荷,则X=10+1=11;
(2)元素种类由核内质子数决定,A、B、C、D四种粒子共表示3种元素;
(3)D原子最外层电子数为7,在化学反应中易得到电子,原子的最外层电子数决定元素的化学性质;
(4)镁元素和氯元素形成的化合物的化学式为;
(5)最外层电子数为8的结构具有相对稳定结构,A—E结构示意图中具有相对稳定结构的是AE。
【分析】(1)根据原子里核内质子数等于核外电子数分析;
(2)根据核内质子数决定元素种类分析;
(3)根据最外层电子数决定元素化学性质分析;
(4)根据原子的最外层电子数确定化学式;
(5)根据最外层电子数为8的结构是稳定结构分析。
28.【答案】(1)原子
(2)核电荷数
(3)MgCl2
(4)S2-
【知识点】分子和原子的区别和联系;原子和离子的相互转化;原子结构示意图与离子结构示意图
【解析】【解答】(1)分子可以分解成原子,原子可以结合成分子,原子得失电子形成离子,根据转化关系可知,①表示的是原子;
(2)元素的种类由核内质子数即核电荷数相决定,BC属于同种元素,是因为核电荷数或者核内质子数相同;
(3)A为氯元素,B为镁元素,AB形成的化合物的化学式为MgCl2;
(4)当x=16时,该粒子为硫离子,符号为 S2-。
【分析】(1)根据分子,原子,离子的关系分析;
(2)根据元素的种类由核内质子数决定分析;
(3)根据元素化合价书写化学式;
(4)根据原子得失电子形成离子分析。
29.【答案】(1)Na+
(2)C+O2 CO2
(3)H2O或H2O2
【知识点】原子的定义与构成;原子和离子的相互转化
【解析】【解答】(1)D元素是钠元素,失去一个电子后形成带一个单位正电荷的钠离子,故填:Na+。
(2)B组成的单质是氧气,C是碳,碳在氧气中完全燃烧生成二氧化碳,故填:C+O2 CO2,故填:C+O2 CO2。
(3)A是氢元素,B是氧元素,这两种元素能形成水或过氧化氢,故填:H2O(或H2O2)。
【分析】根据氢原子核内没有中子,氧气能供给呼吸,及原子的核外电子排布方式分析
30.【答案】(1)Cl;S;O;Na
(2)S2-;Na2S、K2S或MgS
(3)
【知识点】原子和离子的相互转化
【解析】【解答】(1)由分析可知,A是Cl;B是S;C是O;D是Na;
(2)B元素形成常见单核离子为 ,由该离子形成的常见化合物,如 、K2S或MgS;
(3)氯气和碘化钾反应生成氯化钾和碘单质,文字表达式为: 。
【分析】(1)根据原子得失电子形成离子分析
(2)根据化学式书写方法分析
(3)根据氯气和碘化钾反应生成氯化钾和碘分析
试题分析部分
1、试卷总体分布分析
总分:93分
分值分布 客观题(占比) 34.0(36.6%)
主观题(占比) 59.0(63.4%)
题量分布 客观题(占比) 17(56.7%)
主观题(占比) 13(43.3%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
微粒的性质 8(26.7%) 29.0(31.2%)
离子 9(30.0%) 33.0(35.5%)
原子结构 13(43.3%) 31.0(33.3%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (66.7%)
2 容易 (23.3%)
3 困难 (10.0%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 物质的微粒性 22.0(23.7%) 1,2,5,6,7
2 原子和离子的相互转化 35.0(37.6%) 9,13,22,24,25,26,27,28,29,30
3 分子的定义与分子的特性 19.0(20.4%) 1,2,4,5,7,8
4 原子的定义与构成 18.0(19.4%) 10,11,12,16,18,20,21,29
5 分子和原子的区别和联系 6.0(6.5%) 3,28
6 核外电子在化学反应中的作用 6.0(6.5%) 14,15,16
7 原子的有关数量计算 21.0(22.6%) 9,10,11,12,13,17,18,20,21,23
8 原子结构示意图与离子结构示意图 23.0(24.7%) 17,19,26,27,28
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
专题05 分子和原子
1.(2023九上·桐城期中)下列对宏观事实的微观解释,错误的是( )
A.墙内开花墙外香——分子是不断运动的
B.60000 L氧气在加压的情况下可装入容积为40L的钢瓶中——分子体积变小
C.氧气和液氧都能支持燃烧——物质的分子相同,其化学性质相同
D.水壶中的水烧开沸腾后,壶盖被顶起——水分子间的间隔增大
2.(2023九上·顺义期中)下列事实的微观解释不合理的是( )
A.CO和CO2化学性质不同一分子种类不同
B.干冰升华一分子体积变大
C.走过花圃闻到花香一分子在不断运动
D.一滴水中大约有1.67×1021个水分子一分子很小
3.(2020九上·西丰期中)从分子的角度解释下列事实,其中错误的是( )
A.热胀冷缩﹣﹣分子间有间隔
B.水结成冰﹣﹣分子停止运动
C.食物腐烂﹣﹣分子本身发生改变
D.一滴水中大约有1.67×1021个水分子﹣﹣分子很小
4.(2024九下·邵东期中)压瘪的乒乓球放入热水中重新鼓起来, 此过程中乒乓球内气体分子的( )
A.质量变大 B.体积变大 C.数目变多 D.间隔变大
5.(2023九上·慈利期中)从分子的角度分析并解释下列问题。
(1)氧气可用于抢救病人。保持氧气化学性质的最小粒子是 。
(2)过氧化氢溶液可用于消毒。构成过氧化氢的微粒是 。
(3)50mL的水和50mL的酒精混合后,总体积小于100mL: 。
(4)天气炎热时,更容易闻到花香: 。
6.(2023九上·蔡甸期中)物质是由各种微观粒子构成的。氩气的构成粒子是 ,铁的构成粒子是 ,五氧化二磷的构成粒子是 ,氯化钠的构成粒子是 。
7.(2023九上·南明期中)化学是在分子、原子层次上研究物质的科学。
(1)物质是由微观粒子构成的。请举例说明:
由分子构成的物质,例如 ;由原子构成的物质,例如 ;由离子构成的物质,例如 。
(2)微观粒子的性质:
①1滴水中大约有1.67×1021个水分子,说明 ;
②6000L氧气可装入容积为40L钢瓶中,说明 ;
③温度越高,分子运动速率越快,举例说明 。
8.(2023九上·晋中期中)【化学与技术】山西老陈醋驰名中外,酿制陈醋首要的原料是高粱,酿造时长大约24天,其主要酿造流程如下图所示,结合图文信息,分析思考,解决问题:
(1)将高粱粉碎的目的是 。
(2)加入大曲发酵的过程中要不停地翻动原料,以保证所有的原料都能充分接触 。
(3) 晒醋是让新醋的水分快速挥发,这一过程从微观角度解释是 。
9.(2023九上·自流井期中)X原子的相对原子质量为M,中子数为N,它的阳离子Xm+与Y原子的阴离子Yn-核外电子排布相同,则Y原子核内质子数为( )
A.m+n+M-N B.m+n-M-N C.M-N-m-n D.M-N+m-n
10.(2022九上·南海期中)硒是人体必需的微量元素,严重缺硒有可能诱发皮肤疾病。已知硒的核电荷数为34,质子数与中子数之和为79。下列有关硒原子的说法中,不正确的是( )
A.质子数为34 B.核外电子数为34
C.相对原子质量为79g D.中子数为45
11.(2024九下·东乡区期中)原子序数为118的元素是一种人工合成的稀有气体元素,其元素符号为Og,相对原子质量为294,则该原子的核外电子数为( )
A.294 B.176 C.118 D.412
12.(2021九上·广汉期中)如图为小明制作的原子结构模型,外圈上的小球为电子,内圈为原子核,下列说法正确的是( )
A.该模型表示一种碳原子
B.该原子的核电荷数为4
C.该原子的相对原子质量为2
D.该原子核由2个质子和2个中子构成
13.(2024八下·滨城期中)下列关于Na、Na+两种粒子的判断中,正确的是( )
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同
④质量几乎相等 ⑤质子数相等 ⑥Na+比Na稳定
A.①②⑤ B.①③⑤⑥ C.①④⑤⑥ D.②③④
14.(2019九上·株洲期中)影响元素化学性质的最主要因素是()
A.原子的质子数 B.原子的电子层数
C.原子的最外层电子数 D.组成某种物质的原子个数
15.(2023九上·怀化期中)下列各组原子结构示意图中,所表示的两种元素具有相似化学性质的是( )
A. B.
C. D.
16.(2023九上·天河期中)2022年9月9日,中国国家航天局、国家原子能机构在北京发布了嫦娥五号最新科学成果,其中一个是发现月球新矿物:氦-3;已知地球上大量存在的是氦-4.下图所示是两种原子的结构示意图,关于两种原子说法错误的是( )
A.“●”表示质子,“○”表示中子
B.氦-3与氦-4是同种元素的不同原子
C.氦-3比氦-4的相对原子质量小
D.氦-3与氦-4的最外层电子数均为2,容易失去电子成为阳离子
17.(2023九上·武汉期中)某原子的相对质量为23,原子核内有12个中子,请写出该元素的名称并画出该原子的结构示意图 。
18.(2023九上·保定期中)结合所学知识填空或计算:
(1)日本所排放的核污水中含有的氚是氢元素的一种原子,它具有放射性,相对原子质量为3,则其原子核内的质子数为 ,中子数为 。
(2)某原子R的中子数为20,相对原子质量为39,则该原子形成的离子的核外电子数为 。
19.(2019九下·兰陵期中)我国自主研发的“硅衬底高光效氮化镓(GaN)发光二极管(简称LED)技术”已广泛应用于照明、显像等多个领域.请回答下列问题:
(1)有以下微粒的结构示意图:
上述微粒中,属于硅原子的是 (填序号),属于阳离子的是 (填序号),化学性质相似的是 (填序号),D粒子的化学符号为 .
(2)镓(Ga)的原子结构示意图如下,x= .磷化镓也是制造LED的一种材料,其化学式为 .
20.(2024八下·宁津期中)下表列出了几种原子中的粒子数:
原子 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钾 19 20 19
分析表中信息,下列说法正确的是( )
A.原子核内质子数等于中子数 B.原子核都由质子和中子构成
C.原子只由质子和电子构成 D.原子中质子数等于核外电子数
21.(2023九上·合江期中)1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的高速运动的 α 粒子轰击金箔,发现:“大多数 α 粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”回答下列问题:
(1)1个 α 粒子由2个中子和2个质子构成,α 粒子带正电;1个 α 粒子与1个He - 4原子构成上的差别 。
(2)当 a 粒子轰击金属箔时,如图所示的运动轨迹不可能是 。
22.(2024九下·南京期中)核电荷数少于核外电子数的粒子一定是( )
A.分子 B.原子 C.阴离子 D.阳离子
23.(2023九上·惠来期中)已知Q元素的相对原子质量A与其原子核内的质子数和中子数之和在数值上相等。若Q2+核外有x个电子,则其原子核内的中子数为( )
A.A+x+2 B.A+x-2 C.A-x-2 D.A-x+2
24.(2021九上·泊头期中)元素X的核电荷数为a,它的阳离子Xm+与元素Y的阴离子Yn-的电子层结构相同,则元素Y的核内质子数是()
A.a+m+n B.a-m+n C.a-m-n D.a+m-n
25.(2023九上·小店期中)镁离子在人体内可以抑制钙通道,防止钙离子在血管壁沉积。镁离子的结构示意图可表示为( )
A. B.
C. D.
26.(2023九上·吕梁期中)生活中离不开各种电池,从镍氢电池到锂电池,再到钠电池、钾电池,科学家在不断提升电池的性能。请根据如图回答问题:
(1)金属失去电子后形成 (填“阴”或“阳”)离子,锂、钠、钾等原子很容易失去电子变成离子,所以常被用作电池材料。这些元素具有相似的化学性质的原因 。
(2)研究表明,半径越大的离子越容易在电池正负极之间移动,充电速度越快。如图是锂、钠、钾三种金属的离子半径大小,电池容量相同的这三种电池,充满电的时间最短的 电池。
(3)请画出钠离子的离子结构示意图 。
27.(2023九上·石家庄期中)根据下列粒子结构示意图,回答问题。
(1)若E粒子带1个单位正电荷,则X= 。
(2)如图A、B、C、D四种粒子共表示 种元素,因为 决定元素的种类。
(3) D原子在化学反应中易 (填“得到”或“失去”)电子,因为 决定着元素的化学性质。
(4)由B元素和D元素组成的化合物的化学式为 。
(5)上述A--E结构示意图中具有相对稳定结构的是 (填字母代号)。
28.(2023九上·昌黎期中)建立宏观、微观和符号之间的相互联系是化学学科的特点。请根据下列信息回答有关问题:
图1图2
(1)图1为粒子之间的转化关系图,其中①表示的是 。
(2)图2中B、C属于同种元素,因为 相同。
(3)图2中A、B形成的化合物的化学式为 。
(4)图2中D为某粒子的结构示意图,当x=16时,则表示该粒子的符号为 。
29.(2020九上·昆明期中)有 A、B、C、D 四种元素,已知 A 元素核内没有中子;B 元素的单质是一种气体,这种气体能供给呼吸;C 元素核外有 2 个电子层,其中第二个电子层上的电子数是另一个电子层上电子数的 2 倍;D 元素的原子失去一个电子后的电子排布与氖原子的电子排布相同。则
(1)D 元素的离子符号是 。
(2)C 元素与 B 元素的单质充分反应的符号表达式为 。
(3)A、B 形成的化合物的化学式是 。
30.(2020九上·临洮期中)有A、B、C、D四种元素,A的原子核外有三个电子层,且第三电子层上的电子数比第二层上的电子数少1;B元素的某氧化物分子组成为BO3,其中B元素与氧元素的质量比为2∶3,且B原子核内的质子数与中子数相等;C2-和D+的电子层结构与氖原子相同。
(1)写出上述四种元素的元素符号:A ,B ,C ,D 。
(2)B元素形成常见单核离子为 ,由该离子形成的常见化合物,如 (任写一个符合要求的化学式 )。
(3)已知A元素的单质能与碘化钾 溶液发生反应,生成氯化钾和碘单质 ,这一反应的文字表达式 。
答案解析部分
1.【答案】B
【知识点】物质的微粒性;分子的定义与分子的特性
【解析】【解答】A、墙内开花墙外香:花中的分子在不断运动,可向四周扩散,故A不符合题意;
B、60000 L氧气在加压的情况下可装入容积为40L的钢瓶中,是因为分子间的间隔变小,故B符合题意;
C、氧气和液氧都能支持燃烧,是因为物质的分子相同,其化学性质相同,故C不符合题意;
D、水烧开以后易把壶盖冲起,由于水分子之间有间隔,在受热时,分子间的间隔变大,故D不符合题意;
故答案为:B。
【分析】根据分子的基本特征进行分析解答;
B、根据分子的体积和大小进行分析解答;
C、根据氧气和液氧的分子相同进行分析解答;
D、根据分子间存在间隔进行分析解答。
2.【答案】B
【知识点】物质的微粒性;分子的定义与分子的特性
【解析】【解答】A、 结构决定物质的性质,CO由一氧化碳分子构成,CO2由二氧化碳分子构成,一氧化碳和二氧化碳的结构不同,故它们的化学性质不同。该说法正确,不符合题意;
B、分子间有间隔,而干冰升华时,分子间的间隔变大,干冰的体积变大,但分子的体积不变,故该说法错误,符合题意;
C、分子的特性有,分子在运动。故走过花圃闻到花香,说明分子在做无规则的运动,该说法正确,不符合题意;
D、分子有质量,且分子很小。 一滴水中大约有1.67×1021个水分子说明分子很小,该说法正确,不符合题意。
故答案为:B.
【分析】A、根据物质的性质由结构决定,不同物质的结构不同,化学性质不同来解答;
B、根据物质的三态的转换,说明分子间的间隔发生变化来解答;
C、根据分子在做无规则的运动来解答;
D、根据分子很小,分子有质量来解答。
3.【答案】B
【知识点】分子和原子的区别和联系
【解析】【解答】A、热胀冷缩,是因为分子间的间隔随温度的变化而改变,故选项解释正确.
B、分子总是在不断的运动的,水结成冰,分子仍是在不断的运动的,故选项解释错误.
C、食物腐烂,有新物质生成,分子本身发生了改变,故选项解释正确.
D、一滴水中大约有1.67×1021个水分子,说明分子很小,故选项解释正确.
故选:B.
【分析】根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”,结合事实进行分析判断即可.本题难度不大,掌握分子的基本性质(可以简记为:“两小运间,同同不不”)及利用分子的基本性质分析和解决问题的方法是解答此类题的关键.
4.【答案】D
【知识点】分子的定义与分子的特性
【解析】【解答】 压瘪的乒乓球放入热水中重新鼓起来, 此过程中因温度升高,乒乓球内气体分子的间隔变大。
故选D
【分析】根据分子间存在间隔,随温度升高分子间隔变大分析。
5.【答案】(1)氧分子
(2)过氧化氢分子
(3)分子间有间隔
(4)分子在不断运动,并且温度越高
【知识点】物质的微粒性;分子的定义与分子的特性
【解析】【解答】(1)保持氧气化学性质的最小粒子是氧分子;
(2)构成过氧化氢的微粒是过氧化氢分子;
(3)50mL的水和50mL的酒精混合后,总体积小于100mL是因为分子间有间隔;
(4)天气炎热时,更容易闻到花香是因为温度越高,分子运动速率越快。
【分析】(1)根据分子是保持物质化学性质的最小粒子分析;
(2)根据过氧化氢是由过氧化氢分子分构成的分析;
(3)根据分子之间有间隔分析;
(4)根据温度越高,分子运动速率越快分析。
6.【答案】Ar;Fe;P2O5;Na+、Cl-
【知识点】物质的微粒性
【解析】【解答】解: 氩气的构成粒子是氩原子,符号为 Ar ;铁的构成粒子是铁原子,故符号为Fe;磷的构成粒子是由五氧化二磷分子构成,故符号为 P2O5 ;氯化钠的构成粒子是由钠离子和氯离子构成的,符号为 Na+、Cl- 。
【分析】根据物质由分子、原子、离子构成来解答。
7.【答案】(1)氧气、氮气、氯气、水;金属、固体非金属;氯化钠、硫酸镁、碳酸钙
(2)分子很小;分子间有间隔;夏天晒衣服干的更快
【知识点】物质的微粒性;分子的定义与分子的特性
【解析】【解答】 (1)、物质是由微观粒子构成的。请举例说明:
由分子构成的物质,例如 氧气、氮气、氯气、水等;由原子构成的物质,例如金属、固体非金属等;
由离子构成的物质,例如氯化钠、硫酸镁、碳酸钙等。
(2)、微观粒子的性质:
①1滴水中大约有1.67×1021个水分子,说明分子很小;
②6000L氧气可装入容积为40L钢瓶中,说明分子间有间隔;
③温度越高,分子运动速率越快,举例说明夏天晒衣服干的更快。
【分析】(1)根据物质由分子、原子、离子构成来解答;
(2)根据分子的特性有:分子很小、分子间有间隔、分子在运动来解答。
8.【答案】(1)在蒸料过程中增大了高粱的受热面积
(2)氧气
(3),温度越高,分子的运动速度越快
【知识点】分子的定义与分子的特性
【解析】【解答】(1) 将高粱粉碎的目的是在蒸料过程中增大了高粱的受热面;
(2)发酵过程中原理与氧气反应,不停翻动原料,可以保证原料能与氧气充分接触;
(3) 晒醋是让新醋的水分快速挥发,温度越高,分子的运动速度越快,新醋的水分可以更快的蒸发。
【分析】(1)粉碎可以增大物质的表面积;
(2)翻动可以增大反应物的接触程度;
(3)利用温度对分子运动速度的影响分析。
9.【答案】C
【知识点】原子和离子的相互转化;原子的有关数量计算
【解析】【解答】X原子的相对原子质量为M,中子数为N,相对原子质量=质子数+中子数,质子数=M-N,原子里,质子数=电子数,则电子数为M-N,阳离子Xm+的电子数=M-N-m,阴离子Yn-的电子数为M-N-m,Y原子核外电子数=M-N-m-n,核内质子数M-N-m-n。
故答案为:C。
【分析】根据相对原子质量=质子数+中子数,计算出X原子的质子数和电子数,根据原子得失电子形成离子,计算X离子的核外电子数,再计算Y原子的核内质子数。
10.【答案】C
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】原子里,核电荷数=核内质子数=核外电子数,相对原子质量=质子数+中子数。
A、硒的核电荷数为34,质子数为34,故A正确;
B、硒的核电荷数为34,核外电子数为34,故B正确;
C、质子数与中子数之和为79,相对原子质量为79,故C错误;
D、中子数为79-34=45,故D正确;
故答案为:C。
【分析】根据原子里,核电荷数=核内质子数=核外电子数,相对原子质量=质子数+中子数分析。
11.【答案】C
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】在原子结构中,原子序数=质子数=核电荷数=核外电子数,该原子序数为118,则其核外电子数也为118, 故答案为:C。
【分析】结合原子结构的数量关系解答题目。
12.【答案】D
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】A、由原子模型图,内圈为原子核,核外有2个电子,原子中核内质子数=核外电子数,核内质子数为2,则该模型表示的是氦原子,不符合题意;
B、由原子模型图,内圈为原子核,核外有2个电子,原子中核内质子数=核外电子数,核内质子数为2,该原子的核电荷数为2,不符合题意;
C、由模型可知该原子核内有2个质子和2个中子,相对原子质量为2+2=4,不符合题意;
D、由原子模型图,内圈为原子核,核内质子数和中子数均为2,符合题意。
故答案为:D。
【分析】原子由原子核、核外电子构成,原子核内有质子和中子,原子中核外电子数=质子数=核电荷数。
13.【答案】C
【知识点】原子和离子的相互转化;原子的有关数量计算
【解析】【解答】钠原子的结构示意图 ,与钠离子的结构示意图相比,Na、Na+核电荷数相同、质子数相同、核外电子数不等、电子层结构不同、原子的质量集中在原子核上,钠原子变钠离子,原子核没有改变,质量几乎相等,钠原子没有达到稳定结构,钠离子达到了相对稳定结构。
故答案为:C。
【分析】根据钠原子与钠离子的结构示意图比较分析。
14.【答案】C
【知识点】核外电子在化学反应中的作用
【解析】【解答】A、在化学变化中,质子数不发生变化,不能决定元素的化学性质,A不符合题意确;
B、在化学变化中,原子的电子层数能影响元素的化学性质,但不是最主要因素,B不符合题意;
C、在化学变化中,最外层电子数是失去、得到还是不变,决定元素的化学性质,是影响元素化学性质的最主要因素,C符合题意;
D、组成某种物质的原子个数,不影响元素化学性质,D不符合题意。
故答案为:C。
【分析】根据最外层电子数决定元素的化学性质分析
15.【答案】A
【知识点】核外电子在化学反应中的作用
【解析】【解答】A. 质子数为2的原子为He原子,质子数为10的原子为Ne原子,二者都是稀有气体元素,化学性质都表现为稳定,故符合题意;
B. 质子数为9的原子最外层有7个电子,不稳定,易得1个电子而形成稳定结构;质子数为11的原子最外层有1个电子,不稳定,易失去最外层的1个电子而形成稳定结构;化学性质不同,故不符合题意;
C. 虽然两种元素的原子的最外层电子数相同,但它们的化学性质却完全不同。质子数为2的He为稀有气体元素,化学性质稳定;而质子数为12的原子最外层电子数为2,不稳定,易失最外层的2个电子形成稳定结构,故不符合题意;
D. 质子数为12的原子最外层电子数为2,不稳定,易失最外层的2个电子形成稳定结构;质子数为8的原子最外层电子数为6,不稳定,易得2个电子形成稳定结构。两种元素化学性质无相似处,故不符合题意;
故答案为:A。
【分析】 原子的最外层电子数相同,元素的化学性质相似。
16.【答案】D
【知识点】原子的定义与构成;核外电子在化学反应中的作用
【解析】【解答】A、原子核由质子和中子构成,原子中质子数=电子数,由图示可知“●”表示质子,“○”表示中子 ,不符合题意;
B、 氦-3与氦-4质子数相同,中子数不同,是同种元素的不同原子 ,不符合题意;
C、相对原子质量由质子数和中子数决定,氦-3和氦-4质子数相等,中子数氦-3比氦-4少,则相对原子质量小 ,不符合题意;
D、 氦-3与氦-4的最外层电子数均为2,第一层为最外层2个电子达到了相对稳定结构,不容易得失电子,符合题意;
故选D
【分析】A、根据图示及原子构成分析;
B、根据氦-3与氦-4质子数相同,中子数不同分析;
C、根据相对原子质量=质子数和中子数分析;
D、根据第一层为最外层2个电子达到了相对稳定结构分析。
17.【答案】钠、
【知识点】原子结构示意图与离子结构示意图;原子的有关数量计算
【解析】【解答】相对原子质量≈质子数+中子数,故该原子的质子数为23-12=11,质子数=原子序数,11号元素是钠元素,在原子中,质子数=核外电子数,故该原子的核外电子排布为2、8、1,故该原子的结构示意图为:,故填:钠、 。
【分析】根据相对原子质量≈质子数+中子数,计算出质子数;
再根据在原子中,质子数=核外电子数,分析出该原子的核外电子排布为2、8、1。
18.【答案】(1)1;2
(2)18
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】(1)氚是氢元素的一种原子,其原子核内的质子数为1;中子数=相对原子质量-质子数=3-1=2;
(2)某原子R的中子数为20,相对原子质量为39,相对原子质量=质子数+中子数,该原子的质子数=39-20=19,原子里核内质子数等于核外电子数,其核外电子数为19,最外层电子数为1,容易失去电子形成的离子,该原子形成的离子的核外电子数为18。
【分析】(1)根据相对原子质量等于质子数加中子数分析;
(2)根据相对原子质量等于质子数加中子数,原子里核内质子数等于核外电子数,可分析该原子的核外电子数为19,形成的离子核外电子数为18。
19.【答案】(1)C;E;AB;S2﹣
(2)3;GaP
【知识点】原子结构示意图与离子结构示意图
【解析】【解答】(1)硅原子的质子数为14,故属于硅原子的是C;E的质子数大于电子数,属于阳离子,A、B的最外层电子数相同故化学性质相似;D的质子数是16,电子数是18,故是硫离子,离子符号为:S2﹣;
(2)质子数=核外电子数,所以x的值是31﹣2﹣8﹣18=3;镓的最外层电子数是3,所以在化合物中一般显+3价,磷原子最外层5个电子易得3个电子,在化合物中显﹣3价,根据化合物中各元素化合价代数和为零,磷化镓表示GaP。
【分析】(1)在离子中,核内质子数≠核外电子数,核内质子数>核外电子数,表示阳离子;核内质子数<核外电子数,表示阴离子。
质子数决定原子的种类。
最外层电子数相同的原子,其化学性质相似。
一个粒子的质子数比电子数少几个,此粒子表示离子,一个此离子变带有几个单位的负电荷。
(2)在原子中,质子数=核外电子数。
根据化合物中,各元素正负化合价代数和为零。
20.【答案】D
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】由题中信息可知,原子核内质子数等于核外电子数,与中子数没有必然关系;氢原子没有中子,所以原子中一定有的微粒是质子和电子;原子是由位于原子中心的原子核和核外电子构成,原子核是由质子和中子构成;
故答案为:D。
【分析】根据原子的构成及原子中有关微粒数量的关系结合表中数据进行分析判断。
21.【答案】(1)α粒子中没有电子,1个He-4原子中含有2个电子
(2)BC##CB
【知识点】原子的定义与构成;原子的有关数量计算
【解析】【解答】(1)1个α粒子由2个中子和2个质子构成,α粒子带正电;1个α粒子与1个He - 4原子构成上的差别:α粒子中没有电子,1个He-4原子中含有2个电子;
(2)当a粒子轰击金属箔时,如图所示的运动轨迹不可能是BC,因为α粒子带正电,金原子核带正电,同种电荷相互排斥。
【分析】(1)根据原子一般是由质子,中子、电子构成的分析;
(2)根据α粒子带正电,金原子核带正电分析。
22.【答案】C
【知识点】原子和离子的相互转化
【解析】【解答】 A.分子是由原子构成的,原子不显电性,则分子不显电性,A错误;
B.原子不显电性,B错误;
C.阴离子中,核电荷数=质子数<核外电子数,C正确;
D.阳离子中,核电荷数=质子数>核外电子数,D错误。
故答案为:C。
【分析】 阳离子是核电荷数多于核外电子数的粒子,带正电荷,据此结合常见粒子的电性进行分析判断。
23.【答案】C
【知识点】原子的有关数量计算
【解析】【解答】Q2+是指在原子中失去了两个电子,带了两个单位的正电荷,由于在原子中核内质子数等于核外电子数;设该元素的核内质子数为Y则由关系式:Y-2=x,所以Y=x+2,又因为相对原子质量=核内质子数+中子数,所以中子数=相对原子质量-质子数=A-(x+2)=A-x-2。
故答案为:C。
【分析】根据相对原子质量=质子数+中子数计算。
24.【答案】C
【知识点】原子和离子的相互转化
【解析】【解答】解:设元素Y的核电荷数是b,因为X的核电荷数为a,它的阳离子Xm+,所以它的离子中带有(a-m)个电子,因为阳离子Xm+与元素Y的阴离子Yn-电子层结构相同,即核外电子数相同,所以b+n=a-m,即b=a-m-n。
故答案为:C。
【分析】原子失去几个电子,那么它的离子就带有几个单位的正电荷;原子得到几个电子,那么它的离子就带有几个单位的负电荷。
25.【答案】B
【知识点】原子和离子的相互转化
【解析】【解答】镁是12号元素,其原子核内有12个质子,带正电,在化学反应中失去最外层的2个电子,核外电子排布变为2、8,故答案为:B
【分析】镁离子是镁原子失去2个电子形成的,据此分析。
26.【答案】(1)阳;原子最外层电子数相等
(2)钾或K
(3)
【知识点】原子和离子的相互转化;原子结构示意图与离子结构示意图
【解析】【解答】(1)金属失去电子形成阳离子,因为锂、钠、钾等原子的最外层电子数相同,因此化学性质相似,故答案为:阳;原子最外层电子数相等;
(2)半径越大的离子越容易在电池正负极之间移动,充电速度越快。结合图示可知钾的离子半径最大,因此充电时间最短,故答案为:钾或K;
(3)钠原子失去一个电子形成钠离子,核内有11个质子,核外电子排布为2、8,则离子结构示意图为,故答案为:。
【分析】(1)根据原子失去电子形成阳离子,化学性质相似时最外层电子数相同;
(2)根据题中的信息及图片信息进行分析;
(3) 根据原子结构示意图的画法进行分析。
27.【答案】(1)11
(2)2;质子数
(3)得到;最外层电子数
(4)
(5)AE
【知识点】原子和离子的相互转化;原子结构示意图与离子结构示意图
【解析】【解答】(1)若E粒子带1个单位正电荷,则X=10+1=11;
(2)元素种类由核内质子数决定,A、B、C、D四种粒子共表示3种元素;
(3)D原子最外层电子数为7,在化学反应中易得到电子,原子的最外层电子数决定元素的化学性质;
(4)镁元素和氯元素形成的化合物的化学式为;
(5)最外层电子数为8的结构具有相对稳定结构,A—E结构示意图中具有相对稳定结构的是AE。
【分析】(1)根据原子里核内质子数等于核外电子数分析;
(2)根据核内质子数决定元素种类分析;
(3)根据最外层电子数决定元素化学性质分析;
(4)根据原子的最外层电子数确定化学式;
(5)根据最外层电子数为8的结构是稳定结构分析。
28.【答案】(1)原子
(2)核电荷数
(3)MgCl2
(4)S2-
【知识点】分子和原子的区别和联系;原子和离子的相互转化;原子结构示意图与离子结构示意图
【解析】【解答】(1)分子可以分解成原子,原子可以结合成分子,原子得失电子形成离子,根据转化关系可知,①表示的是原子;
(2)元素的种类由核内质子数即核电荷数相决定,BC属于同种元素,是因为核电荷数或者核内质子数相同;
(3)A为氯元素,B为镁元素,AB形成的化合物的化学式为MgCl2;
(4)当x=16时,该粒子为硫离子,符号为 S2-。
【分析】(1)根据分子,原子,离子的关系分析;
(2)根据元素的种类由核内质子数决定分析;
(3)根据元素化合价书写化学式;
(4)根据原子得失电子形成离子分析。
29.【答案】(1)Na+
(2)C+O2 CO2
(3)H2O或H2O2
【知识点】原子的定义与构成;原子和离子的相互转化
【解析】【解答】(1)D元素是钠元素,失去一个电子后形成带一个单位正电荷的钠离子,故填:Na+。
(2)B组成的单质是氧气,C是碳,碳在氧气中完全燃烧生成二氧化碳,故填:C+O2 CO2,故填:C+O2 CO2。
(3)A是氢元素,B是氧元素,这两种元素能形成水或过氧化氢,故填:H2O(或H2O2)。
【分析】根据氢原子核内没有中子,氧气能供给呼吸,及原子的核外电子排布方式分析
30.【答案】(1)Cl;S;O;Na
(2)S2-;Na2S、K2S或MgS
(3)
【知识点】原子和离子的相互转化
【解析】【解答】(1)由分析可知,A是Cl;B是S;C是O;D是Na;
(2)B元素形成常见单核离子为 ,由该离子形成的常见化合物,如 、K2S或MgS;
(3)氯气和碘化钾反应生成氯化钾和碘单质,文字表达式为: 。
【分析】(1)根据原子得失电子形成离子分析
(2)根据化学式书写方法分析
(3)根据氯气和碘化钾反应生成氯化钾和碘分析
试题分析部分
1、试卷总体分布分析
总分:93分
分值分布 客观题(占比) 34.0(36.6%)
主观题(占比) 59.0(63.4%)
题量分布 客观题(占比) 17(56.7%)
主观题(占比) 13(43.3%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
微粒的性质 8(26.7%) 29.0(31.2%)
离子 9(30.0%) 33.0(35.5%)
原子结构 13(43.3%) 31.0(33.3%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (66.7%)
2 容易 (23.3%)
3 困难 (10.0%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 物质的微粒性 22.0(23.7%) 1,2,5,6,7
2 原子和离子的相互转化 35.0(37.6%) 9,13,22,24,25,26,27,28,29,30
3 分子的定义与分子的特性 19.0(20.4%) 1,2,4,5,7,8
4 原子的定义与构成 18.0(19.4%) 10,11,12,16,18,20,21,29
5 分子和原子的区别和联系 6.0(6.5%) 3,28
6 核外电子在化学反应中的作用 6.0(6.5%) 14,15,16
7 原子的有关数量计算 21.0(22.6%) 9,10,11,12,13,17,18,20,21,23
8 原子结构示意图与离子结构示意图 23.0(24.7%) 17,19,26,27,28
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
