1.2 离子反应 课件(19张PPT)高中化学人教版(2019)必修 第一册
文档属性
| 名称 | 1.2 离子反应 课件(19张PPT)高中化学人教版(2019)必修 第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-22 09:47:37 | ||
图片预览






文档简介
(共19张PPT)
离子反应
历史故事
后主建兴三年(公元225年)诸葛亮为了擒拿南王孟获(历史上有名的七擒七纵),率军南征至云南西洱河,遇四口毒泉,其中一口为“哑泉”。
时逢天气好生炎热,人马引用了哑泉泉水后,一个个说不出话来。后来的一智者指教,复饮“安乐泉”泉水。
哑泉-----“人若饮之,则不能言,不过旬日必死”。
安乐泉 “随即吐出恶涎,便能言语”。
原来哑泉水中含有较多的硫酸铜,导致铜盐中毒,致哑、呕吐、腹泻、最后虚脱、痉挛致死。
而安乐泉水中含有较多的碱,其中的碱会在肠胃中与硫酸铜发生离子反应:
Cu2+ + 2OH- = Cu(OH)2↓
使人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而被排出,因此有解毒作用。
“哑泉致哑”、“安乐泉解毒”
混合前 混合后
CuSO4溶液
BaCl2溶液 问题1 CuSO4溶液和BaCl2溶液混合有什么变化?
①宏观现象
蓝色透明溶液
无色透明溶液
白色沉淀
蓝色溶液
②微观分析
CuSO4和BaCl2的 电离方程式 CuSO4===Cu2++SO42- BaCl2===Ba2+ +2Cl- 混合前两种 溶液中的离子 CuSO4溶液: Cu2+ 、SO42-
BaCl2溶液:
Ba2+ 、Cl-
混合后数目减少的离子 Ba2+ 、SO42- 混合后数目不变的离子 Cu2+、Cl- 反应实质 Ba2+ 和SO42-结合成BaSO4白色沉淀 问题2 CuSO4溶液和BaCl2溶液混合有什么变化?
BaSO4↓ + Cu2+ + Cl-
反应前 反应后
Cu2+ + SO42-
Ba2+ + Cl-
Ba2+ + SO42- == BaSO4 ↓
二、离子方程式:用实际参加反应的离子表示反应的式子
一、离子反应:有离子参加的反应叫离子反应
电解质在溶液中的反应实质上是离子之间的反应
离子反应
,这样的反应属于
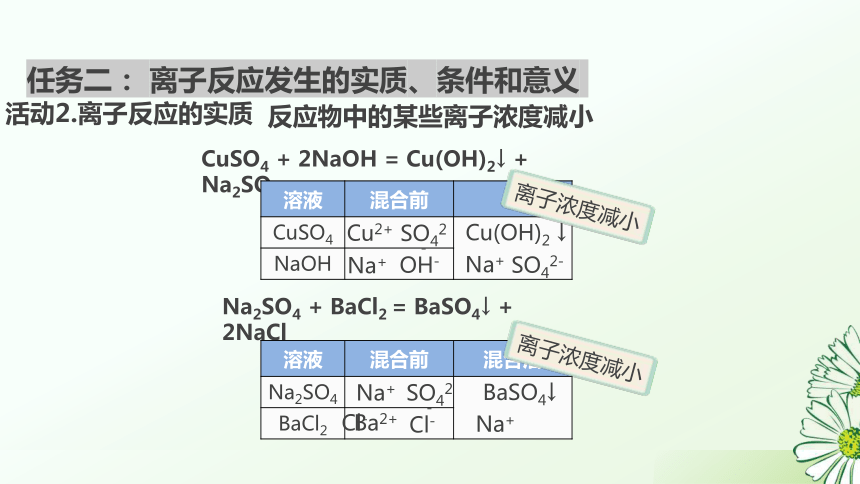
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
溶液 混合前
CuSO4
NaOH Cu2+
Na+
OH-
SO42-
Cu(OH)2 ↓
SO42-
Na+
任务二: 离子反应发生的实质、条件和意义
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
溶液 混合前 混合后
Na2SO4
BaCl2 Ba2+
Na+
Cl-
SO42-
BaSO4↓
Cl-
Na+
离子浓度减小
离子浓度减小
反应物中的某些离子浓度减小
活动2.离子反应的实质
编 号 溶液 编号 混合前溶液 中的离子 发生 混合的 溶液 混合后 溶液中的离子 生成的物质
① CuSO4 ①和②
② NaCl ②和③
③ BaCl2 ①和③
Cu2+ SO42-
Na+ Cl-
Ba2+ Cl-
Cu2+ SO42-
Na+ Cl-
无
Na+ Cl-
Ba2+ Cl-
无
Cu2+ Cl-
BaSO4
活动3.当任意两种或多种电解质溶液混合后,溶液中离子
之间是否能够发生反应
复分解型离子反应
条件
生成沉淀
生成气体
三者具备
其一即可
电解质
导电能力很弱
——难电离
如:弱酸、弱碱、水等
生成难电离
的物质
氧化还原型(置换反应)离子反应
活泼的金属(非金属)单质可以将不活泼的金属(非金属)单质从盐溶液或酸溶液中置换出来
离子反应发生的条件
活动4 写出下列物质反应的离子方程式,由此你能得出什么结论
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠
盐酸与氢氧化钾
硫酸与氢氧化钠
总结
活动4 写出下列物质反应的离子方程式,由此你能得出什么结论
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠 HCl+NaOH===NaCl+H2O H++OH-===H2O
盐酸与氢氧化钾 HCl+KOH===KCl+H2O H++OH-===H2O
硫酸与氢氧化钠 H2SO4+2NaOH===Na2SO4+2H2O H++OH-===H2O
总结 思考:能代表所有的强酸和强碱反应吗?
不能,例如:H2SO4 + Ba(OH)2 ==BaSO4 + 2H2O
1.写 书写化学方程式
2.拆 将易溶于水且易电离的物质拆写成离子形式
3.删 删去方程式两边不参加反应的离子,并将方程式化成最简
4.查 检查离子方程式两边各元素的原子个数和电荷总数是否相等
Na2SO4+BaCl2==BaSO4↓+2NaCl
任务三 如何正确书写离子反应方程式
SO42- + Ba2+ == BaSO4↓
SO42- + Ba2+ == BaSO4↓
2Na++SO42-+Ba2+ +2Cl— ==BaSO4↓+2Na++2Cl—
符号
离子方程式书写的最关键步骤是“拆”与“不拆”的理解判断。
强酸:HCl、HNO3、H2SO4、HClO4 、HBr、HI
强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2
大多数盐
拆写
“两易”
易溶易电离
钾钠铵盐硝酸盐
氯化物(除AgCl )
硫酸盐(除BaSO4、CaSO4、PbSO4)
不拆写
单质气体氧化物:CI2、CO2、CaO等
难溶性物质:CaCO3、BaCO3、Mg(OH)2 、Fe(OH)3 等
难电离物质
水
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3
弱碱:所有难溶性碱、 NH3 H2O
任务四:离子反应的应用
活动6 如何判断溶液中离子能不能大量共存
①生成难溶物CaCO3 ②生成微溶物CaSO4
③生成水 ④生成NH3·H2O
⑤生成H2O和CO2 ⑥能大量共存
常见的离子不共存归纳
(1)若阴、阳离子能相互结合生成难溶物或微溶性盐,则不能大量共存。
(2)弱碱的阳离子不能与OH-大量共存。
(3)弱酸根阴离子不能与H+大量共存。
(4)弱酸的酸式酸根阴离子与H+和OH-均不能大量共存。
(5)还需注意隐含条件
①“无色透明”溶液不存在有色离子,如:
②酸性溶液中不能大量存在与H+反应的离子
“酸性”溶液的不同描述:酸性溶液、pH<7的溶液、使石蕊溶液变红的溶液。
③碱性溶液中不能大量存在与OH-反应的离子
“碱性”溶液的不同描述:碱性溶液、pH>7的溶液、使石蕊溶液变蓝的溶液。
Cu2+ 蓝色
Fe3+ 棕黄色
Fe2+ 浅绿色
MnO4- 紫红色
CrO42- 黄色
Cr2O72- 橙色
思考: 某河道两旁有甲、乙两工厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。甲厂的废水呈碱性,则甲厂废水中所含的三种离子是什么
肯定有 肯定无
甲厂
乙厂
OH-
Ag+ Fe3+
Ag+ Fe3+
Cl-
Cl-
K+
NO3-
四项原则推断物质
(1)肯定性原则:根据题干或实验现象确定物质。
(2)互斥性原则:根据已确定的物质结合反应排除不存在的物质。
(3)进出性原则:注意实验过程中物质的引入对推断物质的干扰。
(4)电中性原则:在溶液中一定为电中性,阴、阳离子带的电荷数相等。
1.离子反应
2.离子方程式的书写
3.离子反应实质条件和意义
4.离子反应的应用
宏观
微观
符号
课堂小结
离子反应
历史故事
后主建兴三年(公元225年)诸葛亮为了擒拿南王孟获(历史上有名的七擒七纵),率军南征至云南西洱河,遇四口毒泉,其中一口为“哑泉”。
时逢天气好生炎热,人马引用了哑泉泉水后,一个个说不出话来。后来的一智者指教,复饮“安乐泉”泉水。
哑泉-----“人若饮之,则不能言,不过旬日必死”。
安乐泉 “随即吐出恶涎,便能言语”。
原来哑泉水中含有较多的硫酸铜,导致铜盐中毒,致哑、呕吐、腹泻、最后虚脱、痉挛致死。
而安乐泉水中含有较多的碱,其中的碱会在肠胃中与硫酸铜发生离子反应:
Cu2+ + 2OH- = Cu(OH)2↓
使人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而被排出,因此有解毒作用。
“哑泉致哑”、“安乐泉解毒”
混合前 混合后
CuSO4溶液
BaCl2溶液 问题1 CuSO4溶液和BaCl2溶液混合有什么变化?
①宏观现象
蓝色透明溶液
无色透明溶液
白色沉淀
蓝色溶液
②微观分析
CuSO4和BaCl2的 电离方程式 CuSO4===Cu2++SO42- BaCl2===Ba2+ +2Cl- 混合前两种 溶液中的离子 CuSO4溶液: Cu2+ 、SO42-
BaCl2溶液:
Ba2+ 、Cl-
混合后数目减少的离子 Ba2+ 、SO42- 混合后数目不变的离子 Cu2+、Cl- 反应实质 Ba2+ 和SO42-结合成BaSO4白色沉淀 问题2 CuSO4溶液和BaCl2溶液混合有什么变化?
BaSO4↓ + Cu2+ + Cl-
反应前 反应后
Cu2+ + SO42-
Ba2+ + Cl-
Ba2+ + SO42- == BaSO4 ↓
二、离子方程式:用实际参加反应的离子表示反应的式子
一、离子反应:有离子参加的反应叫离子反应
电解质在溶液中的反应实质上是离子之间的反应
离子反应
,这样的反应属于
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
溶液 混合前
CuSO4
NaOH Cu2+
Na+
OH-
SO42-
Cu(OH)2 ↓
SO42-
Na+
任务二: 离子反应发生的实质、条件和意义
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
溶液 混合前 混合后
Na2SO4
BaCl2 Ba2+
Na+
Cl-
SO42-
BaSO4↓
Cl-
Na+
离子浓度减小
离子浓度减小
反应物中的某些离子浓度减小
活动2.离子反应的实质
编 号 溶液 编号 混合前溶液 中的离子 发生 混合的 溶液 混合后 溶液中的离子 生成的物质
① CuSO4 ①和②
② NaCl ②和③
③ BaCl2 ①和③
Cu2+ SO42-
Na+ Cl-
Ba2+ Cl-
Cu2+ SO42-
Na+ Cl-
无
Na+ Cl-
Ba2+ Cl-
无
Cu2+ Cl-
BaSO4
活动3.当任意两种或多种电解质溶液混合后,溶液中离子
之间是否能够发生反应
复分解型离子反应
条件
生成沉淀
生成气体
三者具备
其一即可
电解质
导电能力很弱
——难电离
如:弱酸、弱碱、水等
生成难电离
的物质
氧化还原型(置换反应)离子反应
活泼的金属(非金属)单质可以将不活泼的金属(非金属)单质从盐溶液或酸溶液中置换出来
离子反应发生的条件
活动4 写出下列物质反应的离子方程式,由此你能得出什么结论
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠
盐酸与氢氧化钾
硫酸与氢氧化钠
总结
活动4 写出下列物质反应的离子方程式,由此你能得出什么结论
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠 HCl+NaOH===NaCl+H2O H++OH-===H2O
盐酸与氢氧化钾 HCl+KOH===KCl+H2O H++OH-===H2O
硫酸与氢氧化钠 H2SO4+2NaOH===Na2SO4+2H2O H++OH-===H2O
总结 思考:能代表所有的强酸和强碱反应吗?
不能,例如:H2SO4 + Ba(OH)2 ==BaSO4 + 2H2O
1.写 书写化学方程式
2.拆 将易溶于水且易电离的物质拆写成离子形式
3.删 删去方程式两边不参加反应的离子,并将方程式化成最简
4.查 检查离子方程式两边各元素的原子个数和电荷总数是否相等
Na2SO4+BaCl2==BaSO4↓+2NaCl
任务三 如何正确书写离子反应方程式
SO42- + Ba2+ == BaSO4↓
SO42- + Ba2+ == BaSO4↓
2Na++SO42-+Ba2+ +2Cl— ==BaSO4↓+2Na++2Cl—
符号
离子方程式书写的最关键步骤是“拆”与“不拆”的理解判断。
强酸:HCl、HNO3、H2SO4、HClO4 、HBr、HI
强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2
大多数盐
拆写
“两易”
易溶易电离
钾钠铵盐硝酸盐
氯化物(除AgCl )
硫酸盐(除BaSO4、CaSO4、PbSO4)
不拆写
单质气体氧化物:CI2、CO2、CaO等
难溶性物质:CaCO3、BaCO3、Mg(OH)2 、Fe(OH)3 等
难电离物质
水
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3
弱碱:所有难溶性碱、 NH3 H2O
任务四:离子反应的应用
活动6 如何判断溶液中离子能不能大量共存
①生成难溶物CaCO3 ②生成微溶物CaSO4
③生成水 ④生成NH3·H2O
⑤生成H2O和CO2 ⑥能大量共存
常见的离子不共存归纳
(1)若阴、阳离子能相互结合生成难溶物或微溶性盐,则不能大量共存。
(2)弱碱的阳离子不能与OH-大量共存。
(3)弱酸根阴离子不能与H+大量共存。
(4)弱酸的酸式酸根阴离子与H+和OH-均不能大量共存。
(5)还需注意隐含条件
①“无色透明”溶液不存在有色离子,如:
②酸性溶液中不能大量存在与H+反应的离子
“酸性”溶液的不同描述:酸性溶液、pH<7的溶液、使石蕊溶液变红的溶液。
③碱性溶液中不能大量存在与OH-反应的离子
“碱性”溶液的不同描述:碱性溶液、pH>7的溶液、使石蕊溶液变蓝的溶液。
Cu2+ 蓝色
Fe3+ 棕黄色
Fe2+ 浅绿色
MnO4- 紫红色
CrO42- 黄色
Cr2O72- 橙色
思考: 某河道两旁有甲、乙两工厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。甲厂的废水呈碱性,则甲厂废水中所含的三种离子是什么
肯定有 肯定无
甲厂
乙厂
OH-
Ag+ Fe3+
Ag+ Fe3+
Cl-
Cl-
K+
NO3-
四项原则推断物质
(1)肯定性原则:根据题干或实验现象确定物质。
(2)互斥性原则:根据已确定的物质结合反应排除不存在的物质。
(3)进出性原则:注意实验过程中物质的引入对推断物质的干扰。
(4)电中性原则:在溶液中一定为电中性,阴、阳离子带的电荷数相等。
1.离子反应
2.离子方程式的书写
3.离子反应实质条件和意义
4.离子反应的应用
宏观
微观
符号
课堂小结
