第四章-4.3-化学键 高中化学人教版必修第一册(共92张PPT)
文档属性
| 名称 | 第四章-4.3-化学键 高中化学人教版必修第一册(共92张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-23 16:39:53 | ||
图片预览











文档简介
(共92张PPT)
第四章 物质结构元素周期律
第三节 化学键
高中化学人教版必修第一册
必备知识
知识点1 离子键重点
例1-1 下图形象地表示了氯化钠的形成过程。下列叙述不正确的是( )
B
A.钠原子易失去1个电子,氯原子易得到1个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用形成 后,其结构的稳定性增强
D.氯化钠中存在离子键
【解析】A项:钠原子的最外层只有1个电子,易失去1个电子达到8电子稳定结构,
氯原子的最外层有7个电子,易得到1个电子达到8电子稳定结构(√)。
B项:钠原子具有强还原性,而具有弱氧化性, 与钠原子的化学性质不相似
(×)。
C、D项:与以离子键结合形成稳定的 (√)。
例1-2 (上海宝山中学期中)下列说法正确的是( )
C
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素原子与所有非金属元素原子间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系总能量降低
D.在化合物中,两个 间也存在离子键
【解析】A项:离子键是阴、阳离子间的静电作用(不仅仅是吸引作用),包括静
电吸引和静电排斥(×)。
B项:一般地,活泼金属元素原子与活泼非金属元素原子之间形成离子键,但不是所
有,如 中就不存在离子键(×)。
C项:钠原子与氯原子结合成氯化钠后体系总能量降低(√)。
D项:化合物中,只存在与之间的离子键,而两个 (不符合“阴、阳
离子之间”)间不存在离子键(×)。
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
例1-3 下列说法正确的是( )
A
A.含有离子键的化合物一定是离子化合物
B.离子化合物均易溶于水
C.元素周期表中第ⅠA族的元素之间不能形成离子键
D.离子化合物中不一定含有阴离子和阳离子
【解析】A项:含有离子键的化合物一定是离子化合物(√)。
B项:、 等是离子化合物,但它们均难溶于水(×)。
C项:元素周期表中第ⅠA族的和活泼碱金属元素之间可以形成离子键,如
(×)。
D项:离子化合物中一定含有阳离子和阴离子(×)。
例1-4 (东北师大附中段考)元素最高正价与最低负价的绝对值之差是4;元素与
元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物可能是
( )
D
A. B. C. D.
【解析】元素最高正价与最低负价的绝对值之差是4,则其最高正价为 ,最低负
价为,题中只有符合;和 的电子层结构相同,D项正确。
例1-5 下列电子式书写正确的是( )
A
A. B. C. D.
【解析】B项:由和 构成,其电子式正确的写法为 (×)。
C项: 是离子化合物,其电子式正确的写法为 (×)。
D项: 为离子化合物,其电子式正确的写法应为 (×)。
例1-6 用电子式表示下列离子化合物的形成过程。
(1)碘化钙:_ _______________________。
【解析】最外层有2个电子,最外层有7个电子,1个 失去的最外层的2个电子被
2个得到,每个 最外层均达到8电子稳定结构,故其形成过程可表示为
。
(2)硫化钠:_ _________________________。
【解析】最外层有1个电子,最外层有6个电子,2个 各失去最外层的1个电子
成为,1个得到2个电子成为,进而通过离子键形成 ,其形成过程可表
示为 。
知识点2 共价键重点
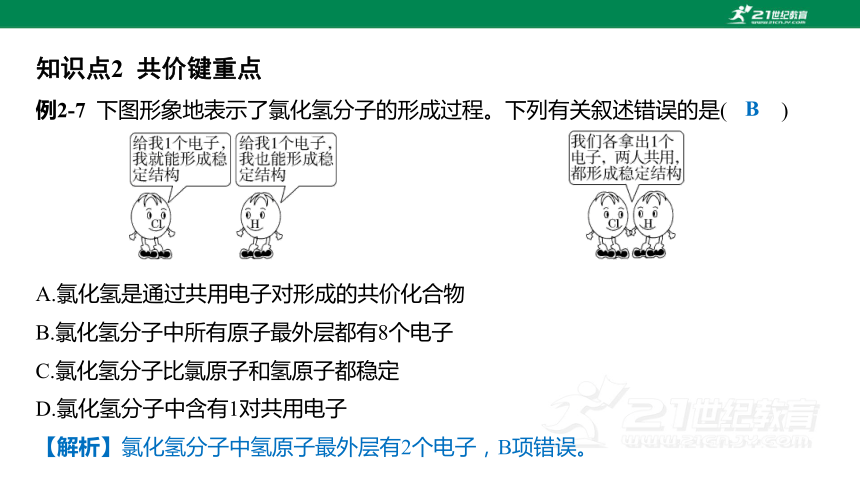
例2-7 下图形象地表示了氯化氢分子的形成过程。下列有关叙述错误的是( )
B
A.氯化氢是通过共用电子对形成的共价化合物
B.氯化氢分子中所有原子最外层都有8个电子
C.氯化氢分子比氯原子和氢原子都稳定
D.氯化氢分子中含有1对共用电子
【解析】氯化氢分子中氢原子最外层有2个电子,B项错误。
例2-8 下列关于共价键的说法正确的是( )
B
A.金属元素原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同种元素原子之间形成
D.稀有气体分子中存在共价键
例2-9 (湖北襄阳五中月考)下列物质中只含有共价键的是( )
C
A.、、、 B.、、、
C.、、、 D.、、、
【解析】、均含有离子键,A项错误; 含有离子键,B项错误;
、、、都只含有共价键,C项正确; 是活泼金属元素与活泼非
金属元素形成的过氧化物,含有离子键 中含有共价键),D项错误。
例2-10 [判断题]判断正误(正确的打“√”,错误的打“×”),并将错误的进行改正。
(1)氨气的电子式为 ( ) ,_ _______。
×
【解析】最外层有 5个电子,与3个形成3对共用电子,使 最外层达到8电子稳定
结构,题给电子式错在 最外层电子未全部标出(×)。
(2)四氯化碳的电子式为 ( ) ,_ ________。
×
【解析】最外层有7个电子,4个 与1个C形成4对共用电子,使各自最外层达到8
电子稳定结构,题给电子式错在 最外层电子未全部标出(×)。
(3) 的电子式为 ( ) ,_ _____。
×
【解析】 是共价化合物,电子式为 (×)。
(4)二氧化碳的电子式为 ( ) ,_ _______。
×
【解析】在中,C与每个 之间要形成2对共用电子,各原子最外层才能达到8电
子稳定结构(×)。
(5)次氯酸分子的结构式为 ( ) ,________。
√
【解析】是共价化合物,原子分别与、 原子形成1对共用电子,使分子中
各原子都达到稳定结构(√)。
(6) 的分子结构模型为 ( ) ,________。
√
【解析】分子的空间结构为 形(√)。
例2-11 人们发现金星大气层中有一种称为羰基硫的分子,其结构与 类似,下
列推测不正确的是( )
C
A. 是含有极性键的共价化合物
B. 为直线形分子
C. 的电子式为
D. 中所有原子最外层都满足8电子稳定结构
【解析】与 的结构相似(【方法】分子的空间结构
可用类比法(同主族元素结构和性质的相似性)来确定),
相当于是分子中的一个原子换成了 原子得到的化
合物。
由的电子式可知, 中所有原子最外层都满足8电子稳定结构。
. .
例2-12 (上海交大附中月考改编)下列属于含有非极性键的离子化合物的是( )
C
A. B. C. D.
【解析】中含有离子键和极性键,A项错误; 中仅含有共价键,是共价化
合物,B项错误;中含有离子键(和之间)和非极性键( 内部),
C项正确; 中仅含有离子键,D项错误。
知识点3 化学键
例3-13 (河北石家庄二中月考)
下列关于化学键的叙述正确的是( )
B
①化学键只存在于分子之间
②化学键只存在于直接相邻的原子或离子之间
③化学键是一种静电作用
④化学键是相邻原子之间强烈的相互吸引作用
⑤离子化合物可能含共价键
⑥共价化合物中可能含离子键
⑦金属元素原子和非金属元素原子之间只能形成离子键
A.②③⑦ B.②③⑤ C.②⑤⑥ D.①④⑤
【解析】化学键是指直接相邻的原子(或离子)之间强烈的相互作用,①错误,②
正确;无论是离子键还是共价键,粒子之间的相互作用都是静电作用,包括静电吸
引作用和静电排斥作用,③正确,④错误;离子化合物中可能含有共价键,但共价
化合物中一定不含离子键,⑤正确,⑥错误;金属元素原子和非金属元素原子之间
也可能形成共价键,如 等,⑦错误。
知识点4 化学键的比较及化合物类型的判断
例4-14 现有下列物质:
(1)只由离子键构成的物质是____(填序号,下同)。
(2)只由极性键构成的物质是____。
(3)只由非极性键构成的物质是____。
(4)由极性键和非极性键构成的物质是____。
(5)由离子键和极性键构成的物质是____。
(6)由离子键和非极性键构成的物质是____。
(7)属于离子化合物的物质是________。
(8)属于共价化合物的物质是______。
⑥
④
①
⑤
③
②
②③⑥
④⑤
【解析】根据物质类别、组成元素进行分析。
例4-15 (浙江卷改编)下列物质在熔融状态下能导电且只含一种化学键的是( )
B
A. B. C. D.
【解析】图示析题·思路具象化
知识点5 分子间作用力——范德华力和氢键
例5-16 下列关于分子间作用力的叙述不正确的是( )
A
A.分子间作用力是一种较弱的化学键
B.分子间作用力较弱,与化学键相比,破坏它所需能量较少
C.分子间作用力对物质的熔、沸点有影响
D.稀有气体分子间存在分子间作用力
【解析】A项:化学键是相邻原子(或离子)间强烈的相互作用,而分子间作用力
是一种比化学键弱得多的作用力(×)。
B项:分子间作用力较弱,与化学键相比,破坏它所需能量较少(√)。
C项:由分子构成的物质,分子间作用力越大,其熔点、沸点越高(√)。
D项:稀有气体是单原子分子,不存在化学键,但存在分子间作用力(√)。
例5-17 如图所示为元素周期表中短周期的一部分,其中的核电荷数为与 的核电
荷数之和。下列说法错误的是
( )
A
A.简单气态氢化物的稳定性:,因为 的简单气态氢化物分子间存在氢键
B.的最高价氧化物对应的水化物的酸性比的强,因为元素的非金属性:
C.熔、沸点:,因为 的相对分子质量较大,分子间作用力较强
D.简单离子半径:,因为它们具有相同的电子层结构且 的核电荷数更大
【解析】图示析题·思路具象化
妙解
A项:简单气态氢化物的稳定性由元素的非金属性强弱决定(×)。
B项:非金属性,所以酸性 (√)。
C项:与的组成和结构相似, 的相对分子质量较大,分子间作用力较强,
熔、沸点较高(√)。
D项:核外电子排布相同时,核电荷数越大,离子半径越小(√)。
知识点6 化学键的断裂、形成与物质变化
例6-18 [新考法·反应历程分析]近期科学家首次用射线激光技术观察到与 在
催化剂表面生成 的历程(部分微粒未画出),反应过程如图所示。下列说法正确
的是( )
B
A.状态Ⅰ 状态Ⅱ发生了化学变化
B.和生成 的过程存在电子转移
C. 是具有非极性共价键的直线形分子
D.状态Ⅲ 状态Ⅴ表示与 的反应
【解析】A项:状态Ⅰ 状态Ⅱ,只有化学键的断裂,没有化学键的形成,没有发生
化学变化(×)。
B项:和生成 的过程中,C元素的化合价发生变化,存在电子转移(√)。
C项:中C与 之间形成极性共价键(×)。
D项:状态Ⅲ 状态Ⅳ表示与反应,状态Ⅳ 状态Ⅴ表示 脱离催化剂表面
的过程(×)。
【学会了吗丨变式题】
1.(湖南长沙长郡中学月考)下列反应过程中,既有共价键的断裂,又有离子键的形成
的是( )
B
A.在中燃烧生成 B.和在加热条件下反应生成
C. 气体溶于水 D.食盐水蒸发结晶
【解析】、和中都只有共价键,反应 中既有共价键的断
裂,又有共价键的形成,A项不符合题意;反应 中既有共价键
中的的断裂,又有离子键(中与 之间)的形成,B项符合题
意;气体溶于水, 分子中的共价键断裂,无离子键的形成,C项不符合题意;
食盐水蒸发结晶有 晶体析出,有离子键的形成,但无共价键的断裂,D项不符
合题意。
关键能力
题型1 化学键类型和物质类别的判断
例19 (湖北云学新高考联盟学校联考)北京大学和中国科学院的化学工作者已成功研
制出碱金属与形成的球碳盐 ,实验测知该物质为离子化合物,具有良好的
超导性能。下列有关分析正确的是( )
B
A.中只含有离子键 B. 中既含有离子键又含有共价键
C.该晶体在熔融状态下不能导电 D.与 互为同素异形体
【解析】为离子化合物,则中一定含有离子键(与之间), 中
C与C之间还存在共价键,A项错误,B项正确;离子化合物在熔融状态下能电离出
自由移动的离子,能导电,C项错误;为单质, 表示质量数为12的碳原
子,二者不互为同素异形体,D项错误。
【学会了吗丨变式题】
2.(2023上海浦东新区建平中学月考)下列各组物质都属于含有共价键的离子化合物的
是( )
C
A.、 B.、
C.、 D.、
【解析】、、都是共价化合物,、、、
都是含有共价键的离子化合物, 是不含共价键的离子化合物,故C项符合题意。
题型28 电子稳定结构的判断
例20 下列物质中,所有原子最外层均满足8电子稳定结构的化合物是( )
B
A. B.
C.(正四面体形) D.
【解析】最外层有5个电子,与其他原子间共用3对电子达到稳定结构, 最外层有
7个电子,与其他原子间共用1对电子达到稳定结构,显然中的 最外层不满足8
电子稳定结构,A项错误;C最外层有4个电子,
与其他原子间共用4对电子达到稳定结构,则 中的原子最外层均满足8电子稳定
结构,B项正确;属于单质,C项错误;中 满足2电子稳定结构,D项错误。
【学会了吗丨变式题】
3.下列分子中各原子最外层均满足8电子稳定结构的是( )
A
A.、、 B.、、
C.、、 D.、、
【解析】中的、中的B、中的、(【提示】 (肼)的电
子式为 )中的最外层均不满足8电子稳定结构,中的、中的 、
中的、中的、中的 最外层电子数均超过8。
. .
例21 下列有关化学用语的表示错误的是__________________(填序号)。
的电子式: 的结构式:
的电子式: 的电子式: 的电子式:
的电子式: 的电子式: ⑧用电子式表示 的形成过
程: 的电子式:
①②③④⑤⑥⑦⑧
【解析】列表分析·逐项释疑惑
错误 正解 警示
① 漏写 原子的未共用电子对 ____________________ 勿漏写未共用电子对
② 混淆电子式与结构式 ________________ 结构式中的共用电子对用短线代
替,未共用电子对不用标明
③ 错误地将 型离子化合物中 的2个A离子合并书写 _________________________________ 书写离子化合物的电子式时,相
同的离子不能合并
④ 原子结合顺序写错, 原子达 到稳定结构需与其他原子共用 2对电子 _____________________ 原子结合顺序应使各原子最外层
达到稳定结构且符合客观事实
错误 正解 警示
⑤ 混淆简单阳离子和复杂阳离子 的电子式写法 简单阳离子的电子式为其离子符
号
⑥ 共用电子对数目写错,C、 原子最外层电子数写错 ________________________ 一般情况下,1个原子与其他原
子间的共用电子对数 该原
子最外层电子数( 除外)
续表
错误 正解 警示
⑦ 化合物类型不清楚,漏写 [ ]及所带电荷数 ______________________________ 书写化合物电子式的前提是准确
判断化合物类型
⑧ 混淆用电子式表示化合物的形 成过程和化学方程式 _______________________________ ___________________ “ ”前是原子的电子式,“ ”
后是化合物的电子式
的结构式为 ,则其电子式为 ,正确。
续表
高考聚焦
考向1 电子式、结构式等化学用语的书写与正误判断
例22 (高考组合)下列表示相关微粒的化学用语正确的是( )
C
A.(2023年6月浙江卷2C) 的电子式:
B.(2023江苏卷2A) 的电子式为
C.(2022北京卷2D) 的电子式:
D.(2024年1月浙江卷3C改编)用电子式表示 的形成过程:
【解析】列表分析·逐项释疑惑
选项 分析 正误
A 是离子化合物,其电子式为
B 带1个单位的正电荷,其电子式为
C 为离子化合物,由2个和1个构成,其中 的2个氧原 子间共用1对电子 √
D 是离子化合物,用“___________”表示其形成时的电子得失,由失电子的 原子指向得电子的 原子,题中箭头方向标反了
【学会了吗丨变式题】
4.(浙江卷组合)
(1)是离子化合物,各原子均满足8电子稳定结构。写出 的电子式
_ ___________。
【解析】是离子化合物, 的电子式为 。
(2)是离子化合物,各原子均满足8电子稳定结构, 的电子式是
_ ___________。
【解析】 是离子化合物,各原子均满足8电子稳定结构,则阴离子的结构式为
,故 的电子式为 。
考向2 元素推断与化学键、化合物类型的判断
例23 (2021全国甲卷)、、、为原子序数依次增大的短周期主族元素, 的最外
层电子数是和的最外层电子数之和,也是的最外层电子数的2倍。和 的单质
常温下均为气体。下列叙述正确的是( )
D
A.原子半径:
B.与 只能形成一种化合物
C. 的氧化物为碱性氧化物,不与强碱反应
D.、和 可形成既含有离子键又含有共价键的化合物
【解析】图示析题·思路具象化
原子半径:,A项错误;、可形成和,B项错误;
为两性氧化物,既可与强酸反应,又可与强碱反应,C项错误;、和 可形成化合
物和 ,二者均既含有离子键又含有共价键,D项正确。
【学会了吗丨变式题】
5.(2022年1月浙江卷)、、、为原子序数依次增大的短周期主族元素。和 同
族,的原子序数是的2倍, 是地壳中含量最多的金属元素。下列说法正确的是
( )
D
A.非金属性: B. 是离子化合物
C.、的氧化物对应的水化物均为强酸 D.与可形成化合物
【解析】图示析题·思路具象化
6.(2021山东卷改编)、为第三周期元素, 最高正价与最低负价的代数和为6,二者
形成的一种化合物能以 的形式存在,下列说法错误的是( )
D
A.原子半径:
B.简单氢化物的还原性:
C.同周期元素形成的单质中 氧化性最强
D. 的最高价氧化物对应的水化物为离子化合物
【解析】图示析题·思路具象化
根据同周期主族元素从左到右原子半径逐渐减小,可知原子半径: ,A项正确;非
金属性:,则简单氢化物的还原性:,B项正确;同周期元素中 的非金属
性最强,因此的氧化性最强,C项正确; 为共价化合物,D项错误。
考向3 物质结构与元素周期律
例24 (2021广东卷)一种麻醉剂的分子结构式如图所示。其中, 的原子核只有1个质
子;元素、、原子序数依次增大,且均位于的下一周期;元素的原子比 原
子多8个电子。下列说法不正确的是( )
C
A.是一种强酸 B.非金属性:
C.原子半径: D.中,的化合价为
【解析】图示析题·思路具象化
A项: (高氯酸)为强酸(√)。
B项:同周期主族元素从左到右,非金属性逐渐增强,故非金属性 。
C项:原子半径 (×)。
D项:无正价,中为价,为 价(√)。
习题课
A 基础练 学考测评
建议时间:20分钟
题组1 化学键和化合物类型的判断
1.[判断题·概念辨析]判断下列关于化学键的说法是否正确(正确的打“√”,错误的
打“×”)。
(1)共价化合物中只存在共价键( )
√
(2)离子化合物中只存在离子键( )
×
(3)只含共价键的物质一定是共价化合物( )
×
(4)只含非金属元素的物质一定不含离子键( )
×
(5)含有离子的物质中都含有离子键( )
×
(6)离子键只存在于化合物中( )
√
(7)离子化合物中一定含有离子键( )
√
(8)共价化合物中一定含有共价键( )
√
(9)离子键、共价键、分子间作用力都属于化学键( )
×
【解析】图示析题·思路具象化
由以上分析可知,离子化合物中一定存在离子键,可能含有共价键,如 ,
错误;含离子的物质中不一定含有离子键,如 溶液中含有离子,但不含
离子键,因为 溶于水时电离,离子键断裂,(5)错误;分子间作用力不属于化
学键,(9)错误。
2.(广东学业水平考试模拟)下列化合物中,既存在离子键又存在共价键的是( )
A
A. B. C. D.
【解析】中和之间存在离子键, 中存在共价键,A项符合题
意;中只存在共价键,B项不符合题意; 中只存在离子键,C项不符合题
意; 中只存在共价键,D项不符合题意。
3.(天津学考)下列物质中,含有非极性键的是( )
B
A. B. C. D.
【解析】中只含有极性键,A项不符合题意;中原子和 原子间是极性键,
两个原子间是非极性键,B项符合题意; 中只含有极性键,C项不符合题意;
中只含有离子键,D项不符合题意。
4.(2024河南郑州测试)过氧化钠常用作防毒面具的供氧剂,原理是
。下列说法正确的是( )
D
A. 的电子式为
B. 的结构示意图:
C.和 互为同位素
D. 属于离子化合物,既含离子键,又含共价键
【解析】A项: 属于离子化合物,其电子式为 (×)。
B项: 的结构示意图为 (×)。
C项:和 均是氧元素形成的不同单质,互为同素异形体(×)。
D项:属于离子化合物,和之间存在离子键, 中含有共价键
(√)。
5.饱和氯化钠溶液中存在如图所示过程,下列说法正确的是
( )
A
A. 固体溶于水,破坏了离子键
B.此过程在通电条件下才能发生
C.温度不变时,再加入 固体,溶质的物质的量浓度变大
D.此过程说明 只有在水溶液中才能电离
【解析】固体溶于水电离出和 ,破坏了离子键,该过程不需要通电,A
项正确,B项错误;饱和氯化钠溶液中,再加入 固体,溶质的物质的量浓度保持
不变,C项错误;此过程说明在水溶液中可以发生电离,但不能说明 只有在
水溶液中才能电离,事实上 在熔融状态下也能电离,D项错误。
6.(2024山东济南测试)现有下列变化:①____溶于水;②酒精 溶于水;
③____溶于水;④____溶于水;⑤__ __溶于水;⑥碘升华;⑦__
__分解;⑧氨气液化;⑨__ __熔化。请按要求回答下列问题:
(1)上述变化过程所涉及的物质(指加下划线的物质)中,只含有共价键的是
______________(填序号,后同),属于共价化合物的是____________。
(2)上述变化过程中没有化学键被破坏的是________,只有离子键被破坏的是______。
(3)⑦中 的电子式为_ _______,用电子式表示⑧中物质的形成过程
_ _____________。
①②⑤⑥⑦⑧
①②⑤⑦⑧
②⑥⑧
③⑨
【解析】是共价化合物,溶于水时破坏共价键;②酒精 是共价化合
物,属于非电解质,在水溶液中不能电离,溶于水时不破坏共价键; 是离子
化合物,溶于水时只破坏离子键; 是含有离子键和共价键的离子化合物,
溶于水时破坏离子键和共价键; 是共价化合物,溶于水时破坏共价键;⑥
碘是非金属单质,升华时不破坏共价键; 是共价化合物,分解时破坏的是共
价键;是共价化合物,液化时不破坏共价键; 是含有离子键和共价键
的离子化合物,熔化时只破坏离子键。
由上述分析可知,只含有共价键的是①②⑤⑥⑦⑧,属于共价化合物的是①②⑤⑦
⑧。上述变化过程中没有化学键被破坏的是②⑥⑧,只有离子键被破坏的是③⑨。
题组2 化学用语、化学键与元素周期律(表)的综合
7.、、、均为短周期元素,原子序数依次增大, 原子核外最外层电子数是次
外层电子数的2倍,与具有相同的电子层结构, 对应的氢化物为强酸。下列说
法错误的是( )
B
A.、 形成的化合物为共价化合物
B.用电子式表示、 形成化合物的过程为
C.、分别与 形成的化合物中,化学键类型不相同
D.最高价氧化物对应的水化物的酸性:
【解析】图示析题·思路具象化
8.(2024山东青岛即墨区第一中学月考)如表所示是元素周期表的一部分,针对表中的
元素①~⑩,填写下列空白:
主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA 0族
二 ① ② ③
三 ④ ⑤ ⑥ ⑦ ⑧
四 ⑨ ⑩
(1)在这些元素中,化学性质最不活泼的是____(填元素符号),原子结构示意图
为_ _______。元素⑩名称为____。
溴
【解析】题给元素中,最不活泼的是稀有气体元素 ,其原子结构示意图是 ,
元素⑩是 。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是________,碱
性最强的化合物的电子式是_ _________。
【解析】对于题给元素,其最高价氧化物对应的水化物中,酸性最强的是 ,碱
性最强的是 ,电子式为 。
(3)用电子式表示由元素④与⑥组成的化合物的形成过程:
_ ________________________,该化合物属于______(填“共价”或“离子”)化合物。
离子
【解析】④是,⑥是,它们形成离子化合物 ,其形成过程可表示
为 。
(4)元素①与⑦形成的化合物的电子式为_ _________,该化合物是由______
(填“极性”或“非极性”)键形成的。
极性
【解析】①是C,⑦是,二者形成的化合物 的电子式是 ,分子中含有
的化学键均属于极性键。
(5)③、⑥、⑦三种元素形成的简单离子的半径由大到小的顺序是______________
_______________。
【解析】、、形成的简单离子半径由大到小的顺序是 。
(6)元素③的最简单氢化物的结构式为_ _______;该氢化物常温下和元素⑦的单质
反应的化学方程式为________________________。
【解析】元素③的最简单氢化物的结构式是 ,它与 反应的化学方程式是
。
B 综合练 选考通关
建议时间:15分钟
9.下列分子中所有原子的最外层均满足8电子稳定结构的是( )
C
A. B. C. D.
【解析】中原子的最外层有4个电子,中原子的最外层有2个电子,
中原子的最外层有12个电子,都不满足8电子稳定结构,A、B、D项错误。 中1
个原子与3个原子形成3个共价键,、 原子的最外层均满足8电子稳定结构,C
项正确。
10.下列说法错误的是( )
D
A.氢气在氧气中燃烧时,存在化学键的断裂和形成
B.主族元素、能形成型化合物,则与 的原子序数之差可能为2或5
C.某主族元素原子最外层只有1个电子,它与氯原子既能形成离子键,又能形成共价键
D.有化学键断裂的过程一定是化学变化
【解析】在 中的燃烧是化学变化,其过程中一定存在旧化学键的断裂和新化学
键的形成,A项正确;主族元素、能形成型化合物,可能有、、 、
、 等,原子序数之差可能为1、2、3、5、8等,B项正确;某主族元素原
子最外层只有1个电子,可能为或碱金属元素,与 形成共价键,碱金属元素原
子与氯原子形成离子键,C项正确;、 等物质溶于水时,化学键会断裂,
但并没有新物质生成,不属于化学变化,D项错误。
11.[新情境· 加氢制燃料]
(2024湖南长沙期末) 加氢转化为燃料是
实现 减排的一个重要策略,我国科学
家在调控 加氢反应的选择性方面取得
新进展,其过程示意图如图所示。下列分
析正确的是( )
D
A.该过程中, 分子中极性键发生断裂
B. 的电子式为
C.该反应中 作还原剂
D.该反应的化学方程式为
【解析】分子中的化学键为非极性键,A项错误; 的电子式为 ,B项错
误;由题图过程知,和反应生成和,碳元素化合价由降低为 ,
,的化合价由0升高为 ,根据得失电子守恒和原子守恒得该反应的
化学方程式为 ,C项错误,D项正确。
12.已知、、、为短周期元素,、同主族,、、同周期, 的简单气态
氢化物的稳定性大于的简单气态氢化物的稳定性,、为金属元素, 的阳离子的
氧化性小于 的阳离子的氧化性。下列说法正确的是( )
A
A.、、、 的原子半径逐渐减小
B.与 形成的化合物中一定只含离子键
C.的简单气态氢化物的沸点一定高于 的简单气态氢化物的沸点
D.若与的原子序数相差5,则二者形成化合物的化学式一定为
【解析】、、、为短周期元素,、同主族, 的简单气态氢化物的稳定性
大于的简单气态氢化物的稳定性,则、分别为第二、三周期非金属元素, 、
、同周期,、为金属元素,的阳离子的氧化性小于 的阳离子的氧化性,则
、、位于第三周期且原子序数依次增大。由、、、 的相对位置关系可知,
、、、的原子半径逐渐减小,A项正确;与形成的化合物如 中含有离
子键和共价键,B项错误;、、 的简单气态氢化物分子间均存在氢键,其沸点均
比其同主族其他元素的简单气态氢化物的沸点高,但若为C,则为, 分子间
不存在氢键,由于的相对分子质量小于,故的沸点较低,C项错误;
与的原子序数相差5,可能形成、 ,D项错误。
13.如图所示是从元素周期表中截取的一个片段,其中、、、 均属于短周期元素。
请回答下列问题:
(1)若的单质为空气的主要成分之一,则 的原子结构示意图为_ _______。
【解析】空气的主要成分是和。由元素在元素周期表中的相对位置可知, 为
,为, 的原子结构示意图为 。
(2)若、、 的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,则
这三种酸的正盐的含氧酸根离子中,有两种电子数相等,这两种离子的离子符号分
别为_______、______。
【解析】三元酸为,即为,为,为 ,三种酸的正盐的含氧酸根离子
中,和 的电子数相等。
(3)若与和 的单质分别反应可以生成相对分子质量相同的两种化合物,其中
与 形成的化合物的电子式为_ ____________,所含化学键的类型为____________
_____。
离子键、共价键
【解析】与和分别反应生成和 ,二者的相对分子质量相等,其中
中既含有离子键又含有共价键。
14.A、B、、、是原子序数依次增大的短周期主族元素,其中A与同主族,与 同
主族,、B与A均可形成10电子化合物;B与的最外层电子数之比为 ,常见化合物
与水反应生成 的单质,所得溶液可使酚酞溶液变红。
请回答下列问题:
(1)元素的原子结构示意图为_ _______;化合物 的电子式为_______。
【解析】为 。
(2)化合物 中含有的化学键类型为_____(填字母)。
AC
A.离子键 B.极性键 C.非极性键
【解析】为 ,既含有离子键又含有非极性键。
(3)化合物和 中,沸点较高的是_____(填化学式)。
【解析】常温下,为液体,为气体, 的沸点较高。
(4)与 发生氧化还原反应的化学方程式为____________________________
____。
【解析】与反应生成和 。
【解析】由与水反应生成的单质,所得溶液可使酚酞溶液变红知,为 ,
则为,为;又与同主族,则为;B与的最外层电子数之比为,则B为C;由 、
B与A均可形成10电子化合物,A与同主族知,A为 。
C 培优练 能力提升
15.(全国Ⅱ卷改编)一种由短周期主族元素组成的化合物(如图所示),具有良好的储
氢性能,其中元素、、、 的原子序数依次增大且总和为24。下列有关叙述错误
的是( )
D
A.该化合物中,、、 之间均为共价键
B. 的单质能与水反应
C. 的最高化合价氧化物的水化物为强酸
D.的氟化物 中原子均为8电子稳定结构
【解析】图示析题·思路具象化
从该化合物的成键情况可确定、B、之间均为共价键,A项正确; 为活泼金属,
能与水反应生成和,B项正确;氮元素的最高价氧化物的水化物 是强
酸,C项正确; 中B原子不满足8电子稳定结构,D项错误。
16.在遭遇冰雪灾害时,常使用一种融雪剂,其主要成分的化学式为,、 均为
周期表前20号元素,其阳离子和阴离子的电子层结构相同,且含有
电子。
(1)该融雪剂的化学式是_______,该物质中化学键类型是________,电子式是
_ ______________。
离子键
【解析】该融雪剂的化学式是 ,其化学键类型是离子键,电子式
是 。
(2)D、均为短周期主族元素,其原子的最外层电子数都是电子层数的2倍,D与
相邻,则D的离子结构示意图是_ _______;D与能形成一种结构类似于 的三原
子分子,且每个原子均达到了8电子稳定结构,该分子的电子式为_ _______,化学键
类型为________。
共价键
【解析】D、原子的最外层电子数是其电子层数的2倍,满足条件的分别是C和 ,
又D与相邻,则D是,是C;的结构示意图是 ,C与 形成的三原子分子
是,结构与 相似,电子式为 ,其化学键类型为共价键。
(3)是与D同主族的短周期元素,是第三周期金属性最强的元素,的单质与
的常见单质反应时有两种产物:不加热时生成______(填化学式),其化学键类型
为________;加热时生成_______(填化学式),其化学键类型为________________
__________,电子式为_ _____________。
离子键
离子键和(非极性)共价键
【解析】与D同主族且为短周期元素,则是 ,第三周期金属性最强的元素是
,与在不加热时反应生成 ,其化学键类型是离子键;加热时反应生成
,其化学键类型是离子键和(非极性)共价键,电子式是 。
【解析】由题给融雪剂的化学式 及阳离子和阴离子的电子层结构相同,可推断该
化合物是离子化合物,阳离子是,阴离子是;由含有 电子,
可知每个离子的电子数为,由此判断出是,是 。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
第四章 物质结构元素周期律
第三节 化学键
高中化学人教版必修第一册
必备知识
知识点1 离子键重点
例1-1 下图形象地表示了氯化钠的形成过程。下列叙述不正确的是( )
B
A.钠原子易失去1个电子,氯原子易得到1个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用形成 后,其结构的稳定性增强
D.氯化钠中存在离子键
【解析】A项:钠原子的最外层只有1个电子,易失去1个电子达到8电子稳定结构,
氯原子的最外层有7个电子,易得到1个电子达到8电子稳定结构(√)。
B项:钠原子具有强还原性,而具有弱氧化性, 与钠原子的化学性质不相似
(×)。
C、D项:与以离子键结合形成稳定的 (√)。
例1-2 (上海宝山中学期中)下列说法正确的是( )
C
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素原子与所有非金属元素原子间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系总能量降低
D.在化合物中,两个 间也存在离子键
【解析】A项:离子键是阴、阳离子间的静电作用(不仅仅是吸引作用),包括静
电吸引和静电排斥(×)。
B项:一般地,活泼金属元素原子与活泼非金属元素原子之间形成离子键,但不是所
有,如 中就不存在离子键(×)。
C项:钠原子与氯原子结合成氯化钠后体系总能量降低(√)。
D项:化合物中,只存在与之间的离子键,而两个 (不符合“阴、阳
离子之间”)间不存在离子键(×)。
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
例1-3 下列说法正确的是( )
A
A.含有离子键的化合物一定是离子化合物
B.离子化合物均易溶于水
C.元素周期表中第ⅠA族的元素之间不能形成离子键
D.离子化合物中不一定含有阴离子和阳离子
【解析】A项:含有离子键的化合物一定是离子化合物(√)。
B项:、 等是离子化合物,但它们均难溶于水(×)。
C项:元素周期表中第ⅠA族的和活泼碱金属元素之间可以形成离子键,如
(×)。
D项:离子化合物中一定含有阳离子和阴离子(×)。
例1-4 (东北师大附中段考)元素最高正价与最低负价的绝对值之差是4;元素与
元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物可能是
( )
D
A. B. C. D.
【解析】元素最高正价与最低负价的绝对值之差是4,则其最高正价为 ,最低负
价为,题中只有符合;和 的电子层结构相同,D项正确。
例1-5 下列电子式书写正确的是( )
A
A. B. C. D.
【解析】B项:由和 构成,其电子式正确的写法为 (×)。
C项: 是离子化合物,其电子式正确的写法为 (×)。
D项: 为离子化合物,其电子式正确的写法应为 (×)。
例1-6 用电子式表示下列离子化合物的形成过程。
(1)碘化钙:_ _______________________。
【解析】最外层有2个电子,最外层有7个电子,1个 失去的最外层的2个电子被
2个得到,每个 最外层均达到8电子稳定结构,故其形成过程可表示为
。
(2)硫化钠:_ _________________________。
【解析】最外层有1个电子,最外层有6个电子,2个 各失去最外层的1个电子
成为,1个得到2个电子成为,进而通过离子键形成 ,其形成过程可表
示为 。
知识点2 共价键重点
例2-7 下图形象地表示了氯化氢分子的形成过程。下列有关叙述错误的是( )
B
A.氯化氢是通过共用电子对形成的共价化合物
B.氯化氢分子中所有原子最外层都有8个电子
C.氯化氢分子比氯原子和氢原子都稳定
D.氯化氢分子中含有1对共用电子
【解析】氯化氢分子中氢原子最外层有2个电子,B项错误。
例2-8 下列关于共价键的说法正确的是( )
B
A.金属元素原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同种元素原子之间形成
D.稀有气体分子中存在共价键
例2-9 (湖北襄阳五中月考)下列物质中只含有共价键的是( )
C
A.、、、 B.、、、
C.、、、 D.、、、
【解析】、均含有离子键,A项错误; 含有离子键,B项错误;
、、、都只含有共价键,C项正确; 是活泼金属元素与活泼非
金属元素形成的过氧化物,含有离子键 中含有共价键),D项错误。
例2-10 [判断题]判断正误(正确的打“√”,错误的打“×”),并将错误的进行改正。
(1)氨气的电子式为 ( ) ,_ _______。
×
【解析】最外层有 5个电子,与3个形成3对共用电子,使 最外层达到8电子稳定
结构,题给电子式错在 最外层电子未全部标出(×)。
(2)四氯化碳的电子式为 ( ) ,_ ________。
×
【解析】最外层有7个电子,4个 与1个C形成4对共用电子,使各自最外层达到8
电子稳定结构,题给电子式错在 最外层电子未全部标出(×)。
(3) 的电子式为 ( ) ,_ _____。
×
【解析】 是共价化合物,电子式为 (×)。
(4)二氧化碳的电子式为 ( ) ,_ _______。
×
【解析】在中,C与每个 之间要形成2对共用电子,各原子最外层才能达到8电
子稳定结构(×)。
(5)次氯酸分子的结构式为 ( ) ,________。
√
【解析】是共价化合物,原子分别与、 原子形成1对共用电子,使分子中
各原子都达到稳定结构(√)。
(6) 的分子结构模型为 ( ) ,________。
√
【解析】分子的空间结构为 形(√)。
例2-11 人们发现金星大气层中有一种称为羰基硫的分子,其结构与 类似,下
列推测不正确的是( )
C
A. 是含有极性键的共价化合物
B. 为直线形分子
C. 的电子式为
D. 中所有原子最外层都满足8电子稳定结构
【解析】与 的结构相似(【方法】分子的空间结构
可用类比法(同主族元素结构和性质的相似性)来确定),
相当于是分子中的一个原子换成了 原子得到的化
合物。
由的电子式可知, 中所有原子最外层都满足8电子稳定结构。
. .
例2-12 (上海交大附中月考改编)下列属于含有非极性键的离子化合物的是( )
C
A. B. C. D.
【解析】中含有离子键和极性键,A项错误; 中仅含有共价键,是共价化
合物,B项错误;中含有离子键(和之间)和非极性键( 内部),
C项正确; 中仅含有离子键,D项错误。
知识点3 化学键
例3-13 (河北石家庄二中月考)
下列关于化学键的叙述正确的是( )
B
①化学键只存在于分子之间
②化学键只存在于直接相邻的原子或离子之间
③化学键是一种静电作用
④化学键是相邻原子之间强烈的相互吸引作用
⑤离子化合物可能含共价键
⑥共价化合物中可能含离子键
⑦金属元素原子和非金属元素原子之间只能形成离子键
A.②③⑦ B.②③⑤ C.②⑤⑥ D.①④⑤
【解析】化学键是指直接相邻的原子(或离子)之间强烈的相互作用,①错误,②
正确;无论是离子键还是共价键,粒子之间的相互作用都是静电作用,包括静电吸
引作用和静电排斥作用,③正确,④错误;离子化合物中可能含有共价键,但共价
化合物中一定不含离子键,⑤正确,⑥错误;金属元素原子和非金属元素原子之间
也可能形成共价键,如 等,⑦错误。
知识点4 化学键的比较及化合物类型的判断
例4-14 现有下列物质:
(1)只由离子键构成的物质是____(填序号,下同)。
(2)只由极性键构成的物质是____。
(3)只由非极性键构成的物质是____。
(4)由极性键和非极性键构成的物质是____。
(5)由离子键和极性键构成的物质是____。
(6)由离子键和非极性键构成的物质是____。
(7)属于离子化合物的物质是________。
(8)属于共价化合物的物质是______。
⑥
④
①
⑤
③
②
②③⑥
④⑤
【解析】根据物质类别、组成元素进行分析。
例4-15 (浙江卷改编)下列物质在熔融状态下能导电且只含一种化学键的是( )
B
A. B. C. D.
【解析】图示析题·思路具象化
知识点5 分子间作用力——范德华力和氢键
例5-16 下列关于分子间作用力的叙述不正确的是( )
A
A.分子间作用力是一种较弱的化学键
B.分子间作用力较弱,与化学键相比,破坏它所需能量较少
C.分子间作用力对物质的熔、沸点有影响
D.稀有气体分子间存在分子间作用力
【解析】A项:化学键是相邻原子(或离子)间强烈的相互作用,而分子间作用力
是一种比化学键弱得多的作用力(×)。
B项:分子间作用力较弱,与化学键相比,破坏它所需能量较少(√)。
C项:由分子构成的物质,分子间作用力越大,其熔点、沸点越高(√)。
D项:稀有气体是单原子分子,不存在化学键,但存在分子间作用力(√)。
例5-17 如图所示为元素周期表中短周期的一部分,其中的核电荷数为与 的核电
荷数之和。下列说法错误的是
( )
A
A.简单气态氢化物的稳定性:,因为 的简单气态氢化物分子间存在氢键
B.的最高价氧化物对应的水化物的酸性比的强,因为元素的非金属性:
C.熔、沸点:,因为 的相对分子质量较大,分子间作用力较强
D.简单离子半径:,因为它们具有相同的电子层结构且 的核电荷数更大
【解析】图示析题·思路具象化
妙解
A项:简单气态氢化物的稳定性由元素的非金属性强弱决定(×)。
B项:非金属性,所以酸性 (√)。
C项:与的组成和结构相似, 的相对分子质量较大,分子间作用力较强,
熔、沸点较高(√)。
D项:核外电子排布相同时,核电荷数越大,离子半径越小(√)。
知识点6 化学键的断裂、形成与物质变化
例6-18 [新考法·反应历程分析]近期科学家首次用射线激光技术观察到与 在
催化剂表面生成 的历程(部分微粒未画出),反应过程如图所示。下列说法正确
的是( )
B
A.状态Ⅰ 状态Ⅱ发生了化学变化
B.和生成 的过程存在电子转移
C. 是具有非极性共价键的直线形分子
D.状态Ⅲ 状态Ⅴ表示与 的反应
【解析】A项:状态Ⅰ 状态Ⅱ,只有化学键的断裂,没有化学键的形成,没有发生
化学变化(×)。
B项:和生成 的过程中,C元素的化合价发生变化,存在电子转移(√)。
C项:中C与 之间形成极性共价键(×)。
D项:状态Ⅲ 状态Ⅳ表示与反应,状态Ⅳ 状态Ⅴ表示 脱离催化剂表面
的过程(×)。
【学会了吗丨变式题】
1.(湖南长沙长郡中学月考)下列反应过程中,既有共价键的断裂,又有离子键的形成
的是( )
B
A.在中燃烧生成 B.和在加热条件下反应生成
C. 气体溶于水 D.食盐水蒸发结晶
【解析】、和中都只有共价键,反应 中既有共价键的断
裂,又有共价键的形成,A项不符合题意;反应 中既有共价键
中的的断裂,又有离子键(中与 之间)的形成,B项符合题
意;气体溶于水, 分子中的共价键断裂,无离子键的形成,C项不符合题意;
食盐水蒸发结晶有 晶体析出,有离子键的形成,但无共价键的断裂,D项不符
合题意。
关键能力
题型1 化学键类型和物质类别的判断
例19 (湖北云学新高考联盟学校联考)北京大学和中国科学院的化学工作者已成功研
制出碱金属与形成的球碳盐 ,实验测知该物质为离子化合物,具有良好的
超导性能。下列有关分析正确的是( )
B
A.中只含有离子键 B. 中既含有离子键又含有共价键
C.该晶体在熔融状态下不能导电 D.与 互为同素异形体
【解析】为离子化合物,则中一定含有离子键(与之间), 中
C与C之间还存在共价键,A项错误,B项正确;离子化合物在熔融状态下能电离出
自由移动的离子,能导电,C项错误;为单质, 表示质量数为12的碳原
子,二者不互为同素异形体,D项错误。
【学会了吗丨变式题】
2.(2023上海浦东新区建平中学月考)下列各组物质都属于含有共价键的离子化合物的
是( )
C
A.、 B.、
C.、 D.、
【解析】、、都是共价化合物,、、、
都是含有共价键的离子化合物, 是不含共价键的离子化合物,故C项符合题意。
题型28 电子稳定结构的判断
例20 下列物质中,所有原子最外层均满足8电子稳定结构的化合物是( )
B
A. B.
C.(正四面体形) D.
【解析】最外层有5个电子,与其他原子间共用3对电子达到稳定结构, 最外层有
7个电子,与其他原子间共用1对电子达到稳定结构,显然中的 最外层不满足8
电子稳定结构,A项错误;C最外层有4个电子,
与其他原子间共用4对电子达到稳定结构,则 中的原子最外层均满足8电子稳定
结构,B项正确;属于单质,C项错误;中 满足2电子稳定结构,D项错误。
【学会了吗丨变式题】
3.下列分子中各原子最外层均满足8电子稳定结构的是( )
A
A.、、 B.、、
C.、、 D.、、
【解析】中的、中的B、中的、(【提示】 (肼)的电
子式为 )中的最外层均不满足8电子稳定结构,中的、中的 、
中的、中的、中的 最外层电子数均超过8。
. .
例21 下列有关化学用语的表示错误的是__________________(填序号)。
的电子式: 的结构式:
的电子式: 的电子式: 的电子式:
的电子式: 的电子式: ⑧用电子式表示 的形成过
程: 的电子式:
①②③④⑤⑥⑦⑧
【解析】列表分析·逐项释疑惑
错误 正解 警示
① 漏写 原子的未共用电子对 ____________________ 勿漏写未共用电子对
② 混淆电子式与结构式 ________________ 结构式中的共用电子对用短线代
替,未共用电子对不用标明
③ 错误地将 型离子化合物中 的2个A离子合并书写 _________________________________ 书写离子化合物的电子式时,相
同的离子不能合并
④ 原子结合顺序写错, 原子达 到稳定结构需与其他原子共用 2对电子 _____________________ 原子结合顺序应使各原子最外层
达到稳定结构且符合客观事实
错误 正解 警示
⑤ 混淆简单阳离子和复杂阳离子 的电子式写法 简单阳离子的电子式为其离子符
号
⑥ 共用电子对数目写错,C、 原子最外层电子数写错 ________________________ 一般情况下,1个原子与其他原
子间的共用电子对数 该原
子最外层电子数( 除外)
续表
错误 正解 警示
⑦ 化合物类型不清楚,漏写 [ ]及所带电荷数 ______________________________ 书写化合物电子式的前提是准确
判断化合物类型
⑧ 混淆用电子式表示化合物的形 成过程和化学方程式 _______________________________ ___________________ “ ”前是原子的电子式,“ ”
后是化合物的电子式
的结构式为 ,则其电子式为 ,正确。
续表
高考聚焦
考向1 电子式、结构式等化学用语的书写与正误判断
例22 (高考组合)下列表示相关微粒的化学用语正确的是( )
C
A.(2023年6月浙江卷2C) 的电子式:
B.(2023江苏卷2A) 的电子式为
C.(2022北京卷2D) 的电子式:
D.(2024年1月浙江卷3C改编)用电子式表示 的形成过程:
【解析】列表分析·逐项释疑惑
选项 分析 正误
A 是离子化合物,其电子式为
B 带1个单位的正电荷,其电子式为
C 为离子化合物,由2个和1个构成,其中 的2个氧原 子间共用1对电子 √
D 是离子化合物,用“___________”表示其形成时的电子得失,由失电子的 原子指向得电子的 原子,题中箭头方向标反了
【学会了吗丨变式题】
4.(浙江卷组合)
(1)是离子化合物,各原子均满足8电子稳定结构。写出 的电子式
_ ___________。
【解析】是离子化合物, 的电子式为 。
(2)是离子化合物,各原子均满足8电子稳定结构, 的电子式是
_ ___________。
【解析】 是离子化合物,各原子均满足8电子稳定结构,则阴离子的结构式为
,故 的电子式为 。
考向2 元素推断与化学键、化合物类型的判断
例23 (2021全国甲卷)、、、为原子序数依次增大的短周期主族元素, 的最外
层电子数是和的最外层电子数之和,也是的最外层电子数的2倍。和 的单质
常温下均为气体。下列叙述正确的是( )
D
A.原子半径:
B.与 只能形成一种化合物
C. 的氧化物为碱性氧化物,不与强碱反应
D.、和 可形成既含有离子键又含有共价键的化合物
【解析】图示析题·思路具象化
原子半径:,A项错误;、可形成和,B项错误;
为两性氧化物,既可与强酸反应,又可与强碱反应,C项错误;、和 可形成化合
物和 ,二者均既含有离子键又含有共价键,D项正确。
【学会了吗丨变式题】
5.(2022年1月浙江卷)、、、为原子序数依次增大的短周期主族元素。和 同
族,的原子序数是的2倍, 是地壳中含量最多的金属元素。下列说法正确的是
( )
D
A.非金属性: B. 是离子化合物
C.、的氧化物对应的水化物均为强酸 D.与可形成化合物
【解析】图示析题·思路具象化
6.(2021山东卷改编)、为第三周期元素, 最高正价与最低负价的代数和为6,二者
形成的一种化合物能以 的形式存在,下列说法错误的是( )
D
A.原子半径:
B.简单氢化物的还原性:
C.同周期元素形成的单质中 氧化性最强
D. 的最高价氧化物对应的水化物为离子化合物
【解析】图示析题·思路具象化
根据同周期主族元素从左到右原子半径逐渐减小,可知原子半径: ,A项正确;非
金属性:,则简单氢化物的还原性:,B项正确;同周期元素中 的非金属
性最强,因此的氧化性最强,C项正确; 为共价化合物,D项错误。
考向3 物质结构与元素周期律
例24 (2021广东卷)一种麻醉剂的分子结构式如图所示。其中, 的原子核只有1个质
子;元素、、原子序数依次增大,且均位于的下一周期;元素的原子比 原
子多8个电子。下列说法不正确的是( )
C
A.是一种强酸 B.非金属性:
C.原子半径: D.中,的化合价为
【解析】图示析题·思路具象化
A项: (高氯酸)为强酸(√)。
B项:同周期主族元素从左到右,非金属性逐渐增强,故非金属性 。
C项:原子半径 (×)。
D项:无正价,中为价,为 价(√)。
习题课
A 基础练 学考测评
建议时间:20分钟
题组1 化学键和化合物类型的判断
1.[判断题·概念辨析]判断下列关于化学键的说法是否正确(正确的打“√”,错误的
打“×”)。
(1)共价化合物中只存在共价键( )
√
(2)离子化合物中只存在离子键( )
×
(3)只含共价键的物质一定是共价化合物( )
×
(4)只含非金属元素的物质一定不含离子键( )
×
(5)含有离子的物质中都含有离子键( )
×
(6)离子键只存在于化合物中( )
√
(7)离子化合物中一定含有离子键( )
√
(8)共价化合物中一定含有共价键( )
√
(9)离子键、共价键、分子间作用力都属于化学键( )
×
【解析】图示析题·思路具象化
由以上分析可知,离子化合物中一定存在离子键,可能含有共价键,如 ,
错误;含离子的物质中不一定含有离子键,如 溶液中含有离子,但不含
离子键,因为 溶于水时电离,离子键断裂,(5)错误;分子间作用力不属于化
学键,(9)错误。
2.(广东学业水平考试模拟)下列化合物中,既存在离子键又存在共价键的是( )
A
A. B. C. D.
【解析】中和之间存在离子键, 中存在共价键,A项符合题
意;中只存在共价键,B项不符合题意; 中只存在离子键,C项不符合题
意; 中只存在共价键,D项不符合题意。
3.(天津学考)下列物质中,含有非极性键的是( )
B
A. B. C. D.
【解析】中只含有极性键,A项不符合题意;中原子和 原子间是极性键,
两个原子间是非极性键,B项符合题意; 中只含有极性键,C项不符合题意;
中只含有离子键,D项不符合题意。
4.(2024河南郑州测试)过氧化钠常用作防毒面具的供氧剂,原理是
。下列说法正确的是( )
D
A. 的电子式为
B. 的结构示意图:
C.和 互为同位素
D. 属于离子化合物,既含离子键,又含共价键
【解析】A项: 属于离子化合物,其电子式为 (×)。
B项: 的结构示意图为 (×)。
C项:和 均是氧元素形成的不同单质,互为同素异形体(×)。
D项:属于离子化合物,和之间存在离子键, 中含有共价键
(√)。
5.饱和氯化钠溶液中存在如图所示过程,下列说法正确的是
( )
A
A. 固体溶于水,破坏了离子键
B.此过程在通电条件下才能发生
C.温度不变时,再加入 固体,溶质的物质的量浓度变大
D.此过程说明 只有在水溶液中才能电离
【解析】固体溶于水电离出和 ,破坏了离子键,该过程不需要通电,A
项正确,B项错误;饱和氯化钠溶液中,再加入 固体,溶质的物质的量浓度保持
不变,C项错误;此过程说明在水溶液中可以发生电离,但不能说明 只有在
水溶液中才能电离,事实上 在熔融状态下也能电离,D项错误。
6.(2024山东济南测试)现有下列变化:①____溶于水;②酒精 溶于水;
③____溶于水;④____溶于水;⑤__ __溶于水;⑥碘升华;⑦__
__分解;⑧氨气液化;⑨__ __熔化。请按要求回答下列问题:
(1)上述变化过程所涉及的物质(指加下划线的物质)中,只含有共价键的是
______________(填序号,后同),属于共价化合物的是____________。
(2)上述变化过程中没有化学键被破坏的是________,只有离子键被破坏的是______。
(3)⑦中 的电子式为_ _______,用电子式表示⑧中物质的形成过程
_ _____________。
①②⑤⑥⑦⑧
①②⑤⑦⑧
②⑥⑧
③⑨
【解析】是共价化合物,溶于水时破坏共价键;②酒精 是共价化合
物,属于非电解质,在水溶液中不能电离,溶于水时不破坏共价键; 是离子
化合物,溶于水时只破坏离子键; 是含有离子键和共价键的离子化合物,
溶于水时破坏离子键和共价键; 是共价化合物,溶于水时破坏共价键;⑥
碘是非金属单质,升华时不破坏共价键; 是共价化合物,分解时破坏的是共
价键;是共价化合物,液化时不破坏共价键; 是含有离子键和共价键
的离子化合物,熔化时只破坏离子键。
由上述分析可知,只含有共价键的是①②⑤⑥⑦⑧,属于共价化合物的是①②⑤⑦
⑧。上述变化过程中没有化学键被破坏的是②⑥⑧,只有离子键被破坏的是③⑨。
题组2 化学用语、化学键与元素周期律(表)的综合
7.、、、均为短周期元素,原子序数依次增大, 原子核外最外层电子数是次
外层电子数的2倍,与具有相同的电子层结构, 对应的氢化物为强酸。下列说
法错误的是( )
B
A.、 形成的化合物为共价化合物
B.用电子式表示、 形成化合物的过程为
C.、分别与 形成的化合物中,化学键类型不相同
D.最高价氧化物对应的水化物的酸性:
【解析】图示析题·思路具象化
8.(2024山东青岛即墨区第一中学月考)如表所示是元素周期表的一部分,针对表中的
元素①~⑩,填写下列空白:
主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA 0族
二 ① ② ③
三 ④ ⑤ ⑥ ⑦ ⑧
四 ⑨ ⑩
(1)在这些元素中,化学性质最不活泼的是____(填元素符号),原子结构示意图
为_ _______。元素⑩名称为____。
溴
【解析】题给元素中,最不活泼的是稀有气体元素 ,其原子结构示意图是 ,
元素⑩是 。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是________,碱
性最强的化合物的电子式是_ _________。
【解析】对于题给元素,其最高价氧化物对应的水化物中,酸性最强的是 ,碱
性最强的是 ,电子式为 。
(3)用电子式表示由元素④与⑥组成的化合物的形成过程:
_ ________________________,该化合物属于______(填“共价”或“离子”)化合物。
离子
【解析】④是,⑥是,它们形成离子化合物 ,其形成过程可表示
为 。
(4)元素①与⑦形成的化合物的电子式为_ _________,该化合物是由______
(填“极性”或“非极性”)键形成的。
极性
【解析】①是C,⑦是,二者形成的化合物 的电子式是 ,分子中含有
的化学键均属于极性键。
(5)③、⑥、⑦三种元素形成的简单离子的半径由大到小的顺序是______________
_______________。
【解析】、、形成的简单离子半径由大到小的顺序是 。
(6)元素③的最简单氢化物的结构式为_ _______;该氢化物常温下和元素⑦的单质
反应的化学方程式为________________________。
【解析】元素③的最简单氢化物的结构式是 ,它与 反应的化学方程式是
。
B 综合练 选考通关
建议时间:15分钟
9.下列分子中所有原子的最外层均满足8电子稳定结构的是( )
C
A. B. C. D.
【解析】中原子的最外层有4个电子,中原子的最外层有2个电子,
中原子的最外层有12个电子,都不满足8电子稳定结构,A、B、D项错误。 中1
个原子与3个原子形成3个共价键,、 原子的最外层均满足8电子稳定结构,C
项正确。
10.下列说法错误的是( )
D
A.氢气在氧气中燃烧时,存在化学键的断裂和形成
B.主族元素、能形成型化合物,则与 的原子序数之差可能为2或5
C.某主族元素原子最外层只有1个电子,它与氯原子既能形成离子键,又能形成共价键
D.有化学键断裂的过程一定是化学变化
【解析】在 中的燃烧是化学变化,其过程中一定存在旧化学键的断裂和新化学
键的形成,A项正确;主族元素、能形成型化合物,可能有、、 、
、 等,原子序数之差可能为1、2、3、5、8等,B项正确;某主族元素原
子最外层只有1个电子,可能为或碱金属元素,与 形成共价键,碱金属元素原
子与氯原子形成离子键,C项正确;、 等物质溶于水时,化学键会断裂,
但并没有新物质生成,不属于化学变化,D项错误。
11.[新情境· 加氢制燃料]
(2024湖南长沙期末) 加氢转化为燃料是
实现 减排的一个重要策略,我国科学
家在调控 加氢反应的选择性方面取得
新进展,其过程示意图如图所示。下列分
析正确的是( )
D
A.该过程中, 分子中极性键发生断裂
B. 的电子式为
C.该反应中 作还原剂
D.该反应的化学方程式为
【解析】分子中的化学键为非极性键,A项错误; 的电子式为 ,B项错
误;由题图过程知,和反应生成和,碳元素化合价由降低为 ,
,的化合价由0升高为 ,根据得失电子守恒和原子守恒得该反应的
化学方程式为 ,C项错误,D项正确。
12.已知、、、为短周期元素,、同主族,、、同周期, 的简单气态
氢化物的稳定性大于的简单气态氢化物的稳定性,、为金属元素, 的阳离子的
氧化性小于 的阳离子的氧化性。下列说法正确的是( )
A
A.、、、 的原子半径逐渐减小
B.与 形成的化合物中一定只含离子键
C.的简单气态氢化物的沸点一定高于 的简单气态氢化物的沸点
D.若与的原子序数相差5,则二者形成化合物的化学式一定为
【解析】、、、为短周期元素,、同主族, 的简单气态氢化物的稳定性
大于的简单气态氢化物的稳定性,则、分别为第二、三周期非金属元素, 、
、同周期,、为金属元素,的阳离子的氧化性小于 的阳离子的氧化性,则
、、位于第三周期且原子序数依次增大。由、、、 的相对位置关系可知,
、、、的原子半径逐渐减小,A项正确;与形成的化合物如 中含有离
子键和共价键,B项错误;、、 的简单气态氢化物分子间均存在氢键,其沸点均
比其同主族其他元素的简单气态氢化物的沸点高,但若为C,则为, 分子间
不存在氢键,由于的相对分子质量小于,故的沸点较低,C项错误;
与的原子序数相差5,可能形成、 ,D项错误。
13.如图所示是从元素周期表中截取的一个片段,其中、、、 均属于短周期元素。
请回答下列问题:
(1)若的单质为空气的主要成分之一,则 的原子结构示意图为_ _______。
【解析】空气的主要成分是和。由元素在元素周期表中的相对位置可知, 为
,为, 的原子结构示意图为 。
(2)若、、 的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,则
这三种酸的正盐的含氧酸根离子中,有两种电子数相等,这两种离子的离子符号分
别为_______、______。
【解析】三元酸为,即为,为,为 ,三种酸的正盐的含氧酸根离子
中,和 的电子数相等。
(3)若与和 的单质分别反应可以生成相对分子质量相同的两种化合物,其中
与 形成的化合物的电子式为_ ____________,所含化学键的类型为____________
_____。
离子键、共价键
【解析】与和分别反应生成和 ,二者的相对分子质量相等,其中
中既含有离子键又含有共价键。
14.A、B、、、是原子序数依次增大的短周期主族元素,其中A与同主族,与 同
主族,、B与A均可形成10电子化合物;B与的最外层电子数之比为 ,常见化合物
与水反应生成 的单质,所得溶液可使酚酞溶液变红。
请回答下列问题:
(1)元素的原子结构示意图为_ _______;化合物 的电子式为_______。
【解析】为 。
(2)化合物 中含有的化学键类型为_____(填字母)。
AC
A.离子键 B.极性键 C.非极性键
【解析】为 ,既含有离子键又含有非极性键。
(3)化合物和 中,沸点较高的是_____(填化学式)。
【解析】常温下,为液体,为气体, 的沸点较高。
(4)与 发生氧化还原反应的化学方程式为____________________________
____。
【解析】与反应生成和 。
【解析】由与水反应生成的单质,所得溶液可使酚酞溶液变红知,为 ,
则为,为;又与同主族,则为;B与的最外层电子数之比为,则B为C;由 、
B与A均可形成10电子化合物,A与同主族知,A为 。
C 培优练 能力提升
15.(全国Ⅱ卷改编)一种由短周期主族元素组成的化合物(如图所示),具有良好的储
氢性能,其中元素、、、 的原子序数依次增大且总和为24。下列有关叙述错误
的是( )
D
A.该化合物中,、、 之间均为共价键
B. 的单质能与水反应
C. 的最高化合价氧化物的水化物为强酸
D.的氟化物 中原子均为8电子稳定结构
【解析】图示析题·思路具象化
从该化合物的成键情况可确定、B、之间均为共价键,A项正确; 为活泼金属,
能与水反应生成和,B项正确;氮元素的最高价氧化物的水化物 是强
酸,C项正确; 中B原子不满足8电子稳定结构,D项错误。
16.在遭遇冰雪灾害时,常使用一种融雪剂,其主要成分的化学式为,、 均为
周期表前20号元素,其阳离子和阴离子的电子层结构相同,且含有
电子。
(1)该融雪剂的化学式是_______,该物质中化学键类型是________,电子式是
_ ______________。
离子键
【解析】该融雪剂的化学式是 ,其化学键类型是离子键,电子式
是 。
(2)D、均为短周期主族元素,其原子的最外层电子数都是电子层数的2倍,D与
相邻,则D的离子结构示意图是_ _______;D与能形成一种结构类似于 的三原
子分子,且每个原子均达到了8电子稳定结构,该分子的电子式为_ _______,化学键
类型为________。
共价键
【解析】D、原子的最外层电子数是其电子层数的2倍,满足条件的分别是C和 ,
又D与相邻,则D是,是C;的结构示意图是 ,C与 形成的三原子分子
是,结构与 相似,电子式为 ,其化学键类型为共价键。
(3)是与D同主族的短周期元素,是第三周期金属性最强的元素,的单质与
的常见单质反应时有两种产物:不加热时生成______(填化学式),其化学键类型
为________;加热时生成_______(填化学式),其化学键类型为________________
__________,电子式为_ _____________。
离子键
离子键和(非极性)共价键
【解析】与D同主族且为短周期元素,则是 ,第三周期金属性最强的元素是
,与在不加热时反应生成 ,其化学键类型是离子键;加热时反应生成
,其化学键类型是离子键和(非极性)共价键,电子式是 。
【解析】由题给融雪剂的化学式 及阳离子和阴离子的电子层结构相同,可推断该
化合物是离子化合物,阳离子是,阴离子是;由含有 电子,
可知每个离子的电子数为,由此判断出是,是 。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
